半枝莲新克罗烷型二萜对人OCI-LY1淋巴瘤细胞增殖、凋亡及细胞周期的影响
2023-01-17刘谦陈敏徐芳华喻友爱刘勇
刘谦,陈敏,徐芳华,喻友爱,刘勇
(1.江西省人民医院南昌医学院第一附属医院病理科,南昌 330006;2.南方医科大学附属萍乡医院病理科,萍乡 337055)
半枝莲又名韩信草,马唇形科黄芩属多年生草本植物,广泛分布于我国南方湿地,功效为清热解毒、化瘀利尿,主治疔疮肿毒、咽喉肿痛等[1]。据《中华肿瘤治疗大成》载,半枝莲作为抗肿瘤药物,主治原发性肝癌、胃癌等消化道肿瘤、肺癌及子宫颈癌等[2]。同时,有部分研究将半枝莲联合化疗用于弥漫性大B细胞淋巴瘤的治疗[3]。现代研究表明,半枝莲的有效成分中,黄酮、多糖、二萜等具有良好的抗肿瘤活性[4]。近年来在半枝莲二萜类化合物中,发现部分新克罗烷型二萜具有显著抗肿瘤活性[5-6]。本研究利用弥漫性大B细胞淋巴瘤细胞株OCI-LY1作为研究对象,探讨半枝莲新型克罗烷二萜J(SJ)对其增殖、凋亡及细胞周期的影响。
1 材料与方法
1.1 材料 人弥漫性大B细胞淋巴瘤OCI-LY1细胞株(上海通派生物科技有限公司),半枝莲二萜J(江西省人民医院药剂科),CCK-8(日本同仁化学,CK04),胎牛血清(Ausbian,VS500T),DMEM(Corning,10-013-CVR),凋 亡 试 剂 盒 (eBioscience,88-8007),PI(Sigma,P4170),RNase A(Fermentas,EN0531),BCR试剂盒(上海碧云天生物技术有限公司,P0010S),cyclin D3(CST公司,1∶500稀释)。
1.2 仪器 细胞计数仪(Nexcelom Cellometer,Auto 1000),酶标仪(Tecan infinite,M2009PR),流式细胞仪(BD,C6 PLUS),荧光显微镜(OLYMPUS,IX71),SDS-PAGE蛋白电泳仪(上海天能,VE-180),蛋白转膜仪(上海天能,VE-186)。
1.3 细胞培养及药物配制 人弥漫性大B细胞淋巴瘤OCI-LY1细胞培养于10%胎牛血清FBS,于37℃、5% CO2培养箱中培养,2~3天传代。半枝莲二萜J用DMSO配制成1 mg/mL,4℃储存备用。
1.4 CCK-8实验 将OCI-LY1细胞悬液以每孔2×103个细胞、每孔100 μL接种于96孔板,待细胞沉淀后,用不同质量浓度的半枝莲二萜J(10、15、20、30、40、60、80、100 μg/mL)处理细胞,同时,设置DMSO作为对照组,作用24、48、72小时;每孔加入10 μL CCK-8,培养2小时后,酶标仪450 nm处测定各孔吸收光度值(A),计算各组细胞活性(%)=实验组A/正常对照组A×100%。
1.5 流式细胞仪检测OCI-LY1细胞凋亡率 将OCI-LY1细胞悬液以每孔2×105个细胞、每孔2 mL接种于6孔板,待细胞沉淀后,用不同质量浓度的半枝莲二萜J(0、20、40、60 μg/mL)处理细胞,培养24小时;收集细胞,用Binding buffer洗涤细胞后,加入4 μL PI染色,重悬细胞,再加入10 μL Annexin V-APC染色,避光15分钟后,用流式细胞仪检测各组细胞凋亡。
1.6 PI-FACS细胞周期检测 将OCI-LY1细胞悬液培养于6 cm dish中,用不同质量浓度半枝莲二萜J(0、20、40、60 μg/mL)处理细胞,培养24小时;收集细胞离心后,经4℃D-Hanks洗涤、75%乙醇固定处理后,按PI∶RNase∶D-Hanks=25∶10∶1000配比进行细胞染色,用流式细胞仪检测并分析数据。
1.7 Western blotting法检测cyclin D3蛋白的表达用不同质量浓度半枝莲二萜J(0、20、40、60 μg/mL)处理细胞,培养24小时后收集OCI-LY1细胞,PBS洗涤两次,加入RIPA裂解液,冰上裂解10分钟,转移至EP管中,超声破碎细胞(40 w,每次1秒,间隔2秒,共20次)。4℃、12000 g,离心15分钟,测定蛋白浓度。每条泳道加蛋白50 μg,进行SDS-PAGE,并转移至PVDF膜上。用含5%脱脂牛奶的TBST溶液室温封闭PVDF膜1小时,与一抗cyclin D3室温孵育2小时,并用TBST洗膜4次,每次8分钟;再与二抗室温孵育1.5小时,并用TBST洗膜。将PVDF膜置于暗盒,胶片曝光,冲洗胶片,并检测蛋白表达情况。
1.8 统计学处理方法 采用IBM SPSS 23.0软件进行数据分析,以(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 半枝莲二萜J对OCI-LY1细胞增殖的影响半枝莲二萜J可以明显抑制OCI-LY1细胞增殖,并呈时间和剂量依赖性(图1),不同质量浓度半枝莲二萜J作用下,细胞增殖抑制率均高于DMSO对照组,差异有统计学意义(P<0.05)。
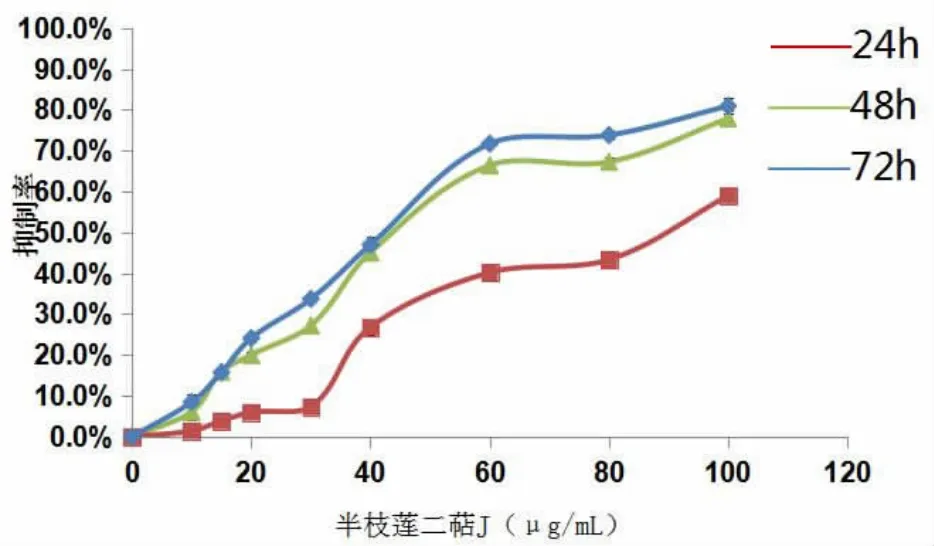
图1 半枝莲二萜J对OCI-LY1细胞增殖的影响
2.2 半枝莲二萜J对OCI-LY1细胞凋亡的影响比较不同质量浓度半枝莲二萜J对OCI-LY1细胞凋亡的影响后发现,加入20 μg/mL半枝莲二萜J处理组和不加药组坏死细胞之间没有出现差异(P>0.05),但早期凋亡和晚期凋亡率之间的差异有统计学意义(P<0.05);加入40 μg/mL和60 μg/mL半枝莲二萜J处理后的细胞坏死率、早期和晚期凋亡率与不加药组比较,差异有统计学意义(P<0.05),见表1,图2。

图2 半枝莲二萜J对OCI-LY1细胞凋亡的影响
表1 半枝莲二萜J对OCI-LY1细胞凋亡的影响(±s,n=3)

表1 半枝莲二萜J对OCI-LY1细胞凋亡的影响(±s,n=3)
浓度(μg/mL)早期凋亡率(%)晚期凋亡率(%)坏死率(%)存活率(%)0 20 40 60 1.90±0.26 3.83±0.25 4.50±0.26 7.03±0.42 1.60±0.17 2.80±0.26 10.77±0.31 28.40±0.79 0.77±0.15 0.77±0.25 3.83±0.75 5.93±0.85 95.70±0.36 92.57±0.42 80.97±0.32 58.63±0.21
2.3 半枝莲二萜J对OCI-LY1细胞周期的影响作用24 h后,比较不同质量浓度半枝莲二萜J对OCI-LY1细胞周期的影响后发现,与不加药组相比,加40 μg/mL和60 μg/mL半枝莲二萜J处理后处于各个周期的细胞总数之间均存在统计学差异(P<0.05);在加入20 μg/mL半枝莲二萜J中,只有处于S期的细胞总数与之相比差异无统计学意义(P>0.05),处于G0/G1期和G2/M期的细胞总数之间差异有统计学意义(P<0.05),见表2,图3。
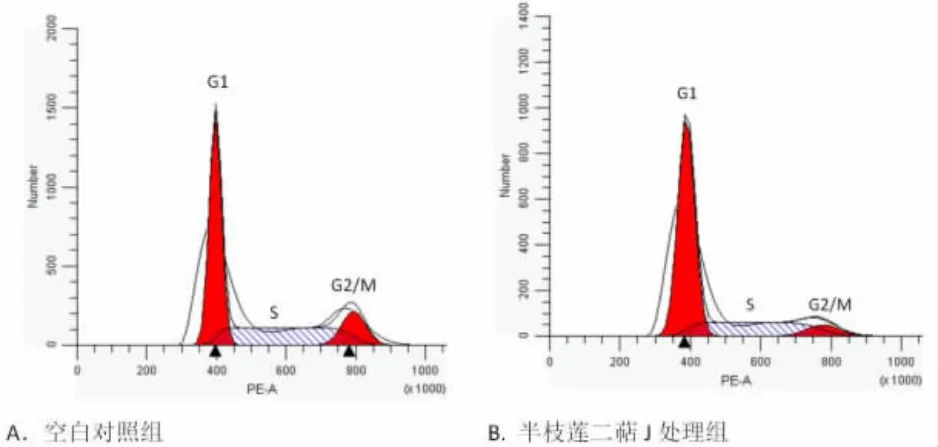
图3 半枝莲二萜J对OCI-LY1细胞周期的影响
表2 半枝莲二萜J对OCI-LY1细胞周期的影响(±s,n=3)
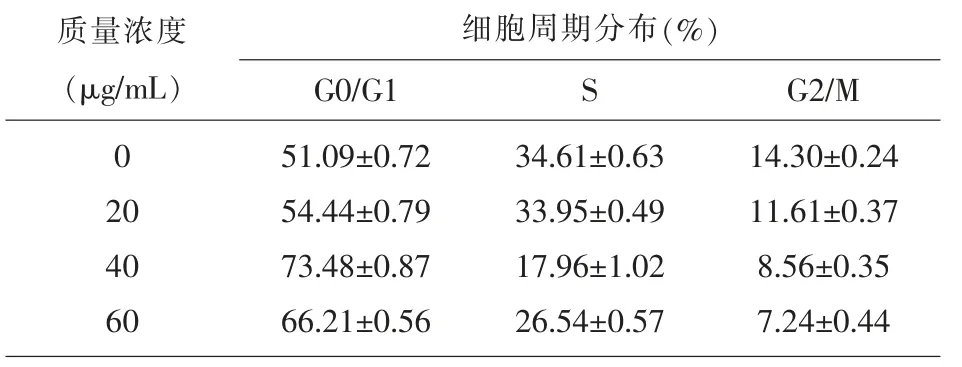
表2 半枝莲二萜J对OCI-LY1细胞周期的影响(±s,n=3)
质量浓度(μg/mL)0 20 40 60细胞周期分布(%)G0/G1 S G2/M 51.09±0.72 54.44±0.79 73.48±0.87 66.21±0.56 34.61±0.63 33.95±0.49 17.96±1.02 26.54±0.57 14.30±0.24 11.61±0.37 8.56±0.35 7.24±0.44
2.4 半枝莲二萜J对OCI-LY1细胞cyclin D3蛋白表达的影响 用不同质量浓度(0、20、40、60 μg/mL)半枝莲二萜J处理OCI-LY1细胞后,在31kDa处检测到目标条带,其cyclin D3蛋白表达均明显减弱,并呈剂量依赖性,见图4。
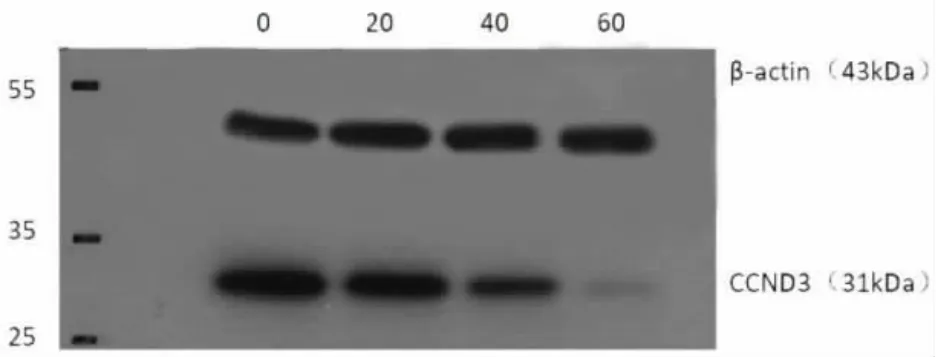
图4 半枝莲二萜J对OCI-LY1细胞cyclin D3蛋白表达的影响:半枝莲二萜J(μg/mL)
3 讨论
半枝莲为唇形科黄芩属植物Scutellaria barbata D.Don的干燥全草,始载于《药镜拾遗赋》。其性辛、苦、寒,具有清热解毒、消肿止痛等功效[7]。在中医治疗中,常用其单方或复方治疗各种肿瘤[8]。半枝莲的药理研究证实,其提取物在体外和体内是肝癌的有效抑制剂[9]。从半枝莲中分离得到的叶绿素a的衍生物,可以通过抑制P-糖蛋白的表达,并诱导HepG2的细胞周期阻滞来降低耐药性[10]。本实验结果表明,半枝莲二萜J能够抑制OCI-LY1细胞增殖,且具有时间和剂量依赖性,并使cyclin D3表达降低,呈剂量依赖性。
流式细胞仪检测细胞凋亡结果显示,半枝莲二萜J以剂量依赖性方式诱导OCI-LY1细胞凋亡,随剂量的递增,其早期凋亡率和晚期凋亡率均增大。但在20 μg/mL半枝莲二萜J处理组和不加药组凋亡细胞之间没有出现差异,而加入40 μg/mL和60 μg/mL半枝莲二萜J处理后的细胞凋亡率与不加药组之间均出现统计学差异,推测可能是随着剂量的增加,细胞凋亡越来越明显,进一步支持了其对细胞凋亡的影响。
本研究在细胞周期方面的结果显示,半枝莲二萜J主要使细胞阻滞于G0/G1期,随剂量浓度的增大,处于G0/G1期的细胞逐渐增多,在质量浓度40 μg/mL时达到峰值。同时,随半枝莲二萜J质量浓度的增大,处于S期的细胞也逐渐减少,在质量浓度40 μg/mL时达到峰值。但在S期中,20 μg/mL半枝莲二萜J处理组相比不加药组之间的差异并没有统计学意义,推测可能由于药物质量浓度小导致差异不明显。另外,G2/M期细胞也以剂量依赖的方式逐渐减少,说明半枝莲二萜J对OCILY1细胞周期的阻滞作用。
由于细胞周期蛋白在细胞周期调控中的重要作用,细胞周期依赖性蛋白激酶(Cyclin Dependent Kinases,CDKs)和周期蛋白被广泛研究[11]。D型细胞周期蛋白(cyclin D)作为有丝分裂传感器,直接将生长因子信号与G1期进展联系起来。同时,cyclin D的降解与大量人类肿瘤相关[12]。cyclin D包括3个亚型:cyclin D1、cyclin D2和cyclin D3,能促进细胞增殖,同时加快细胞周期进程。cyclin D3是G1期CDK4/CDK6的调节亚基,同时作为CDK11P58的伙伴,参与G2/M期的调节[13]。最近有研究证实,cyclin D3与CDK1、CDK2和CDK14之间也有一定相关性[14]。在淋巴造血系统的研究中,cyclin D3被认为是与中国非霍奇金淋巴瘤发病关系最密切的D类细胞周期蛋白,其表达水平与恶性程度呈明显正相关[15]。本研究采用Western blotting法检测不同质量浓度半枝莲二萜J作用OCI-LY1细胞,cyclin D3在蛋白水平的表达变化后发现,半枝莲二萜J以剂量依赖方式使OCI-LY1细胞cyclin D3蛋白表达降低,推测cyclin D3的表达下调可能与弥漫性大B细胞淋巴瘤的发生、发展有关。
弥漫性大B细胞淋巴瘤作为我国最常见的淋巴造血系统肿瘤,治疗方法多以化疗为主[16-17],但对于部分复发难治的患者,疗效仍不能让人满意。本研究以弥漫性大B细胞淋巴瘤细胞株OCI-LY1细胞为研究对象,发现半枝莲二萜J可以通过下调cyclin D3的表达从而阻滞肿瘤细胞周期进展并诱导细胞凋亡,随着研究的逐渐深入,有望为弥漫性大B细胞淋巴瘤的治疗带来新的可能。
