淫羊藿甙改善骨髓充质干细胞在防治股骨头上无菌化坏死作用的机制研究
2023-01-17仇志强廖琦蔡风周斌王萌
仇志强,廖琦,蔡风,周斌,王萌
(南昌大学第二附属医院骨科,南昌 330000)
非创伤无菌性股骨头坏死可以导致髋关节疼 痛不适,最后股骨头发生塌陷,进一步可能需要行全髋关节置换术[1]。现在研究又认为股骨头无菌性坏死是一种骨细胞或者间充质干细胞的疾病。股骨头坏死患者骨髓造血及间室中的间充质干细胞的数量及活力都大为下降[2]。因此有了大量骨髓间充质干细胞移植治疗骨坏死的研究,但是对于其疗效尚存在争议。淫羊藿是传统的补肾壮阳中草药,其主要化学成分是黄酮、苷和多糖。有研究表明,淫羊藿总黄酮具有防治切除卵巢大鼠发生骨质疏松症的作用[3],而单体成分淫羊藿苷不仅促进骨髓间充质干细胞向成骨细胞分化,还抑制其分化为破骨细胞和抑制其骨吸收活性[4]。但它对骨坏死微环境中的骨髓间充质干细胞增殖与成骨分化的影响如何,国内外尚无报道。本实验以加入了坏死骨培养液的条件培养基来模拟体内骨坏死微环境,探讨骨坏死微环境对外源性骨髓间充质干细胞的影响及淫羊藿苷在骨坏死微环境中对骨髓间充质干细胞增殖与成骨分化的影响,佐证淫羊藿苷可以增强BMSCs治疗股骨头无菌性坏死的疗效。
1 材料与方法
1.1 实验动物及主要试剂、仪器12月龄清洁级健康杂种犬4只,雌雄不限,体重15~20 kg,由南昌大学第二附属医院动物实验室提供。L-DMEM培养基、胎牛血清、PBS(GIBCO公司,美国);犬单核细胞分离液(嘉美生物技术公司)ALP检测试剂盒、ALP染液(南京建成生物工程研究所);MTT试剂盒(武汉博士德生物工程有限公司);淫羊藿苷标准品(纯度>98%,北京华迈科生物技术公司);地塞米松、β-磷酸甘油钠和维生素C(Sigma公司,德国);茜素红(北京索莱宝科技公司)恒温CO2培养箱(SANYO公司,日本);超净工作台(北京长城空气净化公司);倒置相差显微镜(Olympus公司,日本);酶标仪(Thermo公司 美国)
1.2 犬BMSCs的分离、培养 对试验狗进行速眠新II(0.04~0.08 mL/kg)肌肉注射全身麻醉,以髂后上棘为穿刺点,抽取骨髓约10 mL。与PBS缓冲液1∶1混匀后,小心加于20 mL的狗单核细胞分离液(1.077 g/mL)的液面上,以2500 r/min离心30分钟,此时离心管中由上至下细胞分四层,收集乳白色的单个核细胞层细胞,反复PBS洗涤、离心后得狗骨髓单个核细胞,接种于含完全培养基(LDMEM、10%FBS、100 U/mL青、链霉素)的75 cm2培养瓶,置37℃、5% CO2及饱和湿度培养箱内培养。每2~3 d全量换液1次,去除未贴壁成分。细胞80%融合时,传代培养。
1.3 坏死骨的培养及培养液的收集 对试验狗进行全身麻醉后固定于手术台上。参照童培建[5]等人的实验方法以液氮冷冻建立股骨头坏死模型。造模后2周处死实验狗,无菌条件下取出坏死的股骨头,去除周围软组织及外层软骨,将股骨头切成大小合适的小骨块,置于含完全培养基的培养皿中培养,同时行病理切块证实股骨头已坏死。每3 d全量换液1次,收集坏死骨培养液,2500 r/min离心30 min去除其中的细胞及杂质,过滤除菌后分装,-20℃冰箱冷藏。
1.4 细胞增殖分析P2代细胞以2×104cell/mL接种于96孔板中,每孔100 μL。24 h后更换含2.58、4.18、6.77、10.95、17.72 μg/mL淫羊藿苷的条件培养基(L-DMEM、10%FBS、5%坏死骨培养液、100 U/mL青、链霉素)。同时设立实验对照组和标准对照组,实验对照组更换不含淫羊藿苷的条件培养基,标准对照组更换普通的完全培养基,且对照组都应加入不含淫羊藿苷的载体溶液(DMSO)1 μL/mL,每组平行做6孔。每2~3天换1次培养液,分别于干预后3、6、8天弃培养液,PBS洗2次,换含无血清DMEM后每孔加入10 μL MTT染色液,继续培养4 h后每孔加入100微升Formanzan溶解液,置摇床上低速振荡10 min。在酶联免疫检测仪630 nm测定吸光度(OD)值。
1.5 成骨性分化分析P2代细胞以5×104cell/mL接种于6孔板中,每孔1.5 mL。3 d后更换含2.58、4.18、6.77、10.95、17.72 μg/mL淫羊藿苷的成骨诱导培养基(条件培养基、10~8 mol/L地塞米松50 umol/L维生素C 10 mmol/L B-甘油磷酸钠)。同时设立实验对照组和标准对照组,实验对照组更换不含淫羊藿苷的成骨诱导培养基,标准对照组更换不含坏死骨培养液的成骨诱导培养基,同样对照组都加入不含淫羊藿苷的载体溶液(DMSO)1 μL/mL,每组平行做3孔。每2~3天换1次培养液。
1.5.1 ALP活性测定 于成骨诱导后第7、14 d收集细胞培养液检测细胞外ALP活性。分别往96孔板中加入待测培养液30 μL,逐一加入缓冲液、基质液各50 μL/孔,37℃水浴30 min,加入显色剂150 μL/孔,充分混匀后置于酶标仪上测定492 nm处的吸光度(OD)值。为计算培养液中ALP浓度及排除坏死骨培养液本身的干扰,特设立标准孔、空白孔及坏死骨培养液对照孔。各组ALP活性最后以金氏单位/100 mL表示。
1.5.2 ALP细胞染色 于成骨诱导后8 d,利用偶氮偶合法进ALP组织化学染色。弃培养液,PBS洗2遍,滴加固定液固定3 min,固定后滴加底物应用液盖满样本部分,加盖疏水膜,放置湿盒中,避光37℃孵育15 min,水洗3遍。 趁湿用苏木素复染3 min左右。水洗,镜检。
1.5.3 钙结节茜素红染色 于成骨诱导后14天进行钙结节茜素红染色。染色方法:细胞用4℃、体积分数为95%乙醇固定1 h,漂洗后加入0.5%茜素红(Tris-Hcl,pH 8.3)37℃染色30 min,钙化结节染为红色。显微镜下观察结果,并使用氯化十六烷基吡啶(Cetylpyridiniumchloride,CPC)对茜素红染色的矿化结节进行溶解,静置10 min后,将溶解后的液体按实验分组收集入96孔板中,上酶标仪,在波长562 nm的设定下测定各孔OD值,收集整理数据进行统计分析。
2 结果
2.1 造模后实验动物的观察 术后正常圈养实验狗,2周后处死实验狗后可见股骨头表面光滑,关节液数量及颜色未发现明显异常,无股骨头塌陷,股骨头外形规则。将股骨头进行X线检查及病理学检查证实股骨头坏死(图1)。

2.2 犬BMSCs形态学观察 原代培养细胞接种后见大量比较一致的圆形细胞。8~12 h后开始贴壁,贴壁细胞多呈多角形、椭圆形或梭形。3 d后贴壁细胞呈短梭形或星形(图2a);6 d时贴壁细胞大部分呈梭形,少部分细胞呈多角形,细胞接触紧密,部分区域融合成片;10~12 d细胞融合成单层,呈典型细长梭形外观,集束状排列(图2b)。犬BMSCs经成骨诱导后,细胞形态由长梭形逐渐变为多边形、三角形;胞浆饱满,继续培养细胞可复层生长至形成密集的细胞团簇,中心出现细胞基质的沉积,培养皿底部可见白色斑块矿化结节(图2c、图2d)。

2.3 淫羊藿苷在骨坏死微环境中对犬骨髓间充质干细胞增殖的影响 如表1所示,淫羊藿苷可抑制BMSCs的增殖,淫羊藿苷实验组细胞量均少于实验对照组,差异有统计学意义(P<0.01);其中干预后第3天17.72 μg/mL组抑制作用最为明显(P<0.01)。坏死骨培养液可促进BMSCs的增殖,实验对照组细胞数量均多于标准对照组,差异有统计学意义(P<0.05)。
表1 各组犬BMSCs增殖情况比较(±s)

表1 各组犬BMSCs增殖情况比较(±s)
注:与实验对照组比较ΔP<0.01;与标准对照组比较*P<0.05,**P<0.01。
组别 n 3 d OD630 6 d 8 d 2.58 μg/mL 4.18 μg/mL 6.77 μg/mL 10.95 μg/mL 17.72 μg/mL实验对照组标准对照组6666666 0.1453±0.0032Δ**0.1483±0.0051Δ**0.1493±0.0351Δ**0.1520±0.0200Δ**0.1270±0.0036Δ**0.1753±0.0152**0.1670±0.0026 0.1687±0.0038Δ 0.1690±0.0061Δ 0.1653±0.0038Δ*0.1757±0.0055Δ 0.1770±0.0020Δ 0.2410±0.0118**0.1787±0.0045 0.2200±0.0132Δ 0.2163±0.0146Δ 0.2180±0.0096Δ 0.2263±0.0153Δ 0.2167±0.0186Δ 0.2683±0.0284*0.2320±0.0223
2.4 淫羊藿苷在骨坏死微环境中对犬骨髓间充质干细胞外ALP活力的影响 犬BMSCs成骨性诱导第7 d,淫羊藿苷实验组ALP活性均显著高于对照组,且差异有统计学意义(P<0.01);高药物浓度组较低浓度组ALP分泌较多,而实验对照组和标准对照组间差异无统计学意义(P=0.598),见表2。

表2 各组细胞外ALP活性
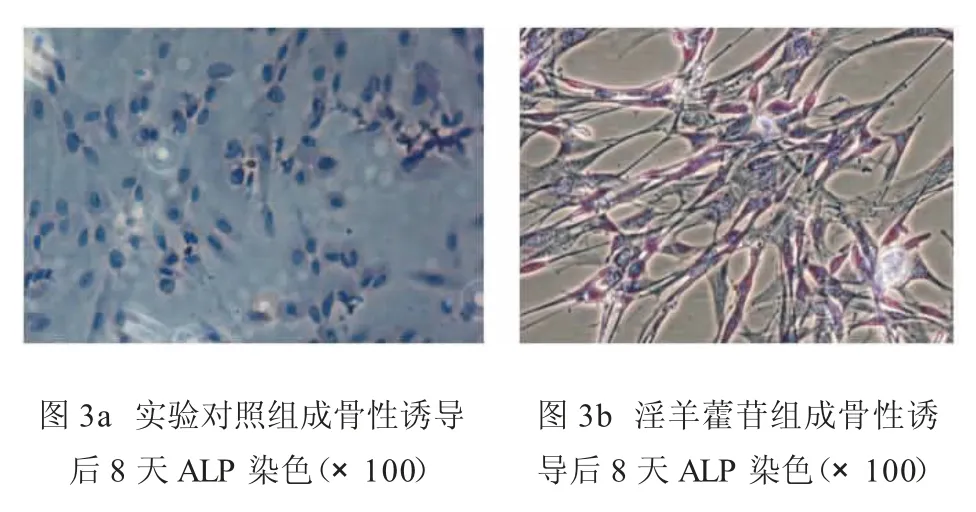
2.5 淫羊藿苷在骨坏死微环境中对犬骨髓间充质干细胞内ALP的影响 细胞经ALP染色后,细胞核呈蓝色,ALP阳性者胞浆中出现红至红棕色颗粒,有些为棕褐色或咖啡色颗粒,各组细胞ALP染色均可见阳性表现,其中实验对照组与标准对照组仅可见弥散的红色,偶见红色或咖啡色颗粒(图3a);淫羊藿苷实验组细胞可见有中等量的红棕色颗粒(图3b),但各药物浓度组间镜下未见明显差异。
2.6 淫羊藿苷在骨坏死微环境中对犬骨髓间充质干细胞钙化结节形成的影响 茜素红染色结果显示,成骨性诱导14天后,各组细胞聚集样生长,在聚集生长的中心可见点状染色阳性的钙化结节;而淫羊藿苷实验组形成钙化结节的作用更强,形成的钙化结节不但数量多,且面积(团块状)也较前两者大(图4a、图4b);钙化结节浓度(见图4c)也显示淫羊藿苷实验组钙结节浓度均多于实验对照组和标准对照组(P<0.01),10.95、17.72 μg/mL淫羊藿苷实验组形成钙结节的浓度更多。实验对照组与标准对照组在形成钙结节浓度上没有明显差异。

3 讨论
至今为止无菌性股骨头坏死的发病机理和原因并没有完全搞清楚。但是,随着干细胞研究和再生医学的研究进展发现股骨头坏死的始动因素可能是细胞起源的,而这也使得细胞疗法治疗股骨头坏死成为可能[6-7]。临床上也出现了许多关于骨髓干细胞移植治疗股骨头坏死的研究,研究表明骨髓干细胞移植对于延缓早期股骨头坏死的进展及减少坏死区域面积具有一定的作用,但还是有许多患者避免不了最终要出现股骨头的塌陷[8-9]。为何同种分期的股骨头坏死患者在进行骨髓干细胞移植后会出现完全相反的结果,骨坏死区域的微环境对植入的骨髓干细胞的影响到底如何,目前还不是很清楚。
本实验以犬BMSCs为研究对象,利用含有坏死骨培养液的条件培养基在体外模拟骨坏死微环境对BMSCs的影响。研究发现坏死骨培养液可促进BMSCs的增殖,但对其成骨性分化未见明显影响。说明在BMSCs培养过程中加入坏死骨培养液来模拟骨坏死微环境是可行的,为BMSCs移植治疗股骨头坏死提供了有力支持,但这一发现也和先前Hernigou等[2]人研究发现的激素诱导性股骨头坏死患者骨髓造血及间室中的间充质干细胞的数量及活力都大为下降这一结果相矛盾。其原因可能是本实验采用的是液氮冷冻法制作股骨头坏死模型,在造模后的这段时间机体会合成一系列的可溶性调节因子来修复损伤刺激,其中包括TGF、IL-1、IL-6、花生四烯酸代谢产物前列环素、小分子多肽等,这些分子都具有调节细胞趋化、增殖、分化及生存的功能[10]。当然也有可能是坏死骨在培养过程中分泌了一些其它的促进BMSCs增殖的物质,具体机制如何还有待进一步研究。
淫羊藿苷是传统中药淫羊藿的有效药理成分,近年来已被广泛用于抗骨质疏松治疗和成骨、破骨细胞研究。既往研究表明淫羊藿苷可通过调节成骨细胞中Cbfa1 mRNA和Osterix mRNA的表达及促进成骨细胞形态发生蛋白2的合成等机制,加速成骨细胞的增殖和分化[11-12]。本实验以骨坏死微环境中培养的犬BMSCs为靶细胞,对淫羊藿苷作为一种骨诱导活性因子的可行性也做了初步研究。结果发现各组浓度的淫羊藿苷在骨坏死微环境中均可抑制BMSCs增殖,且抑制程度与药物浓度相关,以17.72 μg/mL淫羊藿苷组抑制最为明显,其余各相邻药物浓度组间未见明显差异。这可能与此次实验采用了黄金分割原理来实现药物浓度分组有关,使得各组药物浓度的作用变化较为缓和,也更容易发现最适药物浓度[13]。
虽然淫羊藿苷在骨坏死微环境中抑制BMSCs的增殖,但其却提高了细胞内碱性磷酸酶的表达及细胞外碱性磷酸酶活力。因为碱性磷酸酶是BMSCs的早期成骨分化指标,所以该结果证明淫羊藿苷在骨坏死微环境中同样具有成骨分化活性。由于增殖和分化是细胞生命活动的两个方面,增殖中的细胞其分化功能受到抑制,而分化中的细胞其增殖能力降低[14]。因此,考虑淫羊藿苷可能因促进细胞分化而抑制了细胞的增殖效应。淫羊藿苷组和标准对照组在培养后第6 d及第8 d时的细胞数目未见明显差异也可间接说明此范围浓度的淫羊藿苷对细胞并无毒性作用。钙化结节则是成骨细胞功能活动的表现形式,14 d时的茜素红染色同样表明,淫羊藿苷在坏死骨微环境中可诱导犬BMSCs向成骨分化,同时还可促进细胞外钙盐的沉积,高剂量淫羊藿苷组较低剂量组诱导形成的钙化结节数量多、面积更大。这也与早期成骨分化时的碱性磷酸酶结果是基本一致的。
综上所述,本实验说明骨坏死微环境对BMSCs的增殖是有促进作用的,目前暂未发现其对BMSCs的成骨性分化有明显影响。而淫羊藿苷在骨坏死微环境中具有抑制BMSCs增殖的作用,同时可以促进BMSCs向成骨细胞分化。如能在细胞基因及蛋白层面来充分研究淫羊藿苷的药理作用及机制,确定其最适的药物浓度,那么淫羊藿苷可能成为辅助骨髓干细胞移植治疗股骨头坏死的一种新药。当然本次试验尚属初步研究,以坏死骨培养液模拟骨坏死微环境的可行性及可信度如何还有待进一步研究,是否利用Transwell细胞共培养体系来模拟骨坏死微环境更为可行,这将是下一步研究所努力的方向。
