音达日-4味汤提取物对小鼠镇痛、解热及抗菌作用研究
2023-01-17昂格力玛吴圆圆宫菊花
昂格力玛,吴圆圆,红 梅,宫菊花,王 欢
(1.内蒙古民族大学 蒙医药学院,内蒙古 通辽 028043;2.内蒙古民族大学 附属医院,内蒙古 通辽 028043)
1 材料与方法
1.1 实验材料
1.1.1 药物与试剂 乙酸乙酯,富宇精细化工(天津市)有限公司;高活性干酵母,安琪股份有限公司;吐温40,科密欧化学试剂(天津市)有限公司;MH肉汤培养基,信裕生物科技(上海)有限公司;二甲基亚砜,麦恪林生化科技(上海)有限公司;苯扎溴铵溶液,利尔康科技(山东)股份有限公司。音达日-4味汤由内蒙古民族大学附属医院制剂室提供。
1.1.2 实验动物 昆明种小鼠(雌雄各半),SPF级,体质量18~22 g。小鼠购自沈阳本溪实验动物中心,许可证号:SCXK(辽)2019-0023。
1.1.3 菌株来源 金黄色葡萄球菌(Staphylococcus heamolyticus)、肠球菌(Enterococcus galinarum)、表皮葡萄球菌(Staphyloccocus epidermidis)、白色念珠菌(C.albicans)、枯草芽胞杆菌(Bacillus subtilis)、肺炎克雷伯菌(K.peneumoniae)、铜绿假单细胞菌(Pseudomonas aeruginosa)、炭疽芽胞杆菌(Bacillus anthraci)、阴沟杆菌(Enterobacter cloacae)、大肠埃希菌(Escherichia coli)、鲍曼不动杆菌(Acinetobacter baumannii)。除铜绿假单细胞菌(CV CC3359 Pa.1)、炭疽芽胞杆菌(63001-7,A16R)2种菌株为中国药品生物制品检定所的教学实验菌株外,其他9种菌株从临床标本分离和鉴定。待上述11种菌培养16 h后,使用MH肉汤把菌苔稀释成1×105CFU·mL-1菌液,备用。
1.1.4 仪器设备SHIMADZU AUY 120电子天平,SHIMADZU CORPORATION JAPAN;调温电热套,狰城华鲁(山东)电热仪器有限公司;旋转蒸发仪,普渡(上海)生化科技有限公司;电热恒温鼓风干燥箱,鸿都(上海)电子科技有限公司;纯水机,捷创伟业(北京)环保设备有限公司。电子体温计,豪润奇(郑州)电子科技有限公司;智能热板仪,泰盟科技(成都)有限公司。高压灭菌器,施都凯(上海)仪器设备有限责任公司;干烤箱,精宏(上海)实验设备有限公司;CO2培养箱,FORMA STERI-CYCLE CO2Incubator;酶标仪,Multiscan-MK3;DONGL I ANHAER APPARATUS生物安全柜,东联哈尔(北京)仪器制造有限公司;细菌比浊仪,珠海迪尔公司;自动细菌鉴定和药敏系统,亚洲珠海迪尔生物仪器有限公司。
1.2 实验方法[7-11]
1.2.1 溶液的制备
1.2.1.1 乙酸乙酯提取物的制备 取音达日-4味汤散500 g,用乙酸乙酯按1∶20的比例水浴加热回流2次(300 mL×2),每次3 h,合并2次提取液,以3 000r·min-1的速率离心10 min后,上清液转放至旋转蒸发仪对乙酸乙酯进行回收,剩余物体则为提取物,晾干备用。
1.2.1.2 干酵母混悬液的制备 称取高活性酵母粉10 g,加入纯水,配成20%浓度的干酵母混悬液。
左室心肌肥厚程度 与假手术组比较,模型组LVS-BW 比和 LVS-RV比显著增加 (P<0.05)。与模型组比较,Rut低、高剂量组和阳性对照组LVS-BW比和LVS-RV比均显著降低 (P<0.05),见表2。
1.2.2 音达日-4味汤解热作用 昆明种健康小鼠在相对湿度60%左右,温度为22~26℃的实验环境下喂养7 d,后每间隔1 h,用电子体温计测定所有小鼠的肛温1次,共测量3次后计算其平均值,计算结果则作为小鼠的基础体温。同时去除体温波动较大的小鼠,选择体温范围37~38℃的小鼠32只,雌雄兼用。随后将32只实验小鼠随机分为模型组(给予同等体积的吐温40),音达日-4味汤散低(21 g·(kg·d)-1)、中(42 g·(kg·d)-1)、高(84 g·(kg·d)-1)剂量组等4组,每组8只。连续给药7 d后4组小鼠背部皮下均注射提前配制的20%浓度的干酵母混悬液,注射量为10 mL·kg-1。待实验小鼠发热后,选择2 h、4 h、6 h、8 h等时间点对其进行肛温测量,每个时间点测一次即可。
1.2.3 音达日-4味汤镇痛作用 选取体重范围为(20±2)g的健康昆明种小鼠每间隔30 min测量其痛阈值,共测2次,其中,热板温度(55±0.5)℃,实验小鼠置于热板上到舔后足反应发生的时间为痛反应的潜伏期。筛选出痛反应较稳定、不跳跃者、且痛阈值在5~30 s的32只小鼠,雌雄各半,随机分成模型组(给予同等容量的吐温40)及音达日-4味汤低(21 g·(kg·d)-1)、中(42 g·(kg·d)-1)、高(84 g·(kg·d)-1)剂量组等4组,每组8只。连续给药7 d,随后再次测定4组实验小鼠的疼痛反应,对音达日-4味汤低、中、高剂量组等给药组小鼠与模型组小鼠的痛阈值进行比较,分析数值变化,找出组间差异,并对蒙药音达日-4味汤散的镇痛作用等问题展开讨论。
1.2.4 音达日-4味汤抑菌杀菌实验
1.2.4.1 微孔板TTC法测定音达日-4味汤乙酸乙酯提取物MIC取无菌96孔细菌培养板,每孔加MH肉汤培养基100 μL,再加音达日-4味汤散乙酸乙酯提取液100 μL,倍比稀释法加至第10孔混合后弃去100 μL混合液(药物终浓度为2.3 mg·mL-1)。第11孔加阳性对照药液,即苯扎溴铵(最终浓度为0.15 μg·μL-1),第12孔设定为阴性对照,不加药液。再加用MH肉汤稀释的1×105菌液100 μL菌液,每孔中加入0.5%氯化三苯四氮唑(TTC)溶液,密封后,在潮湿环境35℃下培养,每小时观察一次,至出现明显的紫色为止。在450 nm波长处测定OD值。
1.2.4.2 琼脂平板连续稀释法测定音达日-4味汤乙酸乙酯提取物MIC取直径为9 cm的灭菌平皿,为方便辨别,在其对应的点种位置上做好菌名等标记后,依次加入提前配制好的不同梯度浓度的药液1.5 mL及MH琼脂培养基13.5 mL,充分混匀后,平放,待其凝固,在每个细菌点种位置上分别加入配制好的菌液2 μL(约104个细菌),35℃培养箱中培养24 h后观察结果。细菌具体点种位置如图1所示。
图1 细菌点种位置Fig.1 The position of bacterial dibbling
1.2.4.3 琼脂平板转种法测定音达日-4味汤乙酸乙酯提取物MBC制备MH平板时,以音达日-4味汤散乙酸乙酯提取物针对每种细菌所出现的MIC数值为依据。待“1.2.4.1”项实验结束,即判读完MIC数值后,从96孔微孔板中分别吸取2 μL培养液,点种涂布到MH平板上。放置35℃培养箱,培养24 h后观察结果。
1.3 统计学处理
通过SPSS18.0软件对本文所有数据进行统计及分析,其中,各组之间的差异采用双因素方差分析比较其显著性意义,通过均数标准差()来表示所有计量资料。采用t检验进行差异的显著性检验,以P<0.05定为显著性界限。
2 结果
2.1 音达日-4味汤解热作用实验结果
见表1。
表1 音达日-4味汤解热作用实验结果Tab.1 Experimental results of antipyretic effect of Yindari-4 decoction n=8,

表1 音达日-4味汤解热作用实验结果Tab.1 Experimental results of antipyretic effect of Yindari-4 decoction n=8,
注:与模型组比较*P<0.05,**P<0.01。
组 别模型组低剂量组中剂量组高剂量组给药量/(g·kg-1)—12 24 48给药前体温/℃37.20±0.58 37.24±0.32 37.30±0.35 37.36±0.29不同给药时间体温/℃2 h 37.73±0.48 37.81±0.33 37.24±0.40*37.25±0.43*4 h 37.78±0.54 38.41±0.27 37.20±0.78*37.05±0.50**6 h 37.90±0.59 38.41±0.46 37.13±0.43*37.83±0.19*8 h 38.07±0.54 37.77±0.29 37.18±0.37**36.92±0.95*
由表1得出,与模型组比较,音达日-4味汤散乙酸乙酯提取物中、高剂量组造模后2 h、4 h、6 h、8 h均能明显降低小鼠体温,中剂量组在造模后8 h体温值有显著性差异(P<0.01),高剂量组在造模后4 h体温值有显著性差异(P<0.01)。
2.2 音达日-4味汤镇痛作用实验结果
见表2。
表2 音达日-4味汤镇痛作用实验结果Tab.2 Experimental results of analgesic effect of Yindari-4 decoction n=8,

表2 音达日-4味汤镇痛作用实验结果Tab.2 Experimental results of analgesic effect of Yindari-4 decoction n=8,
注:与模型组比较*P<0.05,**P<0.01。
组 别模型组低剂量组中剂量组高剂量组剂量/(g·kg-1)—12 24 48痛阈值/s 13.13±6.18 19.50±10.70 25.11±12.43*28.01±12.12**
由表2得出,在小鼠给药后测定其痛阈值,与模型组比较,音达日-4味汤乙酸乙酯提取物的中剂量组(P<0.05)、高剂量组(P<0.01)小鼠的痛阈值明显升高。
2.3 微孔板TTC法测定音达日-4味汤乙酸乙酯提取物MIC实验结果
见表3。
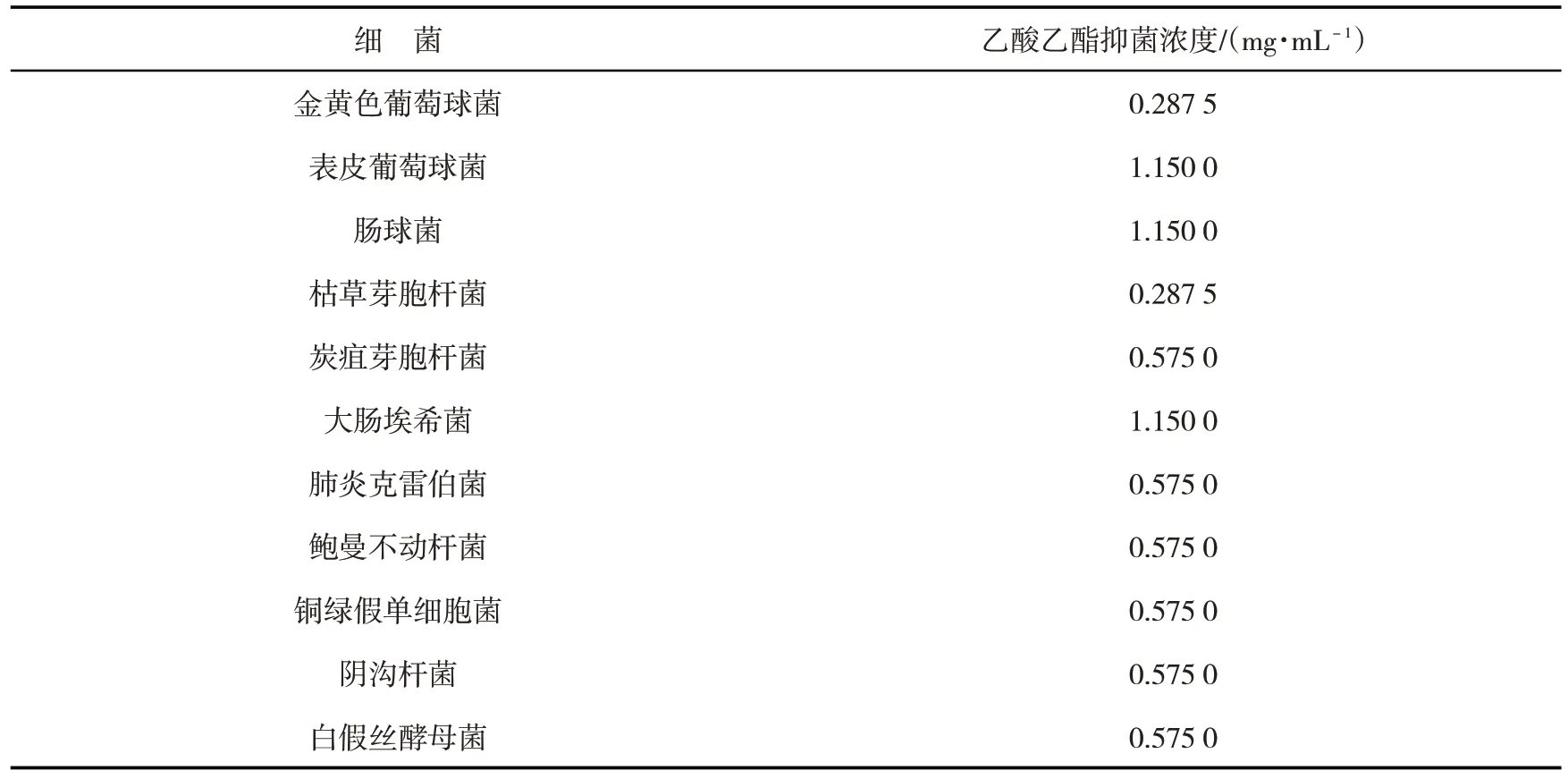
表3 微孔板TTC法测定音达日-4味汤乙酸乙酯提取液抑菌浓度实验结果Tab.3 Experimental results of detection of antibacterial concentration of ethyl acetate extract of Yindari-4 decoction by microporous plate TTC method
实验结果显示,音达日-4味汤乙酸乙酯提取物对金黄色葡萄球菌和枯草芽胞杆菌抑制浓度最低。抑菌浓度数值最高的是表皮葡萄球菌、肠球菌及大肠埃希菌。
2.4 琼脂平板法测定音达日-4味汤乙酸乙酯提取物MIC实验结果
见图2及表4。

表4 琼脂平板法检测音达日-4味汤乙酸乙酯提取液抑菌浓度实验结果Tab.4 Experimental results of detection of bacteriostatic concentration of ethyl acetate extract of Yindari-4 decoction by agar plate method
图2 琼脂平板细菌培养结果Fig.2 Results of bacteria cultured on agar plates
从图2、表4得知,音达日-4味汤乙酸乙酯提取液对金黄色葡萄球菌、肠球菌抑菌浓度最低。音达日-4味汤乙酸乙酯提取液对表皮葡萄球菌、炭疽芽胞杆菌及大肠埃希菌等3种细菌抑制浓度最高。
2.5 琼脂平板法测定音达日-4味汤乙酸乙酯提取物MBC实验结果
见表5。在琼脂平板上的每种细菌的相应点种位置上,若点种及涂布过培养液,但完全没有生长出细菌则定为MBC,即最低(小)杀菌浓度。其中,在细菌的接种位置上,如果生长2个或2个以下的菌落时选择忽略不计。

表5 琼脂平板法测定音达日-4味汤乙酸乙酯提取液杀菌浓度实验结果Tab.5 Experimental results of determination of bactericidal concentration of ethyl acetate extract of Yindari-4 decoction by agar plate method
从表5得出,音达日-4味汤乙酸乙酯提取液对金黄色葡萄球菌与表皮葡萄球菌杀菌浓度最低,对鲍曼不动杆菌杀菌浓度最高。
3 讨论
蒙药传统方剂音达日-4味汤散的主治病症为肠热痢疾、腹痛及腹泻等,此类病症在临床上主要有腹痛,并伴有发热,与西医临床上因病原微生物的感染而引起的临床症状相似。因此,笔者进行了小鼠热板仪疼痛实验和酵母菌引起的解热实验,研究结果表明,音达日-4味汤散乙酸乙酯提取物中剂量和高剂量造模后2 h、4 h、6 h、8 h均能显著降低体温;实验药物中剂量及高剂量镇痛作用较为明显,并与音达日-4味汤散临床应用非常吻合;该结果进一步证明音达日-4味汤散作用有效部位为乙酸乙酯提取部位。
在体外抑菌方面,目前,金黄色葡萄球菌作为医院感染的致病菌中主要细菌,可产生多种毒素和侵袭性酶,从而增加引发多种感染的可能性,例如:皮肤软组织、呼吸道及手术部位的感染等[12]。金黄色葡萄球菌具有分布广泛、致病性强及耐药性高等特点[13]。由于该感染菌对环境的适应性较强,容易在医院内传播流行,已成为医院最常见的革兰氏阳性菌之一,甚至在一些医院引起爆发流行[14-15]。
肠球菌为寄存于人类及动物的肠道中众多正常细菌中的一员,以前一直被人们认为是对机体无害的细菌,然而最近研究表明,由肠球菌而引发的感染病例数量正在日益增加。目前,该病菌已经成为引发医院感染的病原菌中重要的一种细菌,会对人体的多个器官,例如:尿路、皮肤软组织等产生严重的感染。此外,肠球菌还可引起心内膜炎、脑膜炎及败血症等疾病,严重时甚至会危及患者生命[16]。近年来,在临床治疗药物的使用问题上,随着抗菌药物广泛使用现象的加剧,肠球菌的耐药种类及耐药性在不断增长,然而目前依然缺乏其特效药物。
根据本研究结果分析,蒙药音达日-4味汤散的乙酸乙酯提取物对金黄色葡萄球菌和肠球菌具有明显抑制作用,且抑制用药浓度非常低,尤其是对肠球菌抑制效果较好,并且对由此而引起的临床上发热、疼痛症状具有较好的治疗作用。因此,本次研究结果分析音达日-4味汤散乙酸乙酯提取物是该方药在临床上应用清热、止泻等功效的作用部位。
