结直肠癌中SAA2表达与肿瘤免疫微环境的关系
2023-01-17张新燕刘英香赵国栋中南大学湘雅医学院附属海口医院海口市人民医院肛肠科海口570208
张新燕 刘英香 赵国栋(中南大学湘雅医学院附属海口医院,海口市人民医院肛肠科,海口 570208)
血清淀粉样蛋白2(serum amyloid A2,SAA2)是急性时相蛋白(serum amyloid A,SAA)的一种,其他亚 型 包 括SAA1、SAA3和SAA4。SAA1、SAA2和SAA3作为急性响应蛋白在体内炎症调节等方面发挥功能[1-3]。越来越多的研究表明,在机体遭受急性损伤等情况下,SAA1、SAA2和SAA3会大量表达,而SAA4则是以持续激活的形式表达[4]。目前的研究发现,SAA1、SAA2和SAA3蛋白可作为急性炎症和组织损伤的重要生物标志物,在病毒、细菌感染、关节炎、克罗恩病等疾病中发挥辅助诊断作用[5-7]。近年来,SAA1在恶性肿瘤中的研究获得了很大关注。有研究发现血清中SAA1可作为胃癌、胰腺癌、乳腺癌和肺癌的生物标志物,且其表达水平与疾病的发展 进 程 密 切 相 关[8-10]。然 而 关 于SAA2、SAA3和SAA4亚型在肿瘤中的作用尚不明确。根据已有报道,SAA2与SAA1的序列同源性较高,因此本研究聚焦SAA2在结直肠癌中的表达和临床意义。SAA2在结直肠癌中的表达及其与结直肠癌肿瘤免疫微环境的关系尚未见报道。本研究从SAA2在结直肠癌肿瘤组织中的表达水平入手,分析SAA2表达水平对结直肠癌患者预后的影响。同时SAA2作为重要的免疫调节分子,本研究也进一步阐述了其与结直肠癌肿瘤免疫微环境的联系,为开发新的结直肠癌治疗靶点提供重要参考。
1 材料与方法
1.1材料RIPA组织裂解液、蛋白酶抑制剂及羊抗兔过氧化物酶(HRP)标记的二抗购自碧云天生物科技公司;SAA2抗体(13192-1-AP)及内参抗体GAPDH购自武汉三鹰生物科技有限公司。将TCGA数据库中275例结直肠癌肿瘤标本和349例癌旁正常组织和基因组织表达(genotype-tissue expression,GTEx)结肠组织纳入本研究;将Oncomine数据库中65对结直肠癌肿瘤组织和癌旁正常组织纳入本研究。4例结直肠癌肿瘤组织和癌旁正常组织采集于海口市人民医院,患者均签署知情同意书。组织标本取材于术中,将组织储存于超低温冰箱。
1.2方法
1.2.1基因表达分析 利用公共肿瘤数据库TCGA和Oncomine分析结直肠癌肿瘤组织和癌旁正常组织中SAA2基因表达水平。TCGA数据分析在GEPIA工具中完成[11],基因相对表达水平采用Log处理,以TPM+1表示(TPM:transcript per million)。正常组织由癌旁正常组织及GTEx正常组织共同组成。首先在Oncomine数据库输入SAA2基因,选择Cancer type为colorectal cancer,分析类型设置为cancervsnormal,分析出Gaedcke colorectal数据集[12]中SAA2在肿瘤组织中的表达是癌旁正常组织的8.446倍。1.2.2Western blot收集的结直肠癌组织样本储存于超低温冰箱,经液氮速冻后进行研磨,加入RIPA蛋白裂解液,冰上裂解30 min。离心取上清,测定蛋白浓度,加入蛋白上样buffer,100℃煮10 min后置于冰上。行8%的SDS-PAGE凝胶电泳,转至PVDF膜,采用5%脱脂奶粉室温封闭1 h,4℃过夜孵育一抗,TBST清洗3次后,室温孵育二抗1 h,采用ECL系统进行蛋白显影成像。采用Quantity One软件进行蛋白表达水平的半定量分析。
1.2.3患者生存期分析 在Human protein Altas工具中分析TCGA结直肠癌数据[13]。首先输入目的基因,选择病理组织类型为colorectal,将具有临床随访信息的159例结直肠癌患者纳入分析,以SAA2和SAA1基因的中位数表达水平为截断值,将159例结直肠癌患者分为高表达组和低表达组,其中SAA2高表达组119例,低表达组40例,SAA1高表达组80例,低表达组有79例。采用Log-rank法进行生存曲线的统计分析。
1.2.4结直肠癌中肿瘤免疫得分相关性分析 利用TCGA结直肠癌数据,采用CIBERSORT法分析SAA2基因表达水平与肿瘤组织中肿瘤纯度得分(estimate score)相关性、肿瘤免疫得分(immune score)相关性及肿瘤组织中基质得分(stromal score)相关性,相关性分析采用Spearman法[14]。
1.2.5结直肠癌肿瘤中基因相关性分析 在TISIDB肿瘤免疫交互系统工具中输入SAA2基因名,选择immunoinhibitors进行相关性分析,相关性分析采用Spearman法[15]。
1.2.6基因富集分析 根据TCGA结直肠癌数据中SAA2基因表达中位数分为高表达组和低表达组,采用Gene Set Enrichment Analysis(GSEA)法进行SAA2的基因富集分析,基因集数据库选择c2.cp.kegg.v7.1.gmt,number of permutations设置为1 000,phenotype labels设置为lowvshigh,富集统计采 用weighted模 式,metric for ranking genes选 择Signal2Noise,最小基因集设置为15,最大基因集设置为500。
1.2.7组织中基因水平检测12例结直肠癌标本的总RNA采用Trizol试剂盒提取,得到的总RNA采用反转录第一链cDNA合成试剂盒进行逆转录,然后采用荧光定量PCR检测SAA2、CD274和PDCD1的相对表达水平。SAA2正向引物:5'-GCTTCTTTTCGTTCCTTGGCG-3',反向引物:5'-GCCGATGTAATTGGCTTCTCTCA-3';CD274正向引物:5'-GCTGCACTAATTGTCTATTGGGA-3',反向引物:5'-AATTCGCTTGTAGTCGGCACC-3';PDCD1正 向 引 物:5'-CCAGGATGGTTCTTAGACTCCC-3',反 向 引 物:5'-TTTAGCACGAAGCTCTCCGAT-3'。
1.3统计学处理 采用Graphpad Prism软件进行统计绘图,以±s展示数据。两组间表达差异采用Student'st检验,以Spearman法进行相关性分析;总生存期分析采用Kaplan-Meier法进行Log-rank统计。P<0.05表示差异具有统计学意义。
2 结果
2.1SAA2基因在结直肠癌肿瘤组织中高表达 在GEPIA工具中分析TCGA结直肠癌数据,其中结直肠癌肿瘤组织275例,癌旁组织和GTEx正常组织349例,SAA2基因在结直肠癌肿瘤组织中的表达水平显著高于正常组织(P<0.001,图1A)。进一步在Oncomine肿瘤数据库中分析,结果表明,相对于癌旁正常组织,肿瘤组织中SAA2表达水平显著升高(8.446倍,P<0.001,图1B)。而SAA1在结直肠癌肿瘤组织中表达虽然有所升高,但不显著(图1C),且生存分析曲线也表明SAA1的表达水平对结直肠癌患者预后无明显影响(P=0.89,图1D)。
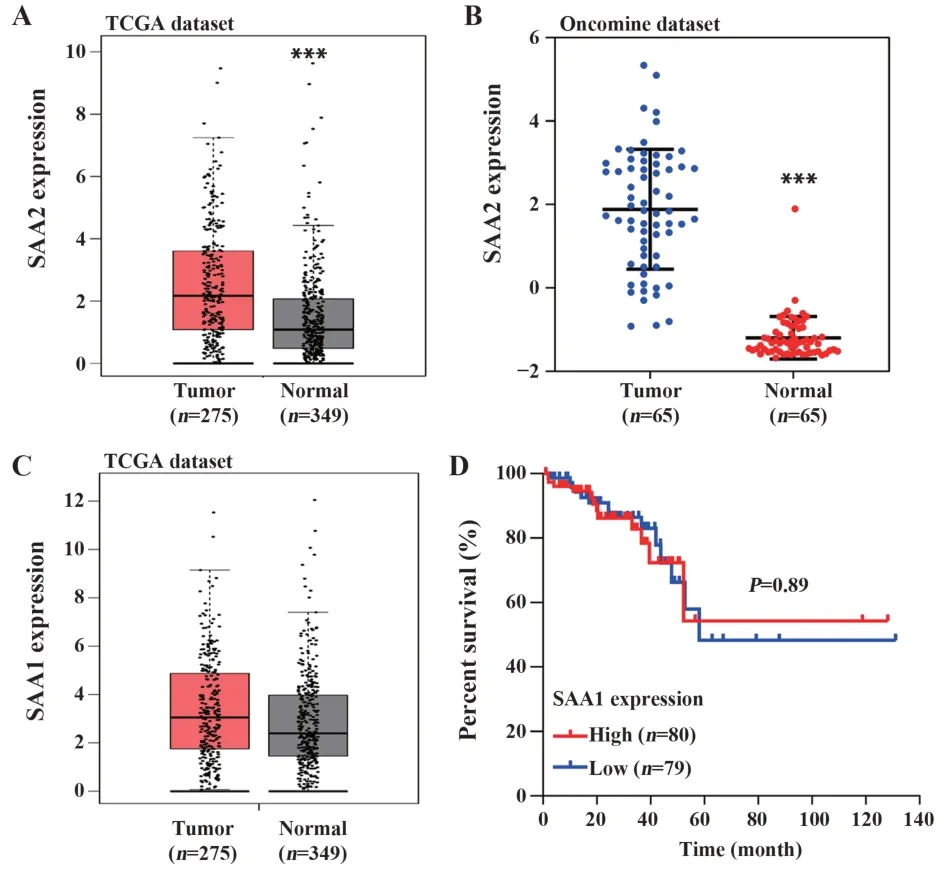
图1 结直肠癌肿瘤组织中SAA2基因高表达Fig.1 SAA2 gene is highly expressed in colorectal tumor tissues
2.2结直肠癌肿瘤组织中SAA2蛋白高表达4例结直肠癌手术切除标本,包括对应癌旁正常组织,Western blot结果表明SAA2蛋白在结直肠癌肿瘤组织中的表达高于癌旁正常组织,差异有统计学意义(P<0.001,图2)。
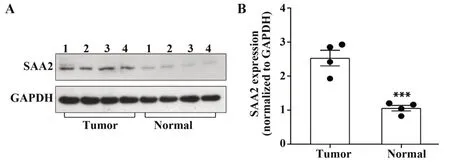
图2 结直肠癌肿瘤组织中SAA2蛋白表达高于癌旁组织Fig.2 Protein expression of SAA2 was higher in colorectal tumor tissues than normal tissues
2.3结直肠癌中SAA2高表达患者生存期下降 由图3可知,119例SAA2高表达组结直肠癌患者生存期显著低于SAA2低表达组患者(P<0.05)。SAA2高表达组中94例存活,25例死亡,而SAA2低表达组中39人存活,仅1人死亡,差异有统计学意义(P<0.01,表1)。
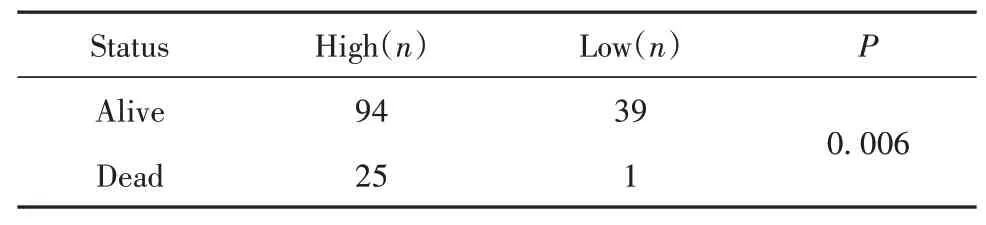
表1 结直肠癌中SAA2表达水平与总生存期的关系Tab.1 Association between SAA2 and overall survival time in colorectal cancer
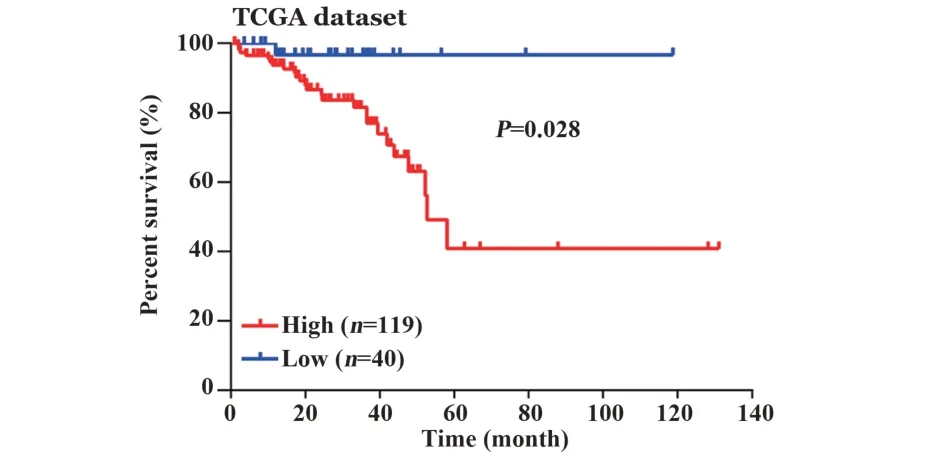
图3 结直肠癌肿瘤组织高表达SAA2的患者生存期差Fig.3 Higher SAA2 expression of colorectal cancer patients showed worse survival rate
2.4结直肠癌中SAA2表达与肿瘤免疫浸润微环境紧密相关 结直肠癌中SAA2表达水平与肿瘤组织中肿瘤纯度的相关性分析显示,两者具有显著的正相关关系(R=0.214,P=3.72e-06,图4A),说明随着肿瘤组织中肿瘤纯度提高,SAA2表达升高,进一步验证了SAA2在结直肠癌肿瘤组织中高表达。对肿瘤组织中浸润的免疫细胞进行免疫得分分析,发现SAA2与结直肠癌肿瘤组织中免疫得分呈正相关(R=0.346,P=2.63e-14,图4B)。然而SAA2表达与结直肠癌中基质得分差异无统计学意义(R=0.074,P=0.111,图4C),说明结直肠癌中SAA2与肿瘤免疫浸润微环境紧密相关。
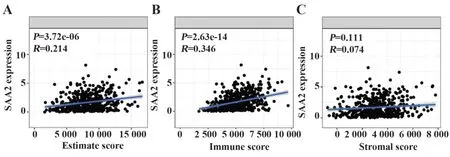
图4 结直肠癌肿瘤中SAA2与免疫浸润微环境紧密相关Fig.4 SAA2 was closely associated with immune infiltration microenvironment in colorectal cancer
2.5结直肠癌中SAA2具有潜在的肿瘤免疫抑制功能 如图5所示,结直肠癌肿瘤组织中SAA2的表达与CD274、CD244、CTLA4、LAG3、PDCD1、IL-10、ADORA2A、TIGIT、BTLA4和CD160等免疫抑制性分子均呈正相关,提示结直肠癌中SAA2具有潜在的肿瘤免疫抑制功能。
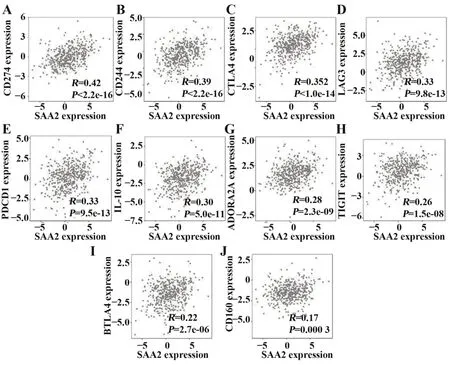
图5 结直肠癌中SAA2具有潜在的肿瘤免疫抑制功能Fig.5 SAA2 has potential regulation function of tumor immune suppression in colorectal cancer
2.6结直肠癌组织中SAA2与CD274和PDCD1呈正相关 分析12例结直肠癌组织中SAA2与CD274和PDCD1表达的相关性,进一步验证SAA2与肿瘤免疫抑制分子的相关性,结果显示,12例结直肠癌组织中SAA2与CD274和PDCD1的表达相关性较强,相关系数分别为0.93和0.90(P<0.001,图6),进一步验证了结直肠癌中SAA2与免疫抑制分子的正相关关系。
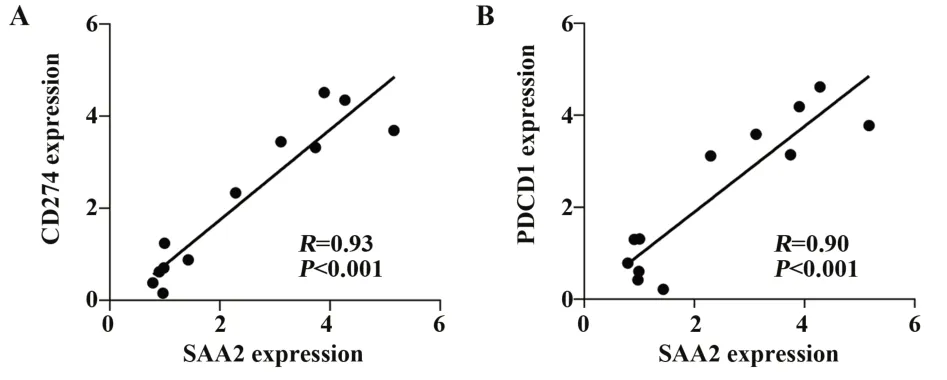
图6 结直肠癌肿瘤中SAA2与CD274和PDCD1表达的相关性Fig.6 Correlation between SAA2 and CD274 and PDCD1 expression in colorectal cancer
2.7结直肠癌中高表达的SAA2可能参与抗肿瘤免疫调节信号通路负反馈调节 进一步基因富集分析显示,结直肠癌高表达的SAA2与趋化因子信号通路和细胞因子受体相互作用网络均呈明显的负相关(图7A、B),结直肠癌中SAA2表达与自然杀伤细胞介导的细胞毒作用及抗原呈递信号网络也呈负相关(图7C、D)。而这些信号通路在抗肿瘤免疫功能的调控中均发挥重要作用,因此结直肠癌中高表达的SAA2可能参与抗肿瘤免疫调节信号通路负反馈调节。
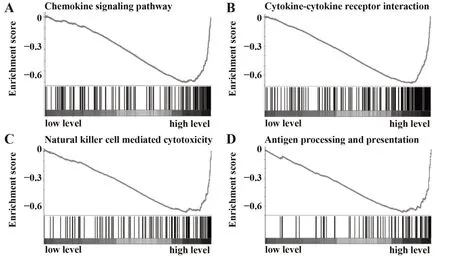
图7 结直肠癌中SAA2可能参与抗肿瘤免疫调节信号通路负反馈调节Fig.7 SAA2 may involve in negative regulation of antitumor immune-regulation signaling pathways
3 讨论
SAA2是最重要的急性时相蛋白之一,在病毒和细菌感染、自体免疫性疾病,如关节炎、红斑狼疮等疾病中均发挥重要调节功能[2,9]。目前的研究进展显示,SAA2作为SAA重要的成员之一,也能够发挥生物标志物作用,在疾病的诊断和辅助治疗方面发挥重要作用[1,6,8]。近年来,关于SAA2在肿瘤中的研究也获得了越来越多的关注,SAA2在结直肠癌中的表达和功能仍不十分明确。同时,考虑到SAA2在免疫炎症方面的重要调节作用,而炎症免疫功能紊乱是结直肠癌炎-癌转化等过程中的一大特点,本研究进一步分析了结直肠癌中SAA2表达与肿瘤免疫调节微环境间的潜在联系。
本研究首先明确SAA2在结直肠癌中的表达水平,发现在结直肠癌肿瘤组织中,SAA2无论在基因水平还是蛋白水平均呈高表达。既往研究发现,作为急性时相蛋白的SAA2在急性炎症反应和组织损伤的情况下表达上调,进而介导免疫炎症信号网络调节,那么在结直肠癌中呈高表达状态的SAA2又具有怎样的生物学功能呢?为解决这一问题,本研究通过分析结直肠癌患者的生存期,阐述SAA2表达对结直肠癌患者生存期的影响。结果表明,高表达SAA2的结直肠癌患者生存期短,提示在结直肠癌中高表达的SAA2具有成为结直肠癌预后标志物的可能。既往研究也证实结肠癌患者血清中SAA2作为诊断标志物具有较好的诊断特异性和敏感度,即使在早期诊断方面也表现出较好的诊断效率[16-17]。本研究进一步丰富了SAA2在结直肠癌患者预后方面的意义,为结直肠癌的诊断和治疗提供临床参考意见。本研究还发现SAA1虽然在结直肠癌中的表达有所升高,但不如SAA2明显,且SAA1表达水平对患者的生存期无明显影响,进一步突出了SAA2在结直肠癌中的研究价值。有研究利用免疫组化检测结直肠癌组织中SAA1高表达,并阐述其与淋巴结转移、远处转移、TNM分期和生存期显著相关[18]。由于SAA1蛋白具有分泌功能,因此其不仅以蛋白组织表达形式存在,还存在分泌形式。本研究以基因水平为切入点分析,在一定程度上概括了其分泌型和组织表达型两种模式,进一步丰富了既往研究结果。
既往研究明确了肿瘤基质作为肿瘤复杂的微环境因素,介导肿瘤的发生发展[19],同时,基于SAA2在免疫调节方面的重要作用及肿瘤免疫微环境对结直肠癌肿瘤进展的重要影响,本研究进一步分析了结直肠癌中SAA2表达水平与肿瘤免疫浸润间的联系,SAA2与肿瘤组织中肿瘤纯度及浸润的免疫细胞均呈显著正相关,而与肿瘤组织中基质无明显相关性。大量研究表明肿瘤组织的免疫浸润与肿瘤免疫耐受紧密相关,而SAA2与结直肠癌肿瘤组织中免疫浸润得分显著相关,表明SAA2可能参与结直肠癌免疫抑制微环境的调控。而关于SAA2在机体免疫调控方面的报道显示,SAA2在机体炎症应激条件下可介导TNF-α等促炎基因表达,然而其具体分子机制还有待进一步深入探究[20]。
炎症是肿瘤微环境最重要的一方面[19],因此本研究通过分析结直肠癌肿瘤组织中SAA2与系列免疫抑制性分子的相关性,发现SAA2与CD274、CD244、CTLA4、LAG3、PDCD1、IL10、ADORA2A、TIGIT、BTLA4和CD160等经典免疫抑制性因子均呈正相关。本研究还进一步在12例结直肠癌组织标本中验证了SAA2与CD274和PDCD1的正相关关系,揭示SAA2可能具有潜在的肿瘤免疫抑制功能,而GSEA基因聚类分析也进一步说明结直肠癌中SAA2与趋化因子信号通路、细胞因子受体相互作用网络、自然杀伤细胞介导的细胞毒作用及抗原呈递信号通路均呈负相关,而这些信号通路在肿瘤免疫功能维持、免疫耐受产生等过程中均发挥重要的调节功能,以上结果提示结直肠癌中高表达的SAA2可能参与抗肿瘤免疫调节信号通路负反馈调节,进而促进结直肠癌肿瘤进展,提示结直肠癌患者的不良预后。
综上所述,本研究发现SAA2在结直肠癌中高表达,且其高表达与肿瘤免疫浸润,特别是免疫抑制性分子紧密相关,进而在参与结直肠癌的发展过程中影响结直肠癌患者的预后水平。