IL-18在脓毒症肺损伤发生发展过程中的作用及机制研究①
2023-01-17贾依娜尔杨立新权荣喜
董 岩 李 方 贾依娜尔 杨立新 权荣喜
(新疆医科大学附属肿瘤医院重症医学科,乌鲁木齐 830011)
脓毒症指由感染因素导致的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),常见原因包括严重创伤、烧伤、再灌注损伤及外科大手术后的并发症等[1]。严重脓毒症患者可并发多器官功能损伤,而肺作为脓毒症的主要受损器官,最常见并发症为急性肺损伤(acute lung injury,ALI)[2]。ALI常见临床表现为进行性低氧血症和呼吸窘迫,若病情进一步发展将导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[3]。ALI发病机制复杂,其中炎症反应爆发和失控是ALI发病的核心环节,而既往研究认为ALI发生发展与Th1/Th2免疫失衡相关[4]。近年研究发现,调节性T细胞(regulatory T cell,Treg)与辅 助性T细 胞17(helper T 17 cell,Th17)及其细胞因子同样在ALI发病机制中发挥重要作用[5-6]。Treg/Th17失衡学说受到越来越多的学者重视,不仅是对Th1/Th2失衡机制的补充,更为ALI发生发展提供了更多免疫学依据。IL-18是由多种细胞(如单核细胞、血管平滑肌细胞及内皮细胞等)产生的具有多项效应的促炎因子,既往研究发现其可诱导T细胞及自然杀伤细胞产生IFN-γ,在抗感染、免疫调节、抗肿瘤及慢性炎症等疾病过程中发挥重要作用[7]。研究发现,IL-18在脓毒症重症患者中的表达显著增加,且与患者不良预后密切相关[8-9]。最近研究显示,IL-18在绝经后骨质疏松症小鼠模型中能够通过调控Treg/Th17及炎症因子表达影响成骨细胞分化[10]。而在脓毒症中高表达的IL-18能否通过影响Treg/Th17平衡参与ALI发生发展尚无报道。本研究将采用IL-18基因敲除(IL-18-/-)小鼠以LPS诱导经典脓毒症模型,观察IL-18对ALI的影响及机制。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级雄性C57BL/6小鼠36只,6~8周龄,体质量22~30 g,购自新疆医科大学实验动物中心。IL-18基因敲除小鼠(IL-18-/-)由苏州赛业生物公司订制。均饲养于SPF级动物房,自由饮食饮水,饲养环境:22~26℃,40%~70%相对湿度,12 h/12 h昼夜交替。本研究所涉及动物实验均符合新疆医科大学附属肿瘤医院医学伦理委员会要求,所有操作遵循实验动物操作管理规范。
1.1.2主要试剂 脂多糖(LPS,美国Sigma公司);DMEM培养液(美国Hyclone公司);佛波酯(PMA)/离子霉素混合物、布雷菲德菌素A(BFA,杭州联科生物);大鼠抗IL-18、STAT3、磷酸化STAT3(p-STAT3)单克隆抗体、GAPDH(美国Abcam公司);辣根过氧化酶(HRP)标记的二抗(广州晶彩);RORγδ、FoxP3(美国Santa Cruz公司);Alexa Fluor 647标记的兔抗大鼠抗体(美国Biolegend公司);TUNEL凋亡检测试剂盒(美国Roche公司);4',6-二脒基-2-苯基吲哚(DAPI)染料、HE染色试剂盒、BCA蛋白试剂盒(江苏碧云天生物公司);FITC-CD4、APC-25、PE-Cy5.5-IL-17A、PE-FoxP3(美国BD公司);PCR试剂盒(日本TaKaRa);PCR引物由上海生工合成;其他试剂均为国产分析纯。
1.2方法
1.2.1脓毒症动物模型构建 实验小鼠分为4组:野生型小鼠对照组(WT组,n=6)、LPS处理的野生型小鼠组(WT LPS组,n=10)、IL-18基因敲除的小鼠对照组(IL-18-/-组,n=10)、LPS处理的IL-18基因敲除小鼠组(IL-18-/-LPS组、n=10)。小鼠适应性喂养1周,术前12 h禁食不禁水,腹腔注射LPS(15 mg/kg)建立脓毒症模型,对照组按同比例注射相应体积生理盐水。LPS处理小鼠后观察小鼠72 h存活率并绘制生存曲线。造模72 h脱臼处死各组小鼠,收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、双肺组织备用。
1.2.2HE染色观察小鼠肺组织病理变化 取各组小鼠肺组织固定于4%多聚甲醛溶液24 h,常规脱水、透明、浸蜡、包埋、切片,HE染色,每只小鼠随机选取3张切片,光镜下观察组织学变化。
1.2.3RT-PCR检测各组小鼠肺组织IL-18 mRNA表达 将小鼠肺组织置于液氮中研磨为组织匀浆,Trizol法提取组织总RNA,分光光度计检测浓度与纯度,根据逆转录试剂说明书逆转录为cDNA,按照RT-PCR试剂说明书及预实验确定的反应时间与温度进行RT-PCR,反应条件:95℃预变性30 s,95℃变性7 s→60℃退火30 s→72℃15 s,40个循环。RT-PCR引物序列为IL-18 F:5'-CCTTCATTGCCACGTACAGG-3',IL-18 R:5'-GGGCTTGATGATGTGCTCTG-3';β-actin F:5'-ATCACCATTGGAATGAGCG-3',β-actin R:5'-TTGAAGGTAGTTCGTGGAT-3'。以β-actin为内参,2-ΔΔCt分析IL-18基因表达。实验单独重复3次。
1.2.4免疫荧光组织化学染色检测小鼠肺组织IL-18表达和定位 各组小鼠肺组织切片常规脱蜡水化后,采用柠檬酸缓冲液微波进行抗原修复,冷却至室温,PBS漂洗,加入5%BSA室温孵育20 min进行封闭,滴加适当稀释后的兔抗IL-18多克隆抗体(1∶200)4℃孵育过夜,次日37℃复温,PBS漂洗,加入Alexa Fluor 647标记的山羊抗兔抗体(1∶800)室温孵育30 min,PBS漂洗,加入5µg/ml DAPI染液室温孵育30 min,PBS漂洗,加入防荧光淬灭剂,荧光显微镜观察。
1.2.5TUNEL试剂盒检测肺组织细胞凋亡 各组小鼠肺组织经4%多聚甲醛固定,石蜡包埋,切片,脱蜡,水化,按TUNEL试剂盒说明书检测肺组织细胞凋亡情况:各组小鼠肺组织切片中加入TUNEL反应液及DAPI染液37℃孵育1 h,PBS洗涤3次,加入防荧光淬灭剂封片,荧光显微镜观察。细胞凋亡率为高倍视野下每100个细胞中TUNEL染色阳性细胞数。实验单独重复3次。
1.2.6肺单个核细胞中Th17与Treg水平检测10%水合氯醛(0.004 ml/g)麻醉小鼠后仰卧位固定,外科剪打开胸腔,暴露心脏,2 ml注射器针头从左心室插入,同时剪破右心房,以1 ml/5 s进行生理盐水灌注,直至右心房流出清亮液体。取双肺组织,生理盐水漂洗,无菌外科剪将肺组织尽量剪碎,置于含0.5 g/LⅠ型胶原酶与DNaseⅠ的DMEM培养基中37℃水浴摇床消化90 min,200目滤网过滤2次,1 000 r/min离心5 min,取底层沉淀,DMEM重悬,轻轻置于40%与80%的Percoll不连续密度梯度液面,3 000 r/min离心20 min,取中层细胞,重悬于10 ml PBS,1 000 r/min离心5 min,洗涤2次,所得底层细胞沉淀即为肺单个核细胞,台盼蓝拒染法检测细胞活力>90%,调整细胞密度至2×106个/ml,流式细胞术检测Th17与Treg占比:①Th17检测:取约2×106个细胞接种于培养皿,含10%FBS的DMEM培养液培养,加入4µl PMA与离子霉素及BFA进行体外刺激,37℃、5%CO2恒温恒湿培养5 h,培养终止后调整细胞至1×106个/ml,取100µl细胞悬液于流式管,加入2µl FITC-CD4,涡旋混匀,4℃避光孵育30 min,加入100 µl固定破膜液,4℃避光孵育15 min,3 ml PBS重悬细胞,1 000 r/min离心5 min,洗涤细胞,弃上清,涡旋分散底层细胞沉淀,加入100µl固定破膜液及5 µl PE-Cy5.5-IL-17A,混匀,4℃避光孵育30 min,PBS再次离心洗涤细胞,加入500µl流式染色缓冲液重悬细胞,上机检测Th17(CD4+IL-17A+)比例;②Treg检测:取1×106个细胞至流式管,PBS按上述方法离心洗涤并重悬,加入5 µl FITC-CD4与APC-CD25,4℃避光孵育40 min,PBS再次离心洗涤细胞,弃上清,涡旋分散细胞,每管加入1 ml固定破膜液,混匀,4℃避光孵育20 min,PBS离心洗涤细胞,加入5 µl PE-FoxP3,涡旋混匀,4℃避光孵育30 min,PBS离心洗涤细胞,加入500µl流式缓冲液上机检测Treg比例(CD4+CD25+FoxP3+)。
1.2.7BALF抽取 小鼠处死后进行气管插管,0.8 ml预冷生理盐水灌洗双肺,停留5~8 s并轻轻按摩双肺组织,缓慢回抽BALF,重复3次。将收集的BALF于4℃、3 000 r/min离心20 min,收集上清,-20℃保存备用。
1.2.8ELISA检测BALF中TNF-α、IL-17A、TGF-1β、IL-10表 达 按 照TNF-α、IL-17A、TGF-1β、IL-10 ELISA试剂盒说明检测各组小鼠BALF中上述细胞因子表达。实验单独重复3次。
1.2.9Western blot检测IL-18、STAT3、p-STAT3及RORγt和FoxP3蛋白水平 取各组小鼠肺组织置于液氮中研磨成粉状,加入400 µl含蛋白酶抑制剂(PMSF)的RIPA裂 解 液 冰 上 消 化30 min,4℃、12 000 r/min离心10 min,上清即为肺组织总蛋白,BCA法进行蛋白定量,按1∶4向上清中加入5×蛋白上样缓冲液,沸水加热变性10 min。取50 µg蛋白进行SDS-PAGE电泳分离蛋白,湿转至PVDF膜,5%脱脂牛奶室温封闭2 h,分别加入IL-18(1∶500)、STAT3(1∶800)、p-STAT3(1∶800)、RORγt(1∶500)、FoxP3(1∶500)、β-actin(1∶2 000)一抗4℃摇床孵育过夜,TBST清洗3次,5 min/次,以HRP标记的二抗(1∶5 000)室温孵育1 h,TBST清洗3次,5 min/次,均匀滴加ECL发光液后于凝胶成像仪曝光拍照,Image J软件测定条带灰度值,蛋白相对表达=目标蛋白灰度值/内参β-actin灰度值。实验重复3次。
1.3统计学分析 采用SPSS19.0软件进行统计学分析,计量资料以±s表示。采用单因素方差分析(one-way ANOVA)进行多组间分析,两组间比较采用LSD-t检验。P<0.05为差异具有统计学意义。
2 结果
2.1IL-18缺陷对LPS诱导的脓毒症肺损伤的影响 观察各组小鼠72 h生存率,结果显示,与WT组小鼠相比,WT LPS组与IL-18-/-LPS组小鼠存活率显著降低(P<0.05),IL-18-/-组小鼠无明显变化(P>0.05);与WT LPS组相比,与IL-18-/-LPS组小鼠存活率显著升高(P<0.05,图1)。各组小鼠肺组织HE染色结果显示,WT组与IL-18-/-组小鼠肺泡结构完整,肺泡上皮细胞及肺泡间隔形态正常,泡腔清晰,无渗出,肺间质无出血、水肿及炎症细胞浸润,WT LPS组小鼠肺泡结构破坏,肺泡腔塌陷或融合,大小不等,肺泡间隔明显增厚,肺间质可见充血、水肿、炎症细胞浸润;IL-18-/-LPS组小鼠肺损伤较WT LPS组小鼠减轻,仅少数肺泡结构破坏,肺间质渗出及炎症细胞浸润减少(图2)。
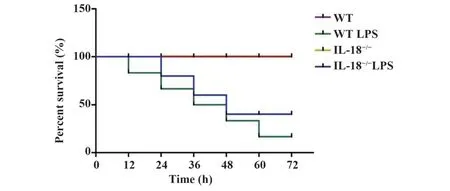
图1 各组小鼠生存曲线Fig.1 Survival curve of mice in each group

图2 HE染色观察各组小鼠肺组织损伤Fig.2 Lung tissue injury of mice in each group observed by HE staining
2.2各组小鼠肺组织IL-18表达及定位RT-PCR及Western blot检测各组小鼠IL-18 mRNA及蛋白表达,结果显示,与WT组相比,WT LPS组小鼠IL-18 mRNA及蛋白表达均显著增加,而IL-18-/-组与IL-18-/-LPS组显著降低(P<0.01,图3);免疫荧光组织化学染色结果同样表明,WT LPS组小鼠IL-18荧光强度较WT组小鼠显著增强(P<0.01),而IL-18-/-组与IL-18-/-LPS组小鼠无明显IL-18荧光表达(图4)。

图3 各组小鼠肺组织IL-18 mRNA及蛋白表达Fig.3 mRNA and protein expressions of IL-18 in lung tissues of mice in each group
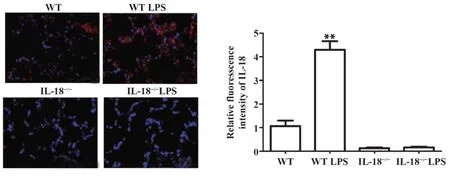
图4 免疫荧光检测各组小鼠肺组织IL-18表达(×200)Fig.4 Expression of IL-18 in lung tissues of mice in each group detected by immunofluorescence(×200)
2.3IL-18缺陷抑制LPS诱导的脓毒症肺组织细胞凋亡TUNEL染色检测各组小鼠肺组织细胞凋亡情况,结果显示,与WT组相比,WT LPS组与IL-18-/-LPS组小鼠凋亡细胞显著增加(P<0.05),IL-18-/-组小鼠无明显变化;而与WT LPS组相比,IL-18-/-LPS组小鼠凋亡细胞显著减少(P<0.05,图5)。

图5 TUNEL染色检测各组小鼠肺组织细胞凋亡Fig.5 TUNEL staining to detect apoptotic cells in lung tissues of mice in each group
2.4IL-18缺陷对LPS诱导的脓毒症肺组织Treg/Th17的影响 流式细胞术检测各组小鼠肺组织单个核细胞Treg与Th17占CD4+T细胞比例的变化,结果显示:与WT组相比,WT LPS组与IL-18-/-LPS组小鼠Treg与Th17占比均明显升高(P<0.05),但WT LPS组Treg/Th17明显降低(P<0.05),而IL-18-/-LPS组该比值显著升高(P<0.05);与WT LPS组相比,IL-18-/-LPS组小鼠Treg占比及Treg/Th17均显著提高(P<0.05),Th17占比差异无统计学意义(P>0.05,图6、表1)。
表1 各组小鼠肺组织Treg、Th17占比及Treg/Th17变化(±s)Tab.1 Changes of Treg,Th17 percentages and Treg/Th17 in lung tissue of mice in each group(±s)

表1 各组小鼠肺组织Treg、Th17占比及Treg/Th17变化(±s)Tab.1 Changes of Treg,Th17 percentages and Treg/Th17 in lung tissue of mice in each group(±s)
Note:Compared with WT group,1)P<0.05;compared with WT LPS group,2)P<0.05.
?

图6 流式细胞术检测各组小鼠Treg、Th17比例变化Fig.6 Treg and Th17 percentages changes of mice in each group detected by flow cytometry
2.5IL-18缺陷对LPS诱导的脓毒症肺组织炎症因子表达的影响ELISA检测各组小鼠BALF中炎症因子TNF-α、IL-17A、TGF-1β、IL-10表达,结果显示,与WT组小鼠相比,WT LPS组与IL-18-/-LPS组小鼠BALF中促炎因子TNF-α、IL-17A、TGF-1β、IL-10表达均显著升高(P<0.05),IL-18-/-组小鼠无明显变化;而与WT LPS组相比,IL-18-/-LPS组小鼠肺组织中抑炎因子TGF-1β、IL-10表达显著增加(P<0.05),而促炎因子TNF-α、IL-17A表达显著减少(P<0.05,表2)。
表2 各组细胞中炎症因子TNF-α、IL-17A、TGF-1β、IL-10表达(±s,pg/ml)Tab.2 TNF-α,IL-17A,TGF-1β and IL-10 expressions of cells in each group(±s,pg/ml)

表2 各组细胞中炎症因子TNF-α、IL-17A、TGF-1β、IL-10表达(±s,pg/ml)Tab.2 TNF-α,IL-17A,TGF-1β and IL-10 expressions of cells in each group(±s,pg/ml)
Note:Compared with WT group,1)P<0.05;compared with WT LPS group,2)P<0.05.
?
2.6IL-18缺陷通过STAT3途径改变LPS诱导的脓毒症肺组织Treg与Th17占比Western blot结果显示,与WT组小鼠相比,WT LPS组与IL-18-/-LPS组小鼠肺组织RORγt、FoxP3表达均降低,而p-STAT3表达显著增加,IL-18-/-组小鼠无明显变化;与WT LPS组小鼠相比,IL-18-/-LPS组小鼠肺组织FoxP3表达显著增加,p-STAT3表达显著降低,而RORγt、STAT3无明显变化,IL-18-/-LPS组小鼠可能通过抑制STAT3磷酸化上调Treg比例(图7)。

图7 Western blot检测各组小鼠肺组织FoxP3、RORγt及STAT3蛋白表达Fig.7 Western blot to detect protein expressions of FoxP3,RORγt and STAT3 in lung tissue of mice in each group
3 讨论
ALI是脓毒症最常见严重并发症,重症患者可发展为ARDS。尽管人们对脓毒症介导的ALI研究众多,但其发病率仍居高不下,病死率可达20%以上[2-3]。因此,积极探索脓毒症导致ALI的相关机制,对疾病早期诊断、治疗及预后评估具有重要临床价值。既往研究证实,Th1/Th2亚群免疫失衡在脓毒症相关ALI的免疫调节中发挥关键作用。严重创伤、感染等应激状态下,机体Th1/Th2平衡被打破,引发异常免疫应答,导致机体对感染的清除能力下降[11-12]。尽管脓毒症介导的ALI损伤机制与Th1/Th2免疫失衡有关,但针对该平衡所采取的干预措施效果却无法令人满意[13]。
Treg是20世纪发现的存在于机体CD4+T细胞中的一个重要亚群,在健康人群中占CD4+T细胞的5%~10%,其中FoxP3是人和动物体内Treg分化的特异性转录因子[14-16]。随着对Treg功能研究深入,研究者发现Treg能够通过表达TGF-β、IL-10等抑炎细胞因子参与免疫应答负性调节:如在肿瘤中,Treg能够通过分泌相关细胞因子发挥免疫抑制作用从而促进肿瘤细胞免疫逃逸[17-18];器官移植中,过继回输Treg能通过降低免疫排斥反应有效保护移植器官功能,延长其存活时间[19]。而Th17是T细胞的另一亚群,能够在IL-6、IL-17A(或IL-17)、RORγt等细胞因子诱导下转录,并通过分泌IL-17A、IL-6及TNF-α等发挥促炎作用[20]。体内Treg/Th17失衡在多种疾病发生、发展过程中具有重要作用,如在幼年特发性关节炎中,Treg/Th17平衡向Th17偏移,导致患儿体内促炎因子IL-6、IL-1β表达增加,促进疾病进展[21]。炎症性肠病中,姜黄素能够通过IL-6/STAT3信号通路调控Treg/Th17平衡治疗溃疡性结肠炎[22]。提示Treg/Th17作为CD4+T细胞的重要组成,对机体免疫功能的正常维持同样发挥不可忽视的作用。
IL-18作为一种重要的促炎因子,能够被肝、肾、骨骼肌等器官及组织的多种细胞(如内皮细胞、单核细胞等)转录并表达,并在抗感染、免疫调节、抗肿瘤及慢性炎症等疾病过程中发挥多项生物学功能[7]。同时,研究显示IL-18作为炎症级联反应上游的重要促炎因子,能够诱导TNF-α、IL-1β、IL-13等早期炎症因子表达,其中TNF-α作为最主要的促炎因子,是内毒素损伤效应的关键递质之一;其次,IL-18还能够通过炎症级联反应进一步诱导下游多种趋化因子(如单核细胞趋化因子、巨噬细胞炎症蛋白等)分泌,并促使其趋化至感染部位,进一步加剧炎症反应[23]。已有研究提示IL-18可调节Treg/Th17平衡,如在阴道念珠菌病中,阴道液中IL-18低表达者更易感染念珠菌,可能与上调Treg表达从而导致Treg/Th17免疫失衡有关[10];小鼠骨质疏松症模型中也证实IL-18通过上调Th17表达,导致Treg/Th17失衡,从而促进破骨细胞生成,导致骨质流失[11]。不过关于IL-18在脓毒症中影响Treg/Th17平衡的作用鲜有报道。
研究显示,小鼠腹腔注射一定剂量(10~20 mg/kg)LPS,6~72 h内 能 较 好 地 动 态 展 示ALI演 变 规律[24-25]。为探究IL-18在ALI发生、发展中的作用,本研究通过敲除IL-18基因表达(IL-18-/-)小鼠腹腔注射15 mg/kg LPS诱导经典小鼠脓毒症模型,发现WT LPS组小鼠72 h生存率较对照组显著降低,且肺组织HE染色显示肺组织结构损害严重,凋亡细胞显著增加,而IL-18-/-组小鼠72 h内生存率、肺组织病理损伤及细胞凋亡均明显改善。进一步研究发现,LPS诱导的ALI小鼠肺组织Treg和Th17占比及相关炎症因子表达均较野生对照组小鼠明显提高,而IL-18-/-LPS组小鼠肺组织Treg占比和Treg/Th17较WT LPS组小鼠显著提高,Treg相关细胞因子TGF-1β、IL-10表达也明显升高,而Th17占比无明显改变,其相关细胞因子TNF-α、IL-17A表达均显著减少。表明LPS诱导的ALI小鼠肺组织中呈过度炎症反应,Treg相关负向免疫调控被抑制,而敲除IL-18基因后,促进Treg表达,小鼠体内Treg免疫应答抑制因IL-18敲除被部分抵消,体内过度炎症反应被抑制。RORγt是Th17分化过程中特征性转录因子,其表达主要受STAT3调节,而STAT3磷酸化可促进RORγt转录及表达[26]。此外,STAT3同样通过多种途径削弱Treg的免疫抑制作用,并抑制其分化与增殖[27]。本研究采用Western blot检测肺组织Treg与Th17重 要 转 录 因 子RORγt、FoxP3蛋 白 表 达 及STAT3磷酸化水平,结果显示,IL-18-/-组小鼠FoxP3表达显著增加,STAT3磷酸化水平明显降低,而RORγt蛋白表达无明显变化,提示敲除IL-18可能通过降低STAT3磷酸化水平促进FoxP3蛋白表达,从而上调Treg比例。
综上,本研究发现IL-18基因缺失能通过降低STAT3磷酸化水平上调FoxP3表达,从而促进Treg及其相关炎症因子表达,改善LPS导致的ALI。本研究补充了IL-18在脓毒症作用中的具体作用及机制,有望为IL-18成为脓毒症ALI治疗过程的新靶点提供依据。