Siglec-15在唑来膦酸特异性γδ T细胞的表达及与抗原提呈相关分子表达的关系①
2023-01-17游红琴黄正华朱会芳李林霖高全立
游红琴 黄正华 朱会芳 韩 露 李林霖 高全立
(郑州大学附属肿瘤医院,河南省肿瘤医院,郑州 450008)
γδ T细胞是外周血中数量较少的CD3+T淋巴细胞亚群,兼具固有免疫和适应性免疫应答特点[1]。γδ T细胞对抗原的识别无主要组织相容性复合体限制性,活化时对共刺激分子信号依赖较少,可在肿瘤发生早期迅速识别多种抗原,如脂质、蛋白质和膦抗原,启动免疫应答[2-4]。经膦抗原激活的γδ T细胞一方面分泌IFN-γ、颗粒酶和穿孔素等效应分子发挥效应细胞功能[5];另一方面与成熟的树突状细胞类似,表达抗原提呈分子人类白细胞抗原(human leukocyte antigen,HLA)-DR和共刺激分子CD80及CD86,发挥专职抗原提呈细胞(antigen presenting cell,APC)功能,对抗原进行加工处理并向初始状态的αβ T细胞提呈抗原,诱导肿瘤特异性细胞毒性T细胞产生[6]。
近期研究发现,唾液酸结合免疫球蛋白样凝集素家族成员唾液酸结合免疫球蛋白样凝集素-15(sialic acid-binding immunoglobulin-like lectin 15,Siglec-15)在肿瘤组织浸润巨噬细胞中表达上调,进而抑制由巨噬细胞发起的适应性免疫应答[7]。Siglec-15在发挥APC功能的γδ T细胞中的表达特点尚无报道,为此,本研究拟从γδ T细胞发挥抗原提呈功能的角度,探索Siglec-15在唑来膦酸(zoledronate,ZOL)激活的γδ T细胞表达特点,分析Siglec-15与共刺激分子CD80、CD86和抗原提呈相关分子HLA-DR在γδ T细胞中表达水平的关系,为今后临床应用γδ T细胞治疗肺癌提供理论基础。
1 材料与方法
1.1材料 淋巴细胞分离液购自美国GE公司;GT-T551 H3培养基购自宝日医生物技术(北京)有限公司;ZOL购自扬子江药业集团;重组人IL-2购自山东泉港药业有限公司;抗人Siglec-15抗体购自上海近岸科技有限公司;流式抗体BV510标记anti-TCRγδ、FITC标记anti-CD3、PE标记anti-CD80、PE/cy7标记anti-CD86和Percp-cy5.5标记anti-HLA-DR均购自美国Biolegend公司;Fortessa流式细胞分析仪和FlowJo V10流式分析软件购自美国BD公司。
1.2方法
1.2.1γδ T细胞的体外培养 收集4例健康对照(healthy control,HC)和5例肺癌患者(lung cancer,LC)外周血,血液标本为2019年12月至2020年7月河南省肿瘤医院免疫治疗科GMP实验室收治的临床检测标本。空腹抽取外周静脉血3 ml于EDTA采血管,2 000 r/min离心10 min(温度22℃,离心半径10 cm),取离心后的自体血浆灭活备用。全血细胞经无血清培养基1∶1稀释后,使用淋巴细胞分离液以2 000 r/min离心20 min(温度22℃,离心半径10 cm)吸取白膜层。以无血清培养基重悬细胞,1 500 r/min离心10 min(温度22℃,离心半径10 cm)去除血小板。再次以无血清培养基重悬细胞,1 200 r/min离心8 min(温度22℃,离心半径10 cm)获取外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。用含3%自体血浆的GT-T551-H3培养基调整细胞浓度为1×106个/ml,分别添加ZOL(浓度为1µmol/L)和IL-2(400 U/ml),将细胞悬液移入48孔板(1 ml/孔),于37℃、含5%CO2的培养箱中培养。培养至第5天时进行第1次传代,将生长状态良好的细胞在培养第6~16天期间每天补液,每隔2 d传代1次。
1.2.2流式细胞术检测Siglec-15、CD80、CD86和HLA-DR在γδ T细胞中的表达 分别取培养前及培养后第4、8、12、16天的细胞悬液,1 500 r/min离心(温度22℃,离心半径10 cm)5 min后,使用含2%胎牛血清的PBS溶液重悬,洗涤1次;调整细胞浓度为1×107个/ml,每管200 µl,用含1%人血白蛋白的PBS溶液室温封闭细胞5 min,1 500 r/min离心(温度22℃,离心半径10 cm)5 min;加入抗人Siglec-15抗体,4℃孵育60 min,用含2%胎牛血清的PBS溶液洗涤2次;加入APC标记二抗,4℃避光孵育30 min,含2%胎牛血清的PBS溶液洗涤2次;加入BV510标记anti-TCRγδ、FITC标 记anti-CD3、PE标 记anti-CD80、PE/cy7标 记anti-CD86和Percp-cy5.5标 记anti-HLA-DR抗体,4℃避光孵育30 min。使用含2%胎牛血清的PBS洗涤2次,重悬于300 µl含2%胎牛血清的PBS,进行流式检测。
1.3统计学方法 实验数据均采用SPSS19.0软件进行统计学分析。数据为计量资料,服从正态分布,数值以±s表示。独立数据组间比较采用单因素t检验;相关性分析采用Spearman法,P<0.05为差异有统计学意义。
2 结果
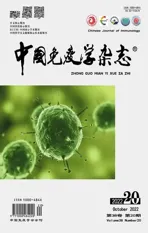
2.1CD80、CD86、HLA-DR和Siglec-15在ZOL激活γδ T细胞的表达 以流式细胞术分析CD80、CD86、HLA-DR及Siglec-15在ZOL刺激前及刺激后不同时间点γδ T细胞的表达(图1)。ZOL刺激前,HC和LC外周血中表达CD80、CD86、HLA-DR和Siglec-15的γδ T细胞比例均较低;随ZOL刺激时间的增加,HC和LC外周血中CD80+γδ T细胞水平出现相似变化趋势:在刺激后4 d升高,刺激后8 d持续升高,刺激后12 d达到峰值;刺激后16 d,CD80+γδ T细胞比例仍保持在高水平。在ZOL刺激前及刺激后的不同时间点,CD80+γδ T细胞水平在两组间差异均无统计学意义(图2A)。共刺激分子CD86在HC和LC外周血γδ T细胞的表达水平呈先升高后降低特点,ZOL刺激后4 d升高,且HC组CD86+γδ T细胞水平显著高于LC组;刺激后8 d达峰值;刺激后12 d后,CD86+γδ T细胞水平降低,刺激后16 d继续下降(图2B)。抗原提呈相关分子HLA-DR在HC和LC外周血γδ T细胞的表达水平呈先升高后降低趋势,ZOL刺激后4 d升高,且HC组的HLA-DR+γδ T细胞水平显著高于LC组;刺激后8 d持续升高,刺激后12 d达到峰值;ZOL刺激后16 d,HLA-DR+γδ T细胞比例下降(图2C)。ZOL刺激后4 d,Siglec-15+γδ T细胞水平在HC组上调至峰值,显著高于LC组;刺激后8 d,Siglec-15+γδ T细胞水平在HC组降低,LC组Siglec-15+γδ T细胞水平上调达峰值;刺激后12 d,两组Siglec-15+γδ T细胞水平均降低;刺激后16 d,表达Siglec-15的γδ T细胞比例降至基线水平(图2D)。

图1 流式细胞术分析CD80、CD86、HLA-DR及Siglec-15表达Fig.1 Expressions of CD80,CD86,HLA-DR and Siglec-15 were analyzed by flow cytometry
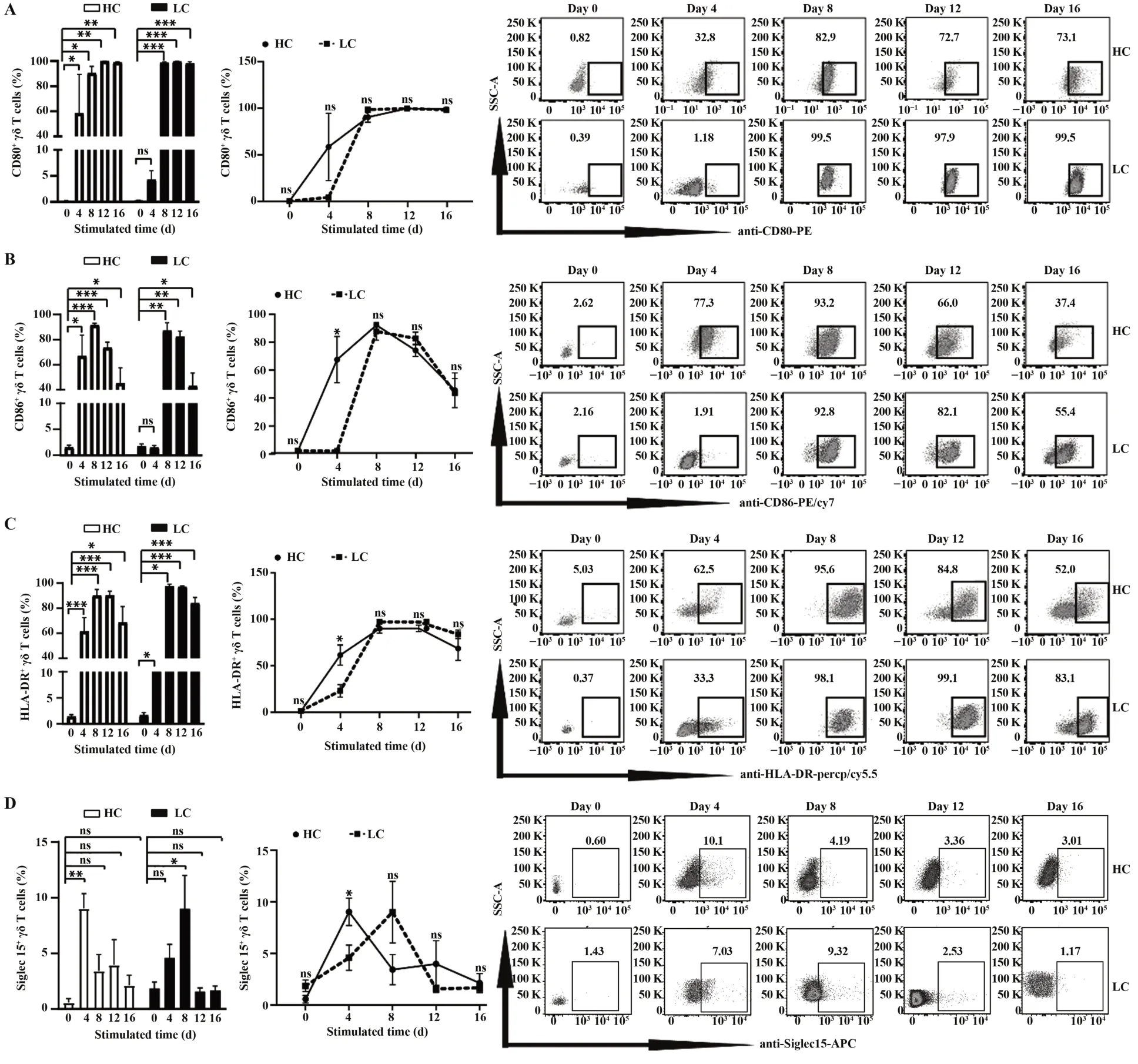
图2 CD80、CD86、HLA-DR和Siglec-15在ZOL激活γδ T细胞的表达Fig.2 Expressions of CD80,CD86,HLA-DR and Siglec-15 on γδ T cells activated by ZOL
2.2Siglec-15与CD80、CD86和HLA-DR在ZOL激活γδ T细胞表达水平的相关性 相关性分析表明,HC组的Siglec-15+γδ T细胞与CD80+、CD86+和HLADR+γδ T细胞比例在各检测时间点均未表现出相关性(图3);LC组Siglec-15+γδ T细胞与CD80+γδ T细胞比例在ZOL刺激前及刺激后的4 d和8 d呈正相关(图4A);与CD86+γδ T细胞的比例在各检测时间点均未表现出相关性(图4B);与HLA-DR+γδ T细胞比例在ZOL刺激前呈正相关(图4C)。

图3 正常对照组Siglec-15与CD80、CD86和HLA-DR在ZOL特异性γδ T细胞表达水平的相关性Fig.3 Correlation of Siglec-15 with CD80,CD86 and HLA-DR expression levels on ZOL specific γδ T cells in HC group
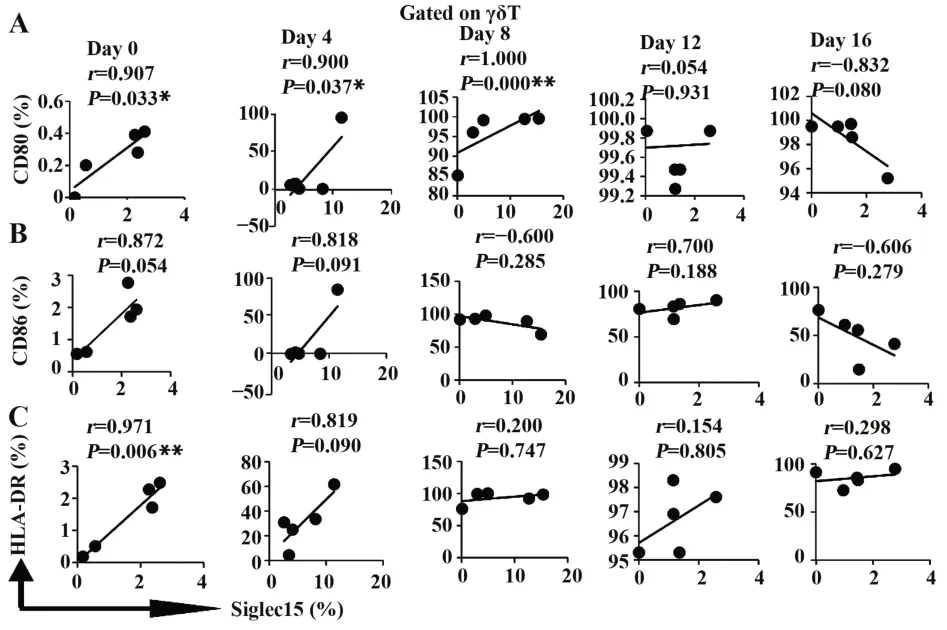
图4 肺 癌 患 者Siglec-15与CD80、CD86和HLA-DR在ZOL特异性γδ T细胞表达水平的相关性Fig.4 Correlation of Siglec-15 with CD80,CD86 and HLA-DR expression levels on ZOL specific γδ T cells in LC patients
3 讨论
除传统手术和放疗外,过继免疫治疗也是肺癌领域研究的热点之一[8]。γδ T细胞发挥免疫监视和抗肿瘤作用,在肺癌细胞治疗方面有广泛的临床应用前景[9-10]。既往研究发现膦抗原活化的γδ T细胞表达高水平的抗原提呈相关分子HLA-DR及共刺激分子CD80、CD86和CD40。表达上述分子的γδ T细胞可向αβ T细胞提呈抗原,刺激αβ T细胞的活化及对肿瘤细胞的杀伤,提示膦抗原激活的γδ T细胞可发挥APC功能,提供初始T细胞活化所需的抗原信号和共刺激信号,介导αβ T细胞针对特异性抗原的免疫应答[11]。
陈列平教授团队研究发现Siglec-15可表达于发挥抗原提呈功能的巨噬细胞表面[12]。本研究以ZOL刺激PBMC,探索抗原提呈相关分子HLA-DR、共刺激分子CD80、CD86和Siglec-15在活化(刺激后0~4 d)及增殖阶段(刺激后5~16 d)γδ T细胞的表达特点。与既往文献报道一致,HC和LC外周血中γδ T细胞被ZOL激活后,在γδ T细胞的活化和增殖阶段均表达高水平的抗原提呈相关分子HLA-DR、共刺激分子CD80和CD86。上述研究提示ZOL激活的γδ T细胞具备提呈抗原能力。在HC中,表达Siglec-15的γδ T细胞比例在活化阶段显著升高,进入增殖阶段后下降至基线水平。LC的外周血中,表达Siglec-15的γδ T细胞水平在早期增殖阶段出现峰值,之后下降至基线水平。随着ZOL刺激时间的延长,Siglec-15在两组γδ T细胞的表达水平均呈先升后降趋势。本研究进一步分析了Siglec-15与CD80、CD86和HLA-DR在γδ T细胞表达水平的关系。发现Siglec-15和CD80在肺癌外周血γδ T细胞的表达水平在ZOL刺激前及刺激后的4 d和8 d均呈正相关,提示在γδ T细胞表达CD80提供T细胞活化所需的第二信号时,Siglec-15的表达水平随之上调,推测Siglec-15可能与CD86发挥协同功能,即向活化的T细胞传导抑制信号,从而避免T细胞过度激活。上述结果提示ZOL在赋予γδ T细胞抗原提呈能力的同时通过上调Siglec-15表达水平抑制其触发的适应性免疫应答,这是机体免疫系统维持免疫稳态的一种调控方式。
综上所述,本研究发现Siglec-15在ZOL特异性γδ T细胞的表达水平先升高后降低,表达水平的上调与CD80表达水平的升高有关。该结果对临床应用γδ T细胞的抗原提呈功能治疗肺癌具有一定的参考价值。