高良姜素对反复呼吸道感染小鼠肺功能的影响
2023-01-16陈志鑫范暖东申广生卜凡丹
陈志鑫,范暖东,申广生,卜凡丹
1.南阳市中心医院,南阳 473000;2.南阳市中医院,南阳 473000
反复呼吸道感染(recurrent respiratory tract infection,RRTI)为儿科常见疾病,病因复杂,部分患儿病情迁延不愈,甚至诱发肺部较重的炎症反应,严重影响患儿的身心健康[1-2]。高良姜素(galangin,Ga)为蜂胶及中药高良姜中一种重要的黄酮醇类化合物,具有抗炎、抗过敏和清除自由基的药理学活性[3]。高良姜素可通过阻断组胺及多种炎症介质的表达缓解肥大细胞源性过敏性炎症,并且能够有效抑制臭氧所致慢性阻塞性肺病小鼠、白蛋白诱导所致过敏性哮喘小鼠的气道炎症,缓解呼吸道症状[4-5]。研究显示,反复呼吸道感染引起的炎症反应与核因子-κB(nuclear factor-κB, NF-κB)/干扰素调节因子3(interferon regulatory factor 3,IRF3)通路介导的细胞信号途径有关[6],为此本研究探讨高良姜素对RRTI模型小鼠肺功能及NF-κB/IRF-3通路的影响,以期阐明其抗气道炎症作用的具体机制,为临床治疗RRTI提供依据。
1 仪器与材料
1.1 仪器
BL-420F型生物机能实验系统(日本奥林巴斯公司);SW1022-ProfiBlot 48 型全自动蛋白印迹分析仪(Bioneer公司);IX73型倒置荧光显微镜(日本奥林巴斯光学有限公司)。
1.2 试药
高良姜素(Ga,美国Sigma公司);注射用氢化可的松琥珀酸钠(规格:10 mg,天津生物化学制药有限公司);水合氯醛,白细胞介素-1β(interleukin-1β,IL-1β),白细胞介素-4(interleukin-4,IL-4)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒均购自武汉EIAab公司;NF-κB p65、p-NF-κB p65、IRF3、p-IRF3一抗及GAPDH抗体均购自美国Abbiotec公司。
1.3 动物
SPF级雄性BALB/c小鼠40只,3周龄,体质量为12~16 g,购自北京维通利华实验动物技术有限公司。动物合格证号: 202010107。动物许可证号:SCXK(京)2020-2-008。
2 方法
2.1 RRTI小鼠模型的建立及分组
将40只雄性BALB/c小鼠适应性喂养1周后,随机分为4组:空白对照组、RRTI模型组、Ga低剂量组、Ga高剂量组,每组10只,全部操作经实验动物管理委员会批准。除空白对照组外,其余3组参考文献的方法[7]均采用疲劳结合饮食失节加烟熏法建立RRTI小鼠模型:连续30 d,每日将小鼠放于深15 cm,水温25 ℃的水池中游泳,当小鼠口鼻浸入水中表明其已达耐力极限时停止游泳;实验期间,单日给小鼠喂食白菜,每只15 g;双日用10 mL·kg-1猪油脂灌胃,交叉喂养,自由饮水和食用饲料;在建模第15天时,使用刨花加烟叶混合烟熏小鼠,每天30 min,连续15 d;当建模小鼠出现游泳耐力明显下降、精神萎靡、毛发枯槁易脱、弓背、眯眼以及消瘦、咳嗽、呼吸急促等症状时表明造模成功。在建模同时,Ga低、高剂量干预组连续分别腹腔注射给予5、10 mg·kg-1的Ga,空白对照组及模型组则给予等量的生理盐水。末次给药后的第2天,空腹12 h后进行后续相关指标检测。
2.2 RRTI模型小鼠肺功能测定
将上述各组小鼠使用水合氯醛(质量浓度0.1 g·mL-1)腹腔注射麻醉,参考文献的方法[8]测定各组小鼠肺功能:将小鼠固定在操作台上,颈部做纵向切口后分离气管,气管上做倒“T”形切口,插入并固定气管插管,接入生物信号采集系统呼吸传感器,记录呼吸曲线,测定小鼠肺功能0.1 s用力呼气容积(forced expiratory volum in 0.1 second,FEV0.1)、0.2 s用力呼气容积(forced expiratory volum in 0.2 second,FEV0.2)、用力呼气流量25-75(forced expiratory flow,FEF 25-75)、最高呼气流速(peak expiratory flow,PEF)。
2.3 RRTI模型小鼠血清中炎症因子水平检测
各组小鼠在肺功能检测结束后,进行腹主动脉采血,分离血清,于4 ℃静置20 min后,以2 000 r·min-1于4 ℃离心20 min,随后抽取上清,分装后置于-80 ℃保存待测。采用酶联免疫法检测血清中IL-1β、TNF-α和IL-4的水平[9]。
2.4 模型肺泡灌洗液中炎性细胞及炎症因子水平检测
各组小鼠在肺功能检测结束后,参考文献的方法[10],在气管切口处插入气管套管,用注射器抽取1 mL预冷的生理盐水,缓慢注入小鼠肺泡内,缓慢抽出并重复3次,将收集的肺泡灌洗液于4 ℃离心15 min(3 000 r·min-1),取上清液,按照酶联免疫吸附(ELISA)试剂盒说明书操作,检测各组小鼠肺泡灌洗液(alveolar lavage fluid,BALF) 中IL-1β、TNF-α、IL-4的表达水平;离心后的下层沉淀用生理盐水稀释后涂在载玻片上,采用瑞士-吉姆萨染色分类计数炎症细胞(巨噬细胞、嗜酸性粒细胞、淋巴细胞、中性粒细胞)的数量。
2.5 RRTI模型小鼠肺组织病理学观察
在肺泡灌洗液收集结束后,处死小鼠,分离肺组织,参考文献的方法[11]进行苏木素精及伊红(HE)染色:体积分数4%甲醛溶液固定24 h,二甲苯透明,石蜡包埋,苏木素精及伊红染色,利用光学显微镜观察支气管、肺组织形态学及病理学改变,并进行图像采集。
2.6 模型肺组织NF-κB/IRF3信号通路蛋白测定
分离上述各组小鼠的肺部组织,参考文献的方法[12]制备肺组织匀浆,RIPA裂解后提取肺组织总蛋白,BCA试剂盒进行蛋白定量。随后常规上样,进行聚丙烯酰胺凝胶电泳,经转膜、封闭,随后依次加入兔源单克隆NF-κB p65(1∶1 000)、p-NF-κB p65(1∶1 000)、IRF3(1∶1 000)、p-IRF3(1∶1 000)一抗,辣根过氧化物酶标志羊抗兔二抗(1∶2 000),化学底物发光法显色,图像扫描分析,采用Image-QuaNT软件测量其光密度,以各GAPDH为内参进行对照分析。
2.7 统计学方法
3 结果
3.1 Ga对模型小鼠肺功能的影响
与空白对照组比较,RRTI模型组的FEV0.1、FEV0.2、FEF 25-75、PEF均显著降低(P<0.05)。与RRTI模型组比较,Ga低、高剂量组的FEV0.1、FEV0.2、FEF 25-75、PEF均显著升高(P<0.05),Ga高剂量组较低剂量组上述指标显著升高(P<0.05)。见表1。
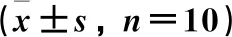
表1 各组小鼠肺功能比较
3.2 Ga对模型小鼠肺组织病理学的影响
空白对照组小鼠肺组织结构清晰,肺泡大小均匀,气道黏膜上皮结构完整,纤毛排列整齐,无炎性细胞浸润。RRTI模型组小鼠肺组织结构破坏明显,肺泡壁塌陷,肺泡腔不规则扩大,支气管黏膜上皮可见大量杯状细胞增生,肺泡间质及气道内存在大量炎性细胞浸润,腔内可见明显的黏液。Ga干预组小鼠肺组织损伤较模型组明显减轻,尤其Ga高剂量组肺泡完整性较好,肺泡融合范围明显缩小,肺间质及气道炎性细胞浸润程度明显减轻,但仍然存在少量炎症细胞浸润。见图1。

注:A.空白对照组;B.RRTI模型组;C.Ga低剂量组;D.Ga高剂量组。
3.3 Ga对模型小鼠炎症因子水平的影响
与空白对照组比较,RRTI模型组血清及肺泡灌洗液中IL-1β、TNF-α和IL-4的水平均显著上升(P<0.05或P<0.01)。与RRTI模型组比较,Ga低、高剂量组血清及肺泡灌洗液中IL-1β、TNF-α和IL-4的水平均显著降低(P<0.05或P<0.01),Ga高剂量组较低剂量组上述指标均显著降低(P<0.05)。见表2。
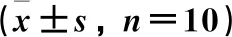
表2 各组小鼠炎症因子水平的比较
3.4 Ga对模型小鼠肺泡灌洗液炎性细胞数量的影响
与空白对照组比较,RRTI模型组肺泡灌洗液中巨噬细胞、嗜酸性粒细胞、淋巴细胞和中性粒细胞的数量均显著增加(P<0.05)。与RRTI模型组比较,Ga低、高剂量组肺泡灌洗液中巨噬细胞、嗜酸性粒细胞、淋巴细胞和中性粒细胞的数量均显著减少(P<0.05),Ga低、高剂量2组间上述指标的差异有统计学意义(P<0.05)。Ga高剂量组较低剂量组肺泡灌洗液中的上述炎性细胞数量显著减少(P<0.05)。见表3。
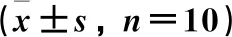
表3 各组小鼠炎性细胞数量的比较
3.5 Ga对模型小鼠NF-κB/IRF3信号通路的影响
与空白对照组比较,RRTI模型组肺组织中p-IRF3/IRF3、p-NF-κB p65/NF-κB p65的相对表达量均显著增加(P<0.05)。与RRTI模型组比较,Ga低、高剂量组肺组织中p-IRF3/IRF3、p-NF-κB p65/NF-κB p65的相对表达量均显著降低(P<0.05),Ga高剂量组较低剂量组肺组织中上述通路蛋白的表达量均显著降低(P<0.05)。见表4。

表4 各组小鼠NF-κB/IRF3信号通路蛋白表达比较
4 讨论
Ga可通过Nrf-2-Keap1抗氧化系统有效抑制慢性阻塞性肺病小鼠气道炎症的发生和发展,同时Ga可降低哮喘小鼠多种炎症因子的表达,减轻哮喘小鼠气道炎症,改善慢性阻塞性肺病小鼠和哮喘小鼠的呼吸道症状[13-14]。在本研究中,Ga能明显改善RRTI模型小鼠FEV0.1、FEV0.2、FEF 25-75、PEF等肺功能指标,病理学结果显示,Ga干预组小鼠肺泡融合范围明显缩小,肺间质及气道炎性细胞浸润程度明显减轻,表明Ga能明显降低RRTI模型小鼠气道受阻的程度,改善肺功能。因此,Ga对于改善反复呼吸道感染的肺功能同样具有较好的疗效。
小儿反复呼吸道感染可伴发呼吸道多种炎症细胞及炎症介质的释放,明显存在嗜酸性粒细胞、淋巴细胞和肥大细胞等炎症细胞的浸润,其中嗜酸性粒细胞还可通过释放前炎症介质和细胞毒性介质来调节气道炎症[15-16]。TNF-α作为一种强有力的致炎症因子,可以刺激呼吸道中白细胞和内皮细胞表达黏附分子,并上调其他致炎细胞因子的表达[17];IL-1β及IL-4作为人体内重要的前炎症细胞因子,可激活和募集上述炎症细胞,加重人体呼吸道的炎症反应[18];在本研究中,Ga能够明显减少RRTI模型小鼠肺泡灌洗液中巨噬细胞、嗜酸性粒细胞、淋巴细胞、中性粒细胞的数量,显著降低血清及肺泡灌洗液中IL-1β、TNF-α、IL-4的水平,表明Ga能明显抑制RRTI模型小鼠气道炎症,减少炎症细胞浸润,缓解机体的炎症反应和因炎症诱导的肺损伤。
反复呼吸道感染存在的炎症反应与NF-κB/IRF-3介导的细胞信号途径有关,多种呼吸道感染物可激活IRF-3和 NF-κB信号,促使下游促炎因子的过度表达和释放,增强细胞基质的合成,从而影响气道炎症反应[19-20]。研究显示,柴胡提取物可通过抑制NF-κB信号减少IL-1β、 IL-4、TNF-α等炎性因子的产生和聚集,从而改善哮喘小鼠的呼吸道炎症[21]。在本研究中,RRTI模型小鼠均存在NF-κB和IRF3的活化,表明RRTI模型小鼠的气道炎症与NF-κB/IRF-3的异常激活有关;在给予Ga干预后,NF-κB和IRF3的活化均受到抑制,同时IL-1β、TNF-α、IL-4等炎症因子的水平明显降低,表明Ga对RRTI模型小鼠气道炎症的缓解作用与抑制NF-κB/IRF-3信号通路、减少炎症因子的产生有关。
综上所述,Ga可改善RRTI模型小鼠肺功能、减轻炎症反应,其作用机制可能与调控NF-κB/IRF-3信号通路、降低炎症因子水平和减少炎性细胞数量有关。
