基于水稻长大粒染色体片段代换系Z66的粒型QTL的鉴定及其聚合分析
2023-01-16向思茜李儒香徐光益邓岢莉余金琎李苗苗杨正林凌英华桑贤春何光华赵芳明
向思茜 李儒香 徐光益 邓岢莉 余金琎 李苗苗 杨正林 凌英华 桑贤春 何光华 赵芳明
基于水稻长大粒染色体片段代换系Z66的粒型QTL的鉴定及其聚合分析
向思茜 李儒香 徐光益 邓岢莉 余金琎 李苗苗 杨正林 凌英华 桑贤春 何光华 赵芳明*
西南大学水稻研究所 / 西南大学农业科学研究院 / 转基因植物与安全控制重庆市重点实验室, 重庆 400715
水稻籽粒大小是一个复杂的农艺性状, 受多基因控制。染色体片段代换系是创造自然变异的有效手段, 也是复杂性状研究的理想材料。本研究构建了一个新的水稻长大粒染色体片段代换系Z66, Z66以日本晴的基因组为遗传背景, 含有来自R225的12个代换片段, 平均代换长度为3.32 Mb。然后, 以日本晴/Z66创建的次级F2群体定位出12个控制水稻籽粒大小的QTL, 并培育出具有目标QTL的5个新单片段代换系(S1~S5)和4个新双片段代换系(D1~D4)。其中有9个QTL ()可被单片段代换系所验证, 表明这些QTL遗传稳定。此外, 还利用单片段代换系鉴定到6个新的QTL (、、、、、)。在这18个QTL中,可能是新鉴定的QTL。双基因聚合分析表明, 不同QTL间聚合产生不同的上位性效应。如(a=0.21)和(a=0.08)聚合产生了0.10的上位性效应, 使D2具有比受体日本晴、S1 ()和S4 ()更大的谷粒长宽比, 且差异显著。(a=3.99)和(a=3.98)聚合产生了-5.35的上位性效应, 其遗传效应(2.62)使D3的千粒重比日本晴显著增加, 而比S1 ()和S5 ()显著减少。了解QTL间的互作效应可对未来基因型的表型进行预测, 从而对实现智能型设计育种至关重要。
水稻; 粒型; QTL; 染色体代换片段; 加性效应; 上位性效应
2008年的食物安全问题仍然使许多亚洲国家记忆犹新, 突如其来的俄乌冲突再次挑动世界粮食危机的敏感神经。保障粮食安全是各国的重中之重, 刻不容缓。稻米作为世界半数以上人口的主要口粮, 在国计民生中具有举足轻重的地位。进一步提高其产量是应对人口持续增加的有效途径。我们肩负着在淡水资源日渐缺乏、农田和投入不断减少的情况下生产更多的稻米的艰巨使命[1-2]。因而, 进一步提高水稻育种效率势在必行。在后基因组时代, 旨在调控作物全部重要农艺性状等位变异基因的“设计育种”概念已被提出。而其核心是自然变异的利用[3]。
遗传变异产生的途径主要有2种, 即自然变异和人工诱变。人工诱变产生的突变体表型往往是由野生基因缺失引起的, 因而不利突变居多。另一个负面影响是随机突变产生的功能缺失突变远多于基因修饰或新的属性[4-6]。与人工诱变相比, 自然变异有以下优点: (1) 许多变异是数量性状, 由QTL控制; (2) 引起的表型变异不仅仅是等位基因功能的存在或缺失, 而且也可能来自功能弱的等位基因; (3)自然变异可在基因功能不丧失的情况下进行基因功能性分析; (4) 自然变异可识别对整体表型有微小影响的基因并研究复杂性状的遗传结构[4-6]。染色体片段代换系(chromosome segment substitution lines, CSSLs)是创造丰富自然变异的理想材料, 它们是从野生和远缘种导入到栽培品种中的优良遗传基因库。每个染色体片段代换系在受体基因组的遗传背景下仅含一个或少量来自供体亲本的染色体代换片段[7]。当仅含有唯一代换片段时, 称之为单片段代换系(single segment substitution lines, SSSL)[3]。这些CSSL可用于评估任何不同于受体亲本的目标表型[7]。由于其遗传背景与受体亲本只有代换片段的差异, 可消除遗传背景的干扰, 因而作为次级作图群体可更精确地分析QTL[3]。已有研究利用水稻CSSL鉴定了一些重要性状的QTL[8-16], 发掘了其中的等位基因变异[17-20], 并分析了QTL之间及QTL与环境之间的互作[21-23], 同时还对一些重要基因进行了克隆及功能分析[24-26]。尤其, 染色体片段代换系鉴定的基因可直接应用于生产实践, 使遗传研究与育种紧密相连, 因此可作为设计育种的理想材料。张桂权等已通过SSSL设计出了“华小黑1号” (粤审稻2005015)、“华标1号” (粤审稻2009033)等黑米、优质品种, 并利用恢复力最强的和等位基因, 育成了具有强恢复力的HJX74恢复系[27]。一系列的研究表明目标染色体代换是水稻设计育种的一种方法[3]。
鉴于不同的等位基因分布于不同的亲本材料中,为了实现不同生态区的育种计划, 本研究创建了以粳稻品种日本晴为受体亲本, 西南大学自育恢复系R225为供体亲本的一系列水稻染色体片段代换系。本文以含12个代换片段的长大粒CSSL-Z66为研究材料, 拟阐明以下科学问题: (1) 鉴于Z66含有12个来自R225的代换片段及与受体日本晴存在极显著的粒型差异, 哪些QTL负责这些差异性状, 且在这些代换片段中如何分布?(2) 如果控制某一性状的QTL多于1个, 它们属于独立遗传, 还是存在上位性互作, 各自的加性效应和相互间的上位效应如何?(3) 在这些QTL中, 哪些是已报道的, 哪些是新发现的QTL?弄清这些问题, 无论对新产生的等位变异基因的分子机制解析, 还是为西南地区水稻分子育种提供设计元件, 均具有重要意义。因而本文拟系统地分析Z66, 并以日本晴/Z66构建的次级F2分离群体进行粒型QTL定位, 进一步以分子标记辅助选择(molecular marker assisted selection, MAS)分离这些目标QTL的次级单片段代换系和双片段代换系, 然后分析这些QTL的遗传稳定性和QTL间的上位性效应, 为这些QTL的进一步分子机制研究和设计育种奠定基础。
1 材料与方法
1.1 试验材料
Z66是以日本晴为受体亲本, 籼型大粒恢复系R225为供体亲本, 通过高代回交和自交, 结合全基因组SSR分子标记辅助选择选育而成的长大粒染色体片段代换系。QTL定位群体是由日本晴与Z66杂交创建的由150个单株组成的次级F2群体。
次级单片段代换系(SSSL)和双片段代换系(double segment substitution lines, DSSL)选育材料, 是据基因型和表型从F2群体中选择的9个含目标QTL的单株, 然后于2021年种成9个株系(Z1085~ Z1093)。
1.2 试验方法
1.2.1 Z66代换片段系培育及代换片段鉴定 首先以均匀分布于水稻全基因组的429个SSR标记, 进行日本晴和R225的多态性分析, 选出253个多态性标记[28], 然后用这些多态性标记从日本晴/R225的BC2F1代进行分子标记辅助选择(MAS), 即对20个BC2F1单株用253个SSR标记进行分子鉴定, 与受体日本晴带型一致时标“A”, 与供体R225的带型一致时标“B”, 杂合带型标“H”。然后将这20个单株与日本晴回交、自交, 具体选育流程如图1, 然后在每一代每个株系选20株用其中的“H”标记和“B”标记进一步MAS, 选出一系列以R225为供体的水稻染色体片段代换系。本文所用的含12个代换片段的长大粒Z66是其中之一, Z66的株型、有效穗数、粒数等性状与日本晴相近。Z66的染色体代换片段鉴定参照崔国庆等[29]描述的方法, 估计代换片段长度的计算参照Paterson等[30]描述的方法进行。
1.2.2 材料种植 2019年6月, 在西南大学重庆歇马基地, 以日本晴与Z66杂交, 收取杂交种并于同年在海南陵水基地种植, 并收获F1种子。2020年3月12日, 在重庆歇马基地进行日本晴、Z66和F2群体育苗, 4月20日, 以株、行距分别为16.67 cm和26.67 cm移栽亲本各30株以及150个F2单株于同一试验田。2021年3月10日, 在重庆歇马基地进行日本晴、Z66和从F2群体选出9个单株育苗, 于4月18日, 将日本晴、Z66和9个株系(Z1085~Z1093)各移栽30株, 按常规方式进行管理。
1.2.3 粒型性状分析 成熟后, 于2020年7月下旬收取日本晴和Z66各10株, 及定位群体150株, 参照Wang等[20]描述的方法考察粒长、粒宽、谷粒长宽比和千粒重。首先将每株脱粒, 然后每株每次选均匀一致的10个籽粒, 分别按长和宽首尾相连排列, 然后用20 cm直尺测量其长度和宽度, 重复3次, 最后计算每粒平均数。谷粒长宽比以粒长与粒宽的比值计算。对于千粒重, 每株每次选饱满籽粒200粒作为一单元, 在电子天平上称量, 重复3次, 然后乘以5计作每株的千粒重。最后以Microsoft Excel 2016计算各材料每株的各性状平均值、标准差, 并对日本晴和Z66的10株各性状进行两尾等方差检验。
1.2.4 QTL定位 采用CTAB法[31]提取Z66、日本晴和F2分离群体的150个单株的DNA, 按照Zhao等[32]描述的方法进行PCR扩增和10%聚丙烯酰胺凝胶电泳。分别将日本晴、Z66、杂合带型和缺失带型用“-1”、“1”、“0”和“.”来表示基因型赋予值, 结合150个F2单株对应的表型值, 利用SAS9.3统计软件(SAS Institute Inc, Cary, NC, USA)的混合线性模型(mixed linear model, MLM)法进行QTL定位, 以阈值<0.05判断存在控制某一性状的QTL。
1.2.5 次级单片段代换系和双片段代换系培育 据2020年QTL定位信息, 从F2代选择9个含目标QTL的单株(含目标代换标记及0~1个杂合标记), 2021年种成株系(Z1085~Z1093)。然后每个株系取30株的叶片提取DNA, 利用分子标记辅助选择(MAS)进一步对其中的杂合标记和目标代换标记进行跟踪筛选, 选育单片段代换系(SSSL)和双片段代换系DSSL。然后于2021年7月下旬, 收获10株日本晴和选育出的SSSL及DSSL的所有单株(6~10株), 按相同的方法测量粒长、粒宽、长宽比和千粒重, 用于目标QTL验证和QTL间的上位性互作分析。
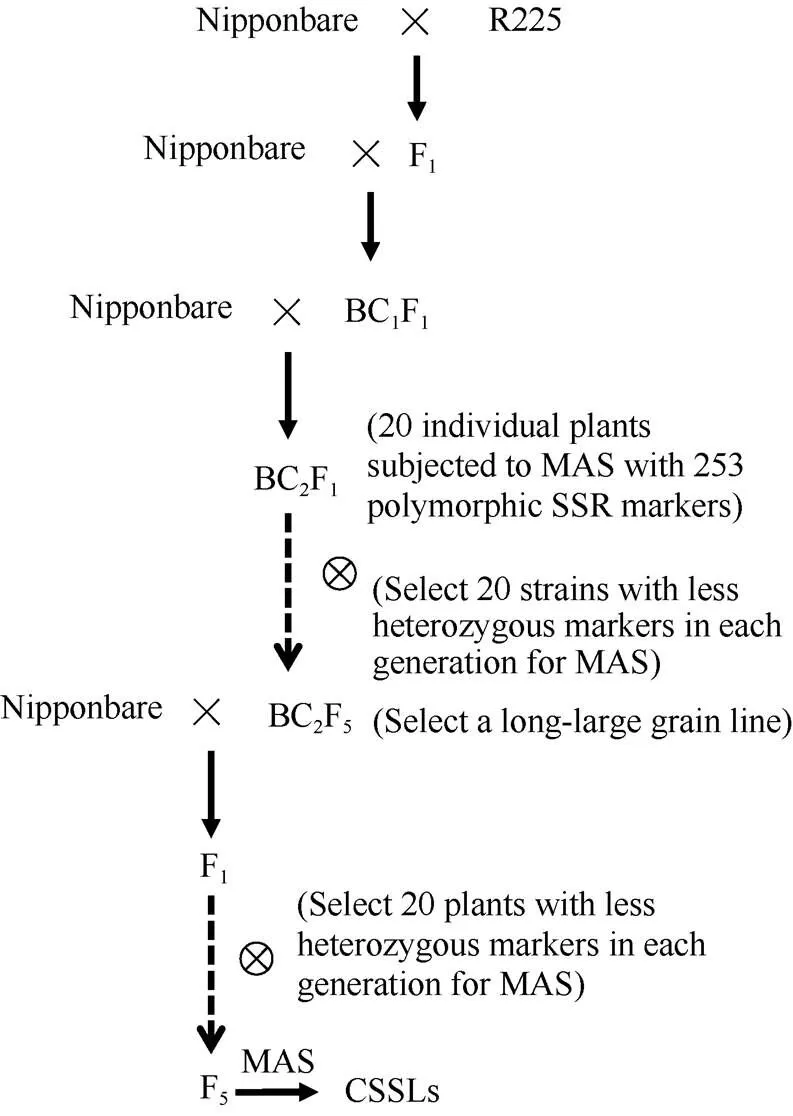
图1 包括Z66的CSSLs的选育过程
MAS: 分子标记辅助选择; CSSL: 染色体片段代换系。
MAS: molecular marker assisted selection; CSSL: chromosome segment substitution lines.
1.2.6 基于5个SSSLs的QTL验证 对于每个SSSL (S1~S5), 首先, 我们假设0: SSSL的代换片段不存在控制某一性状的QTL。因此对每个SSSL和受体日本晴的某一性状进行测验, 若<0.05时, 表明假设不成立, 即SSSLi的代换片段存在控制某一性状的QTL。根据在特定环境条件下, 日本晴的遗传模型0=0+和单片段代换系的遗传模型P=0+a+ε (0为日本晴某一性状的表型值,a为QTL的加性效应,P和0分别表示SSSL和日本晴的表型值,为随机误差[33], 我们可估计出该QTL的加性效应a= (P-0)/2 (表型差一半被估算为由遗传引起)。所有计算均在Microsoft Excel 2016中进行。
1.2.7 基于双片段代换系的目标QTL间的上位性效应分析 对于双片段代换系DSSL, 我们假设0:位于“”和“”代换片段的2个控制某一性状的QTL (Q1和Q2)属于独立遗传, 可表示为“2+0=1+1”。对(日本晴+DSSL)和(SSSL+SSSL)进行检验, 当>0.05时, 则假设成立, 表明这2个QTL独立遗传。此时(日本晴+DSSL)的表型值与(SSSL+SSSL)无显著差异。而<0.05时, 则表明假设不成立, 即位于“”和“”代换片段的Q1和Q2间存在上位性效应, 即“2+0≠1+1”。根据相应的遗传模型, 日本晴:0=0+, SSSLi:P=0+a+, SSSLj:P=0+a+和DSSL:P=0+a+a+I+ε (0为日本晴的平均值,a和a分别为代换片段和的QTL加性效应, 其显著性由相应的单片段代换系SSSL和相应的单片段代换系SSSL及日本晴检验, 具体方法见1.2.6,I为代换片段和的Q1和Q2之间的上位性效应,代表随机误差)[33]。具体鉴定的示意图如图2。我们可知, Q1和Q2之间的上位性效应I = [(0+P)-(P+P)]/2 (表型差的一半被估算为由遗传引起)。最后, 使用IBM SPSS Statistics 25.0对所有SSSLs和DSSLs以及日本晴进行Duncan’s多重比较。
2 结果与分析
2.1 Z66的代换片段鉴定和粒型分析
在Z66选育的基础上, 以代换片段上的17个SSR 记及代换片段外的236个多态性SSR标记对10株Z66进行了代换片段和遗传背景的检测。结果表明, Z66的代换片段鉴定准确, 没有检出其他来自Z225的残留片段。Z66含有来自R225的12个代换片段, 分布在2号、3号、4号、6号、7号、9号和10号染色体上, 其估计的代换片段长度见图3。所有代换片段的总长度为39.81 Mb, 其中最长的为13.90 Mb, 最短的为0.25 Mb, 平均代换长度为3.32 Mb (图3)。
Z66与日本晴株型相近(图4-A), 最明显的差异表现在籽粒的大小和形状(图4-B, C)。与日本晴相比, Z66的粒长、长宽比和千粒重均极显著增加, 分别增加了10.35、8.62和7.04个百分点(图4-B, D, F, G), 而Z66的粒宽与日本晴无显著差异(图4-C, E)。
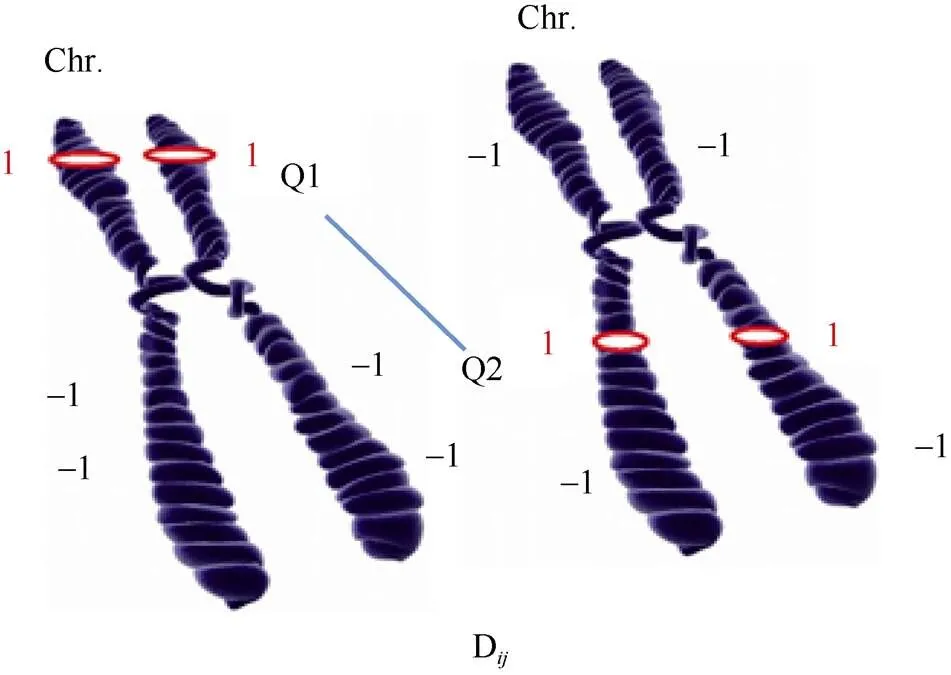
图2 双片段代换系DSSLij的Q1 (第i代换片段)和Q2 (第j代换片段)间的上位性互作示意图
D表示含有第代换片段和第代换片段的双片段代换系, 某一性状QTL (Q1和Q2)的加性效应由相应的的单片段代换系SSSL(含“”代换片段)和SSSL(含“”代换片段)鉴定。Q1和Q2间的加性×加性上位性效应, 由(日本晴+DSSL)和(SSSL+SSSL)进行鉴定。Chr. 代表分别含Q1和Q2的2条水稻染色体, 黑色区表示来自受体日本晴的染色体遗传背景, 标记基因型用“(-1,-1)”表示, 红色区表示来自供体R225的代换区, 其标记基因型用“(1, 1)”表示, Q1和Q2分别表示某一性状的QTL, 位于红色的供体代换区内, Q1和Q2间的连线表示二者间存在上位性互作(<0.05)。
Drepresents the double-segment substitution line containing the “”substitution segment and the “” substitution segment. The additive effects of QTLs (Q1 and Q2) for a certain trait were detected by the according SSSL(containing single “”substitution segment) and SSSL(containing single “”substitution segment). The epistasis effect between Q1 and Q2 is detected by (Nipponbare+DSSL) and (SSSL+SSSL). Chr. represents 2 rice chromosomes carrying Q1 and Q2, respectively. Black region represents the genetic background of the recipient Nipponbare, the genotypes of markers are represented by “(-1,-1)”, the red region represents the substitution region from the donor R225, the genotypes of marker are represented by “(1, 1)”, and if there is QTL for a trait in the substitution regions, they are showed as Q1 and Q2, respectively. The connecting between Q1 and Q2 shows existing epistasis effect at< 0.05.
2.2 粒型性状在日本晴/Z66次级F2群体的频率分布
根据日本晴/Z66构建的次级F2群体的粒型频率分布(图5), 粒长(图5-A)、粒宽(图5-B)、长宽比(图5-C)和千粒重(图5-D)的分布仍然呈现正态分布, 表明这些性状仍由多基因控制, 可以进行QTL分析。
2.3 基于日本晴/Z66次级F2群体的粒型QTL鉴定
以日本晴/Z66构建的次级F2分离群体共鉴定出12个粒型QTL, 分别为3个粒长QTL, 3个粒宽QTL, 3个长宽比QTL和3个千粒重QTL, 分布于3号、6号、7号、9号和10号染色体的相应代换片段上(表1和图3)。
、和与Z66的长粒性状连锁, 分布于3号、7号和10号染色体的代换片段上, 来自R225的相应等位基因分别使Z66的粒长增加0.21、0.10和0.13 mm, 其对表型变异的贡献率分别为8.95%、2.61%和4.62%。、和与Z66的宽粒性状连锁, 来自R225的和的加性效应分别使Z66粒宽减小0.11 mm和0.10 mm, 而则使Z66的粒宽增加0.12 mm, 三者对粒宽变异的贡献率分别为30.78%、14.87%和39.18%。由于、和对粒宽的加性效应相反可能导致Z66的粒宽与日本晴无显著差异。和与Z66的千粒重性状连锁, 其中和增加粒重, 加性效应分别为1.14 g和0.73 g, 分布于3号和10号染色体的代换片段上, 而的加性效应则减小粒重0.79 g, 位于9号染色体的代换片段上。3个粒重QTL对表型变异的贡献率依次分别为9.48%、5.14%和6.05%。影响Z66的谷粒长宽比的QTL 为和, 其加性效应均增加长宽比, 其对表型变异的贡献率依次为14.78%、44.93%和6.40% (表1和图3)。

图3 Z66的染色体代换片段
每条染色体左侧为物理距离(Mb)和定位的QTL, 右侧为标记名称和代换长度(黑箭头指向)。GL: 粒长; GW: 粒宽; RLW: 谷粒长宽比; GWT: 千粒重。
Physical distances (Mb) and mapped QTL are marked at the left of each chromosome; substitution length (black arrow direction) are displayed at the right of each chromosome. GL: grain length; GW: grain width; RLW: ratio of grain length to width; GWT: 1000-grain weight.
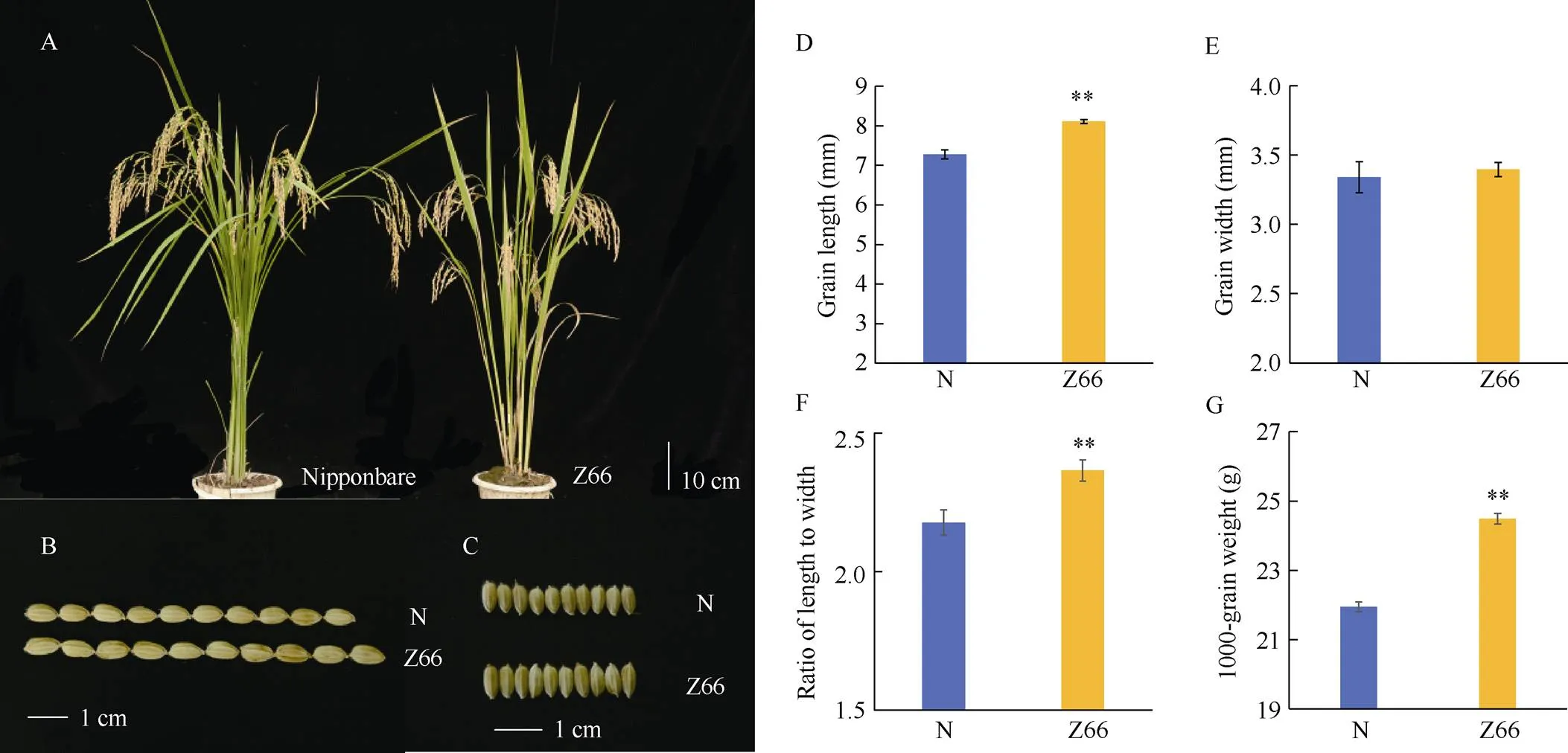
图4 日本晴和Z66的粒型及其统计分析
A: 株型; B: 粒长; C: 粒宽; D~G: 日本晴和Z66的粒长、粒宽、长宽比和千粒重统计分析;**表示日本晴和Z66性状间存在极显著(< 0.01)差异。
A: plant type; B: grain length;C: grain width; D–G: the statistics analysis of grain length, grain width, ratio of length to width, and 1000-grain weight. ** indicate significant difference between the traits of Nipponbare and Z66 at< 0.01, respectively.

图5 粒型性状在日本晴/Z66构建的次级F2群体中的频率分布
A~D: 分别依次为粒长、粒宽、长宽比和千粒重的频率分布。
A–D: the frequency distribution of grain length, grain width, ratio of and length to width, and 1000-grain weight in F2population in sequence, respectively.
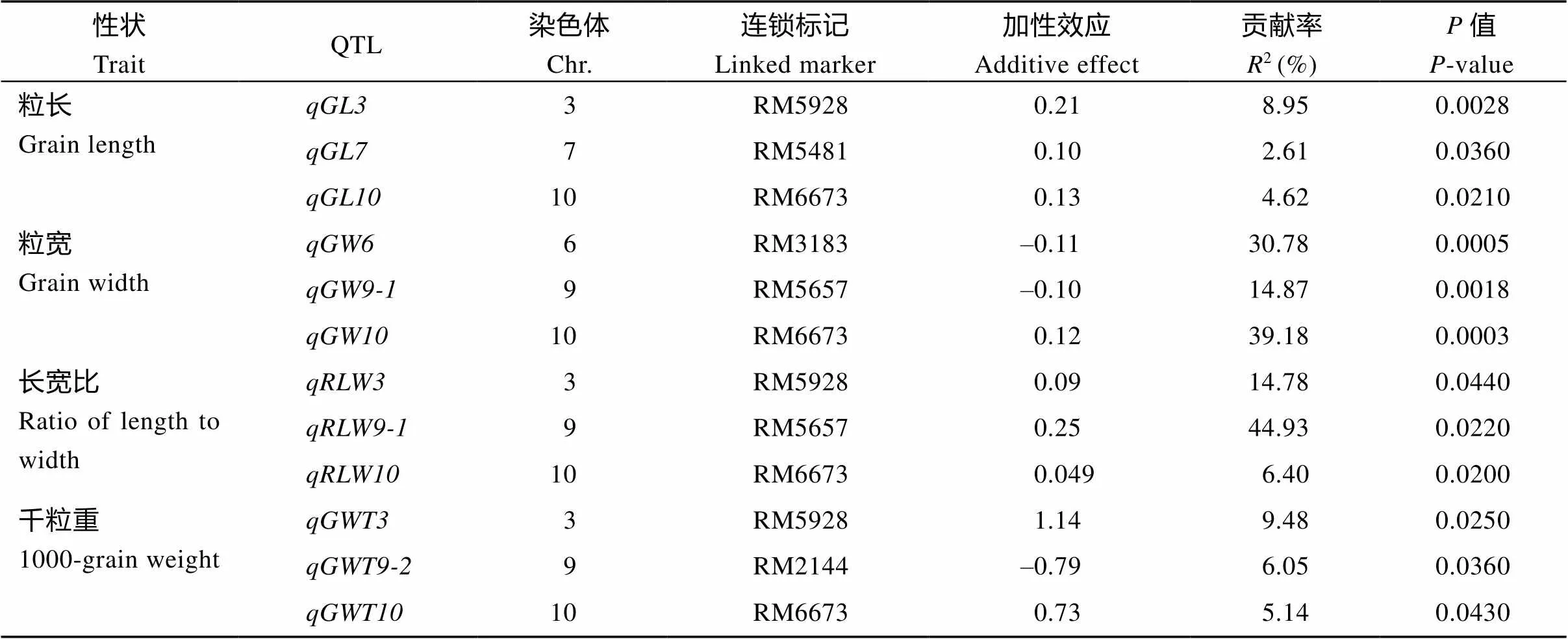
表1 日本晴/Z66的次级F2群体检出的水稻粒型相关性状QTL
2.4 次级片段代换系选育及目标 QTL验证和聚合分析
2.4.1 次级单片段代换系和双片段代换系选育
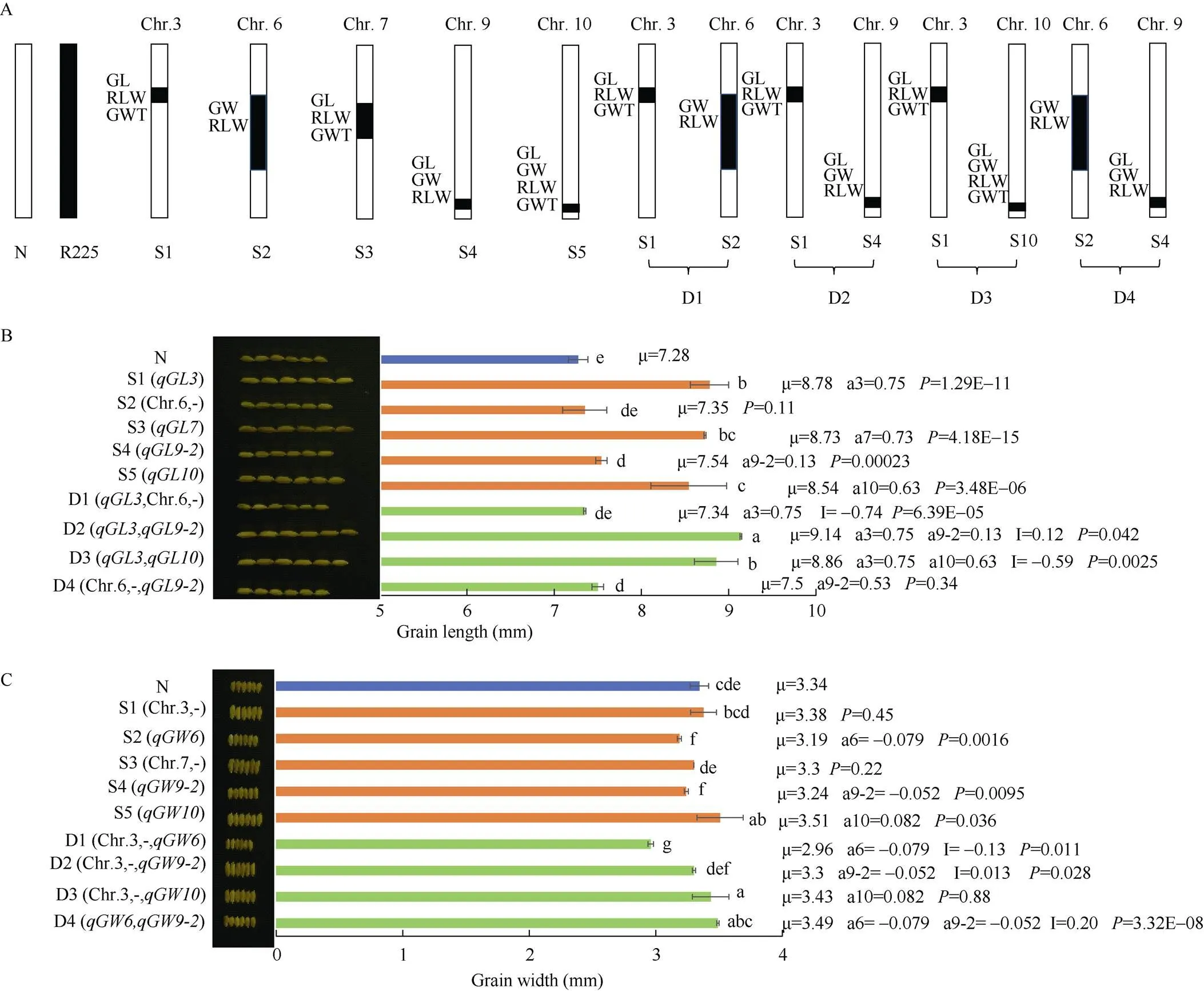
根据QTL定位信息, 利用MAS在F3代共分离出5个单片段代换系(SSSL, S1~S5)和4个双片段代换系(DSSL, D1~D4), 单片段代换系S1、S2、S3、S4和S5分别含有3号、6号、7号、9号和10号染色体的代换片段, 双片段代换系D1含有3号和6号染色体的代换片段, D2含有号3和9号染色体的代换片段, D3含第3和10染色体代换片段, D4含6号和9号染色体的代换片段(图6-A)。
2.4.2 基于单片段代换系(S1~S5)的粒型相关性状QTL验证 S1含有3号染色体的代换片段RM3766--RM5928--RM2917,和能被S1验证, 其加性效应分别为0.75 mm、0.21、3.99 g。其粒长(8.78 mm)、谷粒长宽比(2.60)和千粒重(29.93 g)显著大于受体日本晴(7.28 mm、2.18、21.94 g) (图6-B, D, E)。S2含有6号染色体的代换片段RM3330--RM3183-RM7193-RM3187-RM3827- RM7434-RM5957-RM5371--RM3567,能被S2验证, 其加性效应为-0.079 mm。此外, 还新检测到加性效应为0.11的, 而并未被F2群体检测到。S2的粒宽(3.19 mm)显著窄于日本晴(3.34 mm), 而长宽比(2.34)显著大于受体日本晴(2.18) (图6-C, D)。S3含有7号染色体的代换片段RM1186-- RM5481-RM1135--RM3826,能被S3验证, 其加性效应为0.73 mm。此外还新检测到和, 其加性效应分别为0.33和3.18 g。S3的粒长(8.73 mm)、谷粒长宽比(2.65)和千粒重(28.3 g)显著大于受体日本晴(7.28 mm、2.18、21.94 g) (图6-B, D, E)。S4含有9号染色体的代换片段RM1553--RM2144- RM205--长臂末端,没有被S4验证, 然而却新检测到、和, 其加性效应分别为0.130 mm、-0.052 mm和0.075。S4的粒长(7.54 mm)和谷粒长宽比(2.33)显著大于受体日本晴(7.28 mm和2.18), 而粒宽(3.24 mm)显著窄于受体日本晴(3.34 mm) (图6-B)。S5含有10号染色体的代换片段RM4477--RM6673--长臂末端,、、和能被S5验证, 其加性效应分别为0.63 mm、0.082 mm、0.13和3.98 g。S5的粒长(8.54 mm)、谷粒长宽比(2.44)、粒宽(3.51 mm)和千粒重(29.91 g)显著大于受体日本晴(7.28 mm、2.18、3.34 mm、21.94 g) (图6-B~E)。
综上所述, 在次级F2群体鉴定到的12个QTL中, 有9个可被相应的SSSL验证, 仅有不能被S4所验证。有2个(和)未选到相应的单片段代换系无法被验证。此外, 6个QTL (、)能被相应单片段代换系鉴定到, 而没有在F2分离群体被鉴定出。这些结果暗示了单片段代换系具有更高的QTL检测效率。
2.4.3 基于双片段代换系的目标QTL间上位性效应分析(a=0.75)和6号染色体代换片段聚合产生了-0.74的上位性效应, 使D1的粒长在遗传上增加0.01 mm, 但与日本晴的粒长无显著差异, 表明6号染色体代换片段影响了的遗传, 使D1的粒长显著短于S1 () (图6-B)。(a=0.75)和(a=0.13)聚合产生了0.12 mm的上位性效应, 使D2的粒长在遗传上增加1.00 mm, 表明和聚合产生了比日本晴、S1 ()和S4 ()更长的籽粒。(a=0.75)和(a=0.63)聚合产生了-0.59 mm的上位性效应, 使D3的粒长在遗传上增加0.79 mm, 比日本晴和S5 ()显著增长, 而与S1 ()没有显著差异。(图6-B)。
聚合(a=-0.08)与3号染色体代换片段产生了-0.13的上位性效应, 使D1的粒宽在遗传上减少0.21 mm, 显著窄于日本晴和S1和S2 (含)。聚合(a=-0.05)与3号染色体代换片段产生了0.01 mm的上位性效应, 使D2的粒宽在遗传上减少0.04 mm, 与日本晴无显著差异, 表明3号染色体的代换片段对的遗传产生了影响, 而D2的粒宽与S4 ()和S1均无显著差异。(a=0.08)与第3染色体代换片段在控制粒宽的遗传上是属于独立的, D3的粒宽与S5 (含)无显著差异, 而显著宽于S1和受体日本晴。聚合(a=-0.08)和(a=-0.05)产生了0.20 mm的上位性效应, 使D4的粒宽在遗传上增加0.07 mm, 与日本晴无显著差异, 而显著宽于S2 ()和S4 (), 表明2个窄粒和聚合产生了更宽的籽粒(图6-C)。
(图6)
A: 培育的SSSLs (S1~S5), DSSLs (D1~D4)草图. N: 表示受体日本晴(Nipponbare); S: 单片段代换系(SSSL); D: 双片段代换系(DSSL); B: 粒长; C: 粒宽; D: 谷粒长宽比; E: 千粒重; 柱子上方最下面的小写字母表示Duncan’s多重比较结果(< 0.05), 不同字母表示彼此差异显著。: 各系的平均值, a: QTL的加性效应,: QTL间加性×加性上位性效应, 单片段代换系的表示SSSL与日本晴差异显著性,< 0.05表示二者差异显著, 在代换片段上存在QTL。双片段代换系DSSL的表示(日本晴+ DSSL)和(SSSL和SSSL)的差异显著性,< 0.05表示二者差异显著, 存在上位性效应。S1: Chr3, RM3766–RM2917; S2: Chr6, RM3330–RM3567; S3: Chr7, RM1186– RM3826; S4: Chr9, RM1553-长臂末端; S5: Chr10, RM4477-长臂末端; D1: Chr3, RM3766–RM2917; Chr6, RM3330–RM3567; D2: Chr3, RM3766–RM2917; Chr9, RM1553–RM205; D3: Chr3, RM3766–RM2917; Chr10, RM4477–RM6673; D4: Chr6, RM3330–RM3567; Chr9, RM1553–RM205; 用连字符连接的内部标记表示来自供体的替代段。
A: sketch map of developed SSSLs (S1-S5), DSSLs (D1-D4). N: Nipponbare; S: SSSL; D: DSSL. B: grain length (GL); C: grain width (GW); D: ratio of length to width (RLW); E: 1000-grain weight (GWT). Different lowercase letters indicate significant difference at< 0.05 as determined by Duncan’s multiple comparisons.is the mean value of each line,adenotes the additive effect of QTLs,denotes the additive × additive epistasis effect between QTLs. The-value for a SSSL indicates the probability of a significant difference between the SSSL and Nipponbare, and the SSSL carried a QTL (Student’s-test,< 0.05). The-value for a DSSL indicates the probability of an epitasis effect between QTLs in the DSSL. (Nipponbare + DSSL) and (SSSLand SSSL) (Student’s-test,< 0.05). S1: Chr3, RM3766–RM2917; S2: Chr6, RM3330–RM3567; S3: Chr7, RM1186–RM3826; S4: Chr9, RM1553-End of long arm; S5: Chr10, RM4477-End of long arm; D1: Chr3, RM3766–RM2917; Chr6, RM3330-RM3567; D2: Chr3, RM3766–RM2917; Chr9, RM1553–RM205; D3: Chr3, RM3766–RM2917; Chr10, RM4477–RM6673; D4: Chr6, RM3330–RM3567; Chr9, RM1553–RM205; Hyphenated internal tokens indicate alternative segments from the donor.
(a=0.21)和(a=0.11)聚合产生了–0.17的上位性效应, 使D1的谷粒长宽比在遗传上增加0.15。D1的谷粒长宽比比日本晴显著增加, 而比S1 ()显著减小, 与S2 ()无显著差异。聚合(a=0.21)和(a=0.08)产生了0.10的上位性效应, 使D2的谷粒长宽比在遗传上增加0.39。D2的谷粒长宽比显著大于受体日本晴、S1 ()和S4 (), 暗示了谷粒长宽比效应较大的和聚合产生了比单个QTL更大的谷粒长宽比。(a=0.21)和(a=0.13)聚合产生了-0.18的上位性效应, 使D3的谷粒长宽比在遗传上增加0.16, 比日本晴显著增加, 而与S5 (和S1 ()无显著差异。(a=0.11)和(a=0.08)聚合, 产生了–0.20的上位性效应, 使D4的谷粒长宽比在遗传上减少了0.02,与日本晴无显著差异, 而显著小于S2 ()和S4 (), 暗示了谷粒长宽比效应较大的和聚合产生了较小的谷粒长宽比(图6-D)。
(a=3.99)和6号染色体代换片段聚合产生了–6.08的上位性效应, 使D1的千粒重在遗传上减少2.09 g, 比日本晴显著减少, 表明6号染色体的代换片段显著影响了的遗传。D1的千粒重显著小于日本晴、S1 ()和S2。(a=3.99)和(a=3.98)聚合产生了–5.35的上位性效应, 使D3的千粒重在遗传上增加2.62 g。D3的千粒重比日本晴显著增加, 而显著小于S1 (和S5 ()。表明大粒和聚合产生了比含单个QTL的SSSL更小的籽粒。6号染色体和9号染色体的代换片段聚合, 产生了1.53的千粒重上位性效应, 使D4的千粒重在遗传上增加1.53 g, 比日本晴、S2和S4显著增加。(a=3.99)和9号染色体代换片段属独立遗传, D2的千粒重与S1 ()无显著差异, 而显著大于日本晴和S4 (图6-E)。
综上所述, 多数QTL聚合会产生不同的上位性效应, 因而了解QTL间的上位性效应对基因聚合育种至关重要。
3 讨论
3.1 长大粒水稻染色体片段代换系Z66及分离出的单片段代换系是用于粒型遗传研究的良好材料
水稻粒型是复杂的农艺性状。创建丰富的自然变异, 鉴定并分离其中的粒型QTL对于稻米品质的改良和产量的提高具有重要意义[34-37]。染色体片段代换系的创建可产生丰富的自然变异, 是拓宽已有栽培品种遗传基础的宝贵前育种(pre-breeding)工具, 也是QTL定位及其功能研究的良好基础材料[7]。本研究新鉴定了一个以日本晴为受体、恢复系R225为供体亲本的水稻长大粒染色体片段代换系Z66。Z66含有来自R225的12个代换片段(平均的代换长度为3.32 Mb), 其中6个代换片段携带12个粒型QTL。我们进一步将这些QTL分解到了5个相应的单片段代换系上。由于单片段代换系与受体亲本只存在代换片段的差异, 可消除遗传背景的干扰, 因而作为次级作图群体可更精确地分析QTL[3]。本研究结果也表明单片段代换系具有更高的QTL检测效率, 在F2群体中鉴定出的12个粒型QTL, 有9个可被相应的5个单片段代换系验证。此外, 利用SSSL还鉴定出6个在F2群体中未鉴定出的QTL。在多个研究中, 也证实了单片段代换系的QTL检测高效性[8-9,13,17-18,38]。这些新SSSL的创建为粒型等QTL的遗传解析和基因设计育种奠定了良好基础。
3.2 与前人报道基因(QTL)的相比, qGL9-2等5个可能是新鉴定的QTL
我们利用日本晴/Z66的次级F2分离群体和分离出的5个次级单片段代换系共鉴定出18个粒型相关的QTL。其中, 包括4个控制粒长的QTL, 分别为、、、; 4个粒宽QTL, 分别为、、、; 6个长宽比的QTL, 分别为、、、、、; 4个千粒重QTL, 分别为和。通过与前人在这些区间克隆的相关基因或定位的QTL比较, 编码开花相关的RING蛋白的[39]基因在和的代换区间, 它们均连锁于同一标记RM6673 (22.6 Mb), 可能属于一因多效。与该标记相距0.22 Mb该基因编码C3H4型环指结构域蛋白, 是一个E3连接酶, 通过影响组蛋白H2B单泛素化调控水稻花时和产量相关基因的表达。与野生型相比,-RNAi株系的籽粒变长, 同时单株产量提高[39], 因此,可作为和的候选基因。、和连锁于同一标记RM5928 (12.55 Mb), 可能也属一因多效。在该代换区间内, 我们发现()[40]与该标记相距0.78 Mb, 过表达会增加籽粒大小和增水稻千粒重[40]。据该基因功能和位置推断,可作为、和的候选基因。同时,、和与Wang等[20]鉴定的、、在相似的代换片段上, 可能为相同QTL。此外, 在的区间内, 王大川等[14]同样鉴定了该QTL, 可能为同一个QTL。[41]基因在和的最大代换区间内, 该基因的过表达会导致籽粒显著变小,可作为、和的候选基因。参与调控瞬时淀粉代谢的在的代换区间内, 过表达该基因导致水稻的粒宽减小。[43]对调节细胞周期具有重要作用, 该基因下调导致粒宽减小[42],在的代换片段上。其余5个QTL (、)尚未被报道, 可能是新鉴定的QTL。而这5个QTL均为在一年中被检测到, 还需进一步进行多年多点验证其稳定性, 并测试其与环境的互作效应。本研究结果为这些QTL的进一步功能解析和设计育种鉴定了良好基础。
3.3 了解QTL间的上位性效应可对未来基因型的表型预测, 对分子设计育种有重要意义
上位性效应是遗传的重要组成成分, 尤其对于复杂性状的QTL[44]。了解所有QTL的遗传性效应可解析数量遗传的复杂性。我们利用由日本晴/Z66后代中新选育的单片段代换系S2、S4和S5, 可相应检测到粒宽QTL (、和), 其加性效应分别为-0.08、-0.05和0.08 mm, 而在同时含和的双片段代换系D4中, 还检测到了和的上位性效应为0.02 mm, 但很遗憾没有选到同时含3个粒宽QTL的3片段代换系, 目前无法研究三者间的上位性互作, 但至少和存在0.02 mm的上位性互作。如此, Z66的粒宽至少受到、和加性效应的影响, 且其遗传效应至少是-0.08-0.05+0.08+ 0.02=-0.03 mm。可能该遗传效应太小, 其引起的表型变异尚不足以达到统计上的显著水平, 导致其粒宽表型值3.40 mm与受体日本晴3.34 mm无显著差异, 因此Z66与其受体日本晴在粒宽上的差异不显著。然而, 在图5-B中, 日本晴/Z66构建的次级 F2群体的粒宽频率分布与其他3个性状的分布相似, 也存在正态分布, 是因为在F2群体中, 其个体的遗传成分仍然很复杂, 至少受到3个粒宽QTL、和的加性效应影响, 还受到这些位点杂合状态的显性效应影响, 及这些非等位QTL间的上位性效应的影响。因此, 尽管日本晴和Z66在粒宽表型上没有显著差异,但在遗传上仍是受多个粒宽QTL的影响。这些结果表明, 利用染色体片段代换系可揭示数量遗传的复杂性。此外, 本研究还发现, 有些正向效应的QTL间聚合产生正向的上位性效应, 如(a=0.21)和(a=0.08)聚合产生了0.10的上位性效应, 使D2具有比受体日本晴、S1 ()和S4 () 更大的谷粒长宽比。Zhang等[19]聚合正向效应的长粒和也产生了正向上位性效应, 使聚合系产生了更长的籽粒。而多数正向QTL间聚合却产生了负向的上位性效应, 或负向QTL间聚合却产生了正向的上位性效应。如(a=3.99)和(a=3.98)聚合产生了-5.35的上位性效应, 使D3的千粒重比受体日本晴显著增加, 而比单片段代换系S1 (和S5 () 显著减小。(a=0.11)和(a=0.08)聚合产生了-0.20的上位性效应, 使D4的谷粒长宽比与日本晴无显著差异, 而比单片段代换系S2 ()和S4 () 显著减小。而有些QTL间聚合后则是独立遗传的, 如(a=3.99)和9号染色体代换片段属独立遗传, D2的千粒重与S1 ()无显著差异, 而比日本晴和S4显著增加。因此, 不同QTL间聚合会产生不同的上位性效应。尽管从现象上看很复杂, 但本质上, 2个QTL聚合后的表现取决于其各自加性效应值和上位性效应的代数和。通过比较聚合基因型的遗传效应a+a+a与聚合前a和a相比, 预测Q和Q聚合的表型是否符合我们的育种期望。当代数和大于其中任何一个单片段段代换系上QTL的加性效应时, 新基因型的表型会更大; 当代数和小于其中任何一个QTL的加性效应时, 新基因型的表型会更小; 当代数和介于2个QTL的加性效应之间时, 新基因型的表型也介于2个单片段代换系间[33]。根据这一原则, 我们可据目标QTL的加性效应和QTL间的上位性效应进行聚合基因型的表型预测, 从而实现以染色体片段代换系为平台的设计育种。张桂权等已利用4个SSSL将6号染色体含有和基因的代换片段, 和另外2个分别含有基因基因的代换片段聚合在一起, 形成一个四基因聚合的三段代换系, 成功达到预期目标, 育成了米质达到国家优质稻米2级标准的 “华标1号” (粤审稻2009033)[27]。因此, 开展以水稻染色体片段代换系为基础的重要性状QTL定位及解析QTL间的互作效应, 可对未来基因型的表型进行预测, 对实现分子设计育种具有重要意义。
4 结论
鉴定了一个新水稻长大粒染色体片段代换系Z66。Z66以日本晴为遗传背景含有来自R225的12个代换片段, 平均代换长度为3.32 Mb。此外还培育出5个新单片段代换系和4个新双片段代换系。以日本晴/Z66构建的F2群体及培育的单片段代换系共鉴定出18个粒型相关的QTL。其中、、和与Z66的粒长性状连锁,和与Z66的千粒重性状连锁。有9个QTL (、、、、、、、、)遗传较稳定。6个QTL (、)为单片段代换系新鉴定。与前人报道基因(QTL)的相比,、、均为未报道的QTL, 对进一步研究其功能具有重要意义。双基因聚合分析表明, 不同QTL间聚合产生不同的上位性效应。有些正向效应的QTL间聚合产生正向的上位性效应, 如(a=0.21)和(a=0.08)聚合产生了0.10的上位性效应, 使D2具有比受体日本晴、S1 ()和S4 ()更大的谷粒长宽比。而多数正向QTL间聚合却产生了负向的上位性效应, 或负向QTL间聚合却产生了正向的上位性效应。如(a=3.99)和(a=3.98)聚合产生了–5.35的上位性效应, 使D3的千粒重比日本晴显著增加, 而比S1 (和S5 ()显著减小。了解QTL的加性效应和上位性效应可对未来基因型的表型进行预测, 这些信息对实现智能化设计育种至关重要。
[1] Li G M, Tang J Y, Zheng J K, Chu C C. Exploration of rice yield potential: decoding agronomic and physiological traits., 2021, 9: 577–589.
[2] Xu J L, Xing Y Z, Xu Y B, Wan J M. Breeding by design for future rice: genes and genome technologies., 2021, 9: 491–496.
[3] Zhang G Q. Target chromosome-segment substitution: a way to breeding by design in rice., 2021, 9: 658–668.
[4] Alonso-Blanco C, Koornneef M. Naturally occurring variation in: an underexploited resource for plant genetics., 2000, 5: 22–29.
[5] Yano M. Genetic and molecular dissection of naturally occurring variations., 2001, 4: 130–135.
[6] Parry M A J, Madgwick P J, Bayon C, Tearall K, Hernandez-Lopez A, Baudo M, Rakszegi M, Hamada W, Al-Yassin A, Ouabbou H, Labhilili M, Phillips A L. Mutation discovery for crop improvement., 2009, 60: 2817–2825.
[7] Balakrishnan D, Surapaneni M, Mesapogu S, Neelamraju S. Development and use of chromosome segment substitution lines as a genetic resource for crop improvement., 2019, 132: 1–25.
[8] Yang T F, Zhang S H, Zhao J L, Liu Q, Huang Z H, Mao X X, Dong J F, Wang X F, Zhang G Q, Liu B. Identification and pyramiding of QTLs for cold tolerance at the bud bursting and the seedling stages by use of single segment substitution lines in rice (L.)., 2016, 36: 96.
[9] Zhou Y L, Xie Y H, Cai J L, Liu C B, Zhu H T, Jiang R, Zhong Y Y, Zhang G L, Tan B, Liu G F, Fu X L, Liu Z Q, Wang S K, Zhang G Q, Zeng R Z. Substitution mapping of QTLs controlling seed dormancy using single segment substitution lines derived from multiple cultivated rice donors in seven cropping seasons., 2017, 130: 1191–1205.
[10] Okpala N E, Duan L X, Shen G Q, Zhang G Q, Qi X Q. Comparisons of cooking and eating qualities of tworice cultivars., 2017, 5: 1–5.
[11] Li Z H, Riaz A, Zhang Y X, Anis G B, Zhu A K, Cao L Y, Cheng S H. Quantitative trait loci mapping for rice yield-related traits using chromosomal segment substitution lines., 2019, 26: 261–264.
[12] 张波, 裴瑞琴, 杨维丰, 朱海涛, 刘桂富, 张桂权, 王少奎. 利用单片段代换系鉴定巴西陆稻IAPAR9中的粒型基因. 作物学报, 2021, 47: 1472–1480.
Zhang B, Pei R Q, Yang W F, Zhu H T, Liu G F, Zhang G Q, Wang S K. Identification of grain type genes in rice IAPAR9 by single segment substitution lines.2021, 47: 1472–1480 (in Chinese with English abstract).
[13] 沈文强, 赵冰冰, 于国玲, 李凤菲, 朱小燕, 马福盈, 李云峰, 何光华, 赵芳明. 优良水稻染色体片段代换系Z746的鉴定及重要农艺性状QTL定位及其验证. 作物学报, 2021, 47: 451–461.
Shen W Q, Zhao B B, Yu G L, Li F F, Zhu X Y, Ma F Y, Li Y F, He G H, Zhao F M. Identification and QTL mapping of important agronomic traits of an excellent rice chromosome fragment substitution line Z746., 2021, 47: 451–461 (in Chinese with English abstract).
[14] 王大川, 汪会, 马福盈, 杜婕, 张佳宇, 徐光益, 何光华, 李云峰, 凌英华, 赵芳明. 增加每穗粒数的水稻染色体代换系Z747鉴定及相关性状QTL定位. 作物学报, 2020, 46: 140–146.
Wang D C, Wang H, Ma F Y, Du J, Zhang J Y, Xu G Y, He G H, Li Y F, Ling Y H, Zhao F M. Identification and QTL mapping of related traits of rice chromosome replacement line Z747 with increased grain number per panicle.2020, 46: 140–146 (in Chinese with English abstract).
[15] Ma F Y, Zhu X Y, Wang H, Wang S M, Cui G Q, Zhang T, Yang Z L, He G H, Ling Y H, Wang N, Zhao F M. Identification of QTL for kernel number-related traits in a rice chromosome segment substitution line and fine mapping of., 2019, 7: 494–503.
[16] Ma F Y, Du J, Wang D C, Wang H, Zhao B B, He G H, Yang Z L, Zhang T, Wu R H, Zhao F M. Identification of long-grain chromosome segment substitution line Z744 and QTL analysis for agronomic traits in rice., 2020, 19: 1163–1169.
[17] Teng B, Zeng R Z, Wang Y C, Liu Z Q, Zhang Z M, Zhu H T, Ding X H, Li W T, Zhang G Q. Detection of allelic variation at thelocus with single-segment substitution lines in rice (L.)., 2012, 30: 583–595.
[18] Cai J, Liao Q, Dai Z, Zhu H, Zeng R, Zhang Z, Zhang G. Allelic differentiations and effects of theandgenes on fertility restoration in rice with wild abortive cytoplasmic male sterility., 2013, 57: 274–280.
[19] Zhang T, Wang S M, Sun S F, Zhang Y, Li J, You J, Su T, Chen W B, Ling Y H, He G H, Zhao F M. Analysis of QTL for grain size in a rice chromosome segment substitution line Z1392 with long grains and fine mapping of., 2020, 13: 13–40.
[20] Wang H, Zhang J Y, Naz F, Li J, Sun S F, He G H, Zhang T, Ling Y H, Zhao F M. Identification of rice QTLs for important agronomic traits with long-kernel CSSL-Z741 and three SSSLs., 2020, 27: 414–422.
[21] Chen J, Li X, Cheng C, Wang Y, Qin M, Zhu H, Zeng R, Fu X, Liu Z, Zhang G. Characterization of epistasis interaction of QTLsandcontrolling heading date in rice., 2014, 4: 4263.
[22] Qin M, Zhao X, Ru J, Zhang G, Ye G Y. Bigenic epistasis between QTLs for heading date in rice analyzed using single segment substitution lines., 2015, 178: 16–25.
[23] Zhao F M, Zhu H T, Zeng R Z, Zhang G Q, Xu S Z. Detection of additive and additive × environment interaction effects of QTLs for yield-component traits of rice using single-segment substitution lines (SSSLs)., 2016, 135: 452–458.
[24] Wang S K, Wu K, Yuan Q B, Liu X Y, Liu Z B, Lin X Y, Zeng R Z, Zhu H T, Dong G J, Qian Q, Zhang G Q, Fu X D. Control of grain size, shape and quality byin rice., 2012, 44: 950–954.
[25] Wang S K, Li S, Liu Q, Wu K, Zhang J Q, Wang S S, Wang Y, Chen X B, Zhang Y, Gao C, Wang F, Huang H X, Fu X D. Theregulatory module determines grain shape and simultaneously improves rice yield and grain quality., 2015, 47: 949–954.
[26] Fang C, Li L, He R, Wang D, Wang M, Hu Q, Ma Q, Qin K, Feng X, Zhang G, Fu X, Liu Z. Identification of S23 causing both interspecific hybrid male sterility and environment-conditioned male sterility in rice., 2019, 12: 10.
[27] 张桂权. 基于SSSL文库的水稻设计育种平台. 遗传, 2019, 41: 754–760.
Zhang G Q. Rice design and breeding platform based on SSSL library., 2019, 41: 754–760 (in Chinese with English abstract).
[28] 赵芳明, 郭超, 魏霞, 杨正林, 凌英华, 桑贤春, 王楠, 张长伟, 李云峰, 何光华. 日本晴与5个优良恢复系的多态性标记筛选及遗传差异分析. 西南大学学报(自然科学版), 2016, 38(11): 1–7.
Zhao F M, Guo C, Wei X, Yang Z L, Ling Y H, Sang X C, Wang N, Zhang C W, Li Y F, He G H. Polymorphic SSR markers screening and genetic difference analysis between Nipponbare and five excellent restorer lines.(Nat Sci Edn), 2016, 38(11): 1–7 (in Chinese with English abstract).
[29] 崔国庆, 王世明, 马福盈, 汪会, 向朝中, 李云峰, 何光华, 张长伟, 杨正林, 凌英华, 赵芳明. 水稻高秆染色体片段代换系Z1377的鉴定及重要农艺性状QTL定位. 作物学报, 2018, 44: 1477–1484.
Cui G Q, Wang S M, Ma F Y, Wang H, Xiang C Z, Li Y F, He G H, Zhang C W, Yang Z L, Ling Y H, Zhao F M. Identification and QTL mapping of important agronomic traits in rice Z1377., 2018, 44: 1477–1484 (in Chinese with English abstract).
[30] Paterson A H, Damon S, Hewitt J D, Zamir D, Rabinowitch H D, Lincoln S E, Lander E S, Tanksley S D. Mendelian factors underlying quantitative traits in tomato: comparison across species, generations, and environments., 1991, 127: 181–197.
[31] McCouch S R, Kochert G, Yu Z H, Wang Z Y, Khush G S, Coffman W R, Tanksley S D. Molecular mapping of rice chromosomes., 1988, 76: 815–829.
[32] Zhao F M, Tan Y, Zheng L Y, Zhou K, He G H, Ling Y H, Zhang L H, Xu S Z. Identification of rice chromosome segment substitution line Z322-1-10 and mapping QTL for agronomic traits from the F3population.2016, 44: 370–380.
[33] Liang P X, Wang H, Zhang Q L, Zhou K, Li M M, Li R X, Xiang S Q, Zhang Z, Ling Y H, Yang Z L, He G H, Zhao F M. Identification and pyramiding of QTLs for rice grain size based on short-wide grain CSSL-Z563 and fine-mapping of., 2021, 14: 35.
[34] Ma M Y, Gong W J, Duan H Y. Rice grain shape genes: research progress and application., 2020, 10: 21–25.
[35] Bai X F, Luo L J, Yan W H, Kovi M R, Zhan W, Xing Y Z. Genetic dissection of rice grain shape using a recombinant inbred line population derived from two contrasting parents and fine mapping a pleiotropic quantitative trait locus., 2010, 11: 16.
[36] Xing Y, Zhang Q. Genetic and molecular bases of rice yield., 2010, 61: 421–442.
[37] 张静, 李晨, 潘大建, 陈文丰, 孙炳蕊, 刘清, 吕树伟, 江立群,毛兴学, 范芝兰. 水稻粒长遗传及其功能基因研究进展. 广东农业科学, 2021, 48(3): 1–10.
Zhang J, Li C, Pan D J, Chen W F, Sun B R, Liu Q, Lyu S W, Jiang L Q, Mao X X, Fan Z L. Research progress on genetic and functional genes of rice grain length., 2021, 48(3): 1–10 (in Chinese with English abstract).
[38] Wang D C, Zhou K, Xiang S Q, Zhang Q L, Li R X, Li M M, Liang P X, Farkhanda N, He G H, Ling Y H, Zhao F M. Identification, pyramid and candidate genes of QTLs for associated traits based on a dense erect panicle rice CSSL-Z749 and five SSSLs, three DSSLs and one TSSL., 2021, 14: 55.
[39] Du Y W, He W, Deng C W, Chen X, Gou L M, Zhu F G, Guo W, Zhang J F, Wang T. Flowering-related RING protein 1 () regulates flowering time and yield potential by affecting histone H2B monoubiquitination in rice ()., 2016, 11: e0150458.
[40] Yang C, Ma B, He S J, Xiong Q, Duan X K, Yin C C, Chen H, Lu X, Chen S Y, Zhang J S.andregulate ethylene response of roots and coleoptiles and negatively affect salt tolerance in rice., 2015, 169: 148–165.
[41] Zhou S X, Zhu Y, Wang L F, Zheng Y P, Chen J F, Li T T, Yang X M, Wang H, Li X P, Ma X C, Zhao J Q, Pu M, Feng F, Li Y, Fan J, Zhang J W, Huang Y Y, Wang W M.fine-tunes rice immunity againstand yield traits., 2020, 62: 1213–1226.
[42] Wang Z, Wei K, Xiong M, Wang J D, Zhang C Q, Fan X L, Huang L C, Zhao D S, Liu Q Q, Li Q F., Water-Dikinase 1(), an ideal biotechnological target for potential improving yield and quality in rice., 2021, 19: 2606–2618.
[43] Zhang L, Wang R C, Xing Y D, Xu Y F, Xiong D P, Wang Y M, Yao S G. Separable regulation ofin grain size and leaf angle development in rice., 2021, 19: 2517–2531.
[44] Wang X L, Jin L L, Zhu H T, Wang S K, Zhang G Q, Liu G F. QTL epistasis analysis for yield components with single-segment substitution lines in rice., 2018, 137: 346–354.
Identification and pyramid analysis of QTLs for grain size based on rice long-large-grain chromosome segment substitution line Z66
XIANG Si-Qian, LI Ru-Xiang, XU Guang-Yi, DENG Ke-Li, YU Jin-Jin, LI Miao-Miao, YANG Zheng-Lin, LING Ying-Hua, SANG Xian-Chun, HE Guang-Hua, and ZHAO Fang-Ming*
Rice Research Institute, Southwest University / Academy of Agricultural Sciences, Southwest University / Transgenic Plants and Safety Control, Chongqing Key Laboratory, Chongqing 400715, China
Rice grain size is a complex agronomic trait, controlled by multiple genes. Chromosome segment substitution lines are an effective method for creating natural occurring variations and are as the ideal materials for exploring the complex traits. In this study, a novel rice long-large grain chromosome segment substitution line Z66 was developed. Z66 contained 12 substitution segments from R225 (average substitution length was 3.32 Mb) based on the genetic backgrounds of Nipponbare. Then, 12 QTLs for rice grain size were identified by the secondary F2population from Nipponbare/Z66, and 5 novel single-segment substitution lines (SSSLs, S1-S5), and 4 novel double-segment substitution lines (DSSLs, D1-D4) harboring target QTL were developed. Among them, 9 QTLs (,,,,,,,, and) could be verified by the SSSLs, indicating that these QTLs were genetically stable. In addition, 6 novel QTLs (,,,,,and) were detected by the SSSLs. Among 18 QTLs, 5 QTLs (,,,, and) might be novel. Target QTLs pyramiding showed that the pyramid of different QTLs had various epistasis effects. For example, the pyramids of(a=0.21) and(a=0.08) produced an epistasis effect of 0.10, which made the ratio of grain length to width in D2 significantly larger than that in Nipponbare, S1 (), and S4 (). The pyramid of(a=3.99) and(a=3.98) yielded an epistasis effect of-5.35, and its genetic effects in D3 (2.62 g) significantly increased 1000-grain weight of D3 than in Nipponbare, but significantly decreased than that in S1 () and S5 (). Understanding the interaction effects between target QTLs can predict the phenotype of futural QTL pyramid genotypes, which is important for intelligent design breeding in rice.
rice; grain shape; QTLs; chromosome segment substitution line; additive effect; epistasis effect
10.3724/SP.J.1006.2023.12081
本研究由国家自然科学基金项目(32072039)和西南大学种质创制专项项目资助。
This study was supported by the National Natural Science Foundation of China (32072039) and the Germplasm Creation for Southwest University.
通信作者(Corresponding author):赵芳明, E-mail: zhaofangming2004@163.com
E-mail: 969937373@qq.com
2021-11-30;
2022-06-07;
2022-07-07.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220705.1753.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/)
