再生季稻与同期抽穗主季稻干物质分配特性及机制研究
2023-01-16吴冬青郭春林邹京南庞孜钦林非凡何海斌林文雄
吴冬青 李 洲 郭春林 邹京南 庞孜钦 林非凡 何海斌 林文雄,,*
再生季稻与同期抽穗主季稻干物质分配特性及机制研究
吴冬青1李 洲2郭春林3邹京南1庞孜钦3林非凡1何海斌1林文雄1,3,*
1福建农林大学生命科学学院 / 农业生态过程与安全监测福建省重点实验室, 福建福州 350002;2福建省农业科学院亚热带农业研究所, 福建漳州 363005;3福建农林大学作物遗传育种与综合利用教育部重点实验室, 福建福州 350002
研究再生稻干物质积累与转运特性对深入理解再生稻产量形成的生理机制及进一步挖掘增产潜力有重要的理论与实际意义。本研究以华东南稻区推广的常规籼稻佳辐占和籼粳杂交稻甬优2640两个再生稻品种作为供试材料, 在确保2个供试水稻品种的再生季稻和主季稻在籽粒灌浆阶段处于同一晚秋气温条件下抽穗成熟, 比较再生季稻及其同期抽穗的主季晚稻的光合生理、激素含量、干物质生产、非结构性碳水化合物(NSC)、13C同化物在植株地上部和地下部的干物质积累与分配差异。结果表明, 相比同期抽穗的同基因型主季晚稻, 2个供试品种的再生季稻生育期缩短50%, 但有效穗数和收获指数分别增加50%和10%, 最终产量可达到对照产量的55%~65%; 再生季稻在籽粒灌浆前期叶片光合速率和SPAD值均明显增高, 但齐穗后20 d至成熟期其光合速率和SPAD值则明显降低; 再生季稻株体内的ZR、IAA含量在齐穗期较高, 之后相比较低, 再生季稻株内的ABA含量在齐穗期至齐穗后10 d或20 d较高, 达到10%~20%, 而其GA3含量普遍较低; 再生季稻稻桩、叶片和茎鞘的NSC转运率高达67%~78%、59%~67%和52%~61%, 因此其NSC转运对产量贡献率也分别高达10%~18%;13C光合同化物分配在穗部占比大, 成熟期再生季稻穗部的分配率高20.83%, 同时, 减少了再生季稻13C同化物向地下部的转移量达5%, 因而有效穗多, 收获指数高。再生季稻减少了光合同化物向根际土壤的转移与分配, 既能提高其收获指数, 又有利于减少水稻的CH4等温室气体排放量, 是一种经济高效益和环境友好型的稻作模式。
再生季稻;13C脉冲标记; 非结构碳水化合物; 干物质积累与分配
发展机收再生稻是兼顾粮食增产、农民增收的一种水稻种植好方式。中国适宜种植再生稻的区域多为光温资源“一季有余、两季不足”或“双改单”地区, 福建、四川、重庆、江西、安徽、湖南、湖北等省市是其主要产区, 在这些地区发展形成了2种再生稻种植模式, 第一种模式是从20世纪70年代至21世纪初形成的人工收割高留桩再生稻, 各地出现了不少高产典型, 但这时期全国再生稻面积却出现了先增加后逐年下降的趋势, 究其原因主要是农村劳动力转移导致的季节性劳动力短缺; 因而21世纪初形成了第2种再生稻种植模式, 即机收再生稻, 在其发展初期主要为高留桩(留桩高度35 cm以上), 但无法解决高留桩机收碾压导致再生季水稻群体生长及抽穗不整齐和整精米率低等问题。近年来, 中国随着甬优杂交稻系列品种的育成和适宜机收低留桩强再生力品种的筛选、机收减损技术和腋芽促发技术的研发, 机收低留桩再生稻(留桩高度25~30 cm)产量水平不断提高, 其中华中地区如湖北、江西等省机收再生季稻产量达6000 kg hm–2以上[1-2]。近年来, 华东南区域福建省创建了机收低留桩再生稻栽培技术体系, 使几百公顷再生季稻连续6年周年每公顷产量超15 t, 其中近百公顷超高产田再生季稻产量达9000 kg hm–2以上, 两季总产近20 t hm–2, 取得了突破性的再生季产记录[3]; 因而, 机收低留桩减损再生稻栽培技术已逐渐取代人工收割高留桩再生稻栽培技术, 克服了高留桩再生稻因水分管理不当和机收碾压稻桩而导致群体生长不整齐和产量不高不稳的弊端, 已逐渐发展成为我国南方光温资源“一季有余、两季不足”稻区及“双改单”稻区提高复种指数、稳粮增收的一种新的种植制度[4-6]。然而, 再生稻产量高低, 除了与品种的更新换代有关外, 如何协调再生稻的源、库、流关系, 仍然是高产栽培的关键。以往关于再生稻源、库、流的研究中, 主要集中于头季稻与再生季稻源库关系的比较。总的认为, 相比头季稻, 再生季稻的叶片数、叶面积和叶面积指数少, 总库容、每穗粒数和千粒重小, 但光合效率、干物质运转率和经济系数却比较高, 并认为头季稻是增库增产型, 而再生季稻则属增源增产型, 也有人认为是源库互作型, 但这些研究都是在适合高留桩栽培品种条件下进行的, 现行推广的品种是否也有这种栽培共性, 还需进一步验证[4,6-8]。近年来,研究认为要获得低留桩再生季稻高产稳产, 协调解决好头季稻后期的源库矛盾, 提高稻桩中同化物的贮藏量, 有利于再生季库容(即穗数和穗粒数)的增加。也有研究认为再生季稻最终产量的高低还取决于其“源”的供应能力, 即灌浆物质是否充足, 头季稻灌浆中后期的水分控制效果以增强根系活力和提高稻桩的质量[4-5,9-11]。研究发现再生季稻有2次干物质转运特性, 即再生季稻的同化物除了来自再生植株本身产生的光合产物外, 头季稻收割之后稻桩残留的物质是再生季稻获得高产的重要物源基础, 因此头季稻收割时的稻桩质量高低成为再生季稻能否获取高产的关键[5,9,12]。有研究发现, 再生季稻齐穗前的物质积累有35%~40%是来自头季稻桩的转运, 其余的60%~65%源于再生叶片的光合作用; 在再生季稻齐穗后到成熟收割阶段所获得的干物质仍有9%~18%从稻桩而来, 有80%~90%是自身光合作用贡献的, 且与头季稻光合效率相比, 再生季稻光合效率高出了34%~140%, 其高峰期出现在孕穗至抽穗后20 d, 且较之头季稻维持时间更长, 光合产物的转运率和经济系数高[13-14]。然而, 前人研究的结果大多是以头季稻为对照获得的, 其源库流关系更深层的成因与机制还有待深入揭示。此外, 由于头季与再生季环境条件差异明显, 因而其研究结果是否反映其特性, 也常受人们的质疑[6-8]。据此, 本研究在分期播种试验的基础上, 设置了以同一品种的再生季稻和同期抽穗的主季稻(晚稻)为研究对象, 在确保2个供试水稻籽粒灌浆启始阶段处于同一晚秋气温条件下抽穗成熟为前提, 采用作物生理学, 特别是光合生理和13C脉冲标记技术, 研究其干物质(包括非结构化合物)生产与分配、13C同化物在植株地上部和地下部的积累与转运特征及差异机制, 以期为深入理解机收再生稻产量形成的成因与机制,构建相配套的高产栽培促控技术提供科学依据。
1 材料与方法
1.1 材料与栽培概况
于2018—2019年在福建农林大学农学院试验基地进行。以华东南稻区推广的常规籼稻佳辐占和籼粳杂交稻甬优2640两个再生稻品种作为供试材料。2018年春季开始田间试验, 试验地土壤为沙壤土, 含有机质2.12%, 全氮1.86 g kg–1、碱解氮133.4 mg kg–1、有效磷42.8 mg kg–1、速效钾90.1 mg kg–1, pH 6.18。在2018年田间试验的基础上, 2019年选择大田与盆栽相结合(盆栽试验主要用于13CO2脉冲标记测定), 进行重复验证试验。试验地再生稻全生育期昼夜气温和降雨量变化实况记录见图1。大田试验采用随机区组排列, 每个小区18 m2, 重复3次, 各处理小区间筑小埂, 田间四周设有排水沟, 确保各小区单独进行水分排灌, 插秧规格为19.8 cm×16.5 cm, 常规稻每穴2粒谷, 杂交稻单本插。2018—2019年佳辐占和甬优2640的头季均在3月27日播种, 秧龄统一30 d, 4月27日移栽, 分别于6月25日和7月8日齐穗、8月1日和8月13日成熟收割, 留桩高度均为20 cm, 其全生育期分别为123 d和135 d; 根据试验目的, 佳辐占和甬优2640作晚稻种植, 其抽穗期应调整与其再生季稻的抽穗期基本一致(本试验结果前者为8月29日齐穗, 后者则在9月8日齐穗)。据此, 晚季佳辐占和甬优2640分别于6月4日和7月4日移栽(秧龄统一为30 d), 最后确保了佳辐占和甬优2640晚稻与其再生季稻同时抽穗, 并分别于10月4日和10月15日成熟。由此计算, 佳辐占和甬优2640两品种的晚稻全生育期分别为120 d和128 d, 其再生季全生育期分别为63 d和65 d。再生季施肥方法与大田高产栽培同[9], 即分别在头季稻齐穗后20 d和割后3 d按1∶1追施纯氮187.5 kg hm–2。盆栽2次施肥总量折合纯氮为1.32 g 盆–1。其头季稻和其同期抽穗的晚稻肥料使用量相同[9]。
1.2 测定项目与方法
1.2.1 光合速率和SPAD测定 各个处理品种于再生季稻和同期抽穗晚稻齐穗期(heading stage, HS)、齐穗后10 d (10 days after full heading, 10 DAH)、齐穗后20 d (20 days after full heading, 20 DAH)、成熟期(maturity stage, MS), 采用SPAD-502型叶绿素仪测定剑叶SPAD值, 并计算各关键时期的叶绿素衰减率, 同时采用LI-6400便携式光合仪测定剑叶净光合速率。
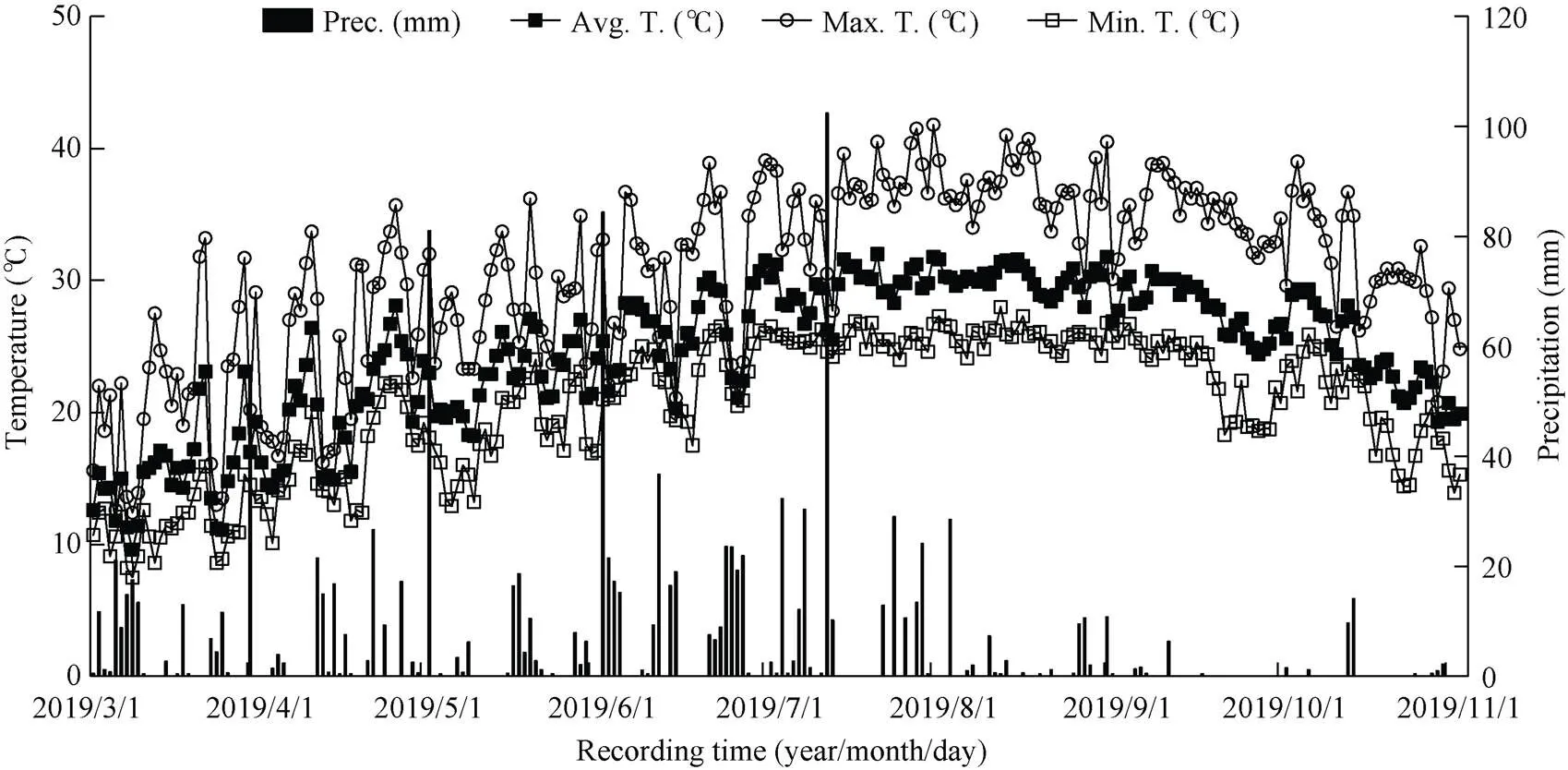
图1 再生稻全生育期气温和降雨量变化态势
1.2.2 产量和干重测定 于不同处理品种的再生季稻和与其同期抽穗的同品种晚稻的抽穗期和成熟期, 选取代表性稻株5株, 齐泥收割, 将再生季稻的植株分为稻桩、再生茎鞘、再生叶和再生穗4个部分, 其晚稻的植株分为茎鞘、叶、穗3个部分, 测算单株叶面积和叶面积指数(LAI), 同时, 在105℃烘箱杀青30 min, 70℃条件下烘干至恒重, 称量各器官干物质重。于成熟期每小区随机调查50株有效穗数, 选取代表性稻株5株穗, 测算每穗粒数、结实率和千粒重等产量构成, 每小区实收计产。
1.2.3 茎鞘叶非结构性碳水化合物 同时, 取3丛有代表性的稻株, 将再生季稻的稻桩、叶片、茎鞘和晚稻的茎鞘烘干称重后, 研磨粉碎, 过100目筛, 参照邹琦[15]的方法测定可溶性糖和淀粉含量, 用沸水浴提取可溶性糖, 剩余残渣加入9.2 mol L–1HClO4提取淀粉, 二者均采用蒽酮比色法在波长为630 nm处测其吸光度, 通过蔗糖标准液求得吸光度与糖含量标准线性方程, 然后换算出样品可溶性糖和淀粉浓度, 单位为mg g–1DW。非结构性碳水化合物(non-structural carbohydrate, NSC)的含量为可溶性糖和淀粉含量之和。
根据上述测定结果, 计算各部位(稻桩、茎鞘、叶片)花后的物质转运量、物质转运率、物质贡献率和物质同化贡献率, 茎鞘中NSC转运率及其对籽粒的贡献率, 其计算公式为:
各部位物质转运量(kg hm–2)=单位面积各部位抽穗期干重–各部位成熟期干重;
各部位物质转运率(%)=各部位物质转运量/各部位抽穗期干重×100;
各部位物质贡献率(%)=各部位物质转运量/成熟期籽粒重×100;
同化物质的籽粒贡献率(%)=(成熟期总重-抽穗期部总重)/成熟期籽粒总重×100;
茎鞘叶中NSC转运率(%)=(1-成熟期茎鞘叶NSC/抽穗期茎鞘叶NSC)×100;
茎鞘叶NSC对籽粒的贡献率(%)=(抽穗期茎鞘叶NSC含量-成熟期茎鞘叶NSC含量)/成熟期籽粒重×100。
1.2.4 植物激素测定 再生季和同期抽穗晚季的齐穗期、齐穗期第10天和第20天, 每个处理选取
长势一致的水稻3株, 用水冲洗干净, 分别取根系、叶片、茎鞘和籽粒迅速放入液氮并转移至–80℃冰箱待测。鲜样置于液氮中研磨成粉, 准确称取1.0 g加入预冷的80%色谱级甲醇10 mL, 上下颠倒混匀, 然后置于4℃摇床避光抽提16 h以上, 在4℃、5000转 min–1下离心10 min, 吸取上清液于冰箱黑暗冷藏, 残渣按上述步骤重复抽提3次, 然后合并抽提液参照陈远平等[16]描述的方法纯化, 经0.22 μm尼龙滤膜过滤的供试液, 进样到岛津LC-20AD型高效液相色谱仪检测。紫外检测器型号为岛津SPD-20A, 色谱柱为Inertsustain C18 (4.6 mm×250 mm, ID 5 μm), 运行参数为柱温箱35℃, 流速0.8 mL min–1, 进样量20 μL, 检测波长254 nm。流动相为A-乙腈(色谱纯)和B-0.6%冰醋酸, 外标法定量, 色谱级标准品试剂ZR、GA3、ABA和IAA均购自Sigma- Aldrich公司, 用色谱级甲醇配成浓度为1 mg mL–1母液, 按梯度制作标准曲线。
1.2.513CO2脉冲标记测定 为进行13CO2脉冲标记测定, 同时进行盆栽试验, 所用的土壤取与大田土壤相同, 每个盆钵装过筛土12 kg, 每盆插4穴, 供试常规稻与杂交稻品种与上述相同, 盆栽插值苗数与田间试验一致, 每个处理20盆(直径30 cm, 高50 cm, 每盆盛土25 kg)。于再生季稻和同期抽穗晚稻齐穗期进行13C同位素标记, 参照方法测定[17]。
植株各部位和土壤的13C净输入含量计算公式为:
13C= (AT%13C-AT%13C)×TC/100 (1)
式中,13C为标记样品13C净输入含量(mg pot–1), AT%13C为标记样品中含13C的丰度(%), AT%13C为未标记样品中含13C的丰度(%), TC为标记样品中的总碳含量(mg pot–1)。
植株各部位和土壤中13C的分配率计算公式为:
D13C= (13C/T13C)×100 (2)
式中, D13C为各部分的分配率(%), T13C为标记植株样品的地上部、根和土壤13C净输入含量的总和(mg pot–1),13C同上。
茎鞘13C同化物的转运率计算公式为:
TR13C= (M13C-H13C)/M13C×100 (3)
式中, TR13C为稻桩茎鞘的13C同化物转运率(%), M13C为头季成熟期茎鞘的13C含量(mg pot–1), H13C为再生季齐穗期茎鞘的13C含量(mg pot–1)。
植株各部位和土壤的13C净输入含量计算公式为:
13C= (AT%13C-AT%13C)×TC/100 (4)
式中,13C为标记样品13C净输入含量(mg pot–1), AT%13C为标记样品中含13C的丰度(%), AT%13C为未标记样品中含13C的丰度(%), TC为标记样品中的总碳含量(mg pot–1)。
植株各部位和土壤中13C的分配率计算公式为:
D13C= (13C/T13C)×100 (5)
式中, D13C为各部分的分配率(%), T13C为标记植株样品的地上部、根和土壤13C净输入含量的总和(mg pot–1),13C同上。
茎鞘13C同化物的转运率计算公式为:
TR13C= (M13C-H13C)/M13C×100 (6)
式中, TR13C为稻桩茎鞘的13C同化物转运率(%), M13C为再生季稻或同期抽穗晚稻成熟期茎鞘的13C含量(mg pot–1), H13C为再生季稻或同期抽穗晚稻齐穗期茎鞘的13C含量(mg pot–1)。
采用Microsoft Excel 2013和SPSS 19.0统计软件对上述结果进行数据整理和分析, 用LSD进行组间差异性检验, Origin 8.0绘图。
2 结果与分析
2.1 不同种植模式下水稻产量及其构成因素差异
统计分析结果表明, 不同稻作模式下, 水稻产量及其构成因素年份之间差异不显著(表1)。不同品种间除了收获指数差异不显著外, 其产量和产量构成因素差异达极显著水平。不同栽培模式(即再生季水稻和其同基因型的同期抽穗的晚稻)间除了结实率差异不显著外, 其余的产量及其构成因素包括收获指数差异达显著或极显著水平。就二因子互作而言, 年度与品种互作除了每穗粒数和结实率2个性状与年度互作达显著和极显著差异外, 两品种的不同种植模式、产量、千粒重和收获指数差异均不显著。就年度与种植模式互作而言, 从表1可知, 除了结实率和千粒重差异不显著外, 其余4项考察指标差异均达显著或极显著水平。从品种与种植模式和年度×品种×种植模式互作看, 考察的产量及其构成因素等6个指标均达到显著或极显著水平(表1), 可见试验结果的有效性。进一步分析2个供试品种再生季稻产量及其同期抽穗晚稻的产量差异表现, 结果表明, 佳辐占(Jiafuzhan, JFZ)再生季稻(ratooning rice, RCR)两年平均产量为4.70 t hm–2, 其同期抽穗晚稻(same genotype main crop (late season) synchronized in rice heading time, STLR)平均产量为7.16 t hm–2, 两者相差2.46 t hm–2, 即佳辐占再生季稻(JFZ-RCR)产量比其晚稻(JFZ-STLR)产量降低34.36%。甬优2640再生季稻(YY2640-RCR)产量2年平均为5.98 t hm–2, 其晚稻(YY2640-STLR)平均产量10.55 t hm–2, YY2640-RCR较其同期晚稻YY2640-STLR产量下降43.32%, 差异均达显著水平。就其产量构成因素而言, 再生季稻的平均穗粒数下降40.62%~60.59%, 千粒重降低了0.20%~ 13.94%, 结实率常规品种再生季上升9.66%, 而杂交稻却下降了3.05%。但有效穗增加48.46%~ 60.38%, 收获指数提高9.00%~23.68%, 差异达显著水平, 2年结果一致(表1)。可见, 无论是常规稻还是杂交稻, 其头季有效总库容量大, 约为再生季稻的1.3~1.9倍, 这是再生季稻产量不及头季稻的关键原因。此外, 与同期抽穗晚稻相比, 两品种再生季稻比其主季晚稻生育期分别缩短了47.5%和49.2%, 但其产量仍能达到同期抽穗的主季晚稻的56%~66%。究其原因, 主要与其单位面积有效数和收获指数显著增加有关。可见, 再生季稻具有光温资源利用率高的生态特性。
2.2 不同种植模式下水稻光合生理差异
2.2.1 净光合速率和SPAD值 灌浆成熟期不同稻作模式水稻叶片净光合速率如图2所示。从齐穗至成熟期, 2个品种的再生季稻与同期抽穗的晚稻叶片光合速率2年表现均呈现下降趋势, 并以再生季稻降幅更明显。与同期抽穗晚稻相比, 佳辐占和甬优2640再生季稻(JFZ-RCR和YY2640-RCR)在齐穗期的光合速率较其同期晚稻(JFZ-STLR和YY2640-STLR)高, 二者相差幅度在10.6%~16.7%,差异显著。但随着籽粒灌浆启动与演进, 再生季稻的高光合作用优势逐渐下降, 除JFZ品种在齐穗后10 d显著高于其同期晚稻外, 再生季稻YY2640- RCR较其同期抽穗的晚稻YY2640-STLR差异不显著; 齐穗后20 d至成熟期2个品种的再生季稻较其晚稻下降幅度分别达7.6%~11.2% (平均为9.8%)、17.3%~26.5% (平均为21.4%)。可见, 再生季稻在灌浆前期光合能力较其同期晚稻强, 但进入灌浆中后期后, 则再生季稻光合能力下降速度比其同期晚稻明显加快(图2)。
进一步分析不同稻作模式下灌浆成熟期再生季稻与其同期抽穗的同基因型晚稻的叶片SPAD值, 其结果与上述测定的光合速率变化趋势相似, 即2个品种的再生季稻与其同期抽穗晚稻的叶片SPAD值从齐穗期至成熟期均大幅度下降(图3)。但2个供试水稻品种在齐穗期, 其再生季稻的叶片SPAD值与其光合效率一致, 即亦表现显著高于其同期抽穗的晚稻, 其SPAD差值在1.9~2.8之间(平均为2.3), 差异显著; 随着水稻的发育进程, 两者之间的差距逐渐缩小, 在齐穗后10 d两个品种的再生季稻叶片SPAD值比其同期抽穗的晚稻平均高出1.3。但在齐穗后20 d, 再生季稻的SPAD值较其齐穗后10 d平均下降了23.0%, 而2个品种的同期晚稻却平均下降15.2%, 导致2个品种同期再生季稻的SPAD值反而显著低于其晚稻; 致使至成熟期时, 再生季稻与其同期抽穗晚稻的SPAD值相差3.0~5.4。由此可见, 与同一遗传背景的同期抽穗的晚稻相比, 无论是常规再生季稻, 还是杂交稻再生季稻, 在其籽粒灌浆的早期, 具有高光合效率的优势, 但进入齐穗灌浆后, 其叶片衰老速度加快, 表现在SPAD值明显下降, 叶绿素降解, 叶片落黄, 光合效率降低, 同化能力下降, 出现全身性衰老的基本生理特征。这可以从水稻群体叶面积指数和功能叶叶绿素衰减速率和齐穗后干物质积累与转运特性进一步得到证实(表2)。

表1 再生季稻与其同期抽穗的晚稻产量及产量构成因素等性状比较
JFZ指常规水稻佳辐占, YY2640指杂交水稻甬优2640。RCR和STLR指再生稻和同一基因型同期抽穗晚稻。同一年同一列里的每个数据后小写字母或大写字母的差异表示显著差异在0.05或0.01水平上。**:< 0.05;**:< 0.01;**:< 0.001; NS: 差异不显著。
JFZ: conventional rice, Jiafuzhan; YY2640: hybrid rice, Yongyou 2640. RCR and STLR refer to ratooning rice and the same genotype main crop (late season) synchronized in rice heading time.Differences in lowercase or uppercase letters after each data in the same column in the same year indicate significant difference at the 0.05 or 0.01 probability levels, respectively.**:< 0.05;**:< 0.01;**:< 0.001; NS: no significant difference.

(图2)
HS、10 DAH、20 DAH、MS分别指抽穗期、齐穗后10 d、齐穗后20 d、成熟期。*在图中代表再生稻和同期抽穗晚稻在抽穗和成熟同一时期的旗叶NPR存在0.05的显著差异水平。缩写同表1。
HS, 10 DAH, 20 DAH and MS refer to heading stage, 10 days after full heading stage, 20 days after full heading stage, and maturity stage, respectively. * in the figure indicates significant difference at the 0.05 probability level in the comparison of NPR in the flag leaves of RCR and STLR detected in the same time courses of the heading and ripening stages. Abbreviations are the same as those given in Table 1.

图3 不同种植方式下水稻抽穗和成熟期不同时期叶片SPAD的检测结果
*在图中代表再生稻和同期抽穗晚稻在抽穗和成熟同一时期旗叶的SPAD值存在0.05的显著差异水平。缩写同表1和图2。
* in the figure indicates significant difference at the 0.05 probability level in the comparison of SPAD values in the flag leaves of RCR and STLR detected in the same time courses of the heading and ripening stages. Abbreviations are the same as those given in Table 1 and Fig. 2.
2.2.2 水稻叶面积指数与剑叶SPAD衰变分析
从表2可以看出, 2个供试的水稻品种, 无论是再生稻甬优2640 (YY2640), 还是常规稻佳辐占(JFZ), 其再生季稻的叶面积指数(LAI)和单株叶干重大约是其同期晚稻的1/2~1/3。相比之下, 甬优2640的再生季稻在齐穗期LAI和单株叶干重较大, 因而其产量也较常规再生季稻高。但这2种类型的再生稻的共同特征是进入灌浆后期, 其叶绿素衰减值较其同期抽穗的主季晚稻显著降低, 这对于促进再生季稻生育后期干物质转运与优化分配有重要意义。
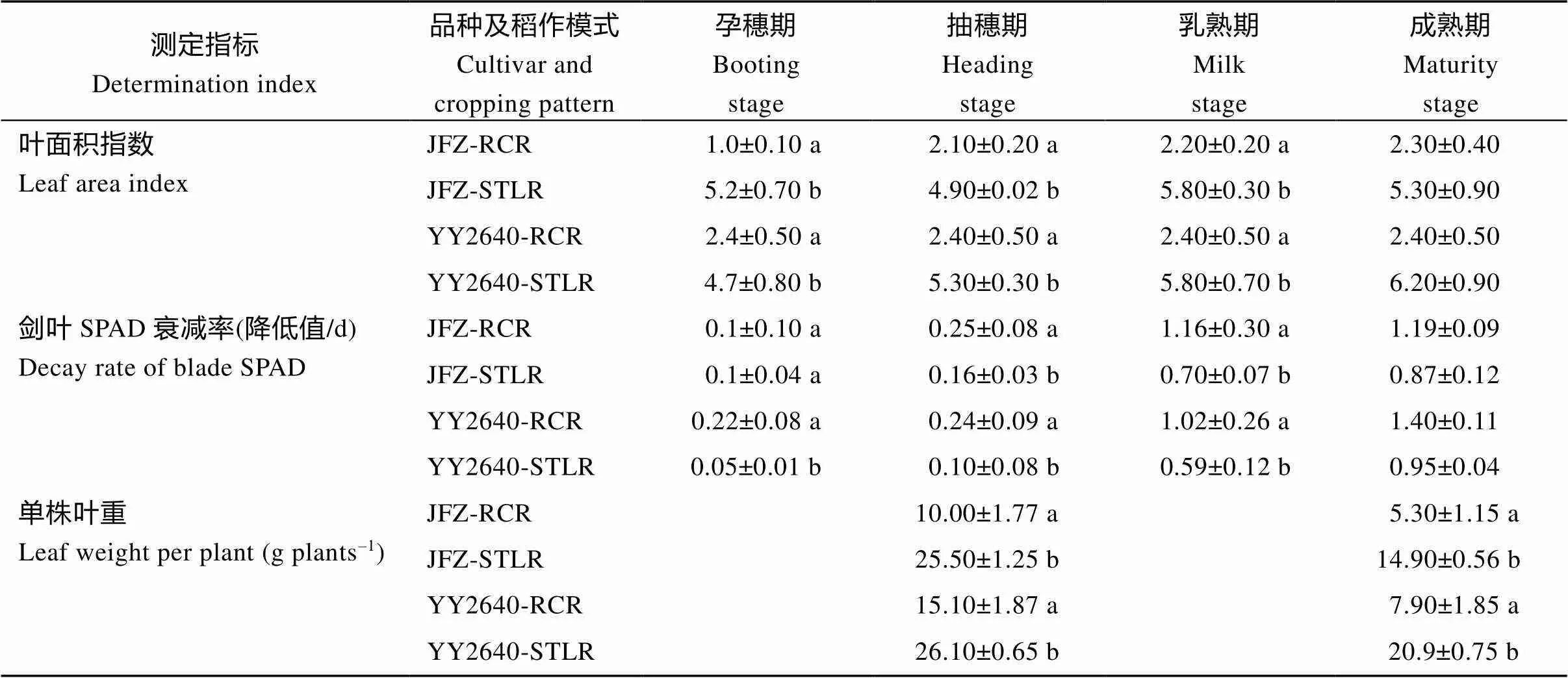
表2 不同种植模式水稻后期叶面积指数与剑叶SPAD衰减率变化
同一年同一列里的每个数据后小写字母的差异表示显著差异在0.05水平。缩写同表1。
Different lowercase letters after each data in the same column in the same year indicate significant difference at the 0.05 probability level. Abbreviations are the same as those given in Table 1.
2.3 植物内源激素含量差异分析
不同稻作模式各个器官中的玉米素核苷(ZR)、赤霉素(GA3)、脱落酸(ABA)和生长素(IAA)的含量如图4所示。2种稻作模式水稻体内的ZR含量在不同时期表现差异显著, 在齐穗期和齐穗后10 d, 再生季稻模式下, JFZ和YY2640水稻品种各部位中的含量整体高于同期抽穗晚稻, 尤其是根系中的含量较高; 但在齐穗后20 d, 2个品种的含量整体低于同期抽穗晚稻。在水稻各器官中的GA3和IAA含量均显示为穗>茎鞘/叶>根, 且随着生育期的推进, 二者在不同部位中的含量呈现逐渐下降的趋势; 从稻作模式上总体而言, 同期抽穗晚稻各部位的GA3含量在齐穗期至齐穗后20 d较再生稻模式相应部位的含量要高, 而2种模式下的IAA的含量则是在灌浆前期表现为再生稻穗部和茎鞘显著高于同期抽穗晚稻, 叶片和根系差异不大, 在灌浆后期再生季稻(RCR)各部位中的生长素均显著低于同期抽穗晚稻。2种稻作模式水稻植株中的ABA含量与GA3和IAA含量变化趋势恰好相反, 随着水稻的生长, 各个器官中的ABA含量呈逐渐上升, 尤其是叶片和茎鞘的ABA含量变化幅度最大, 与同期抽穗晚稻(STLR)相比, 再生季稻模式下的JFZ品种整体含量持续较高, YY2640品种在齐穗期和齐穗后10 d的含量相对更高一些。
总之, 再生季稻体内的ZR、IAA含量在齐穗期高于同期抽穗晚稻, 之后较低, 而ABA含量则相反, 即在再生季稻齐穗期至齐穗后10 d或20 d较其同期晚稻含量更高, 而GA3含量则普遍低于同期抽穗晚稻。相关分析结果表明(表3), 在水稻生育后期, 特别是籽粒灌浆中后期, ABA含量与ZR、IAA、叶绿素含量(SPAD)呈显著负相关, 即ABA含量越高, ZR、IAA和叶绿素含量越低, 但它与干物质运转量和转运率呈显著正相关。再生季稻齐穗后叶绿素(SPAD值)下降速度快, 衰减值大(表2), 暗示全身性衰老明显, 这有利于光合同化物的转运与籽粒灌浆充实, 提高结实率, 保证籽粒产量[18-19]。
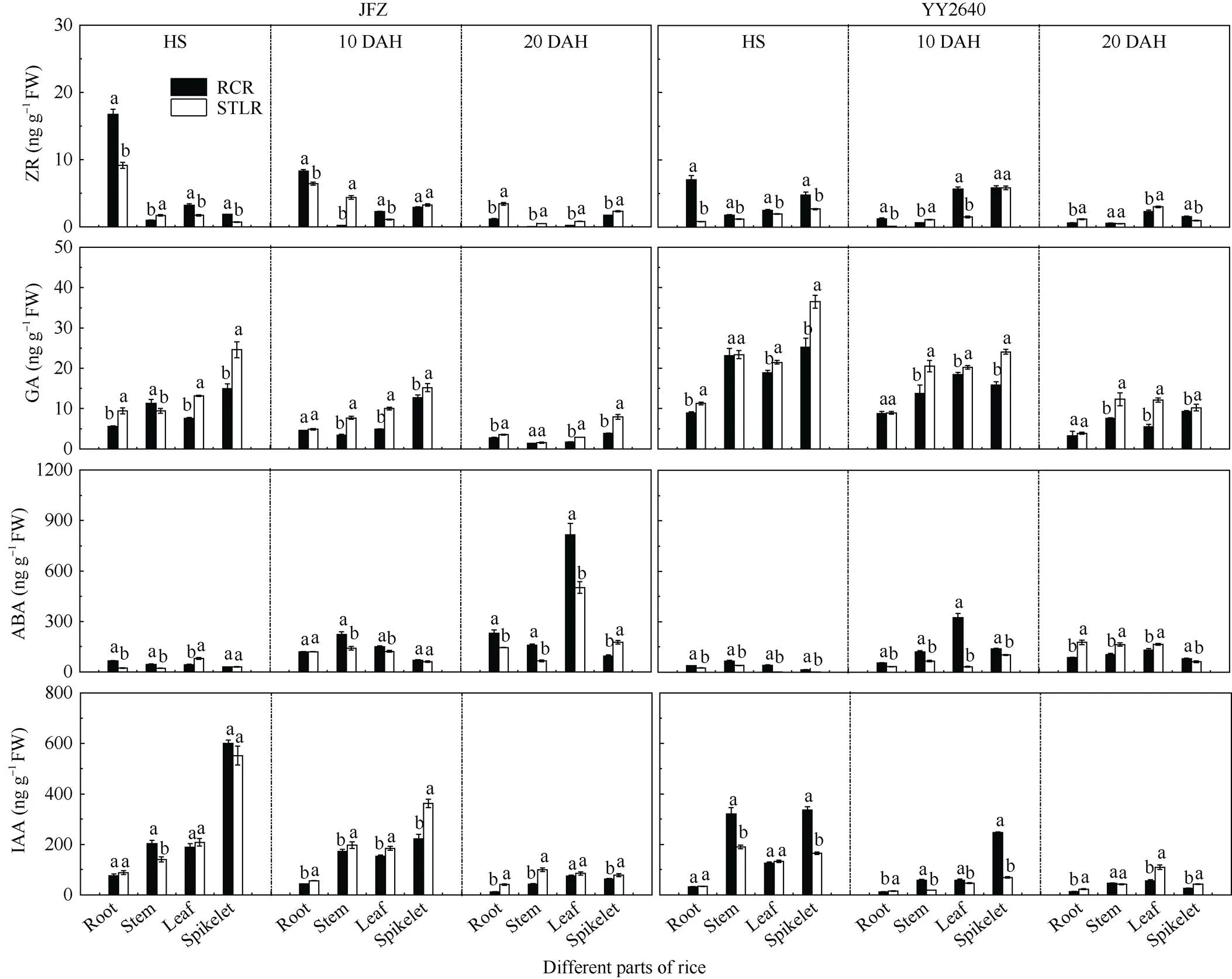
图4 不同种植模式下水稻根、茎、叶和穗部器官中激素含量的差异
缩写同表1和图2。不同小写字母表示在0.05水平差异显著。
Abbreviations are the same as those given in Table 1 and Fig. 2. Different lowercase letters indicate signisicant difference at the 0.05 probability level.
2.4 水稻干物质和非结构性碳水化合物积累与分配特性
2.4.1 干物质积累与转运 进一步分析表明(表4), 不同稻作模式下水稻齐穗后干物质的转运特性差异显著。与同期抽穗晚稻相比, 2个品种的再生季稻齐穗后, 其茎鞘和叶片的干物质转运量差异较大, 虽然因年份和品种不同其表现有所差异, 但其地上部干物质转运总量(包括稻桩、茎鞘和叶片)均表现为再生季稻高于同期抽穗晚稻, 2年平均增长了2.03~2.47倍。而且无论是常规再生季稻, 还是杂交稻再生季稻, 其叶片的物质转运率最高, 且均比其同期抽穗的晚稻高出了1.02~1.27倍。但就其干物质贡献率而言, 再生季稻的茎鞘物质贡献率最高, 比同期抽穗的晚稻增加了0.56~1.22倍, 叶片其次, 比同期抽穗的晚稻增长了40.4%~60.0%。特别是来源与头季的旧稻桩还贡献了4.2%~4.9%。因此, 2个品种的再生季稻(JFZ-RCR和YY2640-RCR)齐穗后物质同化贡献率(分别为73.70%和72.05%)相比其同期抽穗晚稻(JFZ-STLR和YY2640-STLR分别为86.0%和88.4%)低, 下降幅度为14.31%~18.50% (表2)。这说明, 再生季稻在割后到齐穗期这段时间内, 暂时存储在头季稻稻桩和再生季稻的茎鞘和叶片库组织的光合同化物对再生季稻产量形成意义重大, 这是再生季稻有别于其同期抽穗的同基因型晚稻特有的生理特性。其结果进一步说明了再生季稻的收获指数(经济系数)高与其灌浆后期叶片等适时全身性衰老速度快, 导致灌浆启动后存储于茎鞘和叶中的干物质大量转运给籽粒库。
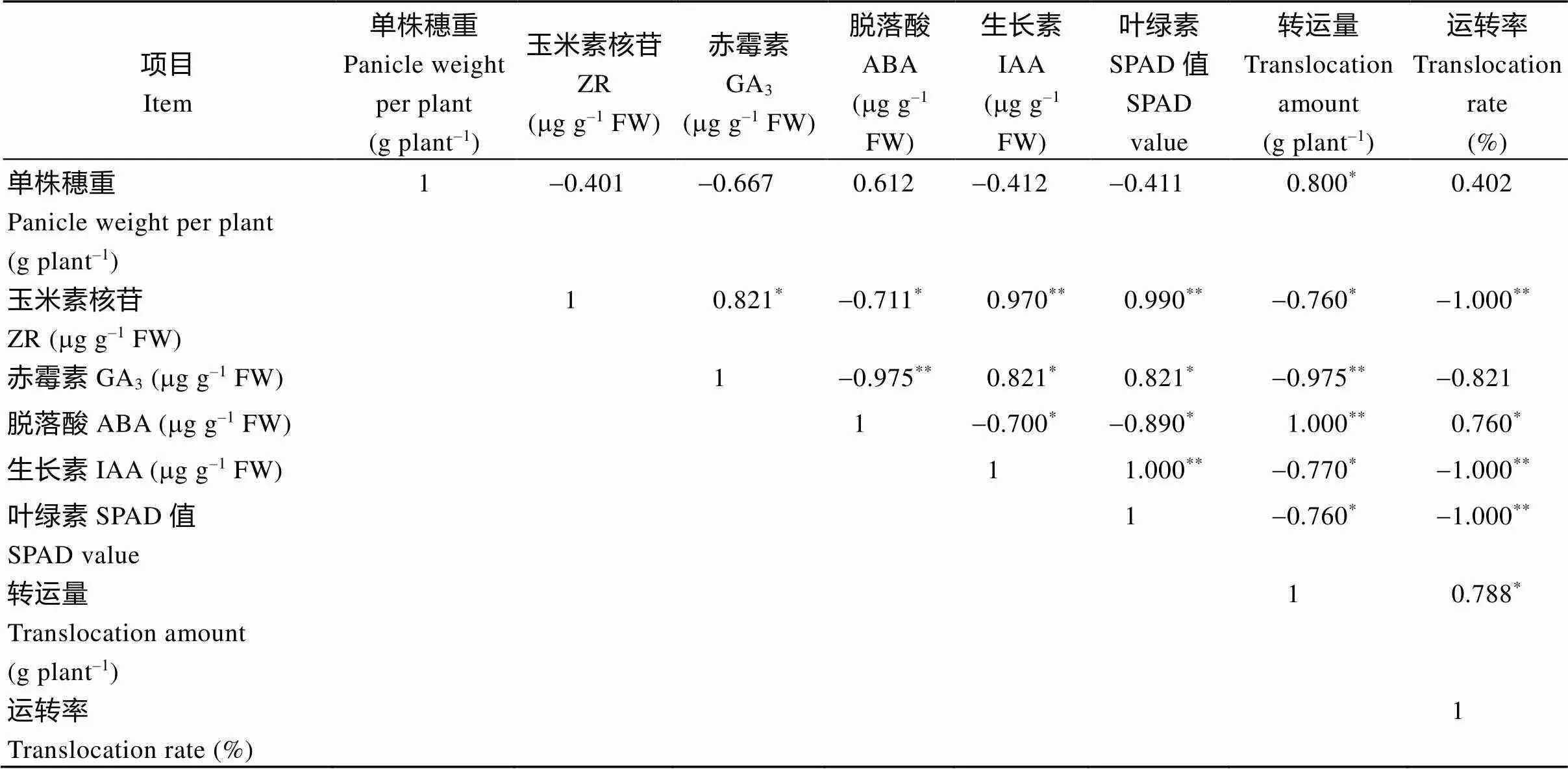
表3 不同种植模式下水稻灌浆抽穗至成熟期间单株穗重与叶绿素SPAD、激素含量、干物质转运量等相关
*:<0.05;**:<0.01
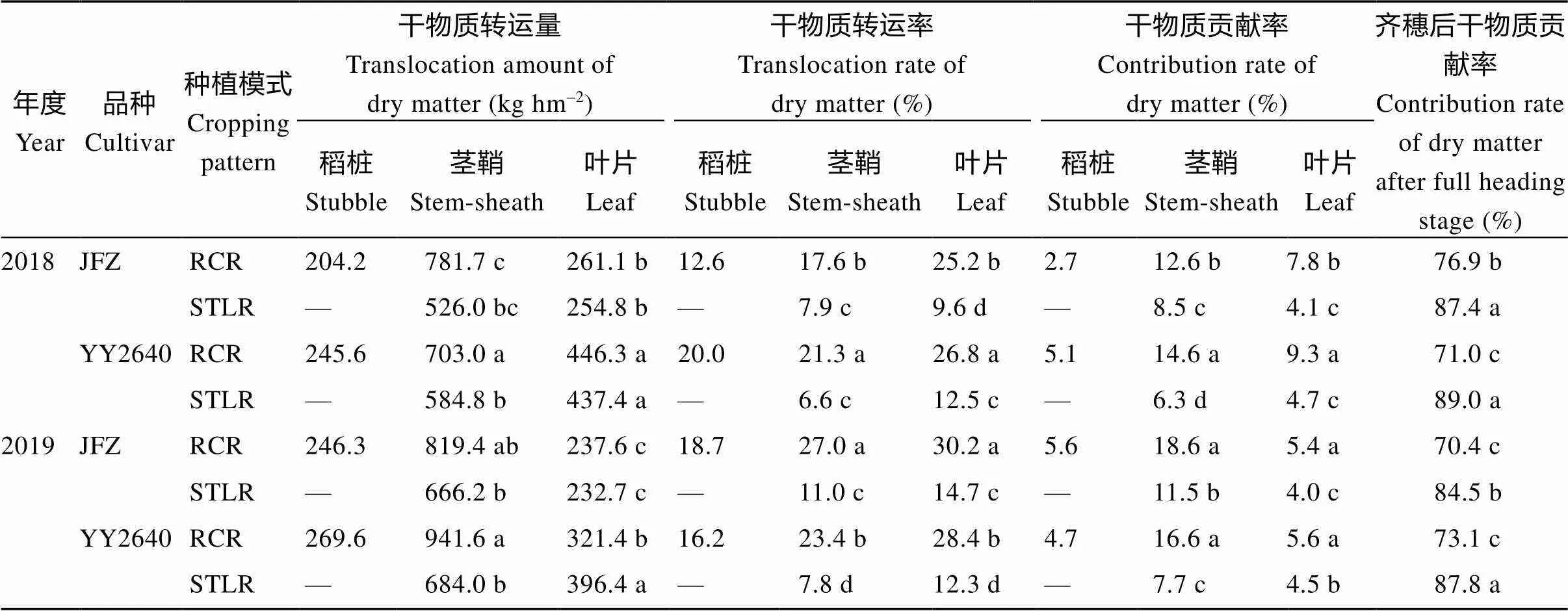
表4 不同水稻种植模式抽穗期后水稻植株干物质转运特性
同一年同一列里的每个数据后小写字母的差异表示显著差异在0.05水平。缩写同表1。
Difference of lowercase letters after each data in the same column in the same year indicates significant difference at the 0.05 probability level. Abbreviations are the same as those given in Table 1.
2.4.2 非结构性碳水化合物含量与转运 分析不同稻作模式水稻灌浆成熟期各器官可溶性糖、淀粉和非结构性碳水化合物(non-structural carbonhydrates, NSC)含量及其分配特性, 结果见表5。从中我们可以看出, 在齐穗期, 无论是再生季稻还是其同期抽穗的主季晚稻, 茎鞘的可溶性糖、淀粉和NSC积累量最大, 其次是根系, 叶片居三, 籽粒较少, 但随着灌浆进程, 籽粒中淀粉, 特别是NSC含量加大, 茎鞘位居第二, 根系和叶片显著减少, 其中再生稻减幅比主季晚稻大, 这与上述分析结果一致。值得注意的是, 再生季稻茎鞘中可溶性糖、淀粉和NSC含量由头季稻收割后遗留的稻桩和由其腋芽萌发再生的茎鞘2个部分组成, 如其中稻桩部分的NSC在齐穗期占其总量的10.08%~12.32%, 到了成熟期则很小, 几乎可以忽略不计, 可见培育健康的稻桩质量是再生稻获取高产关键环节之一。但进入齐穗期后, 再生稻JFZ和YY2640水稻品种茎鞘中NSC含量比同期抽穗晚稻的相应含量低62.82%和57.43%; 在成熟期再生稻JFZ和YY2640水稻品种茎鞘中NSC含量比同期抽穗晚稻的相应含量更低, 即低65.92%和54.19%。这与上述分析的灌浆中后期再生稻进入全身性衰老, 干物质再动员力强有关。具体体现在稻桩、叶片和茎鞘NSC转运率分别高达67%~78%、59%~67%和52%~61%, 显著高于同期抽穗的主季晚稻, 因而其NSC转运对产量贡献率也高(表6)。
2.4.313C同化物的积累与分配 在齐穗期对水稻进行13C同位素脉冲标记, 观察了齐穗后10 d和成熟期不同稻作模式下13C同化物在植株各器官和土壤中分配情况。如表7所示, 再生稻模式下水稻—土壤系统净输入13C同化物总量范围为117.55~125.64 mg pot–1, 同期抽穗晚稻模式为93.56~95.07 mg pot–1, 相比之下, 再生季稻在灌浆前期(齐穗期FHS)固定的13C同化物比其同期同基因型晚稻含量更多, 这印证了上述关于再生季稻比其同期晚稻在这一期间具有较高的光合效率的结论。不同取样时期的2种稻作模式水稻地上部各器官13C同化物含量均表现为穗>茎鞘>叶片, 再生稻模式下的稻桩含量最低; 但二者的根系和土壤中的13C同化物含量存在差异, 再生季稻表现为土壤>根系, 同期抽穗晚稻为根系>土壤, 2个品种趋势相同。从齐穗期标记至成熟期和至齐穗后10 d相比, 随着生育期的推进, 不同稻作模式下穗部13C同化物含量均大大增加, 并且以再生稻模式的增加量更高; 茎鞘和叶片中的13C同化物含量均下降, 除YY2640品种同期抽穗晚稻叶片的含量下降较多外, 其余均以再生稻模式减少更显著, 其茎鞘含量下降最多, 2个品种的稻桩也相应下降了1.10~1.13 mg pot–1; 同样的, 2种模式下的根系和土壤中的13C同化物含量变化趋势不一致, 在再生季稻模式下二者含量均显著下降, 同期抽穗晚稻则都增加。进一步分析发现,13C同化物分配给地下部(土壤+根系), 在齐穗期, 再生季稻比同期抽穗的主季晚稻高, JFZ-RCR和YY2640RCR分别占比为5.10%和3.68%, 而对应的主季晚稻为3.21%和1.91%。进入灌浆成熟期, 则相反, 即JFZ- RCR和YY2640-RCR分别占比为2.89%和2.23%, 而对应的主季晚稻则上升为7.50%和4.27%。
进一步分析发现, 不同稻作模式水稻13C同化物在植株各器官和土壤中的分配率存在显著差异(表8)。再生稻模式下, JFZ品种各部位的分配率依次为穗>茎鞘>叶>土>稻桩>根, YY2640品种为穗>茎鞘>土>叶>稻桩>根; 同期抽穗晚稻模式下, 2个品种各部位分配率大小均表现为穗>茎>叶>根>土。13C同化物主要运输到穗部, 其分配率范围为51.70%~ 87.79%, 随着生育期的推进, 其占比呈上升趋势, 再生季稻穗部的分配率较同期抽穗晚稻要高, 在成熟期最大差值达到20.83%。从齐穗后10 d至成熟期, 再生季稻的茎鞘、叶、稻桩、根系和土壤中的分配率均有不同程度的降低, 下降范围为0.58%~22.98%;同期抽穗晚稻只有茎鞘和叶片的分配率有所下降,13C同化物在其根系和土壤的占比反而分别提高1.41%~1.74%和0.94%~2.49%。由此可见, 与同期抽穗晚稻相比, 再生季稻灌浆后期(成熟期)促进了13C同化物向穗部的转运, 且大部分来自于茎鞘, 并减少了向地下部的转移。这从另一侧面也说明了再生季稻灌浆后期13C同化物分配给地下部减少, 导致根系早衰加剧, 促进同化物向穗部器官转运。上述结果再次说明了再生季稻较同期抽穗的同基因型晚稻具有更强的茎鞘物质输出转运能力, 因而经济系数高, 是一种流强化型的稻作类型。
3 讨论
2年田间试验结果表明, 与同期抽穗的同基因型晚稻相比, 常规稻佳辐占和杂交稻甬优2640两个品种的再生季稻的全生育期比其对照分别缩短48%和49%, 产量分别降低了34%和43%。从产量构成因素变化而言, 2个品种的再生季稻每穗粒数均比同期抽穗的同基因型晚稻显著下降了1.15~1.54倍。其结实率和千粒重差异因品种而异, 佳辐占再生季稻结实率比其同期抽穗的同基因型晚稻显著提高, 但千粒重则相反, 即表现佳辐占再生季稻千粒重比其对照显著下降。甬优2640再生季稻结实率和千粒重比其同期抽穗的同基因型晚稻变化趋势基本相似, 但两两差异不显著(表1)。可见, 再生季稻产量不及其同期抽穗的晚稻, 主要与其生育期显著缩短, 每穗粒数明显减少有关。因此如何有效延长再生季稻的生育期, 以增加其生物量是获取大穗的物质基础和技术关键。前人研究结果表明, 再生季稻生育期长短除了与品种特性有关外, 还与头季稻收割时的留桩高度有关[20-21]。一般认为在稻桩高度15~35 cm范围内, 每提高留桩高度5~10 cm, 再生季稻生育期缩短3~7 d。因此, 在光温资源相对丰富的稻区, 推广机收低留桩(20~25 cm)再生稻栽培技术, 可以有效延长再生季稻生育期, 以增加干物质累积, 提高每穗粒数, 为提升再生季稻产量奠定物质基础[8,22-23]。
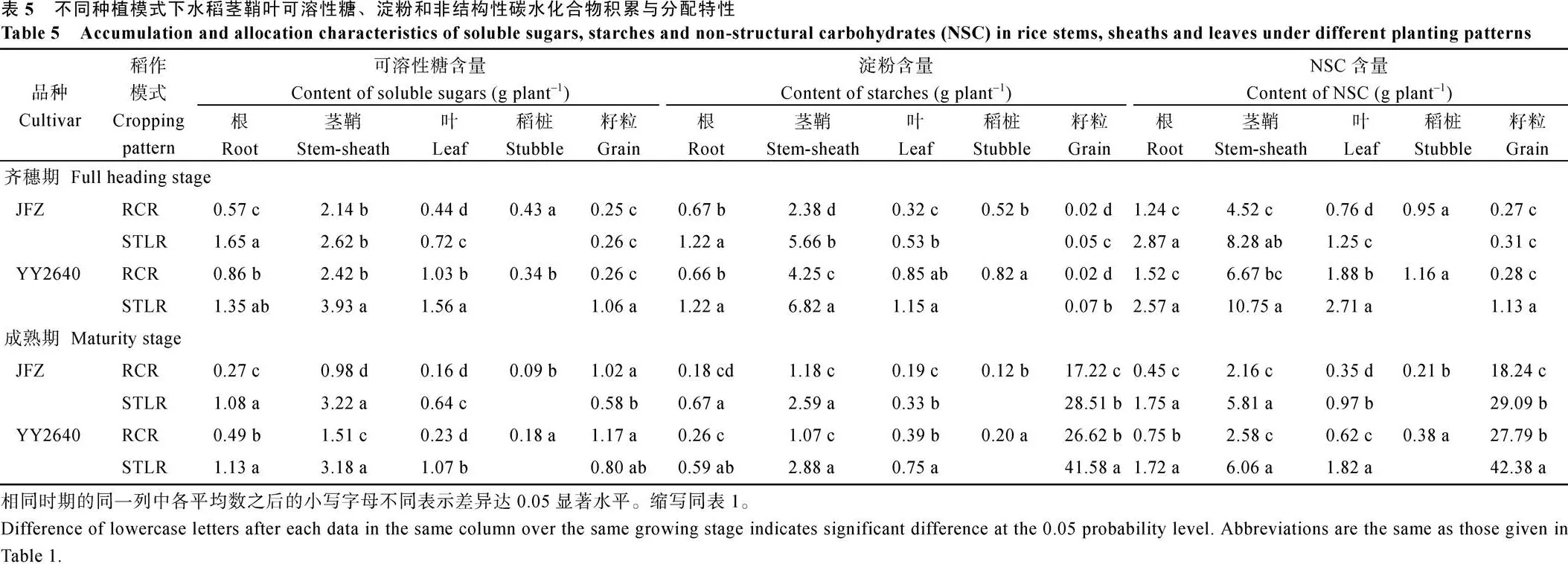
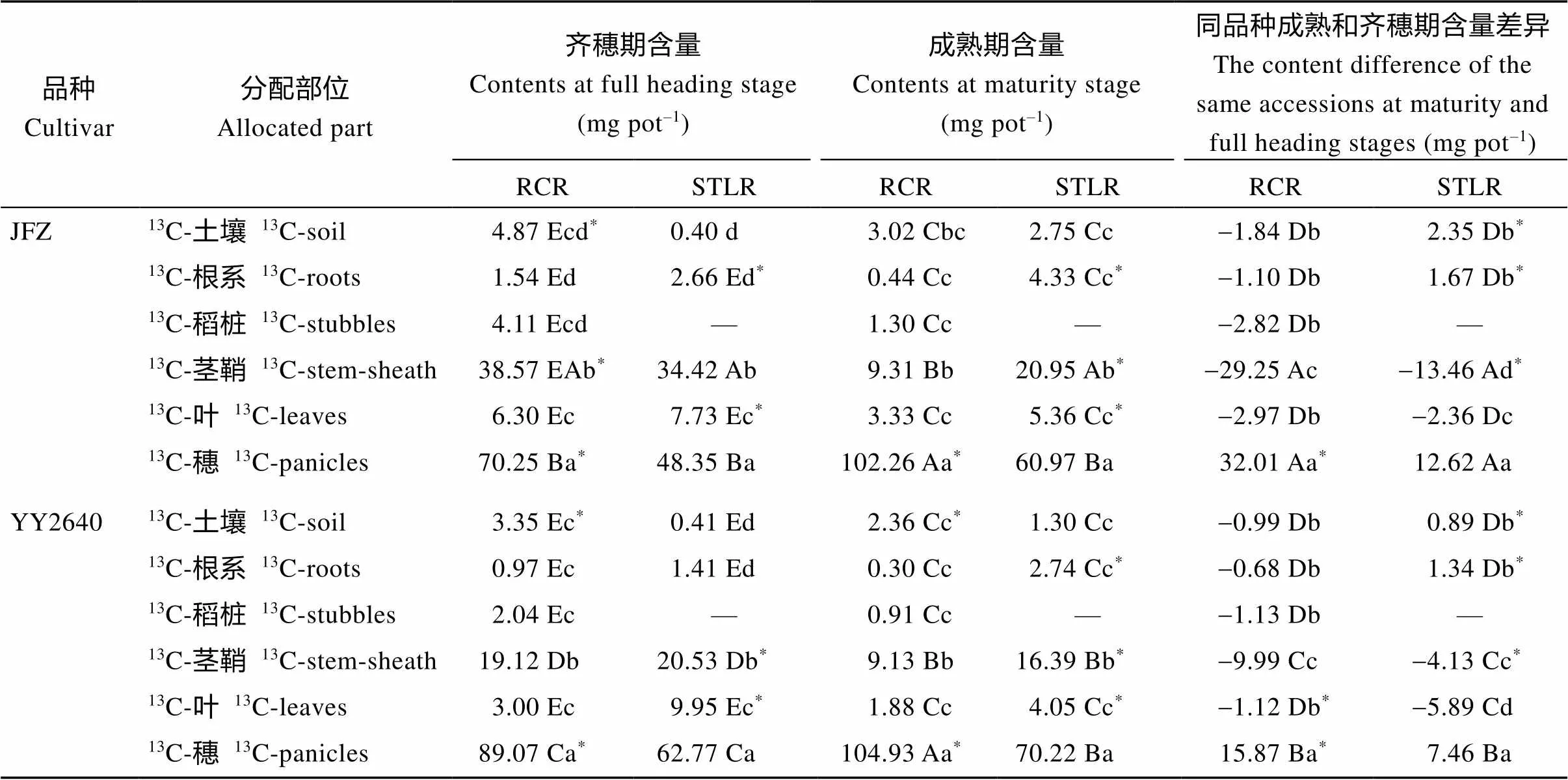
表7 不同水稻种植模式下水稻不同器官和土壤中的13C同化物含量
在同一施氮处理下, 同品种同一列里的不同小写或者大写字母表示在再生季不同部位差异显著达到0.05或0.01。*表示再生季同部位不同施氮处理间存在0.05的显著差异。缩写同表1。
Different letters (lowercase or uppercase) in the same column of the same cultivar have significant difference at the 0.05 or 0.01 probability levels among the different allocated parts at ratooning season under the same nitrogen application treatment.*indicates significant difference at the 0.05 probability level between different nitrogen application treatments at the same allocated part in the ratooning season. Abbreviations are the same as those given in Table 1.

表8 不同水稻种植模式下13C同化物在水稻不同器官和土壤中的分配率
在同一施氮处理下, 同品种同一列里的不同小写或者大写字母表示在再生季不同部位差异显著达到0.05或0.01。*表示再生季同部位不同施氮处理间存在0.05的显著差异。缩写同表1。
Different letters (lowercase or uppercase) in the same column of the same cultivar have significant difference at the 0.05 or 0.01 probability levels among different allocated parts at ratooning season under the same nitrogen application treatment.*indicates significant difference at the 0.05 probability level between different nitrogen application treatments at the same allocated part in the ratooning season. Abbreviations are the same as those given in Table 1.
本研究表明, 尽管2个供试品种的再生季稻生育期比其同期抽穗的同基因型晚稻缩短50%, 但其产量仍可以达到对照产量的55%~65%。进一步分析发现, 2个供试品种的再生季稻有效穗数比其同期抽穗的晚稻显著增加50%, 这既是再生稻品种的遗传特性, 也是再生稻的栽培特性。一般说来, 能作为再生稻栽培的品种其再生力较强。通常其腋芽萌发成穗率较高, 多在基部2~4节位萌发成穗。因此适当提高留桩高度有利于提高再生季稻的有效穗数, 但留桩过高生育期缩短, 影响大穗多粒[24-25]。同时它又受头季稻收割时稻桩质量的影响。本研究结果发现, 来源与头季的旧稻桩对于产量的物质贡献达4.2%~4.9%。而再生季稻茎鞘物质中可溶性糖、淀粉和NSC含量由头季稻收割后遗留的稻桩和由其腋芽萌发再生的茎鞘2部分组成, 特别是稻桩部分NSC在齐穗期占其总量的10.08%~12.32%, 可见培育健康的稻桩质量是再生稻获取高产关键环节之一。前人研究结果表明稻桩质量指标包括头季稻收割时稻桩和根部的非结构性碳水化合物(淀粉、可溶性糖)含量的高低。其中, 葡萄糖、果糖、蔗糖等溶于细胞液的碳水化合物, 不仅能作为糖源为植物生长发育提供能量, 还有调节细胞的渗透势的作用, 进而提高细胞的保水力, 维持细胞的正常生理过程[9,26-28]。头季稻如水肥管理不当, 会导致过早衰老, 或稻桩受病虫侵染, 严重影响稻桩质量, 从而影响腋芽存活和萌发成苗[29]。因此, 近年来华东南推广的机收低留桩再生稻栽培十分强调前氮后移和2次烤田高产栽培技术, 目的就是通过水肥调控措施使头季稻后期根系仍保持较高活力, 叶片不早衰, 收割时稻桩质量好, 腋芽存活率高, 再生成苗率好, 有效穗数增多, 最终实现高产优质[9-10,30]。
本研究还认为, 从源库特征而言, 再生季稻是一个典型的源库限制型稻作类, 反映在由千粒重低, 每穗粒数少导致的库容量小, 和由叶片短, 灌浆后期功能叶衰老快, 导致的叶面指数小的源库特征上, 这一点与前人研究结论一致[6]。但同时我们发现, 再生季稻又是一个典型的流强化型的稻作类型。具体体现在, 2个供试品种的再生季稻的稻桩、叶片和茎鞘的NSC转运率依次高达67%~78%、59%~67%和52%~61%, 显著高于其同期抽穗的主季晚稻, 因而其NSC转运对产量贡献率也高, 分别高达10%~ 18% (表6), 进一步研究表明,13C光合同化物分配在穗部占比大, 其分配率范围为51.70%~87.79%, 随着生育期的推进, 其占比呈上升趋势, 而且再生季稻穗部的分配率较同期抽穗晚稻要高, 在成熟期最大差值可达20.83%, 这与上述分析的灌浆中后期再生稻进入全身性衰老, 干物质再动员力强有关。因此, 进入齐穗期后, 再生稻JFZ和YY2640水稻品种茎鞘中NSC含量比同期抽穗晚稻的相应含量低62.82%和57.43%; 在成熟期再生稻JFZ和YY2640水稻品种茎鞘中NSC含量比同期抽穗晚稻的相应含量更低, 即低65.92%和54.19%。这种强流特性是再生季稻的收获指数比其同期抽穗的同基因型晚稻高的主要生理原因[10]。进一步分析发现, 再生季稻体内的ZR、IAA含量在齐穗期高于同期抽穗晚稻, 之后较低, ABA含量在齐穗期至齐穗后10 d或20 d较之更高, 而GA3含量普遍低于同期抽穗晚稻, 由此引发在再生季稻籽粒灌浆前期(齐穗期), 其叶片光合速率和SPAD值均比同期抽穗的同基因型晚稻明显增高, 但齐穗后20 d至成熟期其光合速率和SPAD则较其对照明显降低, 叶绿素衰减值却大, 体现了再生季稻适时的全株功能性衰老特征[9-10,18-19,31], 有利于光合产物从源向库组织快速转运[31], 使再生季稻花后地上部干物质, 特别是茎鞘中的NSC转运量、转运率及贡献率均显著大于同期抽穗晚稻。同时我们研究还发现再生季稻的这种干物质分配特性还与其在灌浆前期与分配有直接联系的几个关键酶活性较高有关, 如淀粉合酶(StSase)、淀粉分支酶(SB)、蔗糖合成酶(SuSase)和ADP葡萄糖焦磷酸化酶(AGPase), 而进入灌浆中后期则与较低的酶特性相适应[10,18]。
本研究还发现, 与同期抽穗晚稻相比, 再生季稻灌浆后期大部分来自于茎、鞘器官的13C同化物向穗部转运量增多, 同时, 减少了再生季稻13C同化物向地下部的转移量, 加速后期根系衰老进程, 促进干物质向穗部转运, 反映了再生季稻特有的干物质积累与分配特性, 也是再生季稻收获指数高的内在生理生态机制。因此如何应用这一栽培特性以提高再生季稻的有效穗, 实现强源扩库, 提高产量是值得进一步关注的科学问题。此外, 前人研究证实, 通过转基因技术减少水稻干物质对根系的分配可以有效降低土壤甲烷等温室气体的排放[32]。包括本研究团队在内的国内外学者研究认为再生稻种植模式比传统单季稻和双季稻模式碳排放显著降低[33-36]。Denier等[37]研究也认为, 采取合理施肥方式优化水稻生产能力, 扩大籽粒库容量, 减少光合作用固定碳的向下分配, 提高水稻收获指数, 可以减少水稻的CH4气体排放量。本研究认为再生稻正好反映了上述生理生态特性, 特别是再生季稻可以充分利用光合产物, 减少向地下部的分配比例[36], 其高产的形成与其光合产物从源到库的高运转能力和低碳排放特性密不可分, 其过程与机制值得深入研究。
4 结论
无论是杂交稻还是常规稻, 其再生季稻生育期比其同期抽穗的同基因型晚稻明显缩短, 但其单位面积的有效穗数和收获指数却显著增加, 因此最终产量能达到对照产量的55%~65%。进一步分析发现, 再生季稻体内的ZR、IAA含量在齐穗期高于同期抽穗晚稻, 之后较低。ABA含量在齐穗期至齐穗后10 d或20 d较之更高, 而GA3含量普遍低于同期抽穗晚稻, 由此引发的再生季稻在其籽粒灌浆前期叶片光合速率和SPAD值均比同期抽穗的同基因型晚稻明显增高, 但齐穗后20 d至成熟期其光合速率和SPAD值则较其对照明显降低, 体现了再生季稻适时的全株功能性衰老特征, 有利于光合产物从源向库快速转运, 使再生季稻花后地上部干物质, 特别是茎鞘中的NSC转运量、转运率及贡献率均显著大于同期抽穗晚稻;13C-CO2脉冲标记结合盆栽试验结果也证实, 与同期抽穗晚稻相比, 再生季稻灌浆后期大部分来自于茎鞘的13C同化物向穗部转运量增多, 同时, 减少了再生季稻13C同化物向地下部的转移量达2%~5%, 因而有效穗多, 收获指数高, 反映了再生季稻特有的干物质积累与分配特性, 是一个典型的源库限制型和流强化型的稻作类型。因此, 应加强以提高再生季稻有效穗数为核心的增源扩库技术路径研究, 是再生稻实现产量跨越的关键。
[1] 何爱斌, 于朋超, 陈乾, 姜广磊, 王慰亲, 聂立孝. 甬优4949和超优1000在华中地区再生稻种植的氮肥运筹研究. 中国水稻科学, 2019, 33: 47–56.
He A B, Yu P C, Chen Q, Jiang G L, Wang W Q, Nie L X. Optimizing the nitrogen management for Yongyou 4949 and Chaoyou 1000 in ratoon rice system in Central China., 2019, 33: 47–56 (in Chinese with English abstract).
[2] 黄锦文, 吴珈谊, 陈鸿飞, 张志兴, 方长旬, 邵彩虹, 林伟伟, 翁佩莹, 林文雄. 头季稻氮肥运筹对再生稻根际机能及产量的影响. 中国水稻科学, 2021, 35: 383–395.
Huang J W, Wu J Y, Chen H F, Zhang Z X, Fang C X, Shao C H, Lin W W, Weng P Y, Lin W X. Nitrogen fertilizer management for main crop rice and its carrying-over effect on rhizosphere function and yield of ratoon rice., 2021, 35: 383–395 (in Chinese with English abstract).
[3] 林文雄, 陈鸿飞, 张志兴, 徐倩华, 屠乃美, 方长旬, 任万军. 再生稻产量形成的生理生态特性与关键栽培技术的研究与展望. 中国生态农业学报, 2015, 23: 392–401.
Lin W X, Chen H F, Zhang Z X, Xu Q H, Tu N M, Fang C X, Ren W J. Research and prospect on physio-ecological properties of ratoon rice yield formation and its key cultivation technology., 2015, 23: 392–401 (in Chinese with English abstract).
[4] Lin W X. Developmental status and problems of rice rationing., 2019, 18: 246–247.
[5] Zheng C, Wang Y C, Yuan S, Xiao S, Sun Y T, Huang J L, Peng S B. Heavy soil drying during mid-to-late grain filling stage of the main crop to reduce yield loss of the ratoon crop in a mechanized rice rationing system., 2022, 10: 280–285.
[6] 易镇邪, 屠乃美, 陈平平. 杂交稻新组合再生稻头季及再生季源库特征分析. 中国水稻科学, 2005, 19: 243–248.
Yi Z X, Tu N M, Chen P P. Source-sink characteristics of main crop and ratooning rice of several new hybrid rice combinations., 2005, 19: 243–248 (in Chinese with English abstract).
[7] 朱校奇, 邓启云, 陈春光, 龙世平, 尹文雅, 庄文. 超级杂交稻再生稻和主季稻源库关系比较. 亚热带农业研究, 2009, 5(2): 73–78.
Zhu X Q, Deng Q Y, Chen C G, Long S P, Yin W Y, Zhuang W. Comparison on source-sink relationship of ratooning rice and main crop of super hybrid rice., 2009, 5(2): 73–78 (in Chinese with English abstract).
[8] 易镇邪, 周文新, 秦鹏, 屠乃美. 再生稻与同期抽穗主季稻源库流特性差异研究. 作物学报, 2009, 35: 140–148.
Yi Z X, Zhou W X, Qin P, Tu N M. Differences in characteristics of source, sink, and flow between ratooning rice and its same-term heading main-crop rice., 2009, 35: 140–148 (in Chinese with English abstract).
[9] Huang J W, Wu J Y, Chen H F, Zhang Z X, Fang C X, Shao C H, Lin W W, Weng P Y, Khan M U, Lin W X. Optimal management of nitrogen fertilizer in the main rice crop and its carrying-over effect on ratoon rice under mechanized cultivation in southeast China.,2022, 21: 2–15.
[10] Huang J W, Pan Y P, Chen H F, Zhang Z X, Fang C X, Shao C H, Amjad H, Lin W W, Lin W X. Physiochemical mechanisms involved in the improvement of grain-filling, rice quality mediated by related enzyme activities in the ratoon cultivation system., 2020, 258: 107962.
[11] He A B, Wang W Q, Jiang G L, Sun H J, Jiang M, Man J G, Cui K H, Huang J L, Peng S B, Nie L X. Source-sink regulation and its effects on the regeneration ability of ratoon rice., 2019,236: 155–164.
[12] 谢华安. 超级稻作再生稻高产栽培特性的研究. 杂交水稻, 2010, 25(增刊1): 17–26.
Xie H A. Studies on high-yielding cultivation characteristics of super hybrid rice grown as ratoon rice., 2010, 25(S1): 17–26 (in Chinese).
[13] 张上守, 卓传营, 姜照伟, 李义珍, 郭聪华. 超高产再生稻产量形成和栽培技术分析. 福建农业学报, 2003, (1): 1–6.
Zhang S S, Zhuo C Y, Jiang Z W, Li Y Z, Guo C H. Yield formation and cultivation techniques in super high-yielding ratoon rice., 2003, (1): 1–6 (in Chinese with English abstract).
[14] 张海峰, 黄育民, 林文, 李义珍. 再生稻的光合作用和物质生产. 福建稻麦科技, 1991, (4): 41–45.
Zhang H F, Huang Y M, Lin W, Li Y Z. Photosynthesis and material production in ratoon rice., 1991, (4): 41–45 (in Chinese).
[15] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000. pp 111–114.
Zou Q. Experimental Guidance in Plant Physiology. Beijing: China Agriculture Press, 2000. pp 111–114 (in Chinese).
[16] 陈远平, 杨文钰. 卵叶韭休眠芽中GA3I、AA、ABA和 ZT的高效液相色谱法测定. 四川农业大学学报, 2005, (4): 498–500.
Chen Y P, Yang W Y. Determination of GA3I, AA, ABA and ZT in dormant buds of allium ovalifolium by HPLC., 2005, (4): 498–500 (in Chinese with English abstract).
[17] 李洲. 低留桩再生稻产量形成的生理生态研究. 福建农林大学博士学位论文, 福建福州, 2020.
Li Z. Study on Physioecological Mechanism of Yield Formation of Ratooning Rice Generated from Low Stubbles of Main Crop. PhD Dissertation of Fujian Agricultural and Forestry University, Fuzhou, Fujian, China, 2020 (in Chinese with English abstract).
[18] Yang J, Zhang J. Grain filling of cereals under soil drying., 2006, 169: 223–236.
[19] Yang J C, Zhang J H, Wang Z Q, Zhu Q S, Liu L J. Involvement of abscisic acid and cytokinins in the senescence and remobilization of carbon reserves in wheat subjected to water stress during grain filling., 2010, 26: 1621–1631.
[20] Harrell D L, Bond J A, Blanche S. Evaluation of main-crop stubble height on ratoon rice growth and development., 2009, 114: 396–403.
[21] 刘爱中, 邹冬生, 屠乃美, 刘飞. 留桩高度对再生稻生长发育及产量的影响. 安徽农业科学, 2007, 35: 5120–5121.
Liu A Z, Zou D S, Tu N M, Liu F. Effect of stubble height on growth and yield of ratooning rice., 2007, 35: 5120–5121 (in Chinese with English abstract).
[22] 熊绪穰. 谈谈再生稻的桩高问题. 杂交水稻, 1995, (3): 45. Xiong X R. A discussion on the stubble height of ratoon rice., 1995, (3): 45 (in Chinese).
[23] 易镇邪, 周文新, 屠乃美. 留桩高度对再生稻源库性状与物质运转的影响. 中国水稻科学, 2009, 23: 509–516.
Yi Z X, Zhou W X, Tu N M. Effects of stubble height of the main crop on source-sink characteristics and assimilates transportation in ratooning rice., 2009, 23: 509–516 (in Chinese with English abstract).
[24] Daliri M S, Eftekhari A, Mobasser H R, Tari D B, Porkalhor H. Effect of cutting time and cutting height on yield and yield components of ratoon rice (Tarom LangrodiVariety).2009, 8: 89–91.
[25] Yazdpour H, Shahri M M, Soleymani A, Shahrajabian M H. Effects of harvesting time and harvesting height on grain yield and agronomical characters in rice ratoon (L.)., 2012, 10: 438–440.
[26] 王嘉佳, 唐中华. 可溶性糖对植物生长发育调控作用的研究进展. 植物学研究, 2014, 3(3): 71–76.
Wang J J, Tang Z H. The regulation of soluble sugars in the growth and development of plants.,2014, 3(3): 71–76 (in Chinese with English abstract).
[27] 周驰燕, 李国辉, 许轲, 郭保卫, 戴其根, 霍中洋, 魏海燕, 张洪程. 水稻茎鞘非结构性碳水化合物转运机理及栽培调控研究进展. 生命科学, 2021, 33: 111–120.
Zhou C Y, Li G H, Xu K, Guo B W, Dai Q G, Huo Z Y, Wei H Y, Zhang H C. Advances in translocation mechanism and cultivation regulation of nonstructural carbohydrate in rice stem and sheath., 2021, 33: 111–120 (in Chinese with English abstract).
[28] 黄素华, 林席跃, 雷正平, 丁在松, 赵明. 强再生力水稻品种碳氮营养与激素生理特征研究. 作物学报, 2021, 47: 2278–2289.
Huang S H, Lin X Y, Lei Z P, Ding Z S, Zhao M. Physiological characters of carbon, nitrogen, and hormones in ratooning rice cultivars with strong regeneration ability., 2021, 47: 2278–2289 (in Chinese with English abstract).
[29] 杨东, 陈鸿飞, 卓传营, 林文雄. 头季不同施氮方式对再生稻生理生化的影响. 中国生态农业学报, 2009, 17: 643–646.
Yang D, Chen H F, Zhuo C Y, Lin W X. Effect of different N application modes in the first cropping rice on the physiobiochemistry of the first cropping rice and its ratoon rice., 2009, 17: 643–646 (in Chinese with English abstract).
[30] 徐富贤, 熊洪, 张林, 朱永川, 蒋鹏, 郭晓艺, 刘茂. 再生稻产量形成特点与关键调控技术研究进展. 中国农业科学, 2015, 48: 1702–1717.
Xu F X, Xiong H, Zhang L, Zhu Y C, Jiang P, Guo X Y, Liu M. Progress in research of yield formation of ratooning rice and its high-yielding key regulation technologies., 2015, 48: 1702–1717 (in Chinese with English abstract).
[31] Yu S M, Lo S F, Ho T H D. Source–sink communication: regulated by hormone, nutrient, and stress cross-signaling., 2015, 20: 844–856.
[32] Su J, Hu C, Yan X, Jin Y, Chen Z, Guan Q, Wang Y, Zhong D, Jansson C, Wang F, Schnurer A, Sun C. Expression of barley SUSIBA2 transcription factor yields high-starch low-methane rice., 2015, 523: 602–606.
[33] Firous S, Nikkhah A, Aminpanah H. Rice single cropping or ratooning agro-system: which one is more environment-friendly., 2018, 25: 32246–32256.
[34] 张浪, 徐华勤, 李林林, 陈元伟, 郑华斌, 唐启源, 唐剑武. 再生稻和双季稻田CH4排放对比研究. 中国农业科学, 2019, 52: 2101–2113.
Zhang L, Xu H Q, Li L L, Chen Y W, Zheng H B, Tang Q Y, Tang J W. Comparative study on CH4emission from ratoon rice and double-cropping rice fields., 2019, 52: 2101–2113 (in Chinese with English abstract).
[35] 邓桥江, 曹凑贵, 李成芳. 不同再生稻栽培模式对稻田温室气体排放和产量的影响. 农业环境科学学报, 2019, 38: 1373–1380.
eng J Q, Cao C G, Li C F. Effects of different ratooning cultivation modes on greenhouse gas emissions and grain yields in paddy fields., 2019, 38: 1373–1380 (in Chinese with English abstract).
[36] 林志敏, 李洲, 翁佩莹, 吴冬青, 邹京南, 庞孜钦, 林文雄. 华东南再生稻田温室气体排放特征及碳足迹. 应用生态学报, 2022.
Lin Z M, Li Z, Weng P Y, Wu D Q, Zou J N, Pang Z Q, Lin W X. Field greenhouse gas emission characteristics and carbon footprint of ratoon rice in southeast China., 2022 (in Chinese with English abstract).
[37] Denier van der gon H A C, Kropff M J, Van Breemen N, Wassmann R, Lantin R S, Aduna E, Corton T M, Van Laar H H. Optimizing grain yields reduces CH4emissions from rice paddy fields., 2002, 99: 12021–12024.
Dry matter partitioning properties and mechanism of ratooning rice and main crop (late season) synchronized in rice heading time
WU Dong-Qing1, LI Zhou2, GUO Chun-Lin3, ZOU Jing-Nan1, PANG Zi-Qin3, LIN Fei-Fan1, HE Hai-Bin1, and LIN Wen-Xiong1,3,*
1College of Life Sciences, Fujian Agriculture and Forestry University / Fujian Province Key Laboratory of Agro-Ecological Process and Safety Monitoring, Fuzhou 350002, Fujian, China;2Subtropical Agriculture Research Institute, Fujian Academy of Agricultural Sciences, Zhangzhou 363005, Fujian, China;3Key Laboratory of Crop Genetics and Integrated Utilization, Ministry of Education, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
It is of great theoretical and practical significance to study the dry matter accumulation and translocation properties of ratoon rice for further understanding the physiological mechanism of yield formation and exploring the potential of yield increase. In this study, two rice varieties, Jiafuzhan (conventionalrice) and Yongyou 2640 (hybrid rice), popularly planted in Southeast China, were used as the test materials. The ratooning and main rice crops of the two cultivars were regulated to be heading and ripening in the similar temperature condition of late autumn. Differences of photosynthetic physiology, hormone content, dry matter production, NSC translocation, and13C assimilate in aboveground and underground parts of ratooning rice and its main crop synchronized heading in late season were compared. The results showed that, compared with main crop (late season) synchronized in rice heading time, the growth period of ratooning rice of the two varieties was 50% shorter, but they had 50% increase of effective panicles and 10% increase of harvest indexes, so the final yield could still reach 55%–65% of the control yield; the photosynthetic rate and SPAD value of the ratooning rice at the early stage of grain filling were significantly higher, but they turned to be significantly lower from 20 days after full heading to maturity; the content of ZR and IAA in ratooning rice were higher at the full heading stage, but lower later; the content of ABA in ratooning rice was 10%–20% higher from full heading stage to 10 days or 20 days after full heading, while the content of GA3in ratooning rice was generally lower; NSC translocation rates of stubble, leaf and stem-sheath of the two tested varieties were as high as 67%–78%, 59%–67%, and 52%–61%, respectively, and the contribution rate of NSC translocation to yield was also as high as 10%–18%, respectively. The distribution rate of13C photochemical compounds in panicle of ratooning rice at maturity stage was up to 20.83%, and the translocation of13C assimilates to underground part of ratooning rice was reduced by 5%, resulting in more effective panicles and higher harvest index. Therefore, ratooning rice can reduce translocation and allocation of photoassimilates to rhizosphere soil, improve harvest index, lessen CH4,and other greenhouse gas emissions, which is a high-benefit and environment-friendly rice cropping pattern.
ratooning season rice;13C pulse labeling; non-structural carbohydrate; dry matter accumulation and translocation
10.3724/SP.J.1006.2023.22016
本研究由国家重点研发计划项目(2016YFD0300508, 2017YFD0301602, 2018YFD0301105), 闽台种植资源创制与绿色栽培协调创新中心项目(福建2011项目, 2015-75)和福建农林大学科技发展基金项目(KF2015043)资助。
This study was supported by the National Key Research and Development Program of China (2016YFD0300508, 2017YFD0301602, 2018YFD0301105), the Fujian-Taiwan Coordination Innovation Center for Plant Germplasm Creation and Green Cultivation (Fujian 2011 Project, 2015-75), and the Fujian Agriculture and Forestry University Science and Technology Development Fund Project (KF2015043).
通信作者(Corresponding author):林文雄, E-mail: wenxiong181@163.com
E-mail: wudq606@163.com
2022-03-18;
2022-07-21;
2022-08-24.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220823.1747.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
