外源H2S对盐胁迫下红砂幼苗叶片和根系氮代谢的影响
2023-01-16刘行行种培芳马志强谭兵兵
刘行行 种培芳 马志强 谭兵兵 马 帅
(甘肃农业大学林学院,甘肃兰州7 30070)
氮代谢是植物最基本的生理过程之一[1],它与植物的生长发育、产量和品质形成关系密切[2]。氮素作为高等植物重要的营养元素之一,参与氨基酸、蛋白质、叶绿素、核酸、脂类和多种含氮代谢物的合成[3]。植物所吸收的氮主要是无机态氮,也可吸收某些可溶性有机氮化物,如尿素、氨基酸、酰胺等,此外,土壤中低浓度的亚硝酸盐也能被植物吸收[4]。不同形态的氮素进入植物体后,最终都会以相同的方式形成不同的氨基酸,进而合成蛋白质成为植物有机体的一部分[5]。在植物生长发育阶段中,硝酸还原酶(nitrate reductase,NR)、谷 氨 酰 胺 合 成 酶(glutamine synthetase,GS)、谷氨酸合成酶(glutamate synthetase,GOGAT)等氮代谢关键酶发挥着重要作用[6]。而盐胁迫会严重影响氮代谢相关酶的活性,阻碍植物对氮素的正常吸收和利用,使氮代谢系统紊乱[7]。如盐胁迫下,黄瓜幼苗中谷氨酰胺合成酶和谷氨酸合成酶的活性被抑制[8];小麦氮同化率减弱,氮积累量降低[9];颠茄的氮代谢过程受到影响[10]等。
硫化氢(hydroden ulfide,H2S)是一种无机化合物,同时也是继CO、NO后在生物体内发现的第三种气体信号分子[11]。H2S同NO和CO相似[12],可作为信号分子参与植物各种生理功能的调节,促进种子萌发、根的发生,调节光合作用、气孔运动,并参与抵抗重金属、盐、干旱及高温等胁迫[13]。外源H2S的施入能有效提高盐胁迫下茶树的抗氧化水平[14],增强番茄幼苗对NO-3的胁迫耐性[15],促进桃实生苗根系的生长[16]等,在植物非生物胁迫的应答中发挥着重要作用[17]。因硫氢化钠(sodium hydrosulfide,NaHS)可以在生物体内解离成Na+和HS-,HS-又可以与体内的H+结合形成H2S,从而形成一种动态的平衡,实现外源H2S的施入[18],生物学研究中通常用NaHS作为外源H2S的供体。
红砂(Reaumuria soongorica),又称枇杷柴,是柽柳科红砂属的一种强旱生泌盐多年生小灌木[19],主要分布于新疆、内蒙古、宁夏、甘肃、青海等地区,具有很强的抗旱、抗寒、耐盐、固沙、集沙和保持水土能力,对荒漠和草原地区的生态保护具有积极作用[20]。红砂特有的盐腺结构是其能在盐碱环境中生存的重要保障[21],但盐碱地是影响红砂群落分布的主要因素之一[22]。红砂对不同盐分梯度均具有较高的生态位宽度,且在富盐生境中的生长状况比在贫盐生境中更好,群落主要分布于总盐量达到0.5%~2.0%的荒漠地带盐渍化土壤上[20]。研究表明,红砂是典型的泌盐植物[21]。在盐胁迫下,红砂可以通过叶片泌盐和调控活性氧(reactive oxygen species,ROS)等手段来减轻盐害的影响[23]。
近年来,利用小分子物质来调控植物耐盐机理的研究比较广泛,H2S作为新型的小分子物质,对逆境胁迫下植物生理代谢的调控研究已逐渐成为热点,但关于外源H2S对盐胁迫下红砂氮代谢影响机制的研究尚鲜见报道。本试验以当年生红砂幼苗为材料,用NaHS作为外源H2S的供体,探究盐胁迫下外源H2S对红砂氮代谢酶和营养物质的影响,并对其调控机制进行初步探究,以期为进一步发掘和研究如何有效提高红砂幼苗在盐碱荒漠生境中的存活率和繁殖率,以及培育红砂优质种质资源提供理论依据。
1 材料与方法
1.1 供试材料
本试验所用红砂种子采自甘肃省武威市凉州区羊下坝镇,于2020年4月开始,挑选颗粒饱满的红砂种子,用0.3% KMnO4溶液消毒15 min,用蒸馏水冲洗5次并吸干表面水分后播种于预先灭菌的培养基质中,培养基质由泥炭土、蛭石和珍珠岩按体积比3∶1∶1混合均匀而成,每盆填装基质约2 kg,花盆口径25 cm、高30 cm、底径20 cm,在甘肃农业大学校园科研基地四周通风顺畅且透光良好的人工遮雨棚内进行红砂幼苗培育,待自然光照下幼苗长至10~12 cm时,选取大小均匀、生长一致的红砂幼苗进行试验,每盆保留3株。H2S外源供体NaHS购自德国Sigma公司。
1.2 试验设计
试验中盐胁迫浓度选用预先筛选的300 mmol·L-1NaCl溶液[24],该浓度可有效抑制红砂幼苗的生长。盐胁迫处理时,为防止盐分冲击,以每天50 mmol·L-1NaCl溶液递增至处理浓度后记作试验开始。以叶面喷施的方法,设置9个处理组合,对照(CK)用1/2 Hoagland浇灌,单独盐胁迫对照(CK300)用1/2 Hoagland配制的300 mmol·L-1NaCl溶液浇灌,两者叶面均喷施蒸馏水,其余7个H2S处理均用1/2 Hoagland配制的300 mmol·L-1NaCl溶液浇灌,叶面分别喷施0.010、0.025、0.050、0.100、0.250、0.500、1 mmol·L-1NaHS溶液,且上述各浓度处理在以下图表中分别简写为CK、CK300、0.010、0.025、0.050、0.100、0.250、0.500、1,每组处理3个重复,共27盆。每天上午定时对叶片喷施对应浓度NaHS溶液至欲滴,连续处理30 d后采集红砂植株茎中部的功能叶片和部分根系,用液氮速冻后存放于-80℃冰箱低温保存,用于后续氮代谢各项指标的测定。
1.3 测定指标及方法
硝态氮含量采用磺基水杨酸法[25]测定,硝酸还原酶(NR)活性采用磺胺比色法[25]测定,可溶性蛋白含量采用考马斯亮蓝G-250法[25]测定,游离氨基酸含量采用酸性茚三酮法[25]测定。谷氨酸合成酶(GOGAT)和谷氨酰胺合成酶(GS)活性均采用贾向阳等[24]的方法测定。
1.4 数据处理与分析
采用Microsoft Excel 2021对原始数据进行简单处理,SPSS 26.0软件对数据进行统计和方差分析,Origin 2021软件绘图。参考张耿等[26]的方法对红砂各单项指标进行耐盐系数计算,并对6个氮代谢指标的耐盐系数进行单样本T检验、主成分分析和隶属函数计算。其中,单项耐盐系数计算公式如下:
单项耐盐系数α=不同浓度处理下的平均测定值/盐胁迫对照测定值×100%。
2 结果与分析
2.1 外源H2S对盐胁迫下红砂幼苗叶片和根系中氮代谢关键酶活性的影响
2.1.1 谷氨酸合成酶(GOGAT)活性由图1-A可知,300 mmol·L-1NaCl处理(CK300)下红砂幼苗叶片和根系中的谷氨酸合成酶活性较对照(CK)显著降低,在NaCl和不同浓度NaHS的共同作用下,红砂幼苗叶片和根系中的谷氨酸合成酶活性均随NaHS浓度的增加呈先升高后降低趋势,两者酶活性均于0.025 mmol·L-1NaHS处理下达到峰值。上述结果表明,在300 mmol·L-1NaCl胁迫处理下,通过叶面喷施不同浓度的NaHS能有效增强红砂幼苗叶片和根系中谷氨酸合成酶的活性,且以0.025 mmol·L-1NaHS处理效果最为显著。
2.1.2 谷氨酰胺合成酶(GS)活性由图1-B可知,盐胁迫处理(CK300)下红砂幼苗叶片和根系谷氨酰胺合成酶活性较CK显著降低。在NaCl和不同浓度NaHS共同作用后,红砂幼苗叶片和根系中的GS活性均随NaHS浓度的增加表现出先升高后降低的变化趋势,且叶片和根系的酶活性峰值分别出现在0.050和0.025 mmol·L-1处。可见,在300 mmol·L-1NaCl胁迫处理下,叶面喷施不同浓度NaHS能整体显著增强红砂幼苗叶片和根系中的谷氨酰胺合成酶活性,并以叶片0.050 mmol·L-1和 根系0.025 mmol·L-1NaHS处 理效果最佳。
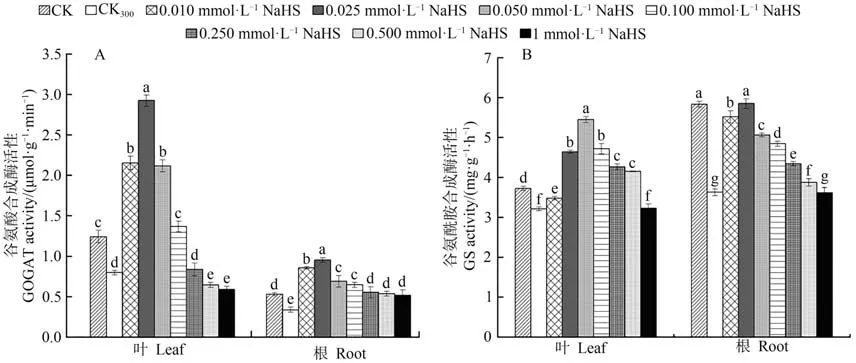
图1 外源H2S对盐胁迫下红砂叶片、根系中谷氨酸合成酶和谷氨酰胺合成酶的影响Fig.1 Effects of exogenous H2S on GOGAT and GS in leaves and roots of R.soongorica under salt stress
2.2 外源H2S对盐胁迫下红砂幼苗叶片和根系中硝态氮含量和硝酸还原酶活性的影响
2.2.1 硝态氮(NO-3-N)含量由图2-A可知,在300 mmol·L-1NaCl胁迫处理下,红砂幼苗叶片与根系的硝态氮含量与CK相比均显著降低。在NaCl和不同浓度NaHS的共同作用下,叶片和根系中的硝态氮含量随NaHS浓度的增加先升高后降低,其含量最大值分 别出 现于0.025和0.100 mmol·L-1处。不同 浓度NaHS处理下红砂叶片和根系的硝态氮含量较CK300整体呈上升趋势。上述结果表明,在盐胁迫下,红砂叶面喷施NaHS能整体提升叶片和根系中的硝态氮含量,并有效缓解盐胁迫对红砂生长发育的影响。
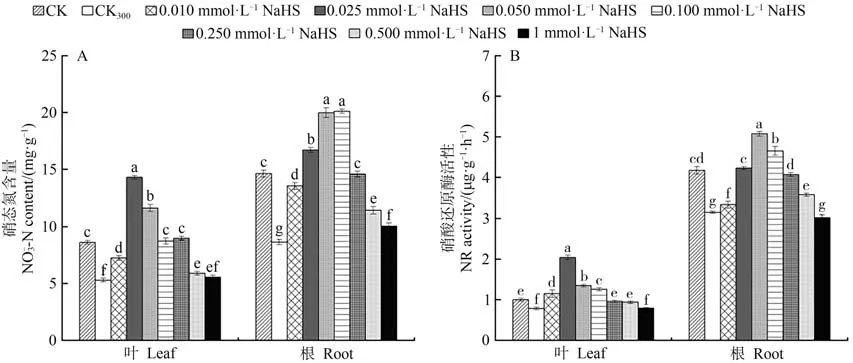
图2 外源H2S对盐胁迫下红砂叶片、根系中硝态氮和硝酸还原酶的影响Fig.2 Effects of exogenous H2S on NO-3-N and NR in leaves and roots of R.soongorica under salt stress
2.2.2 硝酸还原酶(NR)活性由图2-B可知,红砂叶片和根系中的硝酸还原酶活性在CK、CK300和不同浓度NaHS的差异处理下表现出相同的变化趋势。300 mmol·L-1NaCl胁迫下硝酸还原酶活性较CK显著降低;在NaCl和不同浓度NaHS的共同作用下,红砂幼苗叶片和根系中的硝酸还原酶活性均随NaHS浓度的增加呈先升高后降低趋势,叶片和根系酶活性峰值分别出现于0.025和0.050 mmol·L-1处。根系的硝酸还原酶活性在0.010~0.500 mmol·L-1NaHS处理下显著高于CK300处理;而叶片中除1 mmol·L-1NaHS处理浓度外,其他NaHS浓度处理下的硝酸还原酶活性均显著高于CK300。
2.3 外源H2S对盐胁迫下红砂叶片、根系中游离氨基酸和可溶性蛋白含量的影响
2.3.1 游离氨基酸含量由图3-A可知,300 mmol·L-1NaCl处理下红砂幼苗根系中的游离氨基酸含量较CK显著降低,但在叶片中表现不显著。在NaCl和不同浓度NaHS的共同作用下,叶片和根系中的游离氨基酸含量随NaHS浓度的增加先升高后降低,且均高于CK300处理。叶片在0.050~0.250 mmol·L-1NaHS处理下的游离氨基酸含量增幅显著,根系在0.100 mmol·L-1NaHS处理下的游离氨基酸含量最高。上述结果表明,在300 mmol·L-1NaCl胁迫处理下,叶面喷施不同浓度的NaHS能整体显著增加红砂幼苗叶片和根系中的游离氨基酸含量,并且以0.250 mmol·L-1NaHS处理效果最为明显。
2.3.2 可溶性蛋白含量由图3-B可知,盐胁迫处理下红砂叶片和根系中的可溶性蛋白含量与对照相比显著降低。在NaCl和不同浓度NaHS的共同作用下,红砂叶片的可溶性蛋白含量随NaHS浓度的增加先降低后升高,在0.050 mmol·L-1NaHS处理下可溶性蛋白含量最低,而红砂根系中的可溶性蛋白含量表现为随NaHS浓度增加呈先升高后降低的变化趋势,且在0.025 mmol·L-1NaHS处理下可溶性蛋白含量最高。除上述对根系处理的0.025 mmol·L-1NaHS浓度外,叶片与根系在其他浓度NaHS处理下的可溶性蛋白含量均低于CK300。由此可见,在300 mmol·L-1NaCl胁迫处理下,叶面喷施NaHS可整体显著降低红砂叶片和根系的可溶性蛋白含量。
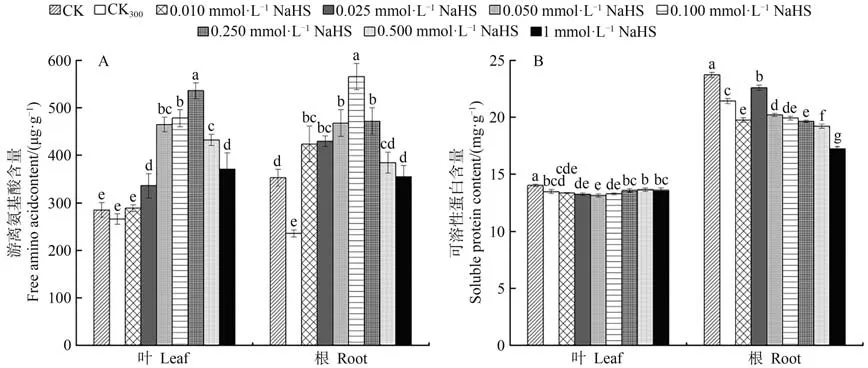
图3 外源H2S对盐胁迫下红砂叶片、根系中游离氨基酸和可溶性蛋白的影响Fig.3 Effects of exogenous H2S on Soluble protein and free amino acid in leaves and roots of R.soongorica under salt stress
2.4 外源H2S对盐胁迫下红砂缓解效应的综合评价
2.4.1 耐盐系数间T检验和相关指标分析利用红砂叶片和根系的6个氮代谢指标平均值计算其耐盐系数并进行单样本T检验(表1),结果显示,在300 mmol·L-1NaCl和不同浓度NaHS的共同作用下,除叶片的谷氨酸合成酶(GOGAT)和两者可溶性蛋白外,红砂叶片和根系的其他氮代谢指标均表现为显著水平(P<0.05)或极显著水平(P<0.01)。红砂叶片和根系可溶性蛋白变异系数均最小,而叶片和根系的其余5个氮代谢指标变异系数分别介于0.185~0.580和0.178~0.301之间,说明红砂叶片和根系中除可溶性蛋白差异不显著外,其他指标之间均存在较大的差异。
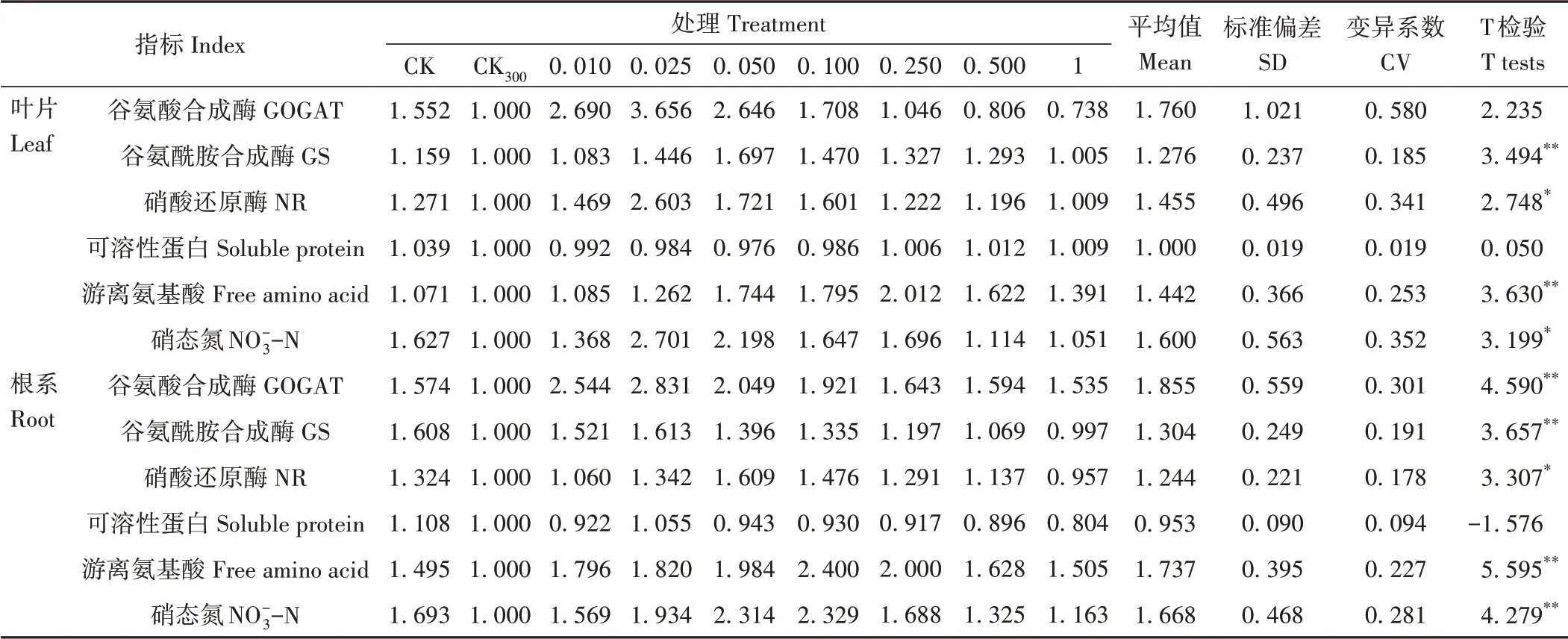
表1 不同处理下红砂氮代谢指标的耐盐系数Table 1 Salt tolerance coefficient of R.soongorica nitrogen metabolism indexes from different treatments
CK处理红砂叶片和根系的耐盐系数均大于CK300处理,说明盐胁迫对红砂的正常生长发育起到了明显的抑制作用,但在300 mmol·L-1NaCl和不同浓度NaHS的共同作用下,除少数NaHS浓度指标低于或接近1外,大部分指标均高于1,且组内之间存在明显的差异,表明不同浓度NaHS对盐胁迫下红砂盐害的缓解具有较为明显的效果。
2.4.2 耐盐系数主成分分析利用耐盐系数分析得出主成分特征值(表2)和综合指标的系数(表3)。由表2可知,叶片主成分1和主成分2的贡献率分别为63.010%和23.692%,累计贡献率达到86.702%;根系主成分1和主成分2的贡献率分别为60.501%和23.144%,累计贡献率达到83.645%。两者累计贡献率均大于80%,表明红砂幼苗叶片和根系的前2个主成分分别代表了6个原始氮代谢指标86.702%和83.645%的信息。
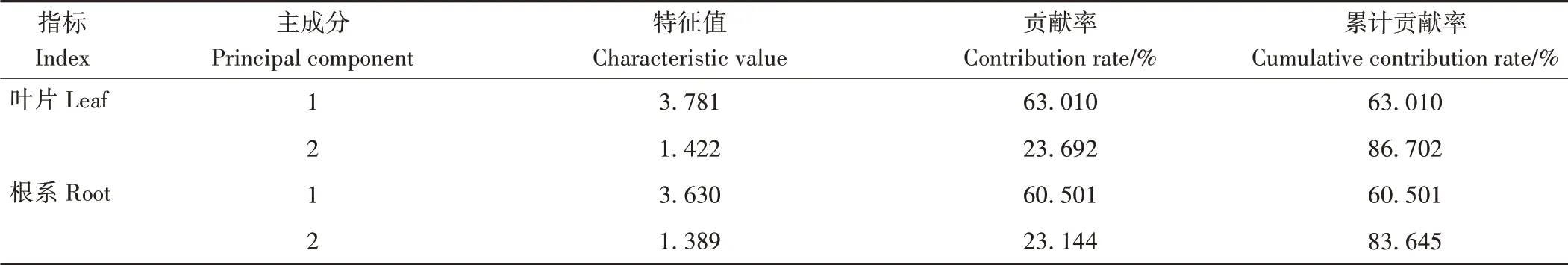
表2 红砂耐盐系数主成分总方差解释Table 2 Interpretation of principal component total variance of R.soongorica salt tolerance coefficient
由表3可知,红砂叶片和根系主成分1中系数较大的指标均是硝态氮(叶0.931、根0.948)和硝酸还原酶(叶0.926、根0.867),而叶片主成分2中系数较大的指标为游离氨基酸(0.939)和谷氨酰胺合成酶(0.471),根系主成分2中系数较大的指标则为可溶性蛋白(0.875)和谷氨酰胺合成酶(0.478)。综上,通过分析2个主成分综合指标相关系数,结合所选的主成分在评价红砂叶片和根系过程中的客观性和代表性,以及考虑到硝态氮含量和硝酸还原酶活性之间呈正相关[27]等因素,最终选取硝酸还原酶(NR)和谷氨酰胺合成酶(GS)活性作为外源H2S对盐胁迫下红砂幼苗的缓解效应的主要评价指标。
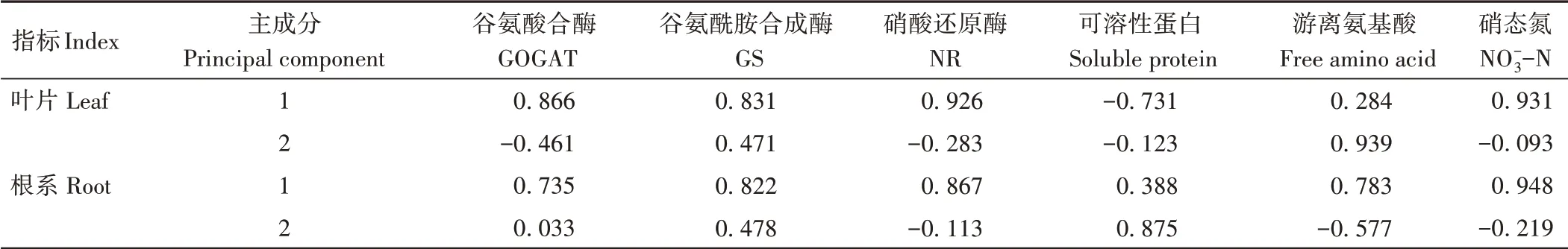
表3 红砂幼苗综合指标值Table 3 Comprehensive index value of R.soongorica seedlings
2.4.3 主成分系数和线性组合根据表2和表3,通过叶片和根系的2个主成分综合指标值与2个特征值开根号后两者之间相除得到的公式系数,分别得到Y1、Y2的线性组合。叶片:

式中,Zx1、Zx2、Zx3、Zx4、Zx5、Zx6分别为谷氨酸合成酶、谷氨酰胺合成酶、硝酸还原酶、可溶性蛋白、游离氨基酸、硝态氮;Y1为主成分1得分;Y2为主成分2得分。
2.4.4 主成分得分和综合得分上述主成分线性方程得到的主成分1得分(Y1)、主成分2得分(Y2)与所对应主成分方差贡献率的乘积之和即为综合得分[28]。由表4可知,叶片和根系主成分1得分数值较高的均为0.025~0.100 mmol·L-13个NaHS浓度梯度,而两者主成分2得分数值较高的分别为0.050~0.500 mmol·L-1NaHS浓度梯度和0.010~0.025 mmol·L-1NaHS浓度梯度,红砂叶片和根系的综合得分最高值均出现在0.025 mmol·L-1NaHS浓度处理,说明0.025 mmol·L-1NaHS对盐胁迫下红砂幼苗的缓解效果最为明显。
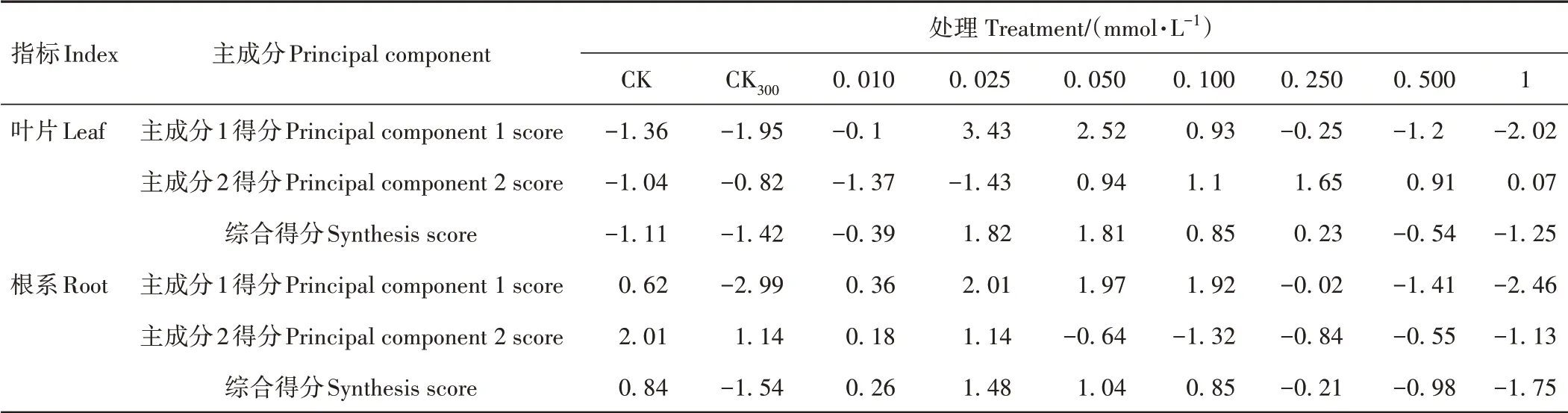
表4 红砂幼苗耐盐系数主成分得分和综合得分Table 4 Principal component score and comprehensive score of R.soongorica salt tolerance coefficient
2.4.5 平均隶属函数以红砂叶片和根系的6个氮代谢指标为依据,计算得到各个指标的平均隶属函数值并进行排序(表5)。结果显示,外源H2S在盐胁迫下对红砂幼苗的缓解效果由大到小依次为0.025 mmol·L-1>0.050 mmol·L-1>0.100 mmol·L-1>0.250 mmol·L-1>0.010 mmol·L-1>0.500 mmol·L-1>1 mmol·L-1,同上述主成分综合得分结论相同,进一步证明了0.025 mmol·L-1NaHS对盐胁迫下红砂幼苗的缓解效果最为突出。
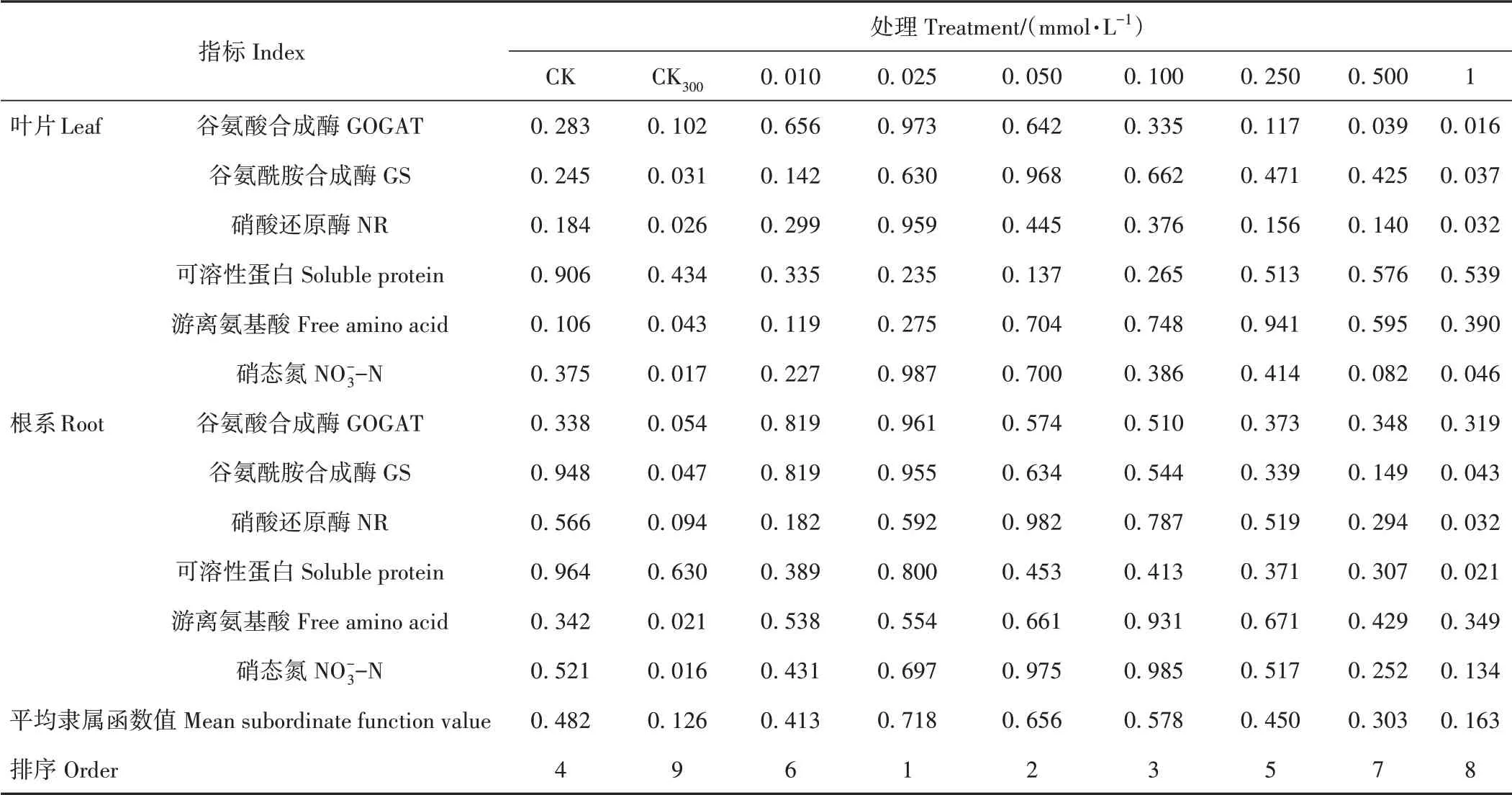
表5 不同处理下红砂氮代谢指标平均隶属函数值及排序Table 5 Average membership function value and ranking of R.soongorica nitrogen metabolism indexes from different treatments
3 讨论
氮元素是植物生长和代谢过程中重要的影响因子之一[29]。氮代谢作为植物获取氮素的主要途径,其生理代谢过程的正常运转是氮素获取的重要保障[30]。盐胁迫下,植物体内NR、GS、GOGAT和转氨酶等与氮代谢相关的酶活性降低会引起氮代谢紊乱,进而影响植物的正常生长发育[31],在一定条件下,植物在生长发育过程中所吸收的主要氮源是无机氮[硝态氮(NO-3-N)、铵态氮(NH+4-N)]和有机氮(氨基酸)等,但大部分有机氮无法被植物直接吸收利用,因而NO-3-N和NH+4-N成为植物根系吸收无机氮的主要形式[32]。但盐胁迫会降低植物体内的硝态氮含量[33],NaCl胁迫下酸枣幼苗根、茎、叶中的硝态氮含量随盐浓度的增加而降低[34]。本试验发现,盐胁迫下红砂幼苗叶片和根系中的硝态氮含量明显降低,通过叶片外源施入NaHS能够提高红砂叶片和根系中的硝态氮含量,与景举伟等[15]的研究结果一致。表明盐胁迫抑制了红砂对硝态氮的吸收效率,而外源H2S可有效缓解盐胁迫对红砂吸收硝态氮的抑制作用。在有机物的结构中,当NO-3被还原为NH+4时,主要受到硝酸还原酶(NR)和亚硝酸盐还原酶(nitrite reductase,NiR)的调控[4]。硝酸还原酶(NR)作为植物氮代谢的起始酶、诱导酶和限速酶,其活性是评价植物氮代谢水平的主要指标[35]。NR活性受到硝态氮含量的正相关性诱导,但盐胁迫会降低植物对硝态氮的吸收效率并影响NR活性[17]。有研究表明,盐胁迫下颠茄中的硝态氮含量和NR活性显著降低[10]。本研究发现,红砂叶片和根系中的NR活性在盐胁迫下显著降低,通过外源H2S处理可提高红砂叶片和根系的NR活性,说明外源H2S能够有效促进红砂对NO-3的还原作用,增强初级氮代谢活跃程度。
虽然土壤的平均NH+4浓度往往低于NO-3,但NH+4也是植物营养的主要氮源[36]。NH+4主要是通过在植物组织中的NO-3还原、木质素合成、光呼吸以及豆科植物的固氮等过程产生,其氨态盐同化是将NH+4通过谷氨酰胺合成酶(GS)催化生成谷氨酰胺(glutamine,Gln),再由谷氨酸合成酶(GOGAT)催化Gln生成谷氨酸(glutamate,Glu)并且进入氨基酸循环途径[37]。但盐胁迫会使植物体内NH+4大量累积,导致NH+4同化受阻,降低植物氮素利用效率[6]。本研究发现,盐胁迫使红砂叶片和根系中GS和GOGAT酶活性降低,外源H2S的施入可有效提高红砂叶片和根系中2种氮代谢酶的活性,表明外源H2S提高GS和GOGAT活性的同时,有效缓解了盐胁迫对红砂GS/GOGAT循环的限制作用,增强了NH+4的同化过程,这与前人研究结果相似[15]。表明适量NaHS的施入在一定程度上通过提高红砂在盐胁迫下氮素营养的积累改善了植物的耐盐性。
在盐胁迫下,植物通过自身的抗逆机制能积累一些小分子含氮有机物来进行代谢或渗透调节,缓解盐胁迫给植物带来的不利影响[38]。例如游离氨基酸是植物氮化合物的主要存在和运输形式,同蛋白质的合成和降解密切相关;可溶性蛋白作为植物氮代谢的中间产物,同游离氨基酸一样,其含量在一定程度上能反映出植物体内氮代谢的活跃程度及养分代谢状况[24]。本研究发现,盐胁迫下红砂叶片和根系中可溶性蛋白和游离氨基酸含量均不同程度降低,这与刘建新等[39]的研究结果相似。通过不同浓度的NaHS处理,红砂叶片和根系中的可溶性蛋白含量大多低于盐胁迫处理,而两者的游离氨基酸含量均高于盐胁迫处理。原因可能是H2S作为一种重要的气体信号分子,参与了红砂在盐胁迫下对抗逆机制的信号传导,加上红砂是一种泌盐植物,长期的高浓度盐胁迫致使红砂叶片与根系中的可溶性蛋白降解成游离氨基酸,通过生理代谢来调节盐胁迫对红砂生长发育的抑制作用。
在植物的氮代谢过程中,NR、GS和GOGAT三者需同时相互协作,否则形成的中间产物NO-2和NH+4就会毒害植物细胞。NR作为氮代谢机制的“启动机”常作为重点研究对象[37]。同时,GS在NH+4同化为谷氨酰胺的过程中发挥关键作用,在植物中,GS以多种同工酶的形式存在于植物的细胞质和质体中,并在整个植物体内进行运动和分配,用于氮化合物的生物合成[40]。本研究通过主成分分析得出NR和GS是外源H2S对盐胁迫下红砂氮代谢缓解效应的主要评价指标,同时结合主成分综合得分和隶属函数分析发现,以叶片喷施0.025 mmol·L-1NaHS对盐胁迫下红砂氮代谢的调控作用最佳。
4 结论
本研究发现,盐胁迫可使红砂幼苗氮代谢机能紊乱,但适量(0.025 mmol·L-1NaHS)外源H2S的介入可增强氮代谢相关酶的活性,有效缓解盐胁迫对红砂氮代谢的抑制作用。同时,NR和GS活性可作为H2S对盐胁迫缓解效应的评价指标。
