微白黄链霉菌对谷子萌发及拔节期生长的作用及机制
2023-01-16乔美霞杨珍平马延玲刘玉涛高志强
乔美霞 杨珍平,2 闫 霞 马延玲 刘玉涛 高志强,2 陈 杰,2,*
(1山西农业大学农学院,山西太谷 030801;2黄土高原特色作物优质高效生产省部共建协同创新中心,山西太谷 030801;3陕西博秦生物工程有限公司,陕西咸阳 713899)
谷子(Setaria italicaL.)为禾本科狗尾草属植物,具有抗旱、耐瘠薄、适应性强等特点,是我国北方的特色杂粮作物[1-3]。谷子籽粒富含蛋白质、脂肪、维生素和黄酮、多酚、低聚糖等多种营养和功能活性物质[4-6],其中多酚、维生素B1、B2、维生素E等的含量均高于小麦和水稻等谷类粮食作物[7]。随着生活水平的提高,人们对谷子的需求量日益增加,然而谷子产量普遍较低,导致供需差距日渐扩大。如何促进谷子植株生长,提高谷子产量已成为谷子生产中急需解决的重要问题。目前常采用的谷子增产措施包括增施化肥和选育高产品种等,但过量施用化学肥料易带来土壤板结、酸化及地下水污染等问题[8-9],而高产品种的培育往往需要较长时间。因此,有必要寻找谷子促生增产的新的有效途径。
外源有益微生物因高效便捷、安全环保等优势而被广泛应用于玉米[10]、小麦[11]、水稻[12]和谷子[13]等作物的抗病促生研究中。目前,对谷子促生微生物的研究主要集中在细菌和真菌上。如毕少杰等[14]研究发现加入恶臭假单胞菌(Pseudomonas pulida)和阴沟肠杆菌(Enterobacter cloacae)的发酵液可提高谷子的生物量和产 量;Ahmadvand等[15]发 现 接 种 印 度 梨 形 孢(Piriformospora indica)促进了谷子生长,增加了谷子产量。与细菌和真菌相比,放线菌因具有突出的抗病、促生等功能而被广泛应用于西瓜[16]、玉米[17]、小麦[18-19]和番茄[20]等作物的促生增产研究中。然而,目前对谷子促生放线菌的了解仍十分有限。
种子萌发是植物生长发育的第一步。干预种子的萌发进程会影响植物早期的生长发育。根系是植物从土壤汲取养分的器官,根系形态结构直接影响植物从土壤中获取营养物质的能力,进而调控地上部植株的生长发育[21-23]。外源微生物通过调节根系的形态结构促进根系对养分和水分的吸收,进而使作物促生增产[24-26]。根际微生物与植物生长密切相关,被视为植物的第二基因组[27]。其中,根际可培养微生物数量和结构变化会影响植物的生长发育。已有研究表明,外源微生物能够通过优化根际可培养微生物群落结构来间接调控植物的生长[28-29]。目前,关于外源放线菌是否能通过影响种子萌发、调控根系发育和根际微生物结构来促进谷子的生长尚不明确。因此,本研究以一株放线菌微白黄链霉菌T4为供试材料,研究T4对拔节期谷子植株生长的影响,并从种子萌发、根系发育及根际可培养微生物的角度解析其促生机制,旨在为谷子促生增产提供科学依据及有应用价值的放线菌株。
1 材料与方法
1.1 试验材料
供试谷子为超早熟品种小米,由山西农业大学农学院农业生物工程研究所提供。供试放线菌为微白黄链霉菌(Streptomyces albidoflavus)T4,由西北农林科技大学微生物资源研究室分离筛选自青藏高原极端生境土壤中。T4对多种作物具有抗病、促生功能。
1.2 培养皿内种子萌发试验
发酵液制备:向活化好的T4试管斜面中加入无菌水3.0 mL,用灭菌竹签将孢子刮下后搅匀得到孢子悬液并转接至装有150 mL已灭菌无琼脂高氏1号液体培养基的250 mL三角瓶中。将三角瓶置于28℃、130 r·min-1的摇床中培养。10 d后用直径0.45µm的微孔滤膜过滤,得到T4无细胞发酵滤液(简称发酵液)的原液。将原液及稀释10、100和1 000倍的发酵液用于种子萌发试验。
种子萌发试验:挑选大小一致、颗粒饱满的谷子种子,先后用5%NaClO溶液浸泡10 s,75%酒精浸泡10 s,无菌水多次冲洗后分别放入上述各浓度T4发酵液中浸泡3 h。以无菌水代替发酵液作为对照(CK0)。随后将种子转移至事先放有两层滤纸的直径为9 cm的培养皿中。各培养皿中放置30粒种子,并加入无菌水3.5 mL,置于25℃恒温条件下进行培养。各处理设置4个培养皿重复。分别于培养24、36、48、60、72、84和96 h后统计各培养皿内发芽种子数,并参照公式(1)~(3)分别计算种子萌发率(seed germination,SG)、发芽势(germination energy,GE)和 发 芽 指 数(germination index,GI)。培养96 h后同时选取各培养皿生长最好的4棵幼苗测量胚根长、胚轴长,并称量各培养皿内幼苗总生物量(鲜重)。

式中,Gt为培养t小时后各培养皿内萌发的种子数;Dt为培养时间,Dt=24、36、48、60、72、84和96 h。
1.3 盆栽试验
取田间耕层土壤,添加100.0 g·kg-1DW有基质、3.0 g·kg-1DW的复合肥(N∶P2O5∶K2O=15∶15∶15)混匀后装入直径10 cm、高8.5 cm的花盆内,每盆0.5 kg。T4以活孢子含量为109CFU·g-1的粉状孢子制剂形式施加。试验设置1.0 g·kg-1DW的T4菌剂包衣(T4-Y)、T4菌剂拌土(T4-B)和无菌剂对照(CK)共3个处理,各处理设置10盆重复,共30盆。
种子包衣方法:将已知粒数的谷子种子用6.0 g·L-1的羧甲基纤维素钠溶液浸湿后放入T4菌剂中,至表面均匀沾附菌剂后将各粒种子取出,播种,每盆6粒。剩余菌剂烘干、称重,算得每粒谷子平均沾附T4孢子数为3.4×105个。将各盆置于昼、夜温度分别为25、22℃,时间分别为16、8 h,光照强度分别为3 000、0 lx的光照培养箱内培养,播后正常管理,出苗后定苗至每盆5株。于播种后25 d终止试验,采集地上部植株、根系和根际土壤样品,测定如下指标:
根系形态结构:各处理随机选取3盆,用自来水冲掉根系周围土壤,获得完整谷子根系样品,采用WinRHIZO根系分析系统对谷子总根长、总根表面积、根系平均直径、总根体积、根尖数和根分叉数指标进行分析。
根际可培养微生物:从剩余7盆谷子中随机选取6盆,将各盆谷子根系取出后,抖掉根系周围松散的土壤,用软毛刷刷取与根系紧密结合的根际土壤,拣去杂质后转移至自封袋中于4℃保存。每2盆根际土壤混匀后作为1个测定重复。采用稀释涂布平板法[30]对根际土壤中细菌(bacteria,B)、真菌(fungi,F)和放线菌(actinobacteria,A)三大类可培养微生物进行分离计数,并计算微生物总数(B、F和A的数量之和)及各类微生物的数量比值B/F、A/F和A/B。
生物量:称量各盆中谷子的地上部植株及根系鲜重,并计算根冠比。
1.4 数据分析
通过Excel 2016对试验数据进行分析处理,SPSS 18.0软件对数据进行单因素方差分析及谷子生长指标与根际微生物之间的Pearson相关系数的计算,并采用最小显著差数法(least significant difference,LSD)在P<0.05或P<0.01水平进行统计检验,Origin Pro 2021软件作图。
2 结果与分析
2.1 T4发酵液对谷子萌发的影响
由表1可知,T4发酵液均不同程度促进了谷子种子萌发,其中稀释100倍的发酵液使培养24、36、60和96 h后谷子的萌发率较对照分别显著提高了9.2、9.2、13.4和7.5个百分点。此外,在培养24 h后,T4发酵液原液、10倍稀释液和100倍稀释液也分别使种子萌发率较对照显著提高了5.8、6.7和9.2个百分点。
文化不是虚的,强化企业文化建设,要塑造的是大家在一起做一番事业是意义和兴趣所在。企业文化更多的是组织对员工的承诺,同时也是员工对组织的承诺。其实是一种精神锁定,是一种心灵契约的锁定。员工在这种组织氛围下,无形之中会做出一种承诺,组织中的一群人都是这样的,如果自己将来不是这样,自己会受煎熬。同时,企业文化最重要的且最终是一种选择机制。企业文化不是解决所有的问题,不是所有人都会这样,而是尽量减少未来动荡的风险。

表1 T4发酵液对谷子萌发率的影响Table 1 Effects of the fermentation broth of T4 on the germination of foxtail millet seeds /%
由图1可知,T4发酵液能够提高谷子种子的发芽势和发芽指数,其中T4发酵液的100倍稀释液浸泡后,谷子种子的发芽势和发芽指数均达到最高,与对照相比分别显著提高了9.17个百分点和23.1%。T4发酵液的10倍和1 000倍稀释液也使谷子的发芽指数和发芽势分别较对照提高了9.6%~13.7%和3.34~4.17个百分点,但差异均未达显著水平。

图1 T4发酵液对谷子种子萌发能力的影响Fig.1 Effects of the fermentation broth of T4 on the germination capacity of foxtail millet seeds
2.2 T4发酵液对谷子胚根、胚轴生长的影响
由图2可知,T4发酵液的100倍稀释液处理使谷子的胚根长度较对照显著增加了13.4%,10倍稀释液处理使谷子胚轴长度较对照显著提高了20.7%。而T4发酵液的原液处理使谷子的胚根长度较对照显著减少了16.7%。稀释1 000倍后,T4发酵液对谷子胚根和胚轴长度均无显著影响。各稀释倍数下,T4发酵液对谷子生物量均无显著影响。

图2 T4发酵液对谷子胚根、胚轴生长及生物量的影响Fig.2 Effects of the fermentation broth of T4 on the radicle,hypocotyl lengths,and biomass of foxtail millet
2.3 T4菌剂对拔节期谷子植株生长的影响
由图3可知,T4菌剂包衣处理使谷子地上植株生物量和根系生物量较无菌剂对照分别显著增加了22.5%和32.7%,同时使根冠比提高了13.1%。而拌土添加T4菌剂对谷子地上植株和根的生物量及根冠比均无显著影响。

图3 T4菌剂对谷子生物量的影响Fig.3 Effects of the T4 microbial agent on the biomass of foxtail millet plants
由表2可知,包衣施加T4菌剂使谷子根尖数和分叉数分别较对照显著增加了90.9%和66.9%,同时使谷子根长、根表面积、根平均直径较对照增加了18.7%~54.0%。T4菌剂拌土处理下谷子根长度、根表面积、根尖数和分叉数较对照增加了24.8%~38.6%,但差异均未达显著水平。

表2 T4菌剂对谷子根系形态结构的影响Table 2 Effects of the T4 microbial agent on the morphological structure of foxtail millet roots
2.4 T4菌剂对拔节期谷子根际微生物的影响
由表3可知,T4菌剂包衣处理使谷子根际细菌数量、微生物总数较无菌剂对照分别显著增加了95.1%和49.5%,同时使根际真菌数量显著降低了52.1%。拌土施加T4菌剂处理使根际细菌、真菌和微生物总数较对照分别显著增加了61.7%、26.3%和28.5%。两种方式施加T4菌剂处理对根际放线菌数量均无显著影响。

表3 T4放线菌剂对谷子根际微生物数量的影响Table 3 Effects of the T4 microbial agent on the number of microorganisms in the rhizosphere soils of foxtail millet
由表4可知,包衣施加T4菌剂处理使A/F和B/F分别较对照显著增加了98.8%和305.2%,而拌土施加T4菌剂处理对A/F和B/F无显著影响。包衣和拌土施加T4菌剂处理分别使A/B较对照显著降低了52.6%和46.8%。

表4 T4菌剂对谷子根际微生物比例的影响Table 4 Effects of the T4 microbial agent on the number ratios of microorganisms in the rhizosphere soils of foxtail millet
2.5 外源T4放线菌作用下谷子生长指标与根际微生物之间的关系
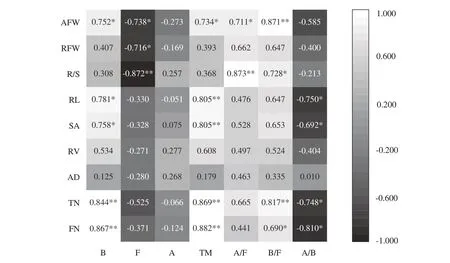
图4 谷子生长指标与根际土壤微生物之间的相关分析Fig.4 Correlation analysis between the indexes of foxtail millet growth and the microorganisms in the rhizosphere soil
3 讨论
外源施加有益微生物能够促进谷子植株生长和产量增加。已有研究表明,施加复合木霉(Trichodermaspp.)和印度梨形孢(P.indica)等真菌[15]及解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)等细菌[13,31]能够促进谷子植株生长,增加谷子的产量。本研究结果表明,放线菌微白黄链霉菌T4具有促进谷子生长发育的能力。其作用机制主要表现在以下几个方面(图5):
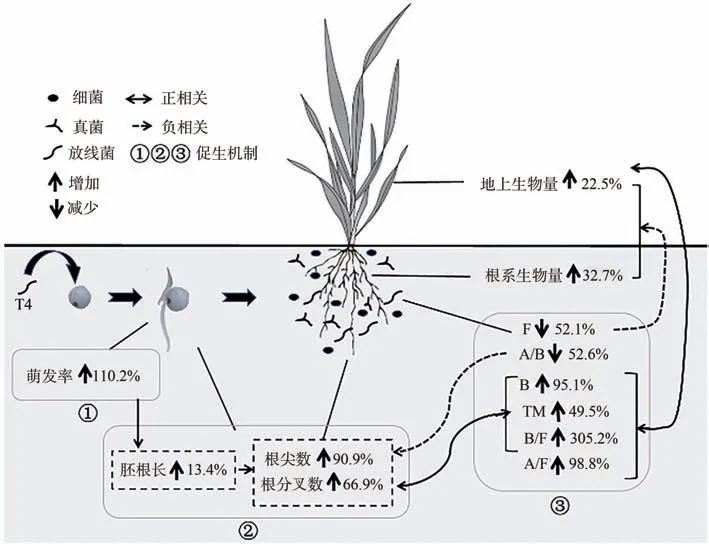
图5 T4促进拔节期谷子生长的作用机制Fig.5 Mechanism of T4 used to promote the growth foxtail millet at jointing stage
T4的次级代谢产物诱导谷子种子提早萌发。已有研究表明,一些微生物通过产生代谢物质刺激植物种子萌发[32-33]。赤霉素是调节种子萌发的主要激素,能够通过加速种子内可溶性蛋白和淀粉等贮藏物质的转化和利用,激活葡萄糖转运蛋白功能,启动并加速糖酵解和三羧酸循环(tricarboxylic acid cycle,TCA),从而增加胚的生长势,克服种子覆盖层的机械抑制[34-37],进而促进种子萌发。解淀粉芽孢杆菌(B.amyloliquefaciens)通过产生赤霉素促进水稻种子萌发及萌发后水稻植株的生长[38];木霉菌(Trichodemaspp.)也能够通过产生赤霉素等多种物质提高紫丁香种子萌发过程中可溶性糖和可溶性蛋白质的含量,促进种子萌发[39-40]。此外,有研究证实,一些内生菌参与银沙槐种子的代谢,并通过提高萌发关键物质含量或产生小分子物质d-野决明碱、司巴丁等方式来提高种子的萌发率[41]。本研究中,T4发酵液处理提高了谷子萌发率,其中以培养24 h后的提高幅度最大。供试发酵液的主要成分是T4的次级代谢产物。因此,产生代谢物质刺激谷子种子提早萌发,进而推动谷子幼苗提早发育是T4促进谷子拔节期生长的机制之一。然而,具体代谢物质及其发挥的作用仍需进一步系统研究。
T4诱导谷子胚根发育,调节根系形态结构。根系是植物直接吸收土壤养分和水分的器官,而一些微生物能够通过色氨酸代谢产生内源性生长素吲哚乙酸(indoleacetic acid,IAA),诱导细胞分裂和伸长,增加根的表面积、体积和长度,进而影响植物根系的形态和发育,使植物更容易汲取土壤中的水分和养分[42]。此外,一些有益微生物定殖于根际土壤后,通过分泌有机酸溶解并释放出土壤颗粒中的养分,延长土壤中有效养分的供给,促进植物根系对土壤中营养元素的吸收利用,从而促进植物根系生长和地上部分生物量的积累[43]。本研究中,T4刺激了萌发后谷子胚根的伸长并增加了拔节期谷子的根尖数和根分叉数,表明刺激根系发育,优化根系形态结构是T4促进谷子生长的又一机制。值得注意的是,本研究培养皿试验中T4发酵液原液抑制了谷子胚根的生长,这可能是由于原液中所含T4代谢产物浓度太高,导致谷子细胞渗透压增大,因此不利于谷子种子的萌发和生长。
T4通过调整根际微生物的结构组成促进拔节期谷子植株生长。根际微生物与植物生长密切相关[44]。根际微生物能够通过分泌植物激素等物质直接影响作物根系的生长发育,也能够通过固氮、溶磷等作用改善土壤理化性质、活化土壤养分来促进作物生长,或通过产生抗生素等抑制有害病原菌生长,减轻作物病害的发生来间接促进作物生长[45-49]。因此,根际微生物的群落结构组成直接或间接影响着作物的生长状态。土壤中微生物之间既会彼此竞争养分、空间和生态位,也会通过产生代谢物质刺激或抑制其他微生物的生长繁殖。外源施加微生物能够提高根际微生物的整体活性、优化根际微生物群落结构,增加有益菌的数量和比例,抑制有害微生物的生长,从而改善土壤微生态环境并影响植物生长[29,50-52]。有益微生物定殖于根际时,能够通过占领根部生态位,改变土壤中微生物的种类和组成,起到防治植物土传病害、诱导植物对不良外界环境产生系统抗性、促进植物生长等多种作用[53]。本试验所用放线菌T4为一株具有抑制多种作物病原菌生长功能的放线菌。本研究发现,T4在增加根际微生物总数的同时降低了真菌数量,表明外源添加T4菌剂可能在促进谷子根际微生物的生长繁殖,提高微生物活性的同时抑制了谷子根际有害真菌的生长,通过减轻谷子根际真菌病害的发生来间接促进谷子植株的生长。通过平板分离技术获得的土壤可培养微生物均是活体微生物,是土壤微生物中的一个特殊类群。前人研究已证实根际可培养微生物数量和比例的变化会影响植物的生长[54-56]。本研究发现,外源施加T4菌剂调整了拔节期谷子根际三大类可培养微生物的数量和比例,且可培养微生物的变化与谷子地上部植株和根系生物量显著相关。表明通过刺激根际土壤微生物的生长、优化根际土壤微生物结构组成,使土壤微生物环境维持在有利于谷子生长的健康状态也是T4促使拔节期谷子生长的重要机制。
此外,本研究结果表明,T4菌剂包衣较拌土处理方式对谷子植株生长及根际土壤微生物的调控效果更好,这可能是由于包衣处理中T4包裹在种子表面,随谷子萌发和根系生长在种子周围扩散,与根系接触更为密切,因此对拔节期谷子的促生效果更明显。
4 结论
微白黄链霉菌T4具有促进拔节期谷子生长发育的能力,其作用机制为:产生代谢产物刺激谷子种子提早萌发;促进谷子根系发育,优化根系形态结构;调控根际微生物数量和结构组成,改善根际微生物环境。但T4具体产生哪种物质促进了谷子生长及其化学组成还需进一步深入研究。
