阿帕替尼联合SOX化疗方案对晚期胃癌患者近期疗效及免疫功能的影响
2023-01-16封芳胡韶军
封芳 胡韶军
胃癌是一种常见的消化道恶性肿瘤,其发生率伴随我国生产力的发展和经济水平的提高逐年上升,根据最新的统计指出,如今我国胃癌患者在全世界中的占比达到42%,并且每年新发生的病例超过42 万例[1],极大威胁着人们的生命健康。由于胃癌在发病之初并无特征性的表现,故患者诊治时,极易误判为胃溃疡、慢性胃炎等,从而导致胃癌进行性进展;这也就导致大多数患者在确诊时,已经发展到中后期,严重者出现远处转移,侵袭淋巴结、肺等[2-3]。尽管手术治疗是胃癌的首要根治方案[4],但后期患者由于癌肿转移,丧失手术机会,只能选择化疗[5]。经过大量临床实践及研究指出,胃癌对化疗极其敏感,接受合适、有效、完整、全疗程的化疗治疗后,可以明显地延长其生存期。但患者易因在化疗期间出现多种严重的毒副反应,从而难以坚持完成化疗的周期,使治疗耽误[6]。研究指出,SOX 方案在临床上具有优异的效果,且其毒副作用较低,多数患者一般可耐受,但临床实践也揭露,该方案虽然安全性高,但其近期治疗有效率达不到临床治疗的满意度[7]。阿帕替尼作为一种小分子抗血管生成靶向药物,可通过高度选择性抑制VAGF受体酶活性[8],以达到控制肿瘤的作用。因此,本研究旨在研究阿帕替尼联合SOX 化疗方案对晚期胃癌患者的疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月-2022 年1 月苏州市第九人民医院肿瘤内科收治的132 例晚期胃癌患者,纳入标准:(1)符合晚期胃癌的相关诊断标准,并行电子胃镜确诊;(2)没有化疗禁忌证;(3)首次行SOX 方案进行化疗;(4)患者年龄>18 岁,预计生存期>3 个月;(5)能以美国临床肿瘤学会实体瘤反应评估标准(response evaluation criteria in solid tumors,RECIST)对肿瘤大小进行评估;(6)TNM分期为Ⅲb、Ⅳ期;(7)患者各生命体征基本正常。排除标准:(1)合并其他种类的肿瘤;(2)合并心、脑、肾等重要脏器疾病;(3)存在意识障碍或精神疾病,依从性差;(4)有呕血、黑便、消化道大出血;(5)KPS 评分<70 分;(6)晚期恶液质。按患者治疗方式的不同分为观察组和对照组,各66 例。经本院医学伦理委员会审批通过,患者及家属自愿参与并签署知情同意书。
1.2 方法
1.2.1 对照组 采取SOX 方案进行治疗。第一日,给予奥沙利珀(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20000337,规格:50 mg)130 mg/m2+250~500 mL 5%葡萄糖溶液,缓慢静脉滴注,时间为2 h。根据体表面积(BSA)计算替吉奥(生产厂家:齐鲁制药有限公司,批准文号:国药准字H20100151,规格:25 mg/粒;生产厂家:山东新时代药业有限公司,批准文号:国药准字H20080802,规格:20 mg)的口服剂量,早晚各一次,连续服用14 d,随后中止服药7 d,21 d 为一个周期。BSA>1.5 m2,60 mg/次;BSA 在1.25~1.50 m2,50 mg/次;BSA<1.25 m2,40 mg/次。
1.2.2 观察组 在SOX 方案的基础上联合应用甲磺酸阿帕替尼[生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20140103,规格:0.25 g/片;生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20140104,规格:0.375 g(以阿帕替尼计);生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20140105,规格:0.425 g(以阿帕替尼计)]进行治疗,500~850 mg/次,1 次/d,固定于每日早餐后30 min 口服,同SOX 方案同步开始,连续服用21 d。
两组患者以21 d 为一个周期,均进行4 个周期的治疗。
1.3 观察指标与评价标准
1.3.1 疗效 患者治疗2 个周期后,采取全腹部增强CT 进行扫描,评估标准参考RECIST 1.1 版本,分别为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。CR:检测无靶病灶,所有的病理淋巴结短轴至少<10 mm;PR:全部靶病灶的长径总和低于基线≥30%;SD:靶病灶的变化幅度在PR 与PD 之间;PD:在治疗过程中,以测得的所有靶病灶直径总和的最小值为参照,长径和相对增加至少20%,另外长径和的绝对值增加至少5 mm。客观有效率(ORR)=1-(SD+PD)例数/总例数×100%,疾病控制率(DCR)=1-PD 例数/总例数×100%。
1.3.2 血清肿瘤标记物及血管新生因子 在治疗前后采空腹静脉血测定癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、糖类抗原125(CA125)及血管内皮生长因子(VAGF)和胰岛素样生长因子(IGF-1),采用电化学发光免疫法检测CEA、CA19-9 及CA125,采用双抗体夹心法测定VAGF、IGF-1。
1.3.3 免疫功能 在治疗前后取空腹静脉血,以双抗体夹心法测定CD3+、CD4+、CD8+并计算CD4+/CD8+的值。
1.3.4 不良反应 根据美国国立癌症研究所药物常见不良反应评价标准4.0 版本进行评估,按严重程度分为5 级,1 级:症状轻微或通常无症状;2 级:出现较轻微的临床反应,需要治疗;3 级:临床症状严重,需要立即接受治疗,住院至症状缓解或消失;4 级:对生命安全存在潜在的危险性或致肢体残疾;5 级:死亡。
1.4 统计学处理 使用SPSS 19.0 软件对数据进行统计学处理,计量资料用()表示,组间、组内比较采用t检验;计数资料用率(%)表示,组间、组内比较采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组基线资料比较 两组患者基线资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
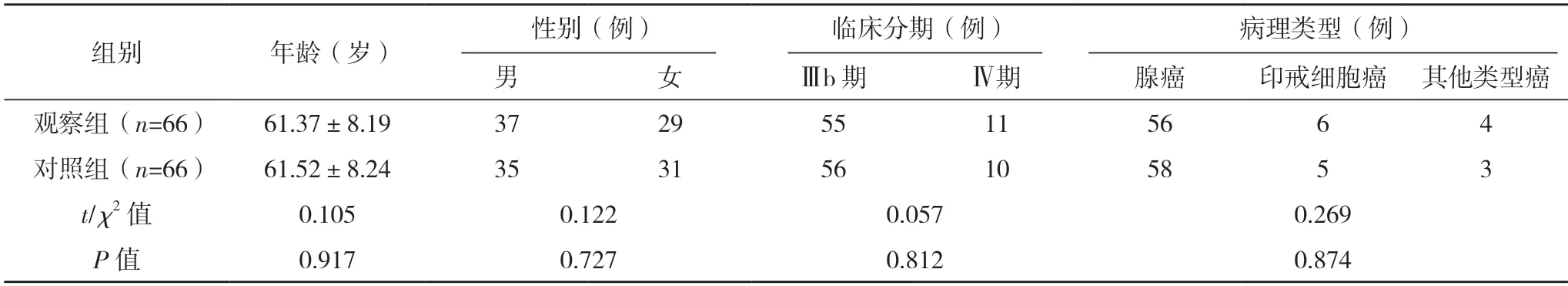
表1 两组基线资料比较

表1(续)
2.2 两组疗效比较 观察组患者的ORR(56.06%)与DCR(83.33%)均高于对照组的25.76%、53.03%(P<0.05),见表2。
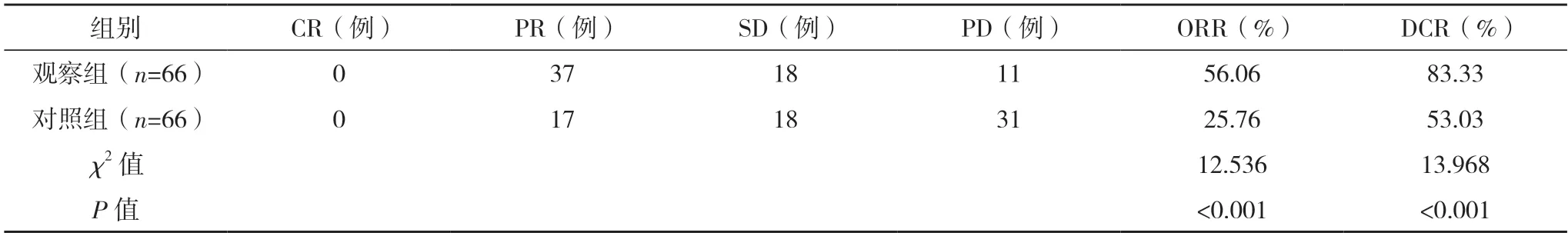
表2 两组疗效比较
2.3 两组血清肿瘤标记物和血管新生因子比较 治疗前,两组癌胚抗原、CA19-9、CA125 及血管内皮生长因子和胰岛素样生长因子比较,差异均无统计学意义(P>0.05);治疗后,两组上述五项指标均明显下降,且观察组均低于对照组(P<0.05)。见表3。
表3 两组癌胚抗原、CA19-9、CA125及血管内皮生长因子和胰岛素样生长因子比较()

表3 两组癌胚抗原、CA19-9、CA125及血管内皮生长因子和胰岛素样生长因子比较()
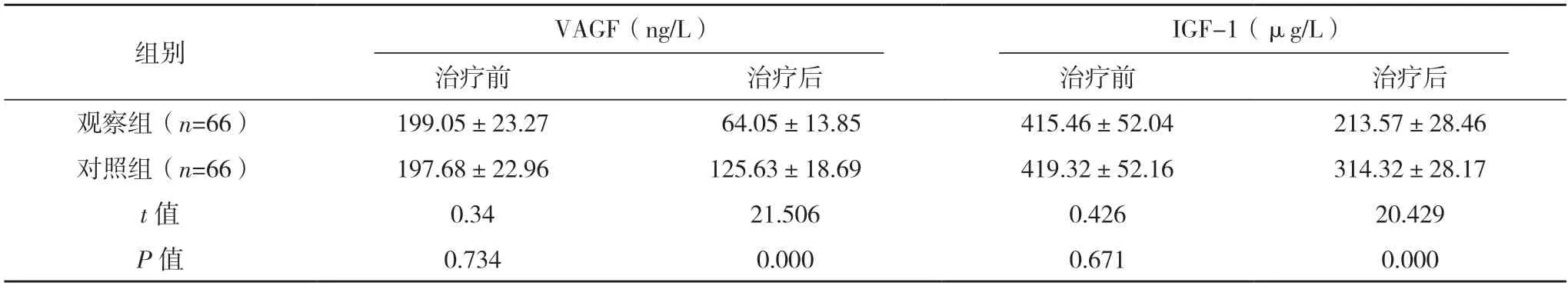
表3(续)
2.4 两组免疫功能比较 治疗前,两组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05);治疗后,两组CD3+、CD4+、CD4+/CD8+均升高,且观察组均高于对照组,CD8+均下降,且观察组低于对照组(P<0.05)。见表4。
表4 两组CD3+、CD4+、CD8+、CD4+/CD8+比较()

表4 两组CD3+、CD4+、CD8+、CD4+/CD8+比较()
2.5 两组不良反应发生率比较 在贫血、恶心呕吐、便秘腹泻、食欲减退、血小板减少、周围神经毒性、肝肾功能不全、白细胞和中性粒细胞减少上,观察组的发生率均明显低于对照组(P<0.05);在蛋白尿、全身乏力、口腔黏膜炎上,两组发生率比较差异均无统计学意义(P>0.05);在高血压、手足综合征上,观察组的发生率均高于对照组(P<0.05)。见表5。

表5 两组不良反应发生率比较[例(%)]

表5(续)
3 讨论
胃癌起源于胃黏膜上皮,可由幽门螺杆菌、饮食、环境、遗传等因素诱发,对于早期胃癌的患者可采用根治性手术切除,术后患者恢复良好。可我国对于胃癌患者的早诊率并不高,约80%的患者在确诊后已经处于进展期胃癌,并且当其一旦进入晚期则将完全丧失手术治疗的机会,而这类患者并不在少数,因此,如何进行安全、高效的化疗,一直是近些年来讨论的热点。最初,临床上一般采用“氟尿嘧啶类”“紫衫类”等药物进行化疗[9],其极大的毒副作用在临床实际应用中效果极差,甚至造成部分患者病情恶化,进而死亡。
替吉奥由替加氟、奥替拉西钾和吉美嘧啶组成,前两者能通过肝脏分解生成氟尿嘧啶和抑制氟尿嘧啶转化,来达到增加肿瘤细胞中氟尿嘧啶的浓度[10],后者为消化道黏膜保护剂,能拮抗氟尿嘧啶的毒副产物,降低化疗的毒性反应[11],因此,较之以往常规的氟尿嘧啶类药物具有更好的疗效,更可靠的安全性。阿帕替尼是血管内皮生长因子受体-2 的小分子酪酸激酶抑制剂,主要作用机制是阻断信号的传导[12],以阻止肿瘤中新生血管的形成与长入,从而使肿瘤失去新生血管为其带来的丰富营养物质与氧供,控制肿瘤的进一步生长侵袭。目前该药已经在2014 年被我国国家食品药品监督管理总局批准,并在晚期胃癌的三线治疗中广泛应用[13]。但也有研究报告指出,该药若协同SOX 化疗方案也可用于晚期胃癌的一线治疗中,并有着显著的临床疗效[14]。
在本次研究中,两组患者近期疗效的比较中,联合治疗的患者其ORR 较单一SOX 化疗方案高出2 倍多,极大地证明了联合治疗方案的临床价值。肿瘤标记物为鉴别肿瘤的特异性标志,能作为疗效的评估指标,CEA 的含量反映了肿瘤演变过程,CA19-9 对胃癌、胰腺癌的敏感度高,CA125 与患者的生存率有关[15],在研究结果中,这三项数值都明显下降,说明经过治疗后,两组患者的肿瘤均得到了控制,而观察组其更低的数值,也说明了该组患者在肿瘤的控制方面,效果更好;作为反映新生血管的两项指标[16],VAGF 与IGF-1 也同样下降,尤其以观察组下降最为明显,证明阿帕替尼的作用效果极为明显,这也可能是,观察组患者肿瘤标记物水平更低和近期疗效更好的原因[17]。因化疗会损害患者的免疫功能,故在本次研究中,还比对了两组的免疫功能,通过结果可以看出,观察组患者的免疫功能较对照组更好。不良反应是化疗治疗的重要关注项目[18],在本次研究中,两组的不良反应的发生率比较,多数表现为观察组患者发生率更低,仅蛋白尿、全身乏力、口腔黏膜炎发生率接近,高血压和手足综合征发生率均高于对照组,这可能同阿帕替尼的副作用有关[19-20],但在本次研究中,多数患者经过对症治疗后均可得到良好的控制。
综上所述,阿帕替尼联合SOX 化疗方案治疗晚期胃癌的患者具有明显的临床效果,改善免疫功能,减少患者化疗不良反应的发生,但也需要提防联合用药后出现血压升高、手足综合征。
