黄精多糖对睡眠干扰诱导小鼠认知功能损伤的作用及机制研究
2023-01-13刘雨培张瑛毓刘佳萌刘新民王凤忠
刘雨培,张瑛毓,韦 震,刘佳萌,孙 晶,范 蓓,王 琼,卢 聪, ,刘新民 ,王凤忠,
(1.湖南中医药大学药学院,湖南长沙 410208;2.中国农业科学院农产品加工研究所,北京 100193;3.中国医学科学院药用植物研究所,北京 100193)
快节奏、高压的生活方式往往会产生失眠、睡眠质量下降、昼夜节律颠倒等问题,长期的睡眠不足会造成认知功能损伤[1-2]。认知功能损伤是中枢神经退行性疾病的前驱症状,认知功能下降会导致轻度认知障碍,进而发展成为痴呆。而与其它疾病相比,功能性损伤无明确的病变部位,靶点不明确,现代医学难以作用。传统中医药讲究整体观念、天人合一、辩证论治,多成分、多靶点、多途径整体协调在防治功能性损伤方面发挥着独特的优势。同时随着我国“健康中国2030”国家战略需求的提出,那么通过中医药与日常饮食相结合进行食养食疗来预防及干预此类功能性损伤意义重大,因此对具备改善认知功效食品功能因子进行挖掘并利用研究具有重要现实意义。
黄精为百合科黄精属(Liliaceae)多年生草本植物的干燥根茎,中国药典将其分为黄精(Polygonatum sibiricumRed.)、多花黄精(PolygonatumcyrtonemaHua.)、滇黄精(Polygonatum kingianumColl.et Hemsl.)3种[3]。黄精作为传统食药同源物质,具有防治抑郁[4]、改善睡眠障碍[5-7]、改善认知障碍[8-9]等多种神经精神类疾病的作用[10]。现代研究表明,黄精粉末[11]、黄精水/醇提取物[12]、黄精多糖[13]等均可改善认知功能损伤。其中黄精多糖(PolysaccharideofPolygonati Rhizoma,PSP)被认为是黄精的主要活性成分[14],研究发现黄精多糖是黄精降低氧化应激水平、增强免疫、缓解炎症反应、促进神经递质释放等多重生物活性的活性组分,同时具有改善血管性痴呆[15]、东莨菪碱诱导认知障碍[16]、D-半乳糖诱导衰老模型[17]、自然衰老记忆损伤模型[11]等多种认知损伤的作用。
目前有关黄精多糖改善认知功能相关研究主要集中于化学因素引起的认知障碍模型,而对于模拟长期暴露于慢性应激因素如长期睡眠剥夺下所诱导的认知功能损伤,黄精多糖是否具备改善作用及其可能
的作用机制研究未见报道。睡眠干扰模型是一种通过模拟人类睡眠缺乏而导致认知损伤的慢性应激模型,造模方式包括化学造模和物理造模,化学造模为药物睡眠剥夺,物理造模包括轻柔刺激、滚筒法和水平台法等,滚筒法睡眠干扰是模拟现代亚健康人群建立认知功能性损伤模型的重要的手段,因此本实验采用滚筒式睡眠干扰仪建立睡眠干扰诱导认知功能损伤小鼠模型,研究黄精多糖干预对慢性应激诱导认知功能损伤的防护作用和分子机制,以期为黄精的精深加工利用奠定理论基础。
1 材料与方法
1.1 材料与仪器
SPF级雄性ICR小鼠 18~22 g,72只,购自北京维通利华实验动物有限公司,许可证号 SCXK(京)2021-0006。本实验方案开展前已获得中国医学科学院药用植物研究所实验动物管理与动物福利委员会(IACUC)的审查许可;小鼠饲养于SPF级动物房,饲养条件:温度(22±2)℃,湿度55%±10%,光照12 h黑暗交替,每笼6只,自由摄食饮水,常规饲养3 d后进行实验;银杏叶提取物 (金纳多,生产企业:Dr.Willmar Schwabe GmbH & Co. KG,批准文号:国药准字HJ20 140768;每片含银杏叶提取物(GBE)40 mg,其中银杏黄酮苷9.6 mg,萜类内酯2.4 mg);黄精多糖 购自上海源叶生物科技有限公司(纯度70% 批号S27804);白介素-6(IL-6)、白介素-1β(IL-1β)、γ-氨基丁酸(GABA)、乙酰胆碱(Ach)试剂盒 均购自南京建成生物工程研究所。
5810R 高速冷冻离心机 德国 Eppendorf 公司;M1000 多功能酶标仪 瑞士 Tecan 公司;KSYYI18S418M1滚筒式睡眠干扰仪、KSYY-OP- V4.0小鼠旷场实时检测分析系统、物体认知实验装置、KSYY -MWM- 4.0小鼠 Morris水迷宫实时在线检测系统、KSYY-AD-V4.0小鼠避暗实时检测分析系统 均由中国医学科学院药用植物研究所、中国航天员中心和北京康森益友科技有限公司联合研发。
1.2 实验方法
1.2.1 动物分组及给药 小鼠随机分成6组,空白组(蒸馏水)、模型组(蒸馏水)、阳性对照组(银杏叶提取物40 mg·kg-1)、黄精多糖低剂量组(100 mg·kg-1)、黄精多糖中剂量组(200 mg·kg-1)、黄精多糖高剂量组(400 mg·kg-1),每组12只;按小鼠体重给药,给药体积为0.1 ml·10 g-1,每天1次,共计46 d。
1.2.2 模型建立 本实验采用滚筒睡眠干扰仪[18]进行造模。动物采购后随机分组,动物房适应3 d,预防给药14 d,取隔音并且稳定的动物房和睡眠干扰室环境(温度:23~25℃,湿度:55%。12 h/12 h明暗周期),在睡眠干扰仪内水瓶装满饮用水、食物后,将除去空白对照组之外的动物放入睡眠干扰仪中,设置干扰参数:转速(1 r/min),旋转1圈休息2 min,随机方向转动。动物放入睡眠干扰仪内, 15~17 d每天3 h(每天固定相同时间段)适应3 d。适应期结束后,18~31 d按此前参数进行睡眠干扰14 d,适应及造模期间持续给药。
造模结束后,32 d起开始行为学检测,每日检测结束后立即将小鼠放回睡眠干扰仪内,直至46 d所有行为学检测结束后取材完成。
1.2.3 行为学检测
在地面油田钻井工程中,稳定器是指钻具与井壁之间的支撑装置,它主要用于减小钻具的振动及涡动,同时实现井眼的轨迹控制[12]。目前在油田钻探领域,钻具多采用旋翼式稳定器,其外包络直径与钻头相当且与井壁之间具有一定的间隙[13-14]。除此之外,现代油田钻井工程中也采用多级稳定器串联的方式,防止钻具与井壁直接接触,以减小钻具的振动,提高钻具的使用寿命[15-16]。
1.2.3.1 旷场实验 32 d进行旷场实验检测小鼠自主活动,查看造模方式和药物是否影响小鼠自主活动。给药30 min后,将小鼠至于旷场箱(40×40×35 cm)中央区,适应3 min后点击开始,记录小鼠5 min内的自主活动情况[19];检测结束后取总路程和平均速度作为主要评价指标。
1.2.3.2 物体认知实验 物体认知实验分为新物体识别和物体新位置识别两种实验模式,操作参照本实验室前期研究方法[20]。给药30 min后进行实验,33~35 d将小鼠背朝入口放入箱体内使其自由探索10 min以适应箱体环境,该过程历时3 d(适应期)。36 d进行新物体识别模式检测,将两个完全相同的物体放入测试箱内的固定位置,小鼠自由探索两物体5 min,然后将小鼠取出(熟悉期),使用酒精擦拭箱体及两物体以消除小鼠遗留的气味,30 min后将两物体中其中一个物体更换成新物体让小鼠再次探索5 min(测试期),分别记录熟悉期和测试期5 min内小鼠对各物体探索时长;37 d进行物体新位置识别模式检测(熟悉期相同,测试期更换其中一个物体位置,另一个物体保持不变)。评价指标采用相对辨别指数(DI):DI=(Tn-Tf)/(Tn+Tf)
Tn 和Tf 分别表示 5 min 内小鼠对“新旧”物体(或位置)的探索时间
1.2.3.3 避暗实验 38~39 d避暗实验流程参照文献进行[21]。避暗实验分为获得和巩固两个阶段,检测小鼠短时学习记忆能力;获得阶段于38 d给药30 min后小鼠足部沾取生理盐水,背朝入口,由明室放入,适应3 min后,在小鼠进入暗室时给予0.5 mA(5 s)电击,学习5 min后取出。巩固阶段于39 d 给药30 min后小鼠足部沾取生理盐水,同样方式放入后立即点击开始,激活暗室电流,记录小鼠从放入到第一次进入暗室时间以及错误次数。
1.2.3.4 Morris水迷宫实验 40~45 d实验流程参照文献进行[22],检测小鼠长时空间记忆能力。实验分为定位航行(5 d)和空间探索阶段(1 d)。定位航行实验,每只每日以不同象限为入水点学习2次,给药30 min后进行实验,圆柱形平台固定一位置放入,水面没过其1~1.5 cm,入水前后均放在平台停留10 s,给予其90 s寻找平台。系统记录小鼠寻台时间作为评价指标。空间探索阶段,将平台撤去,系统记录小鼠90 s内穿台次数。
1.2.4 小鼠血液与海马组织样本的采集 行为学检测结束后,46 d给药30 min后小鼠进行眼眶取血,脱颈处死后,低温剥离小鼠海马组织;全血4 ℃静置2 h后,4 ℃离心,分离血清备用;血清和海马均至于-80 ℃冰箱。
1.3 数据处理
采用SPSS24.0软件进行统计分析,实验结果用平均值±标准误(Mean±SEM)表示。数据采用单因素方差分析(One-way ANOVA),不满足正态分布的数据采用非参数检验,组间差异进行LSD分析比较。分析结果用GraphPad Prism software8.01软件绘制图表,P<0.05时表示有显著性差异。
2 结果与分析
2.1 黄精多糖对睡眠干扰模型小鼠自主活动的影响
如图1旷场实验结果所示,与空白组相比,模型组小鼠总路程和平均速度未出现显著性(P>0.05),表明此睡眠干扰造模方式并不影响小鼠自主活动。与模型组相比,阳性对照组及黄精多糖各剂量组总路程及平均速度虽增加但未出现显著性差异(P>0.05),表明各给药组无异常兴奋或抑制等神经毒副作用。
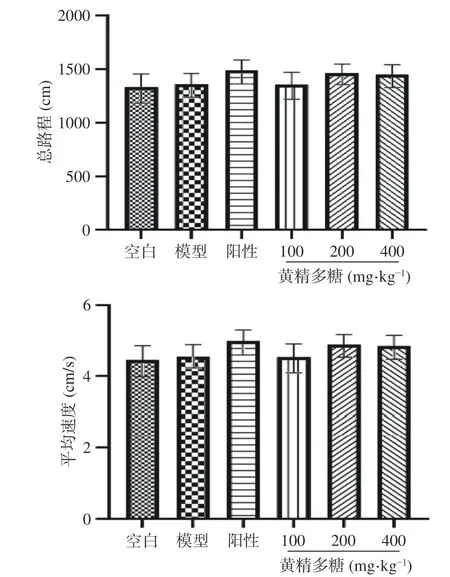
图1 黄精多糖对睡眠干扰模型小鼠自主活动的影响(Mean±SEM, n=10~12)Fig.1 Effects of PSP the locomotor activities of mice induced by SI in the open field test (Mean±SEM, n=10~12)
2.2 黄精多糖对睡眠干扰模型小鼠物体认知的影响
2.2.1 黄精多糖对睡眠干扰模型小鼠新物体识别能力的影响 如图2(A)所示,各组小鼠熟悉期总探索时间未出现显著性差异(P>0.05),说明各组小鼠的探索能力处于同一水平。图2(B)显示,各组小鼠对于实验中相同的两个物体(分别标记为A1、A2)分别探索时间也无显著差异(P>0.05),说明小鼠未对任何一方有偏好。
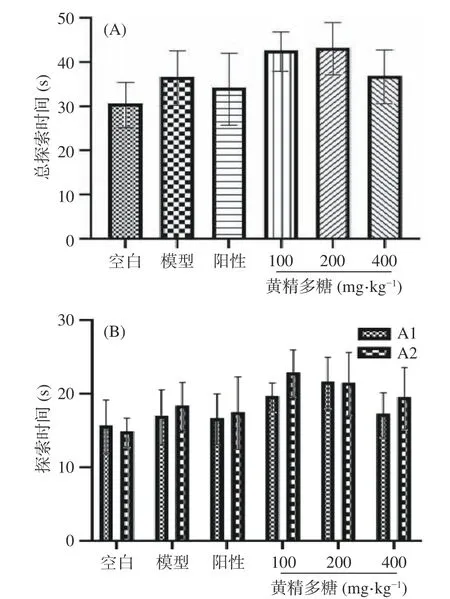
图2 黄精多糖对睡眠干扰模型小鼠新物体识别实验中熟悉期探索时间的影响Fig.2 Effects of PSP on the exploration ability of SI mice in the familiarization phase of the novel object recognition task
图3给出了黄精多糖对睡眠干扰小鼠新物体识
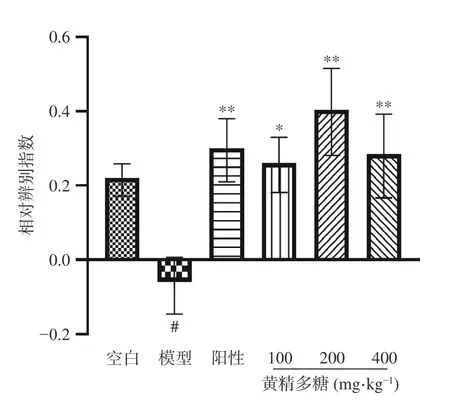
图3 黄精多糖对睡眠干扰模型小鼠新物体识别能力的影响Fig.3 Effect of PSP on the novel object recognition ability of SI mice in the test phase
别相对辨别指数(DI)的影响。与空白组相比,模型组DI显著降低(P<0.05),说明模型组小鼠已无法正确辨别新旧物体;与模型组相比,黄精多糖各剂量组小鼠DI均显著增加(P<0.05,P<0.01),说明各给药组均能识别出新物体,且对新物体更具探索兴趣。
2.2.2 黄精多糖对睡眠干扰模型小鼠物体位置识别能力的影响 如图4所示,与新物体识别熟悉期相同,熟悉期各组小鼠对两物体的总探索时间及两物体分别探索时间均未出现显著性差异(P>0.05),说明各组小鼠的探索能力处于同一水平,且无位置偏好。
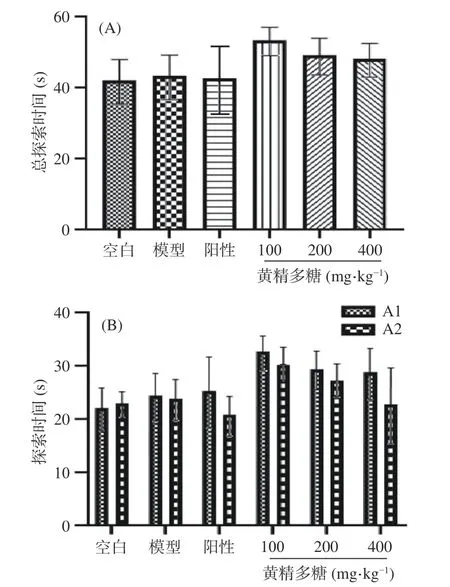
图4 黄精多糖对睡眠干扰模型小鼠物体位置识别熟悉期的影响Fig.4 Effects of PSP on the ability of exploration of SI mice in the familiarization phase of the object location recognition task
图5给出了黄精多糖对睡眠干扰小鼠物体位置识别相对辨别指数(DI)的影响。与空白组相比,模型组DI显著性降低(P<0.05);与模型组相比,阳性对照组及黄精多糖各剂量组小鼠的DI显著升高(P<0.01),表明黄精多糖能提高小鼠短时空间记忆能力。

图5 黄精多糖对睡眠干扰模型小鼠物体位置识别能力的影响Fig.5 Effects of PSP on the object location recognition ability of SI mice in the test phase
2.3 黄精多糖对睡眠干扰模型小鼠避暗实验的影响
如图6避暗实验结果所示,与空白组相比,模型组错误次数显著升高,入暗潜伏期显著降低(P<0.05),说明睡眠干扰模型组小鼠记忆受到损伤。与模型组相比,黄精多糖(100、200 mg·kg-1)组错误次数显著降低(P<0.05),入暗潜伏期显著增加(P<0.05,P<0.01),说明给药后模型小鼠记忆能力得到改善。

图6 黄精多糖对睡眠干扰模型小鼠避暗实验的影响Fig.6 Effects of PSP on mice induced by SI in passive avoidance test
2.4 黄精多糖对睡眠干扰模型小鼠水迷宫实验的影响
如表1所示,小鼠在水迷宫定位航行阶段寻台潜伏期结果显示,与空白组相比,模型组小鼠寻台潜伏期逐渐增加,并在4、5 d时寻台潜伏期呈现显著差异(P<0.05);与模型组相比,4、5 d阳性对照组潜伏期显著下降(P<0.05,P<0.01),黄精多糖(100、200 mg·kg-1)组的潜伏期也显著下降(P<0.01,P<0.001);说明睡眠干扰对小鼠空间记忆造成了损伤,而各给药组可不同程度改善此造模方式带来的记忆伤害。
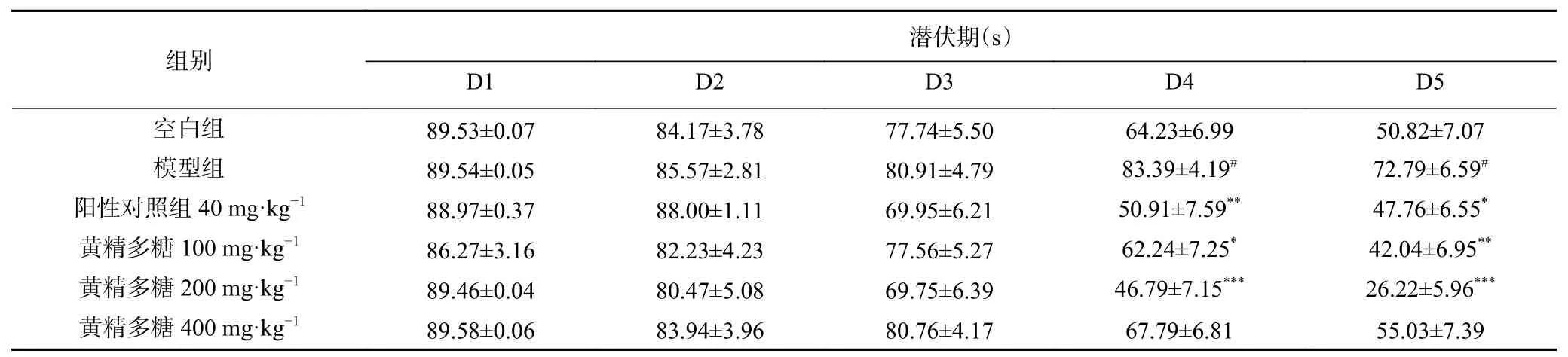
表1 黄精多糖对睡眠干扰模型小鼠水迷宫定位航行寻台潜伏期的影响Table 1 Effects of PSP on escape latency in Morris water maze task of mice induced by SI
2.5 黄精多糖对睡眠干扰模型小鼠血清、海马炎性细胞因子的影响
如图7所示,与空白组相比,模型小鼠血清和海马中促炎细胞因子IL-Iβ、IL-6水平均显著升高;与模型组相比,黄精多糖(100、200 mg·kg-1)给药组小鼠血清中促炎因子IL-β含量降低(P<0.05),而血清中IL-6含量呈降低趋势;海马内促炎因子IL-1β,IL-6均显著降低(P<0.01,P<0.001)。黄精多糖对小鼠血清与海马中促炎因子的改善作用存在差异,可能是药物作用部位的强度不同。
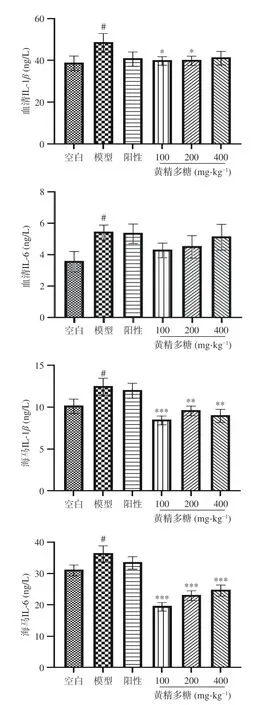
图7 黄精多糖对睡眠干扰模型小鼠血清、海马中IL-1β、IL-6的影响Fig.7 Effects of PSP on IL-1β,IL-6 level in serum and hippocampus of mice
2.6 黄精多糖对睡眠干扰模型小鼠海马神经递质的影响
如图8所示,与空白组相比,模型组小鼠海马组织内GABA水平显著增加(P<0.05),Ach水平显著降低(P<0.05);与模型组相比,黄精多糖各剂量组给药后小鼠海马内GABA呈显著降低(P<0.01),Ach呈增加趋势,其中黄精多糖(400 mg·kg-1)出现显著性差异(P<0.05)。
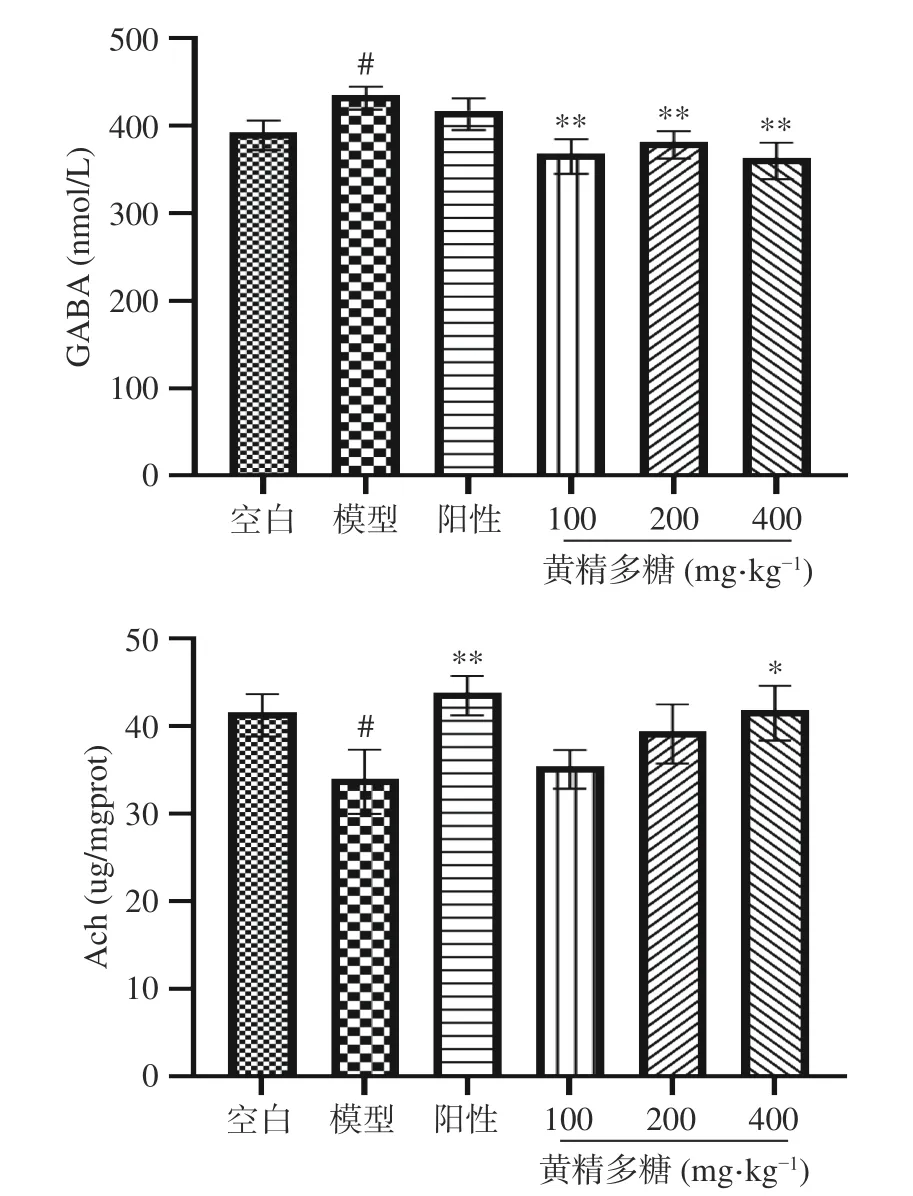
图8 黄精多糖对睡眠干扰模型小鼠海马神经递的影响Fig.8 Effects of PSP on concentration of neurotransmitters in hippocampus of mice
3 结论与讨论
本实验通过旷场、物体认知、避暗、水迷宫四个行为学实验来评价睡眠干扰和黄精多糖干预对小鼠认知功能的影响。本实验中旷场实验结果显示,各组小鼠自主活动处于同一水平,表明造模及给药并未影响小鼠正常活动,这与黄红等[23]探讨睡眠干扰诱导的学习记忆障碍研究中的旷场实验结果一致;物体认知实验结果表明,与模型组相比,黄精多糖各剂量组对物体认知实验中小鼠新旧物体、物体位置的识别能力有明显提高作用,这与Lueptow等[24]探讨的小鼠学习记忆功能在新物体识别检测中的表现结果类似,同时与陈耀辉等[25]在探讨黄精相关复方对AD大鼠学习记忆损伤时的新物体识别检测结果一致;在小鼠短时(避暗)、长时(水迷宫)记忆检测实验中,黄精多糖各剂量组能明显增加小鼠避暗潜伏期、降低错误次数,降低水迷宫寻台潜伏期,这与刘露露等[17]探讨黄精多糖对D-半乳糖致小鼠学习记忆损伤的研究中避暗、水迷宫结果类似。以上结果说明,黄精多糖干预可有效改善睡眠干扰致认知功能损伤。
睡眠不足引起的认知障碍和炎症因子、神经递质密切相关,炎症被认为是学习记忆损伤潜在的机制[26],睡眠不足会激活促炎因子IL-1β、IL-6的表达引起炎症反应,导致细胞凋亡与免疫损伤进而影响认知功能[27-28]。Ach是中枢神经系统功能、调节睡眠和多种认知过程所必需的递质[29-30],GABA为脑内重要的神经递质,与记忆、睡眠等息息相关[31-32],脑内Ach的异常下降和GABA的异常增高会导致学习记忆下降[33-34]。本实验结果中,与模型组相比,黄精多糖各剂量组干预后能够显著降低模型小鼠血清和海马内促炎细胞因子IL-1β、IL-6水平,降低海马组织内神经递质GABA水平,升高Ach水平。由此推测黄精多糖改善睡眠干扰小鼠认知功能损伤作用可能是通过抑制促炎性因子水平和调节脑内神经递质发挥作用。
综上所述,黄精多糖可防治睡眠干扰所致认知功能损伤,主要表现在黄精多糖可提高认知功能损伤小鼠的短时非空间记忆能力(新物体识别)、短时空间记忆能力(物体位置识别)、长时空间学习能力(水迷宫)以及被动逃避记忆能力(避暗),其机制可能是通过调节血清和海马内促炎细胞因子水平和海马内神经递质水平。本研究结果可为黄精多糖神经保护作用的深入挖掘提、为黄精的精深加工利用提供一定的参考。
