核桃粕蛋白提取纯化工艺优化及其功能性质分析
2023-01-13代晹鑫
代晹鑫,徐 莹,毕 爽,刘 野
(北京工商大学食品与健康学院,北京 100048)
核桃(Juglans regiaL.)系胡桃科(Juglandaceae)核桃属植物,有“木本油料之王”的美誉,是世界上最受欢迎的坚果之一[1]。因为核桃有令人满意的风味、营养和健康特征,有极高的经济价值和营养价值,而被广泛食用,有四大干果之首的称号[2-4]。通常,核桃含有55%~70%的脂肪,其中约70%由多不饱和脂肪酸组成,据报道,这对于缓解一系列人类疾病和紊乱很重要[5-8]。同时,核桃还可以提供大量的维生素,维生素及多酚等活性物质,对人体健康非常有益[9-10]。此外,核桃中含15%~18%的蛋白质[11],主要由球蛋白、醇溶蛋白、清蛋白、谷蛋白组成[12],分别约占15.67%、4.73%、7.54%、72.06%[13]。
在我国,只有一少部分采摘的核桃未经加工直接食用,由于多不饱和脂肪酸的含量极高,大多数用于榨油,榨油过程消耗的核桃质量是其生产油量的两倍[14]。因此,生产过程中会出现大量部分脱脂的核桃粕,这些核桃粕通常会被丢弃或者用作动物饲料或肥料,使得其未能得到充分的利用[15]。榨油后的核桃粕中蛋白质含量可达40%左右,含有18种氨基酸且比例均衡,是一种优质的天然植物蛋白源[16-17]。核桃蛋白是一种优质蛋白质和优质抗氧化剂,在我国的利用率还很低。榨油后的核桃粕未得到利用,不仅造成了资源浪费,降低了产业链上下游产品的附加值,而且还对环境造成污染[18]。
核桃粕蛋白的提取普遍采用碱溶酸沉的方法,该方法操作简单,成本低[13,19-20]。植物蛋白纯化常用方法有膜分离法[21]、离子交换法[22]、酶法[23]等,酶法是当今蛋白纯化的常用方法。尤其近年来,糖化酶酶法已被广泛应用于蛋白质纯化,利用糖化酶纯化蛋白的有效性在铁核桃蛋白、菜籽蛋白和米糠蛋白中被验证,效果极佳[24-26]。因此,本研究拟采用糖化酶纯化酶法来改性核桃蛋白,提高核桃蛋白纯度。
本研究通过响应面法优化核桃粕蛋白的提取与纯化工艺,得到核桃粕蛋白提取与优化的最佳的工艺条件,并进行相关性质的测定,为核桃粕的开发利用及后续研究提供理论依据。
1 材料与方法
1.1 材料与仪器
核桃粕 实验室液压冷榨制备(品种为新二);糖化酶(酶活105U/g)、十二烷基硫酸钠 索莱宝试剂有限公司;氢氧化钠 福晨化学试剂有限公司;盐酸
国药集团化学试剂有限公司。
KD-310型自动凯氏定氮仪 瑞典奥普赛斯公司;Alpha 2-4 LD plus型冷冻干燥机 德国Marin Christ 公司;CR22N型台式离心机 日本日立公司;XHF-DY型高速均质分散器 宁波有限公司新芝生物科技。
1.2 实验方法
1.2.1 核桃粕基本成分测定 按表1中方法对核桃粕进行基本成分的测定。

表1 核桃粕基本成分测定Table 1 Determination of basic components of walnut meal
1.2.2 核桃粕脱脂粉的制备 参考任娇艳等[27]和Mao等[28]的方法,将榨油所得的核桃粕放入粉碎机中,进行完全粉碎,采用正己烷对核桃粕进行脱脂处理。料液比1:10 g/mL,搅拌5 h,然后进行抽滤,直至滤液澄清后,置于通风橱中,挥干溶剂,再进行粉碎,过100目筛,即可得到核桃脱脂粉,置于冰箱-20 ℃保存备用。
1.2.3 核桃粕蛋白制备工艺 核桃脱脂粉→加入去离子水(1:40,W/V)→调pH为12→搅拌90 min(55 ℃)→离心(10000×g,15 min,4 ℃)→上清液→调pH为4.5→搅拌1 h→离心(10000×g,15 min,4 ℃)→沉淀→水洗3次→冻干→加入去离子水(1:40,W/V)→调pH为4.5→加糖化酶(0.4%)→酶解129 min(53 ℃)→高温灭酶(90 ℃,10 min)→离心(10000×g,15 min,4 ℃)→沉淀→冷冻干燥→纯化后的核桃粕蛋白。
1.2.4 蛋白质标准曲线的建立 参考Xue等[29]的方法,配制浓度为100 μg/mL标准牛血清白蛋白溶液,分别向试管中加入0、0.2、0.4、0.6、0.8、1 mL,溶液体积不足1 mL的,补加蒸馏水,固定溶液体积为1 mL,再加入5 mL考马斯亮蓝G-250,充分混合后室温下放置5 min,波长595 nm下测得吸光值。以标准蛋白的浓度为横坐标X,吸光值为纵坐标Y,绘制标准曲线。所制标准曲线的线性回归方程Y=0.0075X+0.0045,决定系数R2=0.9995,说明牛血清白蛋白在浓度0~100 μg/mL,线性关系良好。蛋白提取率采用Bradford法测定,蛋白纯度采用凯氏定氮法测定,蛋白提取率和纯度的测定及计算公式如下:

1.2.5 核桃粕蛋白提取工艺的优化
1.2.5.1 pH对蛋白提取率的影响 称取2.0 g 核桃粕脱脂粉,加入60 mL超纯水,调节溶液的pH为8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13, 在30 ℃下浸提60 min。在4 ℃下10000 r/min离心20 min,取上清液采用Bradford法测定提取液中的蛋白质含量,得出最佳pH。
1.2.5.2 时间对蛋白提取率的影响 称取2.0 g核桃粕脱脂粉,加入60 mL超纯水,调节溶液的pH为11.0,在 30 ℃下浸提30、60、90、120、150、180 min。在4 ℃下10000 r/min离心20 min,取上清液采用Bradford法测定提取液中的蛋白质含量,得出最佳时间。
1.2.5.3 料液比对蛋白提取率的影响 称取2.0 g核桃粕脱脂粉,按料液比为1:10、1:15、1:20、1:25、1:30、1:35、1:40、1:45、1:50加入相应体积的超纯水,调节溶液的pH为11.0,在30 ℃下浸提60 min。在4 ℃下10000 r/min离心20 min,取上清液采用Bradford法测定提取液中的蛋白质含量,得出最佳料液比。
1.2.5.4 温度对蛋白提取率的影响 称取2.0 g核桃粕脱脂粉,加入60 mL 超纯水,调节溶液的pH为11.0,分别在30、35、40、45、50、55、60、65 ℃下浸提60 min。然后在4 ℃下10000 r/min 离心20 min,取上清液采用Bradford法测定提取液中的蛋白质含量,得出最佳温度。
1.2.5.5 响应面分析法优化核桃粕蛋白提取条件
根据单因素实验结果,选取pH、温度、料液比、时间这4个影响因子,采用四因素三水平的响应面分析方法对提取条件进行响应面分析,以蛋白质的提取率为响应值,确定最佳提取条件,因素与水平见表2。
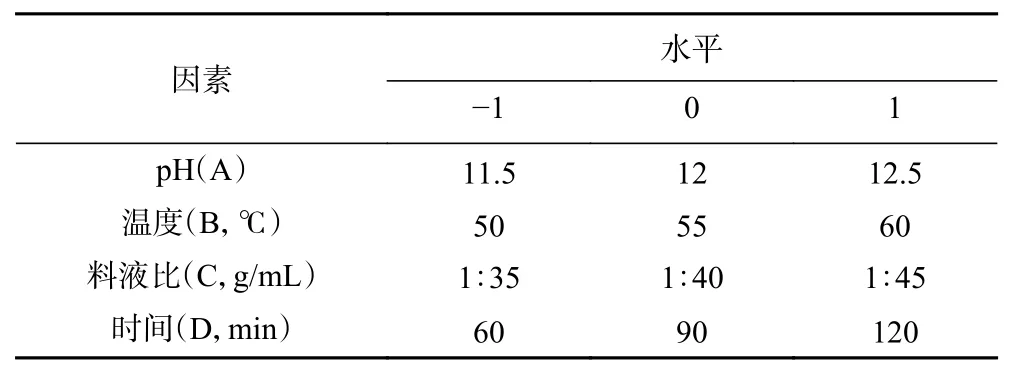
表2 响应面分析因素与水平Table 2 Levels and codes of variables chosen for response surface analysis
1.2.6 核桃粕蛋白酸沉点的确定 根据核桃粕蛋白提取的最佳条件进行实验,收集上清液。用0.1 mol/L HCl调节上清液的pH 分别为2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7,磁力搅拌120 min。在4 ℃下10000 r/min离心20 min,取上清液采用Bradford法测定蛋白质含量,吸光值越低,说明上清液中大部分蛋白沉淀出来,就越接近核桃粕蛋白等电点,即可将吸光值最低点设置为核桃粕蛋白酸沉点。
1.2.7 核桃粕蛋白纯化工艺优化
1.2.7.1 pH对蛋白纯度的影响 称取2.0 g核桃粕蛋白,加入80 mL超纯水,调节溶液的pH为3、3.5、4.0、4.5、5.0、5.5、6,控制加酶量为0.1%,50 ℃下,酶解60 min,测定不同pH下蛋白质的纯度,确定最佳酶解pH。
1.2.7.2 温度对蛋白纯度的影响 称取2.0 g核桃粕蛋白,加入80 mL超纯水,调节溶液的pH至4.5,控制加酶量为0.1%,分别在30、35、40.0、45.0、50.0、55.0、60.0 ℃下,酶解60 min,测定不同酶解温度下蛋白质的纯度,确定最佳酶解温度。
1.2.7.3 时间对蛋白纯度的影响 称取2.0 g核桃粕蛋白,加入80 mL超纯水,调节溶液的pH至4.5,控制加酶量为0.1%,50 ℃下,分别酶解30、60、90、120、150、180 min,计算不同酶解温度下蛋白质的纯度,确定最优酶解时间。
1.2.7.4 加酶量对蛋白纯度的影响 称取2.0 g核桃粕蛋白,加入80 mL超纯水,调节溶液的pH至4.5,分别控制加酶量为0.1%、0.2%、0.3%、0.4%、0.5%,50 ℃下,酶解60 min,计算不同加酶量下蛋白质的纯度,确定最佳加酶量。
1.2.7.5 响应面分析法优化核桃粕蛋白纯化条件
根据单因素实验结果,选取酶解时间、温度、加酶量这3个影响因子,采用三因素三水平的响应面分析方法对纯化条件进行响应面分析,以蛋白质纯度为响应值,确定最佳纯化条件。因素与水平见表3。

表3 响应面分析因素与水平Table 3 Levels and codes of variables chosen for response surface analysis
1.2.8 核桃粕蛋白性质分析
1.2.8.1 核桃粕蛋白溶解性测定 参考Hao等[30]的方法,略改。1 g核桃粕蛋白溶于100 mL超纯水,调节溶液pH3~12,搅拌30 min,在4 ℃下10000 r/min离心10 min,去除沉淀,收集上清液,用Bradford法测定上清液的蛋白质含量,蛋白质的溶解度计算公式如下:

1.2.8.2 核桃粕蛋白吸水性及吸油性测定 参考Sun等[31]的方法,略改。1 g核桃粕蛋白,质量记为W0,倒入离心管中,称量样品和离心管质量记作为W1,加入20 mL超纯水(核桃油),振荡混合30 s,静置30 min。在4 ℃下10000 r/min离心10 min,去除上清液,倒置1 min去除残余水分(核桃油),记录离心后沉淀和离心管质量W2。吸水性和吸油性计算公式如下:

式中:W2—离心后沉淀和离心管质量,g;W1—样品和离心管质量,g;W0—样品质量,g。
1.2.8.3 核桃粕蛋白起泡性及泡沫稳定性测定 参考马开创[32]的方法,略改。1 g核桃粕蛋白,加入100 mL超纯水,调节蛋白溶液的pH3~12,搅拌30 min,高速搅打1 min,迅速转移到量筒中,记录量筒中溶液和泡沫的总体积V1。在室温下记录放置30、60、90 min后量筒中溶液和泡沫总体积V2。起泡性和泡沫稳定性计算公式如下:

式中:V1—溶液和泡沫总体积,mL;V2—静置后溶液和泡沫总体积,mL。
1.2.8.4 核桃粕蛋白乳化性及乳化稳定性测定 参考Yan等[33]的方法,略改。称取0.1 g核桃粕蛋白,加入10 mL超纯水,调节溶液pH3~12,搅拌30 min,加入5 mL核桃油均质1 min,取50 μL液体,加入5 mL的0.1% SDS,混匀,在500 nm处测定吸光度。放置10 min后测定吸光度。乳化活性(EAI)和乳化稳定性(ESI)的计算公式如下所示:
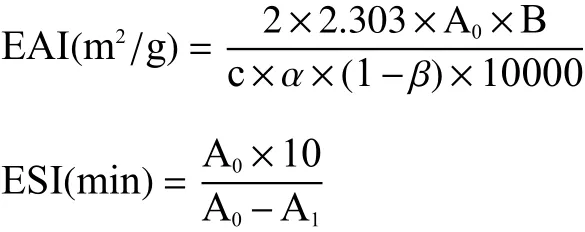
式中:A0—0 min时吸光值;B—稀释倍数(100);c—待测样品浓度,mol/L;α为0.01 m光路;β—分散系数(0.25);A1—10 min时吸光值。
1.3 数据处理
所有实验数据均重复测定3次,取平均值,实验结果以用三次数据的平均值和标准误差的形式表示,采用Excel和Origin软件进行处理分析、制图,并用SPSS进行差异显著性分析。
2 结果与分析
2.1 核桃粕基本成分分析
如表4所示,脱脂核桃粕和核桃粕的蛋白含量、脂肪含量、水分含量和灰分含量均有显著性差异,脱脂核桃粕蛋白含量为51.68%±0.42%,比未进一步脱脂前提高了1.2倍,脂肪含量下降至1.42%±0.62%,水分含量上升至9.18%±0.21%,灰分含量降低至4.32%±0.15%。
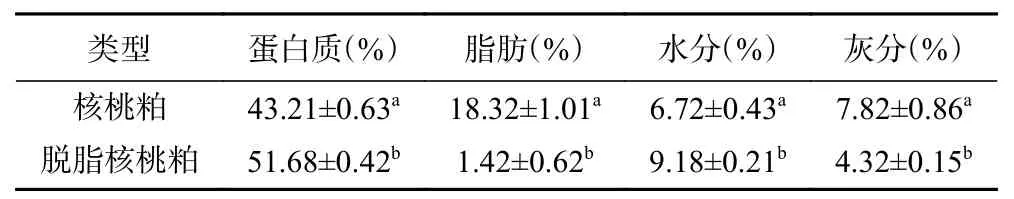
表4 核桃粕基本成分Table 4 Basic ingredients of walnut meal
2.2 核桃粕蛋白提取工艺的优化
2.2.1 pH对蛋白提取率的影响 如图1,随着pH的升高,蛋白质的提取率渐渐升高,当pH上升到pH12的时候,提取率达到71.43%,之后,蛋白质的提取率趋于平缓。这是因为在核桃粕蛋白中谷蛋白含量丰富,且谷蛋白不溶于水,溶于碱,在碱性环境下,随着pH的升高,核桃粕蛋白溶出量增多,即核桃粕蛋白提取率升高,这与Venkatachalam等[34]研究结果相似。因此,最佳pH为12。
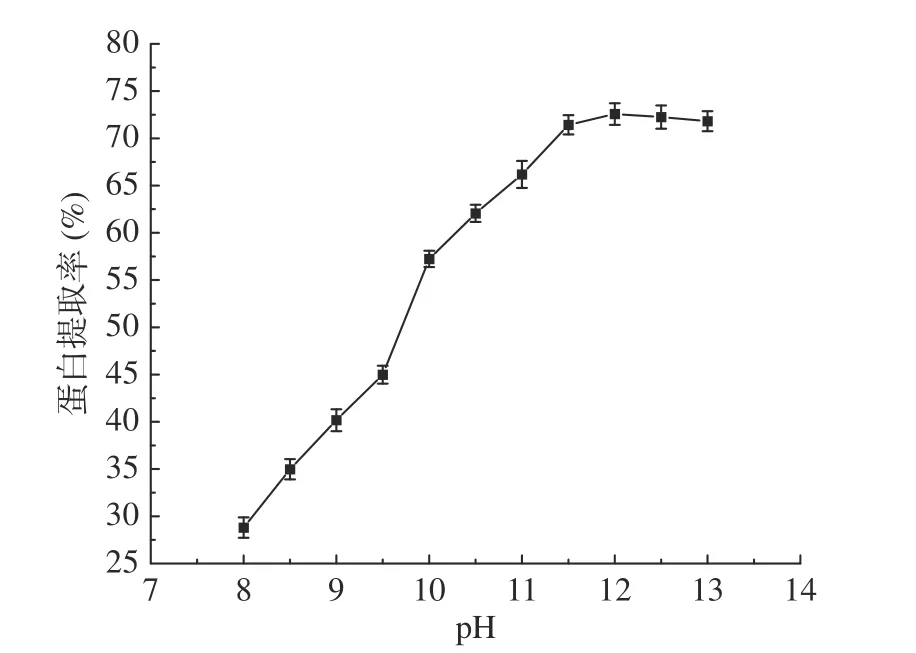
图1 pH对核桃粕蛋白提取率的影响Fig.1 Effect of pH on the extraction rate of walnut meal protein
2.2.2 时间对蛋白提取率的影响 如图2,核桃粕蛋白提取率随提取时间的增加逐渐升高,提取时间90 min时,提取率达到69.98%,之后随着时间的增加,提取率平缓上升。初期,核桃粕中蛋白含量高,溶液中蛋白含量低,随着时间增加,核桃粕蛋白逐渐从核桃粕中向溶液中转移,一定时间后,溶液中核桃粕蛋白含量达到待饱和状态,时间增加,也只能溶解出少量蛋白。因此,最佳提取时间为90 min。
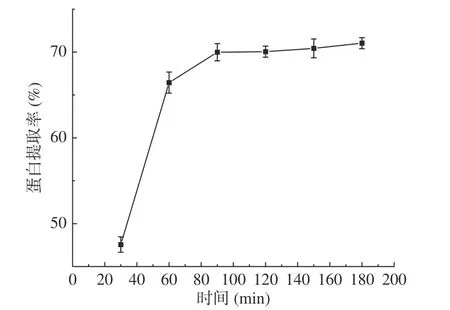
图2 提取时间对核桃粕蛋白提取率的影响Fig.2 Effect of extraction time on the extraction rate of walnut meal protein
2.2.3 料液比对蛋白提取率的影响 如图3,核桃粕蛋白提取率随料液比增加逐渐增大,当料液比为1:40的时候提取率达到71.81%,之后随着料液比的增大,核桃粕蛋白提取率升高不明显。这是因为随着料液比的增加,使得核桃粕蛋白和溶液的接触面增大,且在溶液中所能溶解的蛋白含量增多,从而促进了蛋白质的溶解[35]。当定量的核桃粕蛋白完全溶出后,增加料液比,也只能溶出少量的蛋白。因此,最佳提取料液比为1:40。
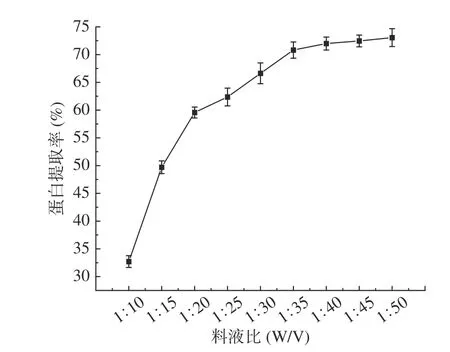
图3 料液比对核桃粕蛋白提取率的影响Fig.3 Effect of solid liquid ratio on the extraction rate of walnut meal protein
2.2.4 温度对蛋白提取率的影响 如图4,核桃粕蛋白提取率随着温度的升高而逐渐增大,当温度达到55 ℃时核桃粕蛋白提取率为71.88%。超过55 ℃时,随温度升高,核桃粕蛋白提取率逐渐减小。这是因为随着温度的升高,蛋白的空间构型发生改变,有助于其与水的相互作用,加快核桃粕中蛋白向溶液中转移,从而促进蛋白质的溶解,当温度升到一定值时,高温使得部分蛋白质变性,蛋白质的溶解少[36]。因此,最佳提取温度为55 ℃。
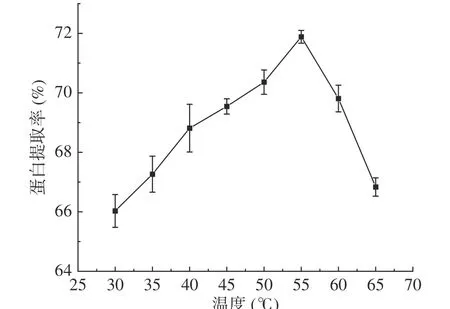
图4 温度对核桃粕蛋白提取率的影响Fig.4 Effect of temperatures on the extraction rate of walnut meal protein
2.2.5 响应面分析 Box-Behnken 设计的四因素三水平的响应面试验,以pH(A)、温度(B)、料液比(C)、时间(D)为自变量,其方案和结果响应面试验结果见表5,方差分析见表6。

表5 响应面设计方案及实验结果Table 5 Design scheme and result of response surface test
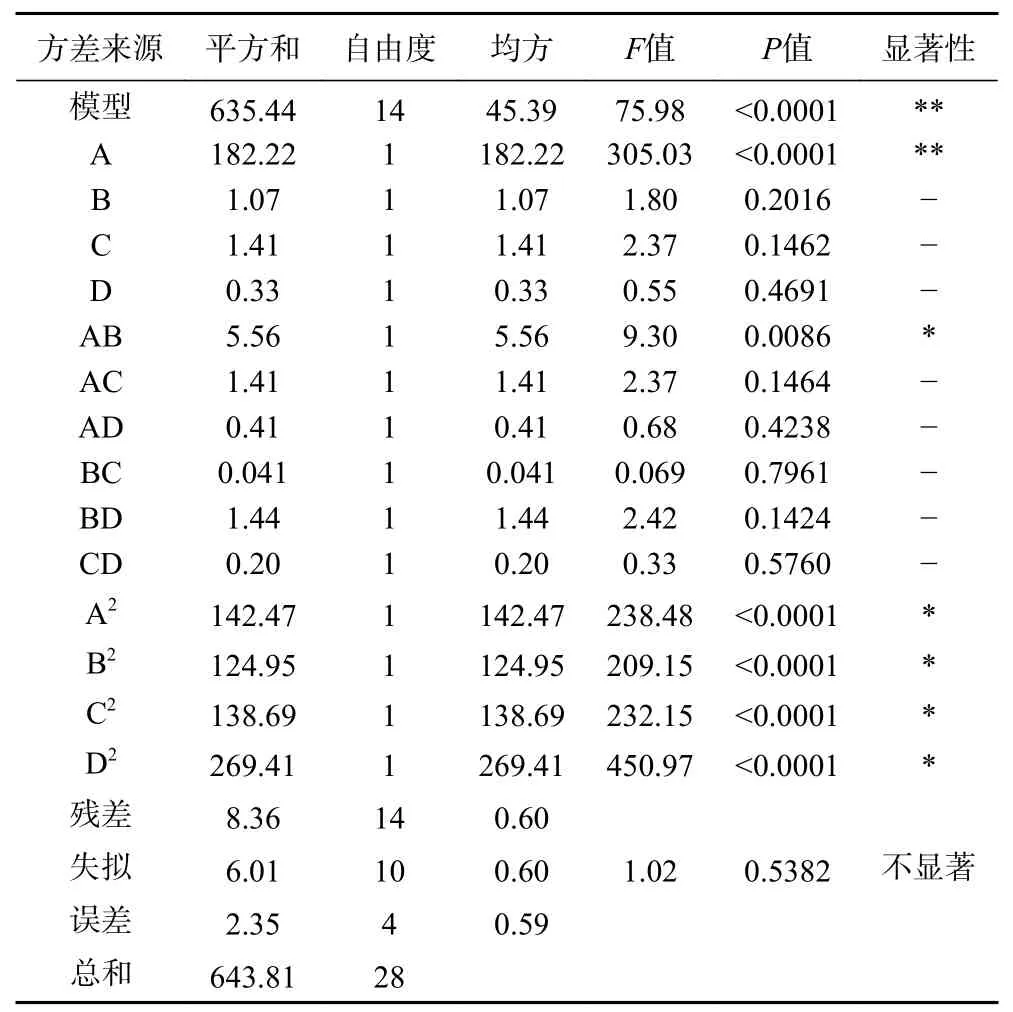
表6 回归模型方差分析Table 6 Analysis of variance in regression model
利用Design-Expert8.0 进行二次多元回归拟合,可得pH(A)、温度(B)、料液比(C)以及时间(D)与响应值为蛋白提取率(Y)的关系。Y=81.09+3.90A-0.3B-0.34C+0.17D+1.18AB+0.59AC-0.32AD-0.1BC+0.6BD+0.22CD-4.69A2-4.39B2-4.62C2-6.44D2,其中,R2=0.9870,R2Adj=0.9740。对该回归模型进行方差分析,结果回归模型显著,失拟检验不显著,实验误差小,故可用该模型对核桃粕蛋白提取率进行分析与预测。根据回归方程,为了更好地分析pH(A)、温度(B)、料液比(C)以及时间(D)对响应值提取率(Y)的影响,作响应面图,考察响应曲面的形状(见图5~图10)。

图5 pH和温度交互作用的曲面图Fig.5 Surface plot of the interaction between pH and temperature

图10 料液比和时间交互作用的曲面图Fig.10 Surface plot of the interaction between solid liquid ratio and time
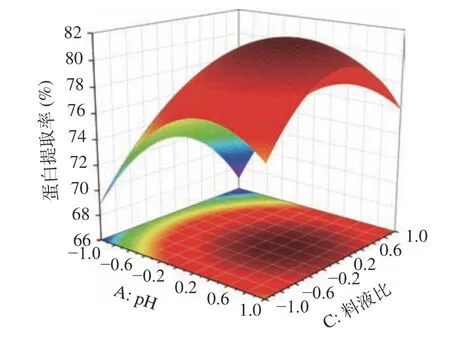
图6 pH和料液比交互作用的曲面图Fig.6 Surface plot of the interaction between pH and solid liquid ratio

图7 pH和时间交互作用的曲面图Fig.7 Surface plot of the interaction between pH and time
用Design-Expert8.0.6软件分析得到的核桃粕蛋白提取的最佳工艺条件为:pH12,温度55 ℃,时间90 min,料液比1:40 g/mL,为了检验响应面法的可行性,在此工艺条件下进行5次重复验证试验,实际测得核桃粕蛋白提取率的平均值为81.89%±1.64%,比预测值相差1.81%,预测值与实际值基本相符。因此实验所得的最佳提取工艺参数可靠。此时核桃蛋白含量为80.68%±0.46%,为得到高纯度的核桃粕蛋白需进行纯化,故采用糖化酶进行酶解纯化,进一步提高蛋白纯度。
2.3 核桃粕蛋白等电点的确定

图8 温度和料液比交互作用的曲面图Fig.8 Surface plot of the interaction between the temperature and solid liquid ratio

图9 温度和时间交互作用的曲面图Fig.9 Surface plot of the interaction between temperature and time
见图11,可以看出,在pH4~5之间,上清液的吸光值都较低,核桃碱溶蛋白的酸沉量是比较大的。在pH4.5下上清液的吸光值最低,所以说明大部分核桃粕蛋白可以在pH4.5下沉淀下来,即将pH4.5作为核桃粕蛋白等电点,这一结果和姜莉[37]的研究结果一致。
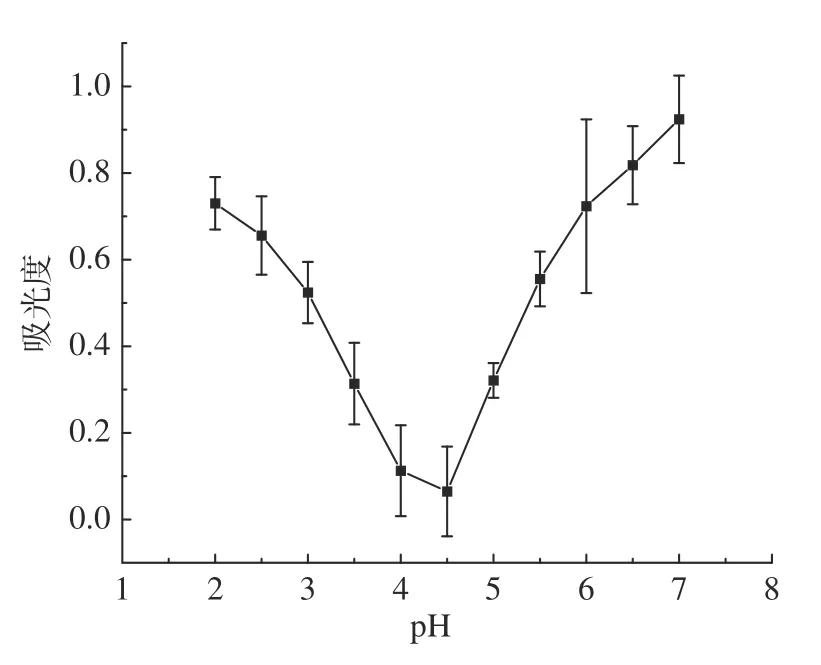
图11 核桃粕蛋白的等电点的测定Fig.11 Walnut meal protein isoelectric point determination
2.4 核桃粕蛋白纯化工艺的优化
2.4.1 pH对蛋白纯度的影响 如图12,核桃粕蛋白纯度随着pH的升高先增加后降低,在pH4.5时纯度达到86.70%。因为过高过低的pH会导致糖化酶的酶活下降,酶与底物的结合差。从结果上看就是蛋白纯度低,所以最佳纯化pH为4.5。
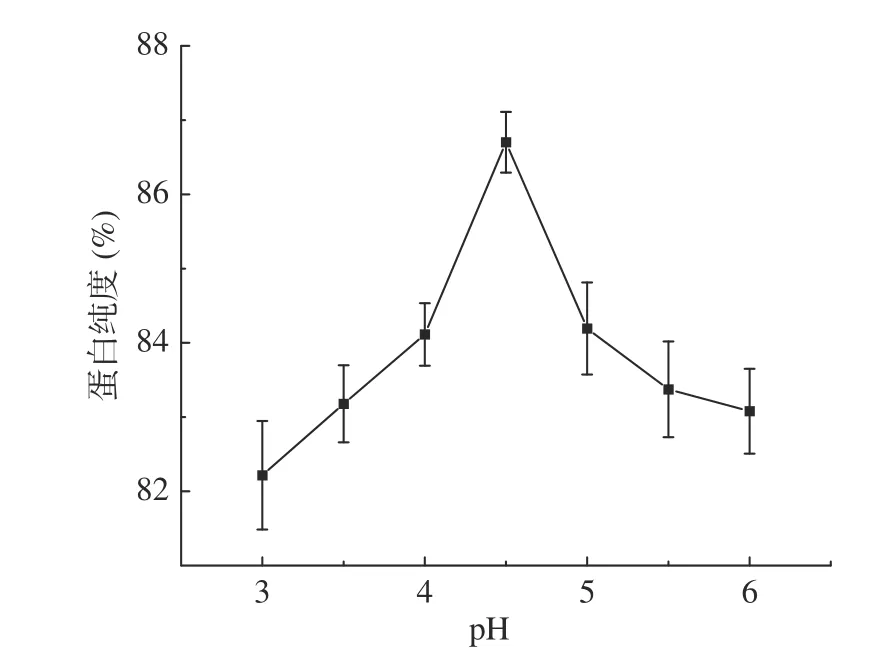
图12 pH对核桃粕蛋白纯度的影响Fig.12 Effect of pH on the purity of walnut meal protein
2.4.2 温度对蛋白纯度的影响 如图13,核桃粕蛋白纯度随着酶解温度的升高先增加后降低,在50 ℃时纯度为86.29%。由于低温会抑制糖化酶的酶活,高温会导致糖化酶部分变性失活,导致酶解能力下降,从而造成蛋白纯度下降[38]。所以最佳酶解温度为50 ℃。
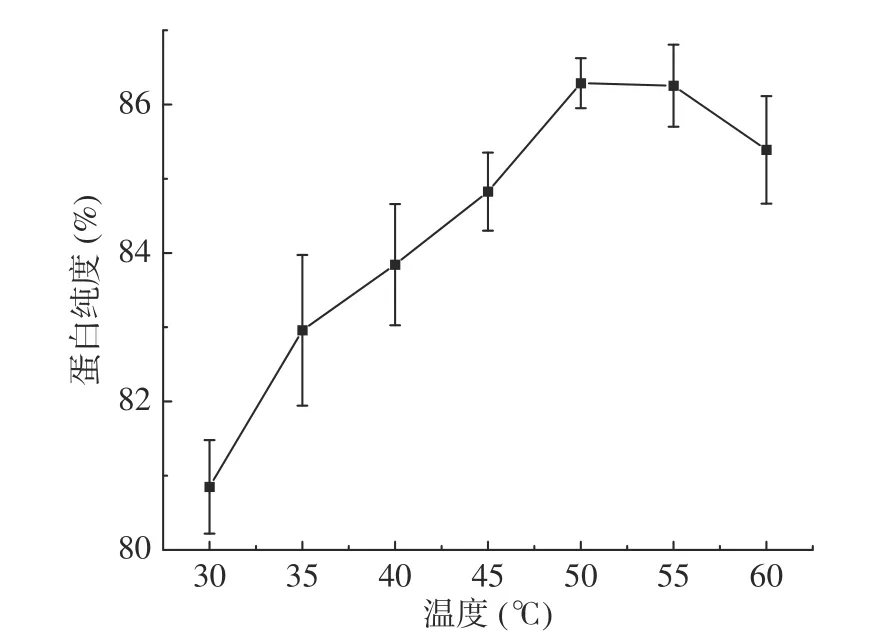
图13 温度对核桃粕蛋白纯度的影响Fig.13 Effect of temperatures on the purity of walnut meal protein
2.4.3 时间对蛋白纯度的影响 如图14,核桃粕蛋白纯度随着酶解时间的增加而提高,而后保持平稳,在120 min时纯度为91.23%。随着酶解时间增加,糖化酶反应地越彻底,一段时间后,反应达到平衡,即核桃粕蛋白纯度保持稳定,所以最佳酶解时间为120 min。
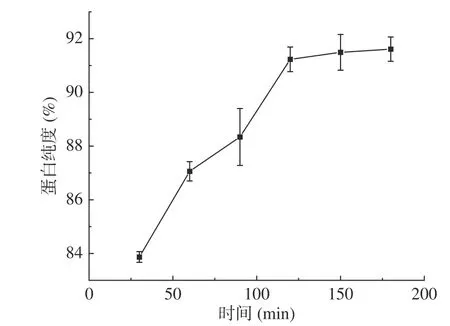
图14 酶解时间对核桃粕蛋白纯度的影响Fig.14 Effect of enzymatic hydrolysis time on the purity of walnut meal protein
2.4.4 加酶量对蛋白纯度的影响 如图15,核桃粕蛋白纯度随着加酶量的增加而提高,而纯度提高的不明显,在加酶量为0.3%时纯度为89.11%。随着加酶量的加大,糖化酶反应越快,当加酶量为0.5%时,反应速率达到最大值为89.91%,综合经济效益考虑,最佳加酶量为0.3%。

图15 加酶量对核桃粕蛋白纯度的影响Fig.15 Effect of enzyme dosage on the purity of walnut meal protein
2.4.5 响应面分析 Box-Behnken 设计的三因素三水平的响应面试验,以时间(A)、温度(B)、加酶量(C)为自变量,其方案和结果响应面试验结果见表7,方差分析见表8。

表7 响应面设计方案及实验结果Table 7 Design scheme and result of response surface test
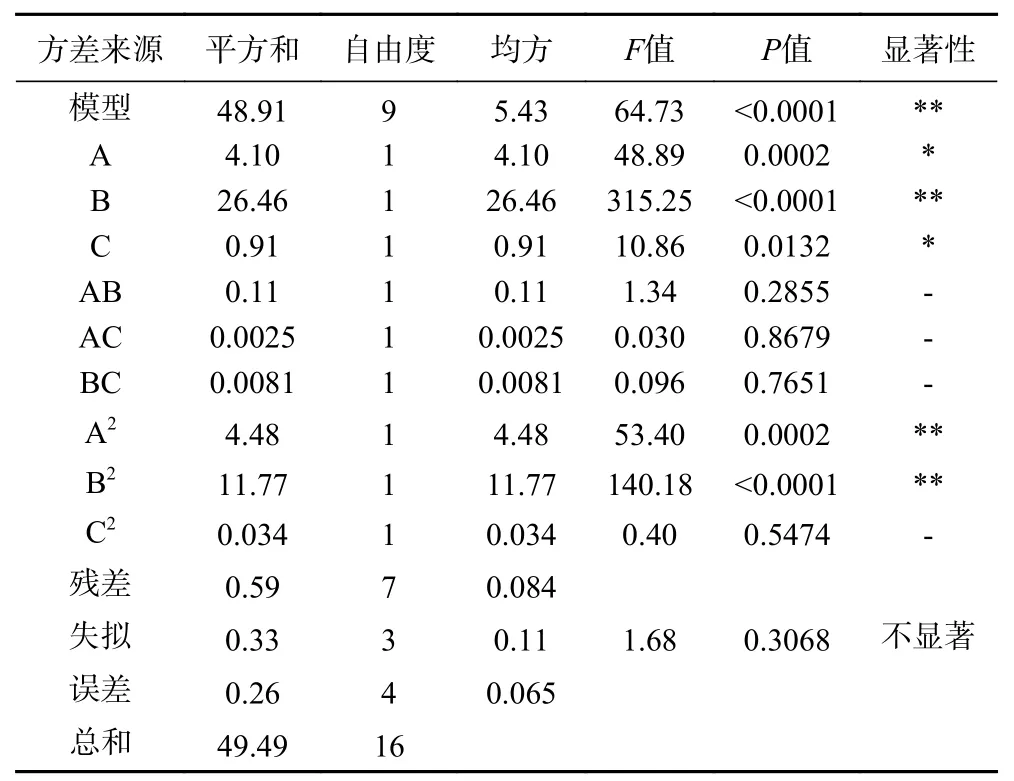
表8 回归模型方差分析Table 8 Analysis of variance in regression model
利用Design-Expert8.0 进行二次多元回归拟合,可得时间(A)、温度(B)及加酶量(C)与响应值纯度(Y)的关系。方程为: Y=93.66+0.72A+1.82B+0.34C-0.17AB-0.025AC+0.045BC-1.03A2-1.67B2-0.089C2,其中R2=0.9881,R2Adj=0.9729。对该回归模型进行方差分析,结果显示,回归模型显著,失拟检验不显著,实验误差小,故可用该模型对核桃粕蛋白纯度进行分析与预测。
根据回归方程,为了更好地分析时间(A)、温度(B)及加酶量(C)对响应值纯度(Y)的影响,作响应面图,考察响应曲面的形状(见图16~图18)。
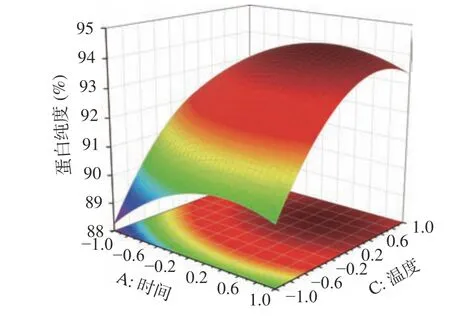
图16 时间和温度交互作用的曲面图Fig.16 Surface plot of the interaction between temperature and time
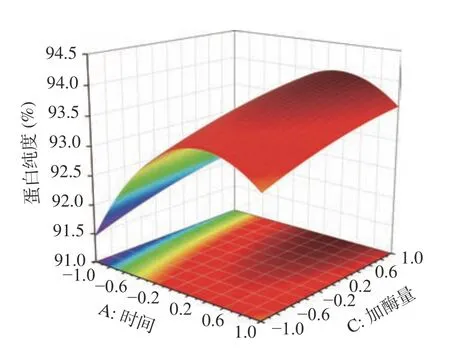
图17 时间和加酶量交互作用的曲面图Fig.17 Surface plot of the interaction between time and enzyme dosage

图18 温度和加酶量交互作用的曲面图Fig.18 Surface plot of the interaction between temperature and enzyme dosage
用Design-Expert8.0.6软件分析得到核桃粕蛋白纯化的最佳工艺条件为:pH4.5,料液比1:40 g/mL,酶解时间129 min,酶解温度53 ℃,加酶量0.4%。为了检验响应面法的可行性,在此工艺条件下进行5次重复验证试验,实际测得蛋白纯度的平均值为94.48%±1.83%,比预测值相差1.45%,预测值与实际值基本相符。因此实验所得的最佳纯化工艺参数可靠。
2.5 核桃粕蛋白性质分析
2.5.1 核桃粕蛋白溶解性 不同pH下两种核桃粕蛋白溶解性变化如图19,两种核桃粕蛋白在pH4.5时溶解性最低,为3.14%,4.9%,因为pH4.5是核桃粕蛋白的等电点,在pH4.5处,蛋白的净电荷是0,蛋白分子之间无静电斥力,蛋白聚集,造成其溶解性低。当pH偏离4.5时,溶解度增大,且在碱性环境下纯化前后核桃粕蛋白的溶解度具有显著性差异(P<0.05), pH7时,溶解度分别为16.47%、24.82%,pH12时,溶解度最高,分别为75.93%、86.53%,因为远离等电点时,静电斥力增加,有利于亲水基团分布在表面,因此溶解性提高[39]。纯化后的核桃粕蛋白的溶解度始终更高,这说明经过纯化后,核桃粕蛋白的溶解度得到了改善。
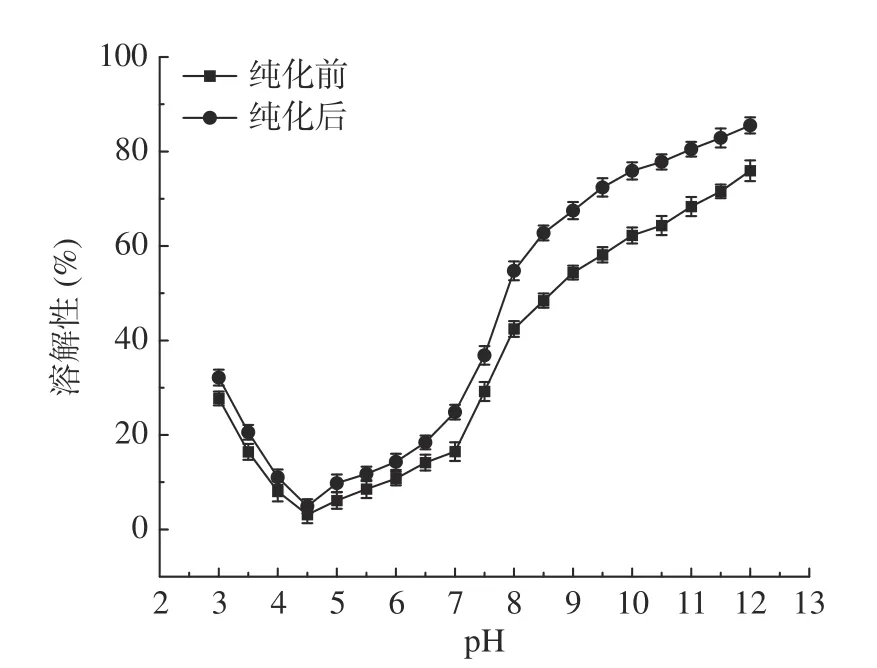
图19 pH对核桃粕蛋白溶解度的影响Fig.19 Effect of pH on the solubility of walnut meal protein
2.5.2 核桃粕蛋白吸水性及吸油性 两种的吸水性及吸油性如图20,纯化前后核桃粕蛋白的吸水性和吸油性具有显著性差异(P<0.05),纯化前后核桃粕蛋白的吸水性分别为2.73、3.06 g/g,纯化前后核桃粕蛋白吸油性分别为2.90、3.15 g/g。这说明纯化后的核桃粕蛋白的吸水性和吸油性有所提高。

图20 核桃粕蛋白的吸水性和吸油性Fig.20 Water and oil absorption of walnut meal protein
2.5.3 核桃粕蛋白起泡性及泡沫稳定性 pH对核桃粕蛋白的起泡性及泡沫稳定性的影响如图21,核桃粕蛋白的起泡性随pH升高,先减少后增大,在pH4.5,纯化前和纯化后的核桃粕蛋白的起泡性最差,分别为5.63%、8.36%。偏离pH4.5,起泡性逐渐提高,pH7时,其起泡性分别为25.51%、30.53%。因为当蛋白偏离等电点时,带电数增多,蛋白质分子之间相互排斥,而蛋白质与水的相互作用增强,造成了溶解性变大,有助于泡沫的形成[40]。pH12时,核桃粕蛋白起泡性有最大值,分别为38.98%、51.76%。
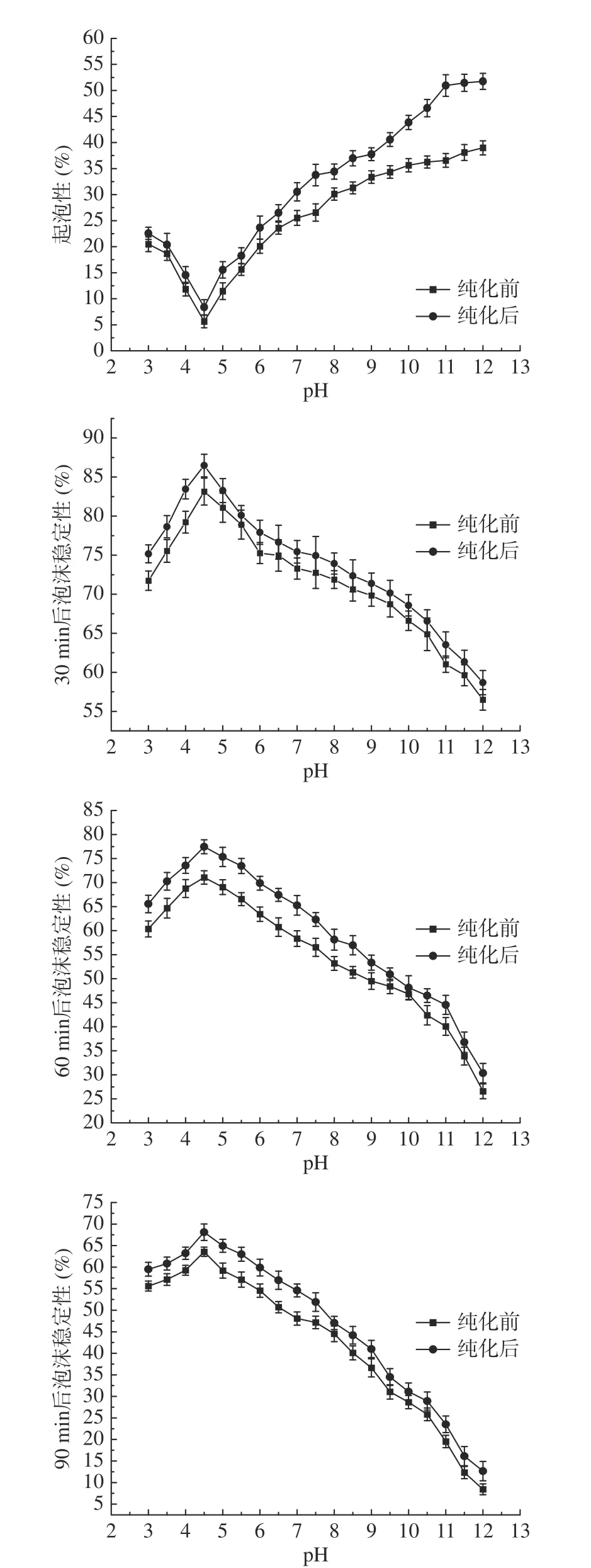
图21 pH对核桃粕蛋白起泡性及起泡稳定性的影响Fig.21 Effect of pH on the foamability and foaming stability of walnut meal protein
30 min后,在pH4.5下核桃粕蛋白的泡沫稳定性良好,远离pH4.5时,其泡沫稳定性变差,pH7时其起泡稳定性分别为73.28%、75.44%,pH12时其泡沫最不稳定。这是因为远离等电点,蛋白质分子间的相互作用减弱,影响了泡沫蛋白膜的压力,导致泡沫体系失稳[41]。且随静置时间的增加,核桃粕蛋白的泡沫稳定性持续下降,因为随时间的增加,核桃粕蛋白溶解的量变多,减少了蛋白质分子间相互作用,造成了其泡沫稳定性变差。在同一条件下,核桃粕蛋白在纯化后的起泡性和泡沫稳定性显著大于纯化前(P<0.05)。因为蛋白质纯度有所增加,纯度较高的蛋白质更易形成多层且强度大的蛋白膜,可承受更大的压力,同时也增大体系的黏度。因此,核桃粕蛋白经过纯化后,其起泡性和泡沫稳定性得到显著性改善。
2.5.4 核桃粕蛋白乳化性及乳化稳定性 pH对核桃粕蛋白乳化性和乳化稳定性的影响如图22所示,随pH增大,核桃粕蛋白的乳化性和乳化稳定性的变化在图中表现为的“V”型,即先降低后增大与其溶解性变化的趋势相似。核桃粕蛋白的乳化性及乳化稳定性在pH4.5处最差,纯化前的核桃粕蛋白的乳化性为2.44 m2/g,乳化稳定性为14.33 min。纯化后的核桃粕蛋白的乳化性为3.85 m2/g,乳化稳定性为19.95 min。pH7时其纯化前后乳化性分别为10.00、16.10 m2/g。乳化稳定性分别为33.31、38.87 min。在pH12时核桃粕蛋白乳化性及乳化稳定性最好,未纯化核桃粕蛋白的乳化性为57.82 m2/g,乳化稳定性为54.97 min。纯化后的核桃粕蛋白的乳化性为66.66 m2/g,乳化稳定性为59.19 min。这是因为,蛋白质中含有脂溶性残基和水溶性残基,在O/W的界面中,脂溶性残基朝向油相,水溶性残基朝向水相,进而减少了界面的表面张力[42]。
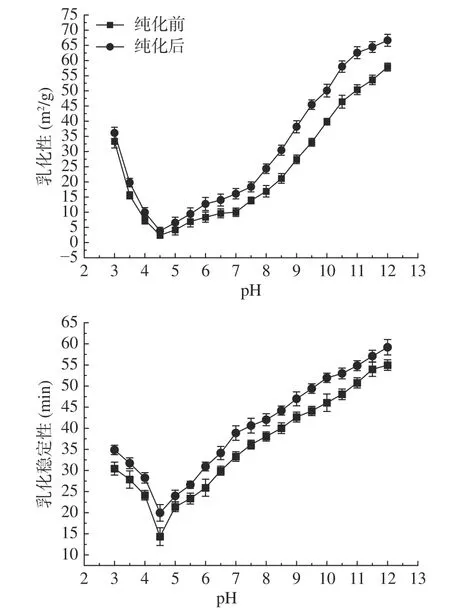
图22 pH对核桃粕蛋白乳化性及乳化稳定性的影响Fig.22 Effects of pH on the emulsification and emulsification stability of walnut meal protein
在pH4.5时,核桃粕蛋白溶解性小,导致存在过高的表面疏水性,影响蛋白质在油滴表面的排列[43],吸附在O/W界面上的蛋白少,O/W界面张力大,从而导致乳化性差。当核桃粕蛋白溶解性升高,其在O/W界面上接触面变大,吸附在O/W界面上的蛋白增多,促进了油相和水相的相互作用,O/W界面张力小,乳化性好。乳化稳定性是指的是乳液在不发生聚结、絮凝和乳状化的情况下保持分散的能力。由于蛋白在向等电点靠近时,其静电斥力不断降低,影响油滴颗粒的稳定排列,使油滴容易聚结或聚集,导致乳化稳定性下降[44]。在同一条件下,未纯化的核桃粕蛋白和纯化后的核桃粕蛋白的乳化性及乳化稳定性有显著差异(P<0.05),经过纯化的核桃粕蛋白的乳化性及乳化稳定性得到了提高。
3 结论
以核桃粕作为实验原料,利用碱溶酸沉法和酶解法制备纯度高的核桃粕蛋白。通过响应面法优化并验证得到了最佳提取工艺条件为pH12,温度55 ℃,时间90 min,料液比1:40 g/mL,且它的沉降点是pH4.5。在此条件下,核桃粕蛋白的提取率可达到81.89%±1.64%。利用糖化酶纯化核桃粕蛋白以提高蛋白纯度,通过响应面法优化并验证得到最佳纯化工艺条件为pH4.5,料液比1:40 g/mL,酶解时间128 min,酶解温度53 ℃,加酶量0.4%。经此条件纯化的核桃粕蛋白的纯度可达到94.48%±1.83%。经过糖化酶纯化的核桃粕蛋白的纯度得到提高,达到了分离蛋白的标准。通过比较纯化前后的两种核桃粕蛋白的性质,纯化后的核桃粕蛋白的溶解性及乳化稳定性均得到显著性提高,特别是在中性条件下,其溶解度为24.82%,吸水性为3.06 g/g,吸油性为3.15 g/g,乳化性为16.10 m2/g,乳化稳定性为38.87 min,起泡性为30.53%,起泡稳定性为75.44%。本文仅对核桃蛋白的提取纯化条件及简单的功能性质进行了研究,该方法对于核桃蛋白其他性质的影响尚需进一步的研究。希望本研究可以为核桃粕蛋白的高值化利用提供一定的技术参考价值和借鉴。
