视网膜内质网应激免疫组织化学抗体浓度选择的实验研究
2023-01-13陈小红梁婉娇黄诗舒池昭晟陈梅珠王云鹏严伟明
陈小红,梁婉娇,黄诗舒,孙 晏,罗 欣,赖 璐,池昭晟,陈梅珠,王云鹏,严伟明
0 引言
应用已知抗体和抗原发生特异性结合,并通过化学反应使标记在结合后的特异性抗体上的显色剂(如荧光素、酶、金属离子和核素)显色,以确定组织细胞内抗原的存在,对其进行定位、定性及半定量研究,称为免疫组织化学(immunohistochemistry,IHC)[1]。目前广泛应用于肿瘤疾病、感染疾病及药物靶向治疗等方面[2]。
内质网应激(endoplasmic reticulum stress,ERS)反应主要包括三种通路,即肌醇需要酶1(inositol-requiring protein-1,IRE1)通路、转录激活因子6(activating transcription factor-6,ATF6)通路、蛋白激酶样内质网激酶(PKR-related ER kinase,PERK)通路。当发生ERS时,其上、下游多种相关信号分子亦发生相应的改变,本研究选用葡萄糖调剂蛋白78(glucose regulated protein 78,GRP78)、含半胱氨酸的天冬氨酸蛋白水解酶12(cysteinyl aspartate specific proteinase 12,Caspase-12)作为反应ERS的上、下游分子的检测指标。
近年研究发现,多种视网膜色素变性(retinitis pigmentosa,RP)模型中内质网有异常蛋白堆积,有相应ERS反应发生[3-5];目前在RP动物模型的构建中,N-甲基-N-亚硝基脲(N-methyl-N-nitrosourea,MNU)诱导的RP模型已被广泛报道[6-8]。IHC亦应用于ERS通道研究[9-13],但其在ERS通道相关抗体使用浓度缺乏统一标准,且因实验标本不同,根据抗体说明书建议稀释比例进行IHC,其结果可能过强或较弱。因此,本研究选用MNU诱导的小鼠RP模型,应用IHC技术检测其视网膜ERS反应通路,探讨IRE1、ATF6、PERK、GRP78、Caspase-12抗体的最佳使用浓度,以期为研究RP发病机制及干预措施提供相应指标的检测方法。
1材料和方法
1.1材料
1.1.1实验动物清洁级、健康雄性C57BL/6J小鼠[上海昇敞生物科技有限公司,SCXK(沪)2021-0002],6~8周龄,体质量16~20g。于室温22℃~25℃、明暗交替12h/12h的环境中适应性饲养14d,食水不限。实验动物的使用遵循视觉与眼科研究协会(Association for Research in Vision and Ophthalmology,ARVO)相关规定,并通过伦理审查(2021-001)。
1.1.2主要试剂与器材戊巴比妥钠溶液(上海行知化工厂,1%体积质量比);盐酸赛拉嗪注射液[商品名:陆眠宁,吉林省华牧动物保健品有限公司;规格:2mL∶0.2g;批号:兽药字(2015)070011777];N-甲基-N-亚硝基脲(MNU,上海阿拉丁生化科技股份有限公司,N136701-1g),4℃环境储存于惰性气体中,使用前立即溶解于含0.05%醋酸的盐水中;粉剂型抗原修复液(柠檬酸法)(福州迈新生物技术开发有限公司,MVS-0066);抗体稀释液(北京中杉金桥生物技术有限公司,ZLI-9030);小鼠二步法检测试剂盒(北京中杉金桥生物技术有限公司,PV-9002);兔二步法检测试剂盒(北京中杉金桥生物技术有限公司,PV-9001);Anti-IRE1抗体(美国abcam,ab37073);Anti-ATF6抗体(美国abcam,ab203119);PERK抗体(B-5)(美国santa cruz,sc-377400);BiP(C50B12) Rabbit mAb(GRP78)(美国Cell Signaling Technology,3177S);Caspase-12抗体(1611)(美国santa cruz,sc-21747)。电子天平(赛多利斯科学仪器(北京)有限公司,SECURA124-1CN);组织包埋机(LEICA,EG1150);自动脱水机(LEICA,ASP300S);石蜡切片机(LEICA,RM2245);隔水式恒温培养箱(上海一恒科技有限公司,GHP-9080);光学显微镜(OLYMPUS,BX53)。
1.2方法
1.2.1动物造模取8只C57BL/6J小鼠,采用随机分组法分为正常组(N)和造模组(M),每组4只,分别腹腔注射生理盐水和60mg/kg MNU[14],造模后第7d时分别对小鼠进行视网膜电图(electroretinogram,ERG)检测及摘取小鼠眼球行苏木精-伊红(HE)染色组织切片,以观察到ERG呈熄灭型、HE染色组织切片上视网膜外核层感光细胞消失为小鼠RP模型造模成功。
1.2.2ERG检测完全暗适应2h以上,采用戊巴比妥钠(0.3mL/100g)和盐酸赛拉嗪注射液(0.01mL)联合腹腔注射麻醉小鼠,复方托吡卡胺滴眼液点眼散瞳,安装电极(记录电极置于小鼠右眼角膜中央,参考电极置于小鼠同侧颊部,接地电极插于小鼠尾部皮下)。固定小鼠于Ganzfeld刺激器前,运用RETI-SCAN视觉电生理检查系统(德国Roland Consult公司)进行国际临床视觉电生理学会(International Society for Clinical Electrophysiology of Vision,ISCEV)ERG五项检测,包括暗适应0.01反应、暗适应3.0反应、暗适应Ops波反应、明适应3.0反应、明适应Flicker反应(明适应反应检测前进行10min标准光强明适应)[15]。
1.2.3组织切片制作ERG检查结束后,注射大剂量戊巴比妥钠溶液使小鼠死亡,立即摘取右侧眼球,置于混合固定液(冰乙酸、甲醛、生理盐水、75%乙醇按1∶2∶7∶10比例配制)中2h后,用注射器在眼球角膜中央扎一小孔,放回固定液中继续固定24h[16]。将固定24h后的眼球置于自动脱水机中,经梯度脱水、二甲苯透明、浸蜡后制成石蜡标本。在组织包埋机上,按瞳孔-晶状体-视神经轴方向固定眼球,进行包埋,待石蜡凝聚成块后,在旋转石蜡切片机上,每个眼球沿瞳孔-视神经轴方向切片,取经视神经连续6张切片,厚度为4μm,摊片、捞片。
1.2.4HE染色组织切片在烤片机上70℃烤片20min,脱蜡至水、HE染色后树脂封片。光学显微镜下观察小鼠眼球组织切片结构。
1.2.5IHC染色将恒温水箱70℃烤片1h的切片经脱蜡、复水、抗原修复后,3% H2O2中室温封闭10min,PBS冲洗后,滴加一抗(阴性对照用PBS代替一抗,根据说明书及目前相关研究报道,按以下浓度稀释抗体:IRE1 1∶125、1∶250、1∶500、1∶1000、1∶2000;ATF6 1∶100[17]、1∶250、1∶500、1∶1000[18]、1∶2000;PERK 1∶100[19-20]、1∶500、1∶1000、1∶1500;GRP78 1∶100[21-22]、1∶200[23-24]、1∶500[25];Caspase-12 1∶100[26]、1∶500、1∶1000),37℃孵育1h;PBS冲洗后,37℃环境先后滴加增强剂、二抗,各孵育20min;DAB显色剂显色,苏木精复染,乙醇脱水透明封片。光学显微镜下观察,并于视乳头旁500μm处拍摄高倍镜(40×10)视野照片,通过图像分析软件Image J对视网膜内质网应激蛋白染色阳性信号进行定量分析。

2 结果
2.1RP小鼠模型造模情况腹腔注射给药后第7d时,正常组小鼠视网膜各层组织结构排列整齐,未见明显变化,ERG暗、明适应3.0反应均可见b波;而造模组小鼠视网膜外核层细胞基本消失,且ERG暗、明适应3.0反应的b波均消失,ERG波形大致呈熄灭型,表明小鼠RP模型建立成功(图1)。

图1 正常组和造模组小鼠视网膜形态与功能检测结果 A:HE染色显示正常组小鼠视网膜各层形态结构正常(绿色箭头示视网膜外核层);B:HE染色显示造模组小鼠视网膜外核层细胞凋亡(红色箭头示视网膜外核层);C:正常组小鼠造模后第7d ERG暗、明适应3.0反应均可见b波振幅的代表性波形(绿色箭头示b波位置);D:造模组小鼠造模后第7d ERG暗、明适应3.0反应均可见b波振幅消失的代表性波形(红色箭头示b波位置)。RPE:视网膜色素上皮层;OS:外节;IS:内节;ONL:外核层;OPL:外丛状层;INL:内核层;IPL:内丛状层;GCL:神经节细胞层。
2.2RP小鼠视网膜ERS相关蛋白IHC染色
2.2.1RP小鼠视网膜IRE1蛋白IHC染色结果IHC染色结果显示,IRE1抗体浓度为1∶125、1∶250、1∶500时,全视网膜(包括细胞核、细胞浆)均呈棕色;IRE1抗体浓度为1∶1000、1∶2000时,视网膜神经节细胞层中神经节细胞呈阳性表达,内核层部分细胞呈阳性表达,外核层细胞呈绕核阳性表达,其余视网膜结构层均呈淡棕色,见图2A。
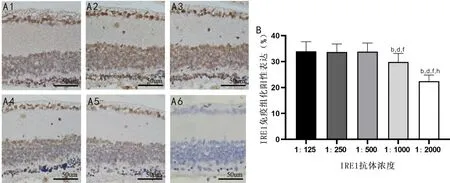
图2 RP小鼠视网膜不同浓度IRE1抗体IHC染色结果 A:IRE1不同抗体浓度IHC染色典型图,A1:1∶125;A2:1∶250;A3:1∶500;A4:1∶1000;A5:1∶2000;A6:阴性对照。B:定量分析各抗体浓度IHC染色阳性表达结果,bP<0.01 vs IRE1抗体浓度1∶125;dP<0.01 vs IRE1抗体浓度1∶250;fP<0.01 vs IRE1抗体浓度1∶500;hP<0.01 vs IRE1抗体浓度1∶1000。
IRE1抗体浓度为1∶125、1∶250、1∶500、1∶1000、1∶2000时,RP小鼠视网膜IRE1阳性表达分别为(32.93±3.44)%、(34.33±2.59)%、(33.56±2.63)%、(29.89±2.77)%、(21.90±2.39)%,差异有统计学意义(F=54.996,P<0.001),其中除IRE1抗体浓度为1∶125、1∶250、1∶500时,IRE1蛋白阳性表达两两比较差异无统计学意义(均P>0.05),其余抗体浓度IRE1蛋白阳性表达两两比较差异均有统计学意义(P<0.01),见图2B。
2.2.2RP小鼠视网膜ATF6蛋白IHC染色结果IHC染色结果显示,视网膜内节层至神经节细胞层均可见阳性表达,其中神经节细胞层、内核层、外核层为核周表达,神经节细胞层、内核层中少数细胞呈阳性表达,且表达强度随ATF6抗体稀释倍数增加而减弱,见图3A。ATF6抗体浓度为1∶100、1∶250、1∶500、1∶1000、1∶2000时,RP小鼠视网膜ATF6蛋白阳性表达分别为(33.47±2.96)%、(32.48±1.30)%、(25.27±1.07)%、(25.42±2.14)%、(13.02±1.98)%,差异有统计学意义(F=348.948,P<0.001),其中除ATF6抗体浓度为1∶100、1∶250时和ATF6抗体浓度为1∶500、1∶1000时,ATF6蛋白阳性表达差异均无统计学意义(P>0.05),其余抗体浓度ATF6蛋白阳性表达两两比较差异均有统计学意义(P<0.01),见图3B。
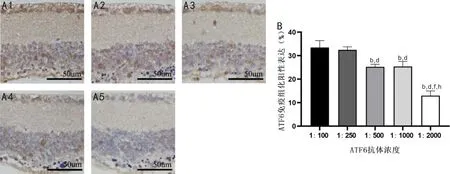
图3 RP小鼠视网膜不同浓度ATF6抗体IHC染色结果 A:ATF6不同抗体浓度IHC染色典型图,A1:1∶100;A2:1∶250;A3:1∶500;A4:1∶1000;A5:1∶2000。B:定量分析各抗体浓度IHC染色阳性表达结果,bP<0.01 vs ATF6抗体浓度1∶100;dP<0.01 vs ATF6抗体浓度1∶250;fP<0.01 vs ATF6抗体浓度1∶500;hP<0.01 vs ATF6抗体浓度1∶1000。
2.2.3RP小鼠视网膜PERK蛋白IHC染色结果IHC染色结果显示,PERK抗体浓度为1∶100时,全视网膜呈强阳性表达,PERK抗体浓度为1∶500、1∶1000、1∶1500时,除神经节细胞层、内核层及外核层的细胞核外,其余视网膜结构均呈阳性表达,见图4A。PERK抗体浓度为1∶100、1∶500、1∶1000、1∶1500时,PERK蛋白阳性表达分别为(68.03±6.84)%、(38.51±3.91)%、(39.18±5.78)%、(31.90±5.76)%,差异有统计学意义(F=153.712,P<0.001),其中除PERK抗体浓度为1∶500、1∶1000时,PERK蛋白阳性表达差异无统计学意义(P>0.05),其余抗体浓度PERK蛋白阳性表达两两比较差异均有统计学意义(P<0.01),见图4B。
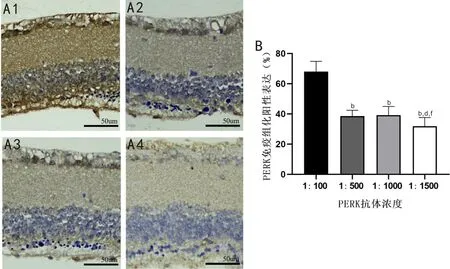
图4 RP小鼠视网膜不同浓度PERK抗体IHC染色结果 A:PERK不同抗体浓度IHC染色典型图,A1:1∶100;A2:1∶500;A3:1∶1000;A4:1∶1500。B:定量分析各抗体浓度IHC染色阳性表达结果,bP<0.01 vs PERK抗体浓度1∶100;dP<0.01 vs PERK抗体浓度1∶500;fP<0.01 vs PERK抗体浓度1∶1000。
2.2.4RP小鼠视网膜GRP78蛋白IHC染色结果IHC染色结果显示,视网膜神经节细胞层、内核层表现为绕核阳性表达,其中神经节细胞层少数细胞呈阳性反应,内核层及外核层个别细胞呈阳性反应,且随抗体稀释倍数增加阳性表达减弱,见图5A。GRP78抗体浓度为1∶100、1∶200、1∶500时,RP小鼠视网膜GRP78蛋白阳性表达分别为(15.32±3.57)%、(12.75±2.35)%、(10.75±2.78)%,差异有统计学意义(F=12.740,P<0.001),且两两比较差异均有统计学意义(P<0.05),见图5B。

图5 RP小鼠视网膜不同浓度GRP78抗体IHC染色结果 A:GRP78不同抗体浓度IHC染色典型图,A1:1∶100;A2:1∶200;A3:1∶500。B:定量分析各抗体浓度IHC染色阳性表达结果,bP<0.01 vs GRP78抗体浓度1∶100;cP<0.05 vs GRP78抗体浓度1∶200。
2.2.5RP小鼠视网膜Caspase-12蛋白IHC染色结果IHC染色结果显示,除视网膜神经节细胞层、内核层及外核层细胞核外,其余视网膜结构均呈阳性表达,见图6A。Caspase-12抗体浓度为1∶100、1∶500、1∶1000时,RP小鼠视网膜Caspase-12蛋白阳性表达分别为(24.24±4.30)%、(14.26±2.21)%、(12.26±1.46)%,差异有统计学意义(F=96.978,P<0.001),且两两比较差异均有统计学意义(P<0.05),见图6B。
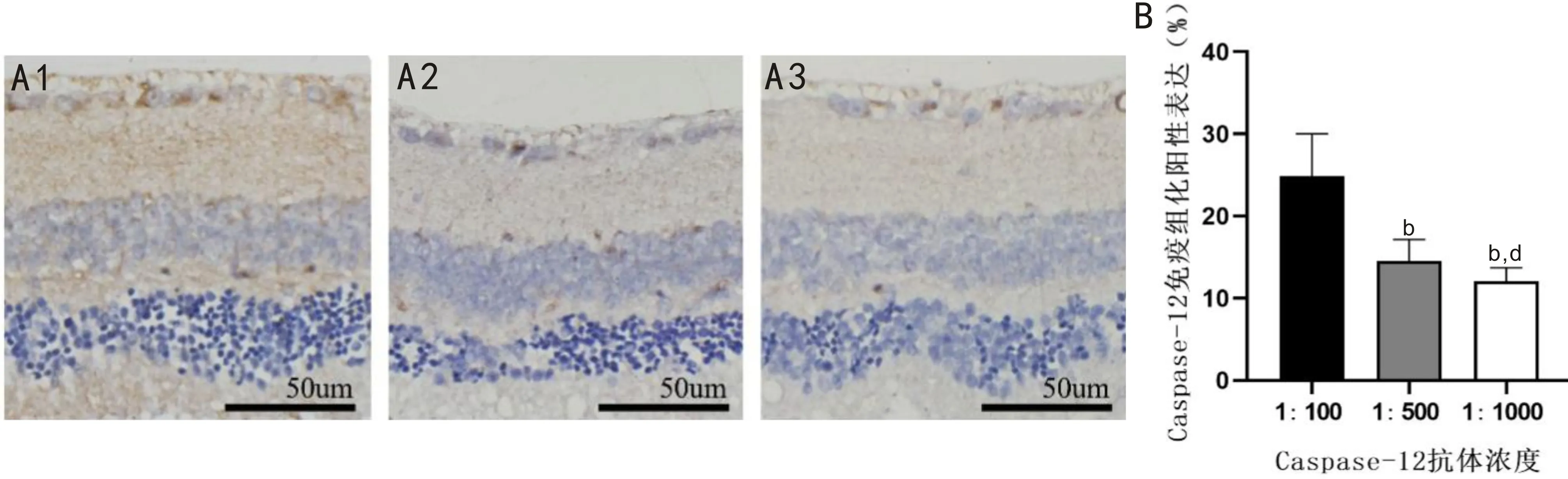
图6 RP小鼠视网膜不同浓度Caspase-12抗体IHC染色结果 A:Caspase-12不同抗体浓度IHC染色典型图,A1:1∶100;A2:1∶500;A3:1∶1000。B:定量分析各抗体浓度IHC染色阳性表达结果,bP<0.01 vs Caspase-12抗体浓度1∶100;dP<0.01 vs Caspase-12抗体浓度1∶500。
3 讨论
IHC染色通过已知一抗及相应二抗与特定目标分子反应,再通过酶标抗体染色法,使目标分子在普通显微镜下即可直接观察其分布情况。目前RP相关研究中,常使用免疫荧光染色技术(IF)进行亚细胞器定位;然而IF染色信号需通过荧光显微镜或共聚焦显微镜显现,技术要求相对较高[27]。内质网是细胞内细胞器的一种,负责细胞内多种蛋白的折叠、加工。ERS是由于正常内质网的内环境受到多种因素刺激后导致蛋白折叠异常、堆积,最终引起细胞功能紊乱,甚至引起细胞凋亡,造成相应疾病的产生,其中包括RP。运用IHC技术检测ERS通道相关蛋白,包括ATF6、PERK、IRE1、GRP78、Caspase-12,根据其阳性反应强度变化,可大致判断ERS三条通路在RP中的参与程度,探索其发病机制,具有简单可行性。
然而,目前关于应用IHC研究ERS相关蛋白的抗体浓度及染色方法未见详细统一报道。Crespo等[28]于2012年探索谷氨酰胺对实验性炎性肠病大鼠ERS和细胞凋亡的影响,对结肠标本行IHC染色时,使GRP78抗体与标本4℃孵育过夜,未明确提及抗体稀释比例。Liu等[29]在2015年研究氟中毒成骨细胞ERS反应时,应用IHC检测氟暴露Wistar大鼠骨组织,其中GRP78、Caspase-12抗体稀释比例为1∶100。2016年,Guo等[23]研究ERS是否参与镍肾毒性机制时,应用稀释比例为1∶200的GRP78抗体与氯化镍(NiCl2)激活的肉仔鸡肾脏组织在4℃孵育过夜。Hirai等[30]于2018年研究ER在麻风病发病机制中的意义,对麻风病患者标本进行IHC检测,其中GRP78、PERK、IRE1α和ATF6抗体按1∶100比例稀释,孵育时间为14h。2020年,Samanta等[31]研究ERS与卵巢癌的相关性时,采用IHC染色检测患者标本时,GRP78、PERK、ATF6抗体孵育30~60min,未明确提及稀释比例。
不同疾病模型中,ERS反应参与程度不同,且实验组织标本各异,因此若简单根据抗体说明书提供的IHC抗体稀释比例及抗体孵育时间或不同疾病、组织的相关研究数据进行实验,最终IHC染色结果差异较大,未能达到实验者所需的最适阳性表达。目前尚无IHC应用于视网膜ERS反应相关指标的详细研究报道,而本研究前期预实验发现ATF6、PERK抗体单纯根据说明书建议的稀释比例进行IHC染色,均未能得到较满意的IHC染色结果。因此,本研究针对RP小鼠模型,将ERS通路中的相关抗体根据说明书及在现有相关研究的基础上,各设置3个及以上稀释浓度,孵育时间均为1h,以便后期根据其阳性表达程度,选择合适的抗体浓度检测相应指标。结果发现,IRE1、ATF6、PERK、GRP78、Caspase-12不同抗体浓度均可在视网膜呈阳性表达,但其强弱程度不同。IRE1抗体浓度为1∶125、1∶250、1∶500时IRE1蛋白阳性表达无区别,且均呈强阳性,IRE1抗体浓度为1∶1000时阳性表达较适宜,IRE1抗体浓度1∶2000时内核层阳性表达明显减弱,这与麻风病组织IHC染色时所使用的1∶100 IRE1抗体孵育14h具有明显差异[30]。ATF6抗体浓度为1∶100和1∶250时其蛋白阳性表达在视网膜各层结构均较强、无法区别,ATF6抗体浓度为1∶500和1∶1000时ATF6蛋白阳性表达适宜,ATF6抗体浓度为1∶2000时其阳性表达在神经节细胞层、内核层、外核层均不显著,而麻风病组织IHC染色时采用1∶100 ATF6抗体孵育14h[30],卵巢癌组织ATF6抗体(未说明抗体浓度)IHC染色一抗孵育时间为30~60min[31],均与本研究不同。PERK抗体各浓度阳性表达均较强,PERK抗体浓度为1∶1500时其目标蛋白阳性表达仍较适宜,本研究中1∶1500的PERK抗体稀释比例远远低于麻风病组织所使用的1∶100 PERK抗体稀释浓度,且孵育时间明显缩短[30]。GRP78抗体浓度为1∶200时,其在RP小鼠视网膜神经节细胞层中与内核层中绕核阳性表达清晰、强度适宜,目前已有的相关研究中,GRP78较常用的稀释比例为1∶100[28,31],亦可见1∶200的抗体稀释比例[23],但其一抗孵育时间均远大于本研究抗体孵育时间。Caspase-12抗体浓度为1∶100时,在视网膜阳性表达较强,Caspase-12抗体浓度为1∶500、1∶1000时,Caspase-12蛋白阳性表达不明显,这与氟中毒成骨细胞ERS反应的相关研究所使用的抗体浓度相符[29]。
本研究结果表明,小鼠RP模型视网膜ERS通路相关抗体IRE1抗体浓度为1∶1000、ATF6抗体浓度为1∶500和1∶1000、PERK抗体浓度为1∶1500、GRP78抗体浓度为1∶200、Caspase-12抗体浓度为1∶100,一抗孵育时间为1h时,均可获得阳性表达强度较适宜的IHC检测结果,可在一定范围内作为后续研究RP中ERS发病机制及干预措施疗效提供具体指标检测参考。未来将在本研究基础上扩大实验动物数量、进一步探索MNU诱导的RP小鼠发病过程中视网膜ERS反应通路中各通路参与其发病机制的情况。
