不同浓度阿托品滴眼液控制儿童青少年近视进展的Meta分析
2023-01-13李松玉杨迎新杨自逸薛雨辛冯晶华
李松玉,杨迎新,杨 潮,杨自逸,薛雨辛,冯晶华
0 引言
近视是世界上最常见的屈光不正类型,也是目前备受关注的公共卫生健康问题。据估计,到2050年49.8%的世界人口(约47.6亿人)将近视[1]。据调查,我国2018年儿童青少年总体近视率为53.6%。其中,6岁儿童近视率14.5%,到了高中时期,近视率将高达81.0%[2]。由于近视所引起的视网膜、脉络膜和巩膜的病理变化,严重的近视可能伴随着不可逆的视力损伤和失明的风险[3]。阿托品是一种毒蕈碱型受体(M受体)拮抗药,目前已有研究表明,不同浓度的阿托品滴眼液延缓儿童青少年近视进展的效果可观,对于控制屈光度及眼轴长度的进展也有一定的作用[4-7]。目前已有阿托品控制儿童近视进展的Meta分析研究[8-9],但仍需进一步研究不同浓度阿托品滴眼液对于眼轴长度变化及屈光度变化。本文将通过Meta分析的方法,研究儿童青少年应用不同浓度阿托品滴眼液后眼轴长度及屈光度的变化。
1 对象和方法
1.1对象搜集PubMed、the Cochrane Library、Embase、中国知网、维普和万方数据库内建库至2022-05阿托品滴眼液治疗儿童青少年近视的临床研究文献。检索语言为中文或英文:英文检索词包括 atropine, hyoscyamine, myopia, diopter, ametropia, axial。中文关键词包括阿托品、近视、眼轴、屈光度;适当调整检索词,根据已发表的文章补充纳入相关文献。纳入标准:(1)受试者符合《眼科学》(第3版)中近视性屈光不正的诊断;(2)受试者年龄≤16岁;(3)数据来自随机临床试验(RCT)或观察性研究;(4)研究中包括非阿托品滴眼液治疗的对照组;(5)结局指标为干预前后眼轴长度及变化值、眼屈光度及变化值;(6)对受试者进行至少12mo的随访。排除标准:(1)无法提取完整数据资料的;(2)在观察期间,受试者应用多种阿托品滴眼液;(3)受试者接受阿托品和其他近视控制治疗方法的联合治疗;(4)重复发表的文献。
1.2方法
1.2.1文献筛选及资料提取所有文献筛选与资料提取均由2名研究员独立完成,并交叉核对;当意见不一致时,则与第 3名研究员讨论并得出结果;文献相关资料提取完成后录入自制的提取表中,提取内容见表1。
1.2.2纳入文献的偏倚风险评估采用《Cochrane干预措施系统评价手册》中针对RCT的偏倚风险评估工具评价。包括是否符合正确随机分组方法,分配隐藏是否充分,是否采用盲法,有无退出、失访及是否采用意向治疗分析、选择性报告结果、其他可能影响结果真实性的因素等,偏倚评价结果分为高风险偏倚、低风险偏倚和不确定风险偏倚。
1.2.3观测结局指标使用眼轴的平均变化和屈光度的平均变化作为主要结果。在所有的比较中,所述值代表了干预前后主要结果的差异。眼轴长度:负值表明干预效果更好(轴向伸长更小);屈光不正:正值表明干预效果更好(近视进展更少)。
统计学分析:采用Review Manager 5.4软件进行Meta分析,Stata 14.0软件进行Egger检验。计量治疗应用加权均数差(mean difference,MD)、二分类变量采用相对危险度(relative risk,RR)和95%可信区间(confidence intervals,CI)作为效应值指标,P<0.05表示差异具有统计学意义。对于研究间的异质性采用I2检验。若各研究结果间无统计学异质性(P≥0.05,I2≤50%),则采用固定效应模型进行Meta分析;若存在异质性(P<0.05,I2>50%),则采用随机效应模型进行Meta分析。通过逐一剔除法进行敏感性分析。依次剔除1篇文献,剩余文献(n-1篇)进行Meta分析合并,通过观察合并结果的变化情况,评估原Meta分析结果是否受某些研究的影响而发生显著变化,剔除可能的异质性来源,增加结果的稳健性。
2 结果
2.1文献筛选流程及结果初筛后得到共366篇文献,去重后剩余294篇。通过阅读标题与摘要排除272篇不相关文献。余下文献阅读全文,最终得到14篇[5, 7, 10-21]符合纳入标准的文献,共包括3946例儿童青少年受试者,年龄4~15岁、基线屈光度-0.50~-6.00D。受试者的干预措施为0.01%~1%的不同浓度阿托品滴眼液。文献筛选流程及结果见图1,表1。文献质量评估结果提示均有不同程度的偏倚风险情况,见图2、3。
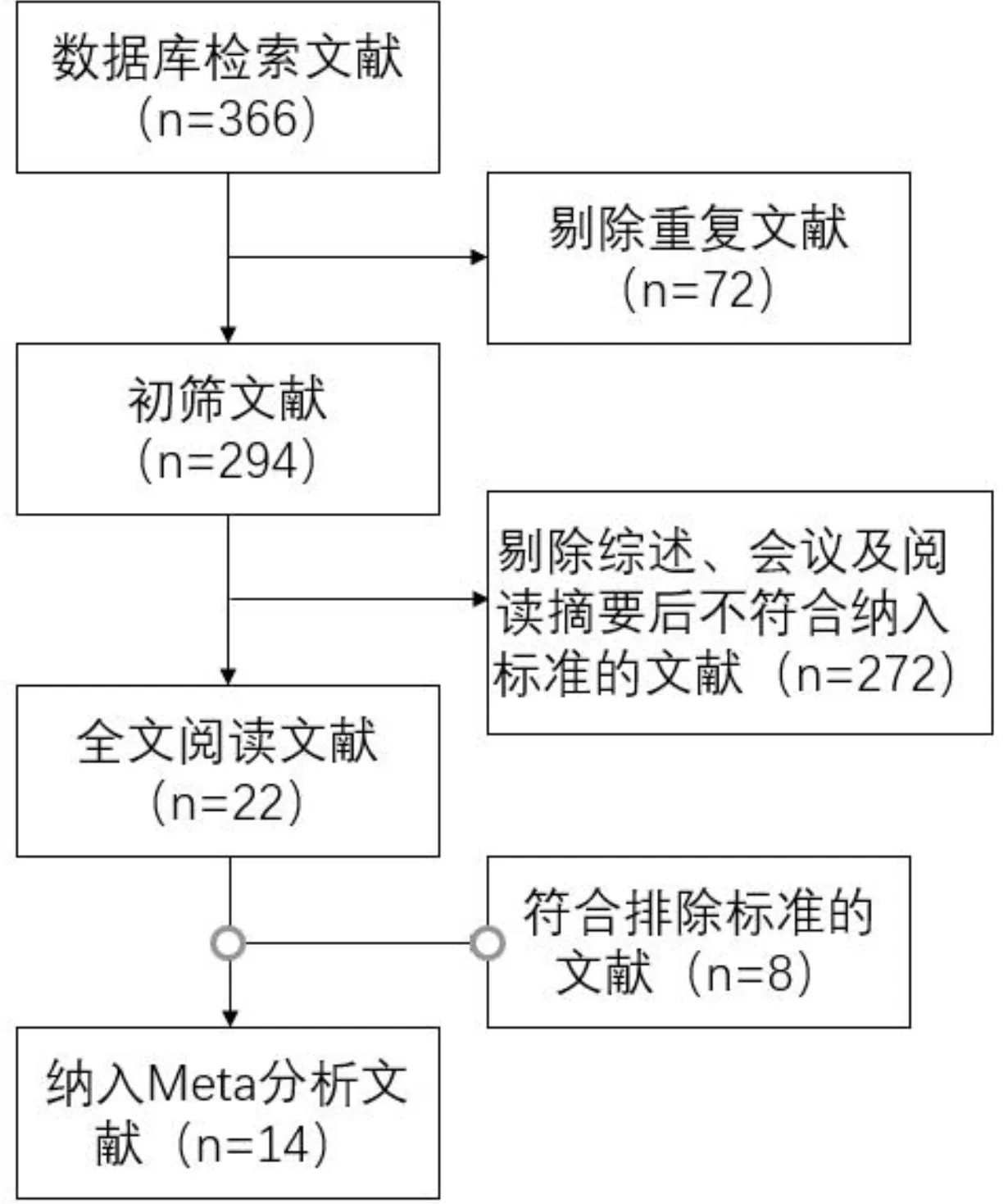
图1 文献筛选流程。
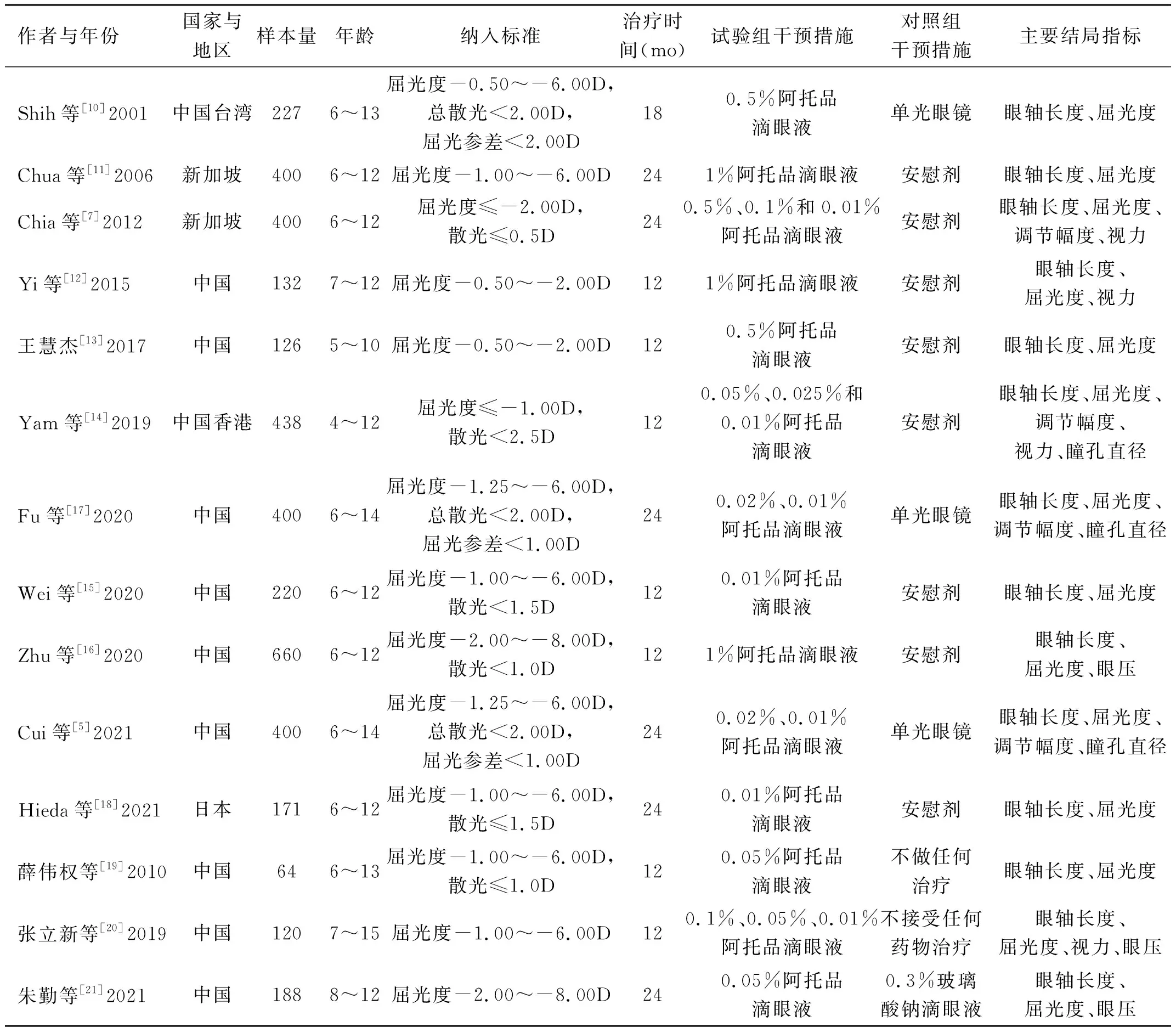
表1 纳入文献的一般资料
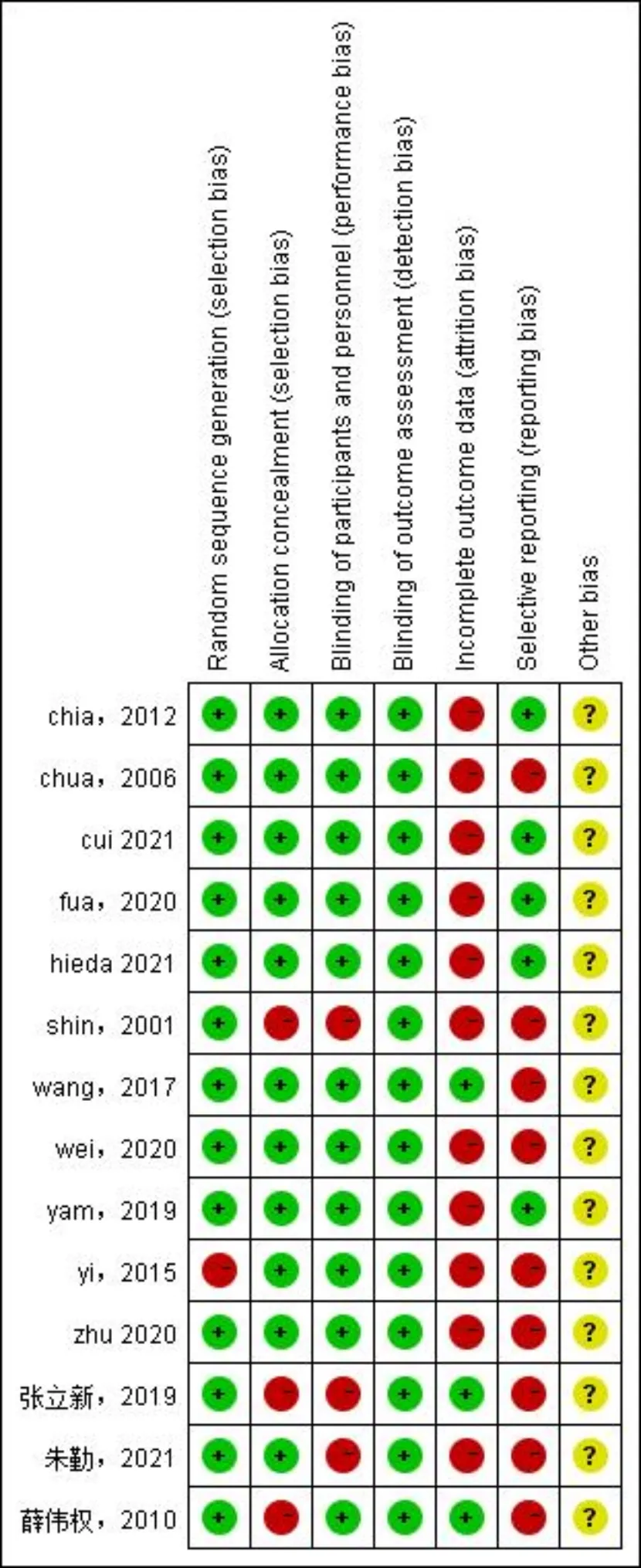
图2 各文献风险偏倚图。
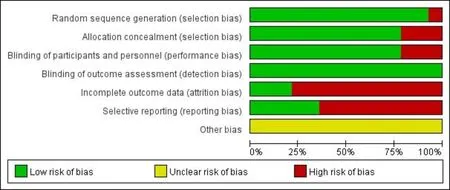
图3 文献偏倚总览图。
2.2Meta分析结果
2.2.1不同浓度阿托品滴眼液用药前后眼轴长度变化的Meta分析14篇[5, 7, 10-21]文献均以用药前后眼轴长度变化作为结局指标,Meta分析结果提示各不同浓度研究间存在异质性(P<0.00001,I2=90.5%),采用随机效应模型,提示阿托品滴眼液对眼轴长度进展方面优于对照组,差异有统计学意义(MD=-0.24,95%CI:-0.32~-0.16,P<0.00001)。1%、0.5%、0.05%、0.02%阿托品滴眼液亚组眼轴长度变化均变化小于对照组,差异均有统计学意义(MD=-0.34,95%CI:-0.39~-0.29,P<0.00001;MD=-0.51,95%CI:-0.79~-0.24,P=0.0003;MD=-0.17,95%CI:-0.30~-0.04,P=0.01;MD=-0.21,95%CI:-0.30~-0.11,P<0.0001);0.1%、0.01%阿托品滴眼液眼轴长度变化均变化小于对照组,但差异均无统计学意义(MD=-0.50,95%CI:-1.28~0.28,P=0.21;MD=-0.05,95%CI:-0.11~0.01,P=0.13)。以上六种不同浓度阿托品滴眼液的亚组间比较差异有统计学意义(P<0.0001),见图4。
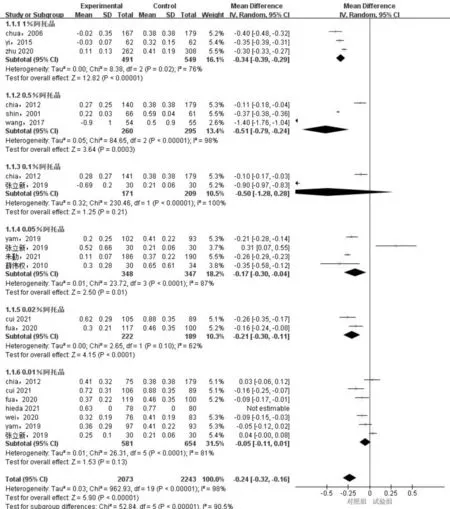
图4 不同浓度阿托品滴眼液用药前后眼轴长度变化的Meta分析结果。
2.2.2不同浓度阿托品滴眼液用药前后屈光度变化的Meta分析14篇[5, 7, 10-21]文献均以屈光度作为主要结局指标。Meta分析结果显示,研究间存在异质性(P<0.00001,I2=88.5%)。采用随机效应模型,提示阿托品滴眼液对控制屈光度发展优于对照组,差异有统计学意义(MD=0.36,95%CI:0.14~0.59,P=0.002)。1%、0.02%阿托品滴眼液亚组屈光度变化均变化小于对照组,差异均有统计学意义(MD=1.05,95%CI:0.91~1.19,P<0.00001;MD=0.42,95%CI:0.21~0.62,P<0.0001);0.5%、0.1%、0.05%、0.01%阿托品滴眼液屈光度变化均变化小于对照组,差异均无统计学意义(MD=0.37,95%CI:-0.15~0.90,P=0.17;MD=0.22,95%CI:-0.94~1.39,P=0.71;MD=0.06,95%CI:-0.51~0.63,P=0.83;MD=0.25,95%CI:-0.14~0.64,P=0.21)。以上六种不同浓度阿托品滴眼液的亚组间比较差异有统计学意义(P<0.0001),见图5。
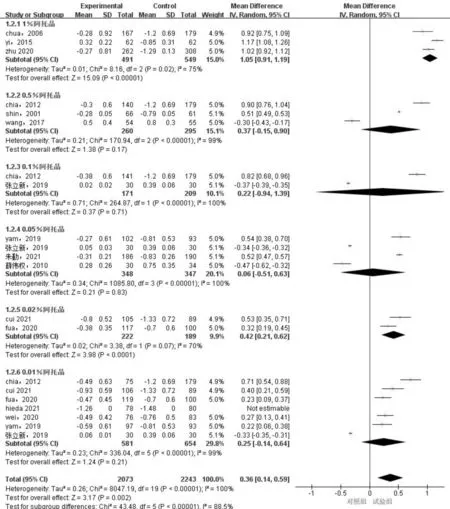
图5 不同浓度阿托品滴眼液用药前后屈光度变化的Meta分析结果。
2.2.3不同浓度阿托品滴眼液不良反应发生率的Meta分析纳入14篇[5, 7, 10-21]文献中,其中9篇[7, 11, 14-18, 20-21]文献记录了使用阿托品滴眼液后的不良反应,主要为畏光、近视力模糊、过敏性结膜炎等,未记录严重阿托品相关不良事件。Meta分析结果显示,各研究间存在异质性(P<0.0001,I2=77%),采用随机效应模型。阿托品滴眼液对不良反应发生率高于对照组,差异有统计学意义(RR=4.38,95%CI:1.54~12.47,P<0.0001),见图6。由于记录0.5%、0.1%、0.02%浓度阿托品滴眼液不良反应发生的文献少于2篇,暂不进行亚组分析,对文献记录多于2篇的浓度进行亚组分析。结果显示1%、0.05%、0.01%阿托品滴眼液亚组的不良反应发生率均高于对照组,差异均无统计学意义(RR=20.85,95%CI:0.12~3600.88,P=0.25;RR=7.58,95%CI:0.96~59.70,P=0.05;RR=1.77,95%CI:0.69~4.54,P=0.23)。不同浓度的不良反应发生率组间差异无统计学意义(P=0.32),见图7。

图6 不同浓度阿托品滴眼液不良反应发生率的Meta分析结果。

图7 不同浓度阿托品滴眼液不良反应发生率亚组分析的Meta分析结果。
2.2.4发表偏倚及敏感性分析采用逐一排除的方法进行敏感性分析,提示0.05%、0.01%阿托品滴眼液屈光度变化及0.01%阿托品滴眼液眼轴长度变化亚组较前统计学意义不同。剔除文献[5, 18]后,0.01%阿托品滴眼液亚组同质性较好(P=0.35,I2=9%),采用固定效应模型检验,结果显示0.01%阿托品滴眼液控制眼轴增长的效果优于对照组,差异有统计学意义(MD=-0.09,95%CI:-0.13~-0.05,P<0.0001),见图8。0.05%阿托品滴眼液亚组剔除文献[17-18]后,0.01%阿托品滴眼液亚组剔除文献[5, 18]后,同质性较好(P=0.81,I2=0%;P=0.47,I2=0%),采用固定效应模型,试验组屈光度变化均小于对照组,差异均有统计学意义(MD=0.52,95%CI:0.48~0.57,P<0.0001;MD=0.27,95%CI:0.19~0.35,P<0.0001),见图9、10。其余亚组结局指标在剔除文献前后统计学意义基本一致,提示以上亚组的结果具有良好的稳定性。异质性来源可能是由于以下几方面所致:(1)已纳入的文献存在偏倚风险;(2)各文献间基线数据不同;(3)研究地区不同;(4)阿托品滴眼液的使用频次不同;(5)各文献中对照组处理的不同。经Egger检验后,眼轴长度变化(P=0.10)及屈光度变化(P=0.17)发表偏倚不具备统计学意义,考虑发表偏倚可能小。

图8 敏感性分析后0.01%阿托品滴眼液干预后眼轴长度变化的Meta分析结果。
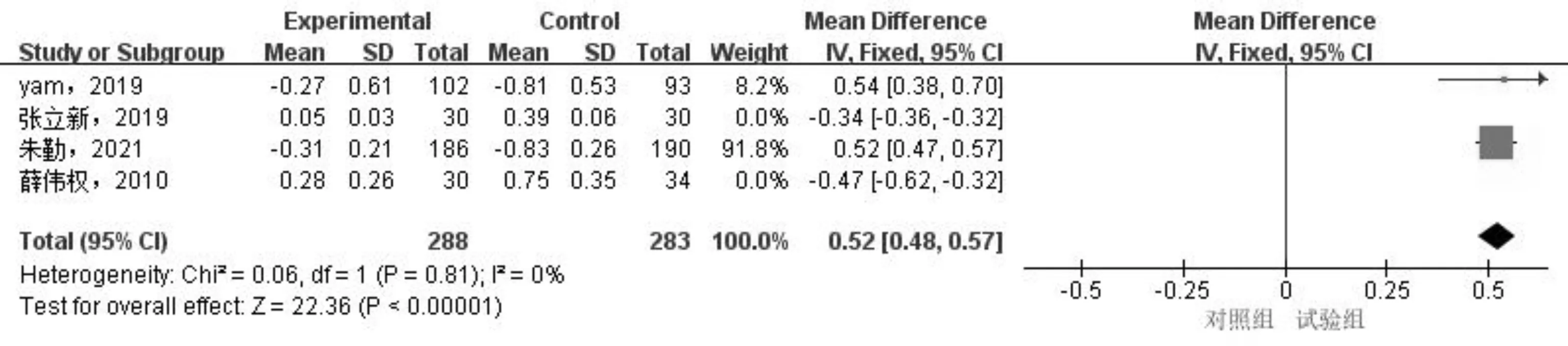
图9 敏感性分析后0.05%阿托品滴眼液干预后屈光度变化的Meta分析结果。
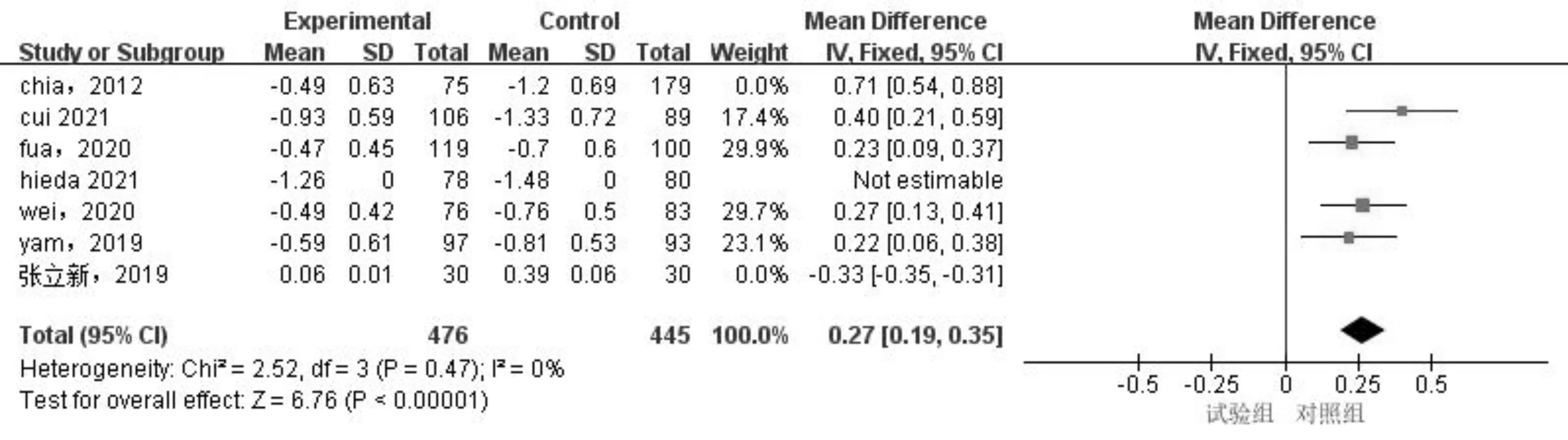
图10 敏感性分析后0.01%阿托品滴眼液干预后屈光度变化的Meta分析结果。
3 讨论
近视是一种广泛存在于世界各地的眼病。近视相关并发症会造成巨大的社会经济负担,尤其是进行性高度近视甚至可能导致潜在的致盲并发症[22-24]。目前,最好的治疗方式是控制近视的进展。我国作为近视患病率最高的国家[25],有效且安全的近视控制方案是目前亟待解决的问题。有研究表明[26],阿托品滴眼液延缓近视进展的效果优于周边离焦角膜接触镜、哌仑西平等其他治疗手段。现关于阿托品滴眼液延缓近视的作用机制尚无定论,大部分研究支持阿托品能直接或间接作用于视网膜或巩膜[27]。Chia等[28]的一项持续5a的大型随机对照试验结果表明,在超过5a的时间里,0.01%阿托品滴眼液在减缓近视进展的疗效优于其余浓度的阿托品滴眼液,且不良反应更少。也有研究表明[23],0.05%阿托品滴眼液是最佳剂量,停药后反弹及不良反应最少。一项Meta分析结果提示,不同浓度的阿托品对近视进展的控制效果可能与剂量不相关[22],关于阿托品最佳剂量问题可能需要进一步地研究分析。
现有的关于阿托品滴眼液的临床研究中表明,阿托品滴眼液的浓度增加与不良反应的发生相关[23],低浓度的阿托品滴眼液在保证延缓近视进展效果的同时,不良反应的发生率较低,具有更高的获益-风险比[24]。近年来,角膜塑形镜的使用是目前我国可长期使用的近视防控的主要手段[29]。随着阿托品滴眼液的临床研究增多,有研究表明,低浓度阿托品滴眼液控制近视的效果与角膜塑形镜相似[30]。而阿托品滴眼液联合角膜塑形镜控制近视进展的效果要优于单独配戴角膜塑形镜[31],或许可以成为更有效的控制近视进展的方案。
为评价不同浓度阿托品滴眼液延缓儿童青少年近视进展的效果,本研究对国内外公认数据库进行检索,最终纳入符合纳入标准的文献14篇,共3946例受试者参与,包括1%、0.5%、0.1%、0.05%、0.02%、0.01%六个不同浓度的阿托品滴眼液。Meta分析结果显示:不同浓度阿托品滴眼液均可以有效控制并缓解儿童青少年近视眼轴增长及屈光度增加,其中不同浓度阿托品滴眼液对眼轴增长及屈光度变化的控制作用间存在差异。而0.01%可以延缓近视进展同时,具有最低的不良反应发生率。
本研究仍有不足存在:(1)Egger分析提示纳入文献存在发表偏倚可能性小,但在使用亚组分析后,异质性仍然很高,通过敏感性分析剔除部分文献后得出结论;(2)本研究涉及6种不同浓度阿托品滴眼液,其中部分浓度所纳入的文献较少,有待完善;(3)一些纳入的文献没有报告不良反应,缺少阿托品滴眼液停药后近视的进展,最佳剂量需进一步地研究;(4)本研究包含的地区均为亚洲地区,且中国地区偏多,缺少关于其他地区的文献;(5)存在发表偏倚可能。
综上所述,阿托品滴眼液可以延缓儿童青少年近视的进展,可延缓眼轴增长以及屈光度进展,且延缓眼轴增长效果较好。不同浓度阿托品对于控制眼轴增长及屈光度进展效果存在差异,且不同浓度间不良反应发生率不同,仍需进一步研究探讨最佳阿托品滴眼液浓度。对于阿托品滴眼液联合其余治疗方法的联合疗法效果,仍需要严谨的临床研究进一步探讨。
