二甲双胍对2型糖尿病大鼠视网膜的保护及其对血清胱抑素C的调节作用
2023-01-13白惠玲朱晓燕张延英康万荣
白惠玲,朱晓燕,刘 勤,,张延英,康万荣,张 书
0 引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的眼部并发症,是导致失明的重要原因。炎症反应和氧化应激是贯穿DR整个病理过程的关键特征,DR患者的视力损害主要由该两种途径引起[1-2]。血清胱抑素C(Cystatin C, Cys C)是机体有核细胞合成的一种非糖基化碱性蛋白,主要由视网膜色素上皮细胞分泌[3-4],近年来有研究表明,血清Cys C是DR的独立危险因素之一[5],因此血清Cys C的分泌情况可能与DR的发生和发展密切相关。二甲双胍是目前治疗2型糖尿病(type 2 diabetes mellitus,T2DM)的首选口服药物。近期研究表明,二甲双胍还可以通过减轻炎症反应和氧化应激对视网膜色素上皮细胞的损伤,抑制视网膜新生血管生成来延缓DR进程[6-7]。本研究通过观察二甲双胍对T2DM大鼠视网膜血管、组织病理学改变及血清Cys C的影响,旨在探讨二甲双胍通过对血清Cys C调控,预防T2DM大鼠DR的发生,同时对已经发生DR的大鼠病情转归的干预作用。
1材料和方法
1.1材料
1.1.1动物模型的构建及分组给药选取6周龄雄性SD大鼠120只,体质量约为130~170g,购自甘肃中医药大学动物实验中心[许可证号:SYXK(甘)2020-0009]。本实验通过甘肃中医药大学实验动物伦理委员会审查(伦理审查编号:2020-298)。120只大鼠中随机抽取30只分为空白对照组A(10只),T2DM组(10只)和二甲双胍干预组A(10只);其余90只再次随机分为三组,分别为空白对照组B(30只),DR组(30只)和二甲双胍干预组B(30只)。所有大鼠适应性饲养7d后给予空白对照组A、B普通饲料喂养,其余组均给予高脂高糖饲料喂养,饲养4wk给空白对照组A、B左下腹腔注射柠檬酸钠缓冲液,将其余组大鼠按30mg/kg左下腹腔注射链脲佐菌素(STZ),给药后所有大鼠均改为普通饲料喂养,直到实验结束。注药72h后测量尾静脉血糖浓度,记录体质量、饮水量和尿量,当血糖>16.7mmol/L,尿糖>+++,且有多饮、多食、多尿时即认为T2DM模型成功。
造模成功后给予二甲双胍干预组A大鼠二甲双胍灌胃[第1wk剂量为150mg/(kg·d),第2wk为300mg/(kg·d),第3wk调整为400mg/(kg·d),该剂量一直保持到3mo],空白对照组A和T2DM组大鼠给予生理盐水灌胃[2mL/(kg·d),每日1次,连续3mo],干预3mo后三组大鼠进行观察:测量各组大鼠空腹血糖(fasting blood glucose, FBG)和空腹血清胰岛素(fasting serum insulin, FINS)指标,计算并分析胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR),心脏采血测各组大鼠血清Cys C、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-8(interleukin-8, IL-8)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和活性氧(reactive oxygen species, ROS)水平,并行眼底荧光造影(fundus fluorescein angiography, FFA)观察各组大鼠眼底血管变化,HE染色观察各组大鼠视网膜组织形态和厚度,透射电镜观察大鼠视网膜毛细血管超微形态。
在T2DM病程3mo后,二甲双胍干预组B大鼠开始给予二甲双胍灌胃[400mg/(kg·d),每日1次,连续3mo],空白对照组B和DR组大鼠均给予生理盐水灌胃[2mL/(kg·d),每日1次,连续3mo]。按干预时长不同,分别于第4、5、6mo各组取10只大鼠进行观察:测各组大鼠血清Cys C、TNF-α、IL-8、VEGF和ROS水平,并行FFA观察各组大鼠眼底血管变化,HE染色观察各组大鼠视网膜组织形态和厚度,透射电镜观察大鼠视网膜毛细血管超微形态(图1)。
1.1.2试剂与仪器盐酸二甲双胍片:中美上海施贵宝制药有限公司(批号:ABT8279);链脲佐菌素:北京索莱宝科技有限公司(批号:616S0212);荧光素钠注射液:美国Alcon Research LLC(批号:314040F);眼底血管荧光造影机:德国海德堡公司(型号:SpectralisHRA+Multicolor);大鼠胰岛素、Cys C、TNF-α、IL-8、VEGF ELISA试剂盒:江苏菲亚生物科技有限公司;大鼠ROS ELISA试剂盒:上海恒远生物科技有限公司。
1.2方法
1.2.1模型的观察指标测量空白对照组A、T2DM组和二甲双胍干预组A大鼠的FBG和FINS指标,比较各组的FBG值、FINS变化并计算分析HOMA-IR(=FBG×FINS/22.5)。
1.2.2FFA检查大鼠腹腔注射2%戊巴比妥钠50mg/kg进行麻醉,双眼滴复方托吡卡胺滴眼液充分散瞳后,将大鼠固定于眼底血管造影机前,腹腔注射10%荧光素钠0.5mL/kg,观察各组大鼠眼底有无病变及荧光素有无渗漏。
1.2.3ELISA实验大鼠经2%的戊巴比妥钠50mg/kg麻醉后行心脏采血5mL,静置30min后4000r/min离心15min,取上清分别检测各组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量,并且根据标准曲线和吸光度值计算各组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS的浓度。
1.2.4HE染色大鼠处死后迅速取出两个眼球,左眼置于眼球固定液行HE染色。
1.2.5透射电镜每组大鼠的右眼放入2.5%戊二醛溶液用于透射电镜观察。

2 结果
2.1T2DM大鼠成模及死亡率T2DM造模大鼠一次成模69只,二次累加成模11只,总成模率100%。T2DM大鼠共死亡4只,死亡率5%,分别于病程5mo(2只)、病程6mo(2只)时死亡。空白对照组大鼠无死亡。
2.2各组大鼠FBG和FINS及HOMA-IR比较三组间FBG、FINS和HOMA-IR差异均具有统计学意义(F=205.708、171.955、321.631,均P<0.01),见表1。与空白对照组A比较,T2DM组大鼠FBG、FINS和HOMA-IR显著升高,差异均有统计学意义(P<0.05),提示T2DM大鼠造模成功;与T2DM组比较,二甲双胍干预组A大鼠FBG、FINS和HOMA-IR显著降低,差异均有统计学意义(P<0.05)。

图1 实验分组及动物处理流程。

表1 各组大鼠FBG和FINS及HOMA-IR比较
2.3各组大鼠FFA检查结果空白对照组A大鼠视网膜血管管径均匀一致,走行规则,以视盘为中心呈放射状分布,未见黄斑样结构(图2A1);T2DM组大鼠眼底可见由稀疏的分支小动脉形成的浅层毛细血管网,毛细血管迂曲并可见荧光渗漏(图2A2);二甲双胍干预组A大鼠眼底血管粗细均匀一致,走行规则,未见荧光渗漏(图2A3)。提示T2DM病程3mo时大鼠眼底血管已出现DR的改变,而二甲双胍干预可以预防T2DM大鼠眼底血管发生病变。
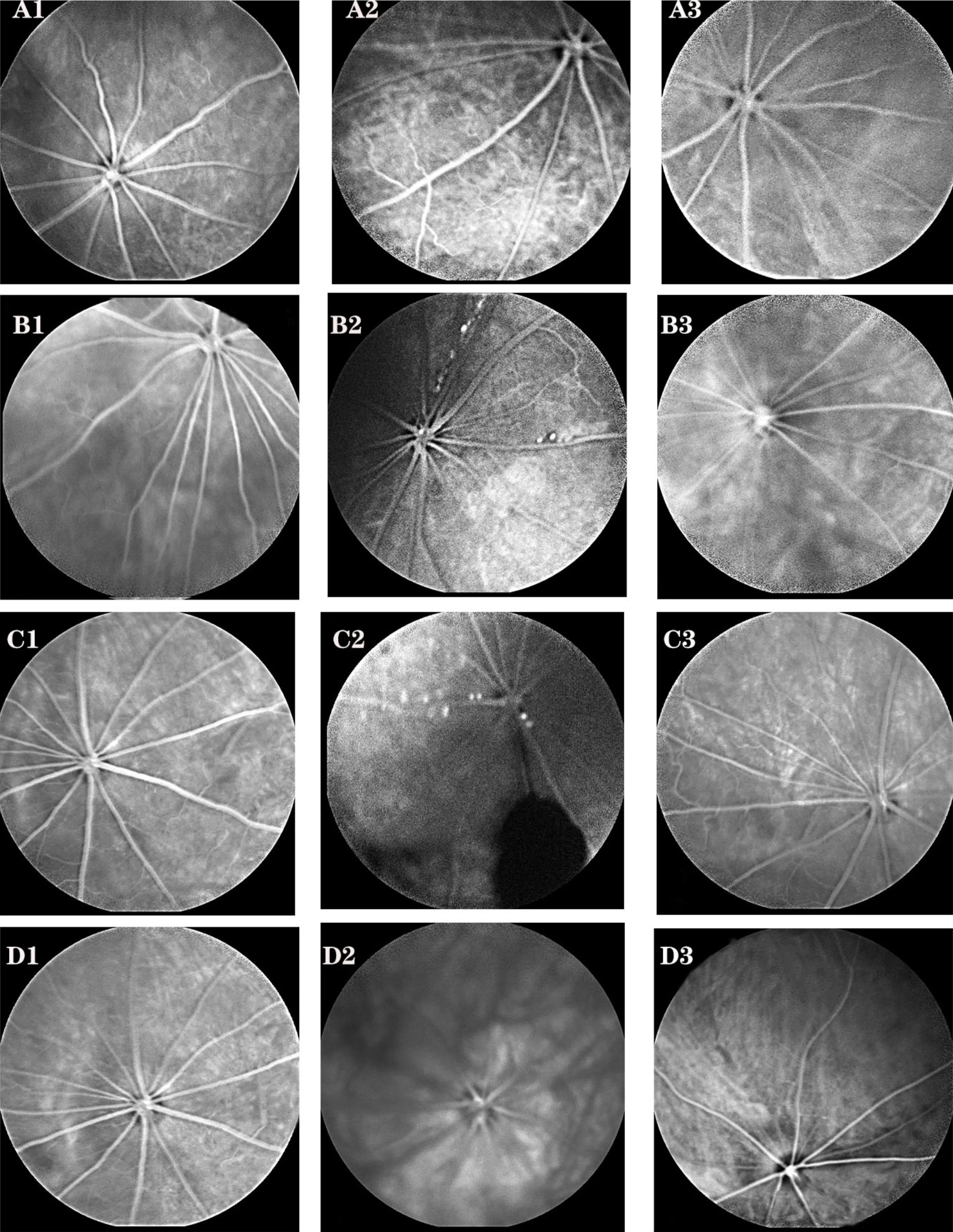
图2 各组大鼠FFA检查结果 A1~A3:病程3mo;A1:空白对照组A;A2:T2DM组;A3:二甲双胍干预组A;B1~B3:病程4mo;B1:空白对照组B M4组;B2:DR组 M4组;B3:二甲双胍干预组B M4组;C1~C3:病程5mo;C1:空白对照组B M5组;C2:DR组 M5组;C3:二甲双胍干预组B M5组;D1~D3:病程6mo;D1:空白对照组B M6组;D2:DR组 M6组;D3:二甲双胍干预组B M6组。
不同干预时间,空白对照组B大鼠眼底血管均清晰可见,管径均匀一致,走行规则,无渗出和出血(图2B1、C1、D1)。DR组(M4组)大鼠眼底血管走行迂曲,可见血管串状样改变和无灌注区形成(图2B2);DR组(M5组)大鼠眼底无灌注区面积增大,并可见出血遮蔽荧光(图2C2);DR组(M6组)大鼠眼底屈光间质混浊,可能存在玻璃体出血(图2D2)。二甲双胍干预组B(M4、M5、M6组)大鼠眼底屈光间质清晰,荧光渗漏及无灌注区随着二甲双胍干预时间的延长,至M6组时眼底病变已明显好转(图2B3、C3、D3)。
2.4各组大鼠血清中CysC、TNF-α、IL-8、VEGF、ROS的浓度各组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS浓度差异均具有统计学意义(F=182.128、167.362、166.013、249.265、76.803,均P<0.01)。与空白对照组A相比,T2DM组和二甲双胍干预组A大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量均明显升高,差异均有统计学意义(P<0.05);二甲双胍干预组A大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量较T2DM组均明显下降,差异均有统计学意义(P<0.05),见表2。

表2 各组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量的变化
各组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS在4、5、6mo差异均有统计学意义(P<0.01)。随后用LSD-t法进行两两比较,结果显示,在各时间点,与同期空白对照组B比较,DR组和二甲双胍干预组B大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量均明显升高,差异均有统计学意义(P<0.05),但二甲双胍干预组B大鼠增高不如DR组明显;与DR组比较,二甲双胍干预组B大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量均明显下降,差异均有统计学意义(P<0.05)。且随着病程的延长,DR组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量也显著增高(均P<0.05),而二甲双胍干预组B大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量增高不如DR组明显,见表3~5。

表3 各组大鼠血清中Cys C和TNF-α含量的变化

表4 各组大鼠血清中IL-8和VEGF含量的变化
表5 各组大鼠血清中ROS含量的变化
2.5各组大鼠HE染色结果空白对照组A大鼠视网膜各层结构清晰可见,内界膜完整,细胞排列整齐,细胞形态结构正常(图3A1);T2DM组大鼠视网膜各层细胞排列稀疏,细胞间隙明显增宽,内核层和外核层细胞密度明显减少,排列稀疏,厚度变薄(图3A2);二甲双胍干预组A大鼠视网膜各层结构完整,细胞排列整齐,细胞形态正常(图3A3)。与空白对照组A比较,T2DM组大鼠视网膜变薄(P<0.05);与T2DM组比较,二甲双胍干预组A大鼠视网膜增厚(P<0.05,图4),提示二甲双胍干预可以预防T2DM视网膜组织发生病变。

图3 各组大鼠HE染色结果 A1~A3:病程3mo;A1:空白对照组A;A2:T2DM组;A3:二甲双胍干预组A;B1~B3:病程4mo;B1:空白对照组B M4组;B2:DR组 M4组;B3:二甲双胍干预组B M4组;C1~C3:病程5mo;C1:空白对照组B M5组;C2:DR组 M5组;C3:二甲双胍干预组B M5组;D1~D3:病程6mo;D1:空白对照组B M6组;D2:DR组 M6组;D3:二甲双胍干预组B M6组。
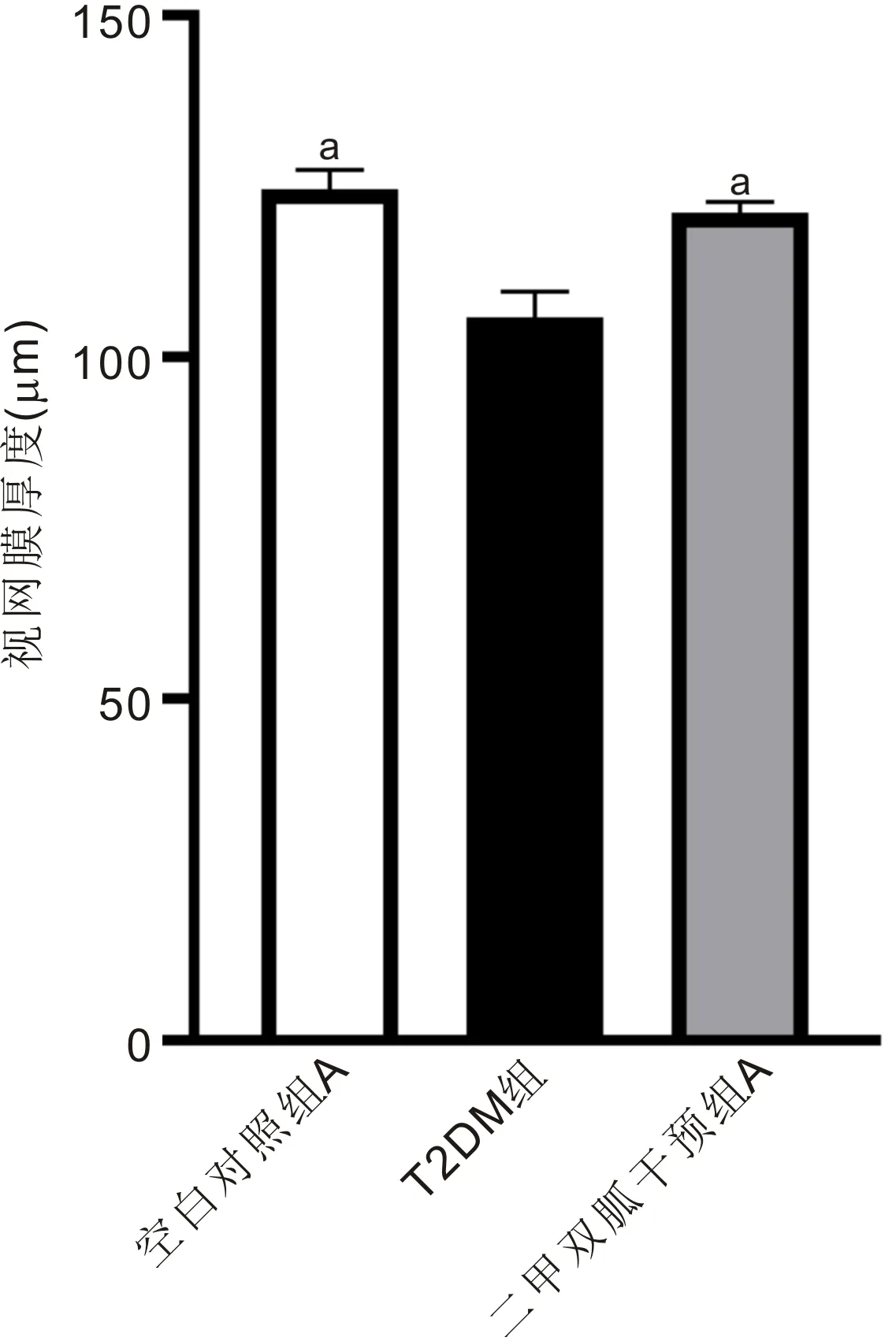
图4 二甲双胍对T2DM大鼠视网膜厚度的影响 aP<0.05 vs T2DM组。
不同时间点空白对照组B(M4、M5、M6组)大鼠视网膜各层结构均完整且连接紧密,细胞排列整齐;DR组(M4组)大鼠视网膜各层结构排列紊乱,内界膜断裂、水肿,外核层结构明显紊乱、变薄,大量细胞结构被破坏并可见部分空泡,DR组(M5组)大鼠视网膜各层结构紊乱加剧,内界膜肿胀断裂严重,可见内皮细胞突破内界膜,神经节细胞层细胞明显减少,DR组(M6组)大鼠视网膜内界膜严重肿胀,神经节细胞层细胞进一步减少,内外核层界限消失,内丛状层、内核层、外丛状层、外核层细胞数量均减少,排列稀疏,各层的毛细血管明显扩张,管腔增粗,腔内可见红细胞,还可见部分红细胞渗漏到血管外的组织中,毛细血管数量增加;二甲双胍干预组B(M4、M5、M6组)大鼠视网膜各层结构排列稍紊乱,少量细胞结构被破坏,形态结构改变较DR组各亚组均较轻,见图3B、C、D。与同期空白对照组比较,DR组大鼠视网膜变薄(P<0.05);与DR组比较,二甲双胍干预组B大鼠视网膜增厚(P<0.05),且随着病程的延长,DR组大鼠视网膜进一步变薄(P<0.05),而二甲双胍干预组B大鼠视网膜厚度变化不明显(P>0.05),见图5。

图5 二甲双胍对DR大鼠视网膜厚度的影响 aP<0.05 vs DR组;cP<0.05 vs 病程4mo DR组;eP<0.05 vs 病程5mo DR组。
2.6各组大鼠视网膜毛细血管的透射电镜结果空白对照组A大鼠视网膜毛细血管由基底膜、内皮细胞和周细胞组成,位于管腔内面的内皮细胞被连续的基底膜和周细胞环绕,内皮细胞和周细胞核形态正常,异染色质分布均匀,细胞器结构清晰,基底膜连续完整(图6A1);T2DM组大鼠内皮细胞和周细胞核的异染色质凝聚靠边,核膜凹陷褶皱,线粒体嵴部分消失,个别呈空泡变,内皮细胞胞质内饮泡增多,胞质向管腔突出,基底膜增厚(图6A2);二甲双胍干预组A大鼠透射电镜下视网膜毛细血管内皮细胞核的周围可见少量异染色质,管壁的厚度基本正常,线粒体基本正常,未见肿胀和嵴断裂,基底膜无增厚(图6A3)。提示二甲双胍干预可以预防T2DM大鼠视网膜毛细血管发生病变。
空白对照组B(M4、M5、M6组)大鼠视网膜毛细血管周细胞和内皮细胞结构均清晰,线粒体结构正常,基底膜连续完整,无增厚(图6B1、C1、D1);DR组(M4组)大鼠视网膜周细胞和内皮细胞的线粒体出现空泡样改变,线粒体膜中断不连续,基底膜增厚,电子密度增加,毛细血管管腔变形(图6B2);二甲双胍干预组B(M4组)大鼠视网膜毛细血管内皮细胞及周细胞核的异染色质凝聚并靠边,内皮细胞胞质内饮泡增多且胞质向管腔突出以及线粒体肿胀(图6B3),但视网膜损害较DR组(M4组)轻;DR组(M5组)大鼠视网膜毛细血管周细胞及内皮细胞核固缩,异染色质边聚,周细胞、内皮细胞细胞器结构模糊,内皮细胞向管腔突出,基底膜断裂缺失,管腔变形(图6C2);二甲双胍干预组B(M5组)大鼠视网膜毛细血管内皮细胞核的周围可见少量异染色质并且核内也可见散在的异染色质,仍有管腔内突起物,线粒体基本正常,未见肿胀、嵴断裂,基底膜稍厚(图6C3);DR组(M6组)大鼠视网膜毛细血管改变较前更加严重,管腔狭窄闭塞,管壁周细胞和内皮细胞均出现明显固缩,内皮细胞向管腔突出严重,细胞器结构不清,管腔周围水肿明显,基底膜缺失(图6D2);二甲双胍干预组B(M6组)大鼠在视网膜毛细血管内皮细胞中,细胞核周边可见异染色质聚集,细胞核内亦可见异染色质,线粒体正常,管壁厚度基本正常,管腔内见少量突起物,周细胞核及线粒体内偶见空化现象,但基底膜无增厚(图6D3)。
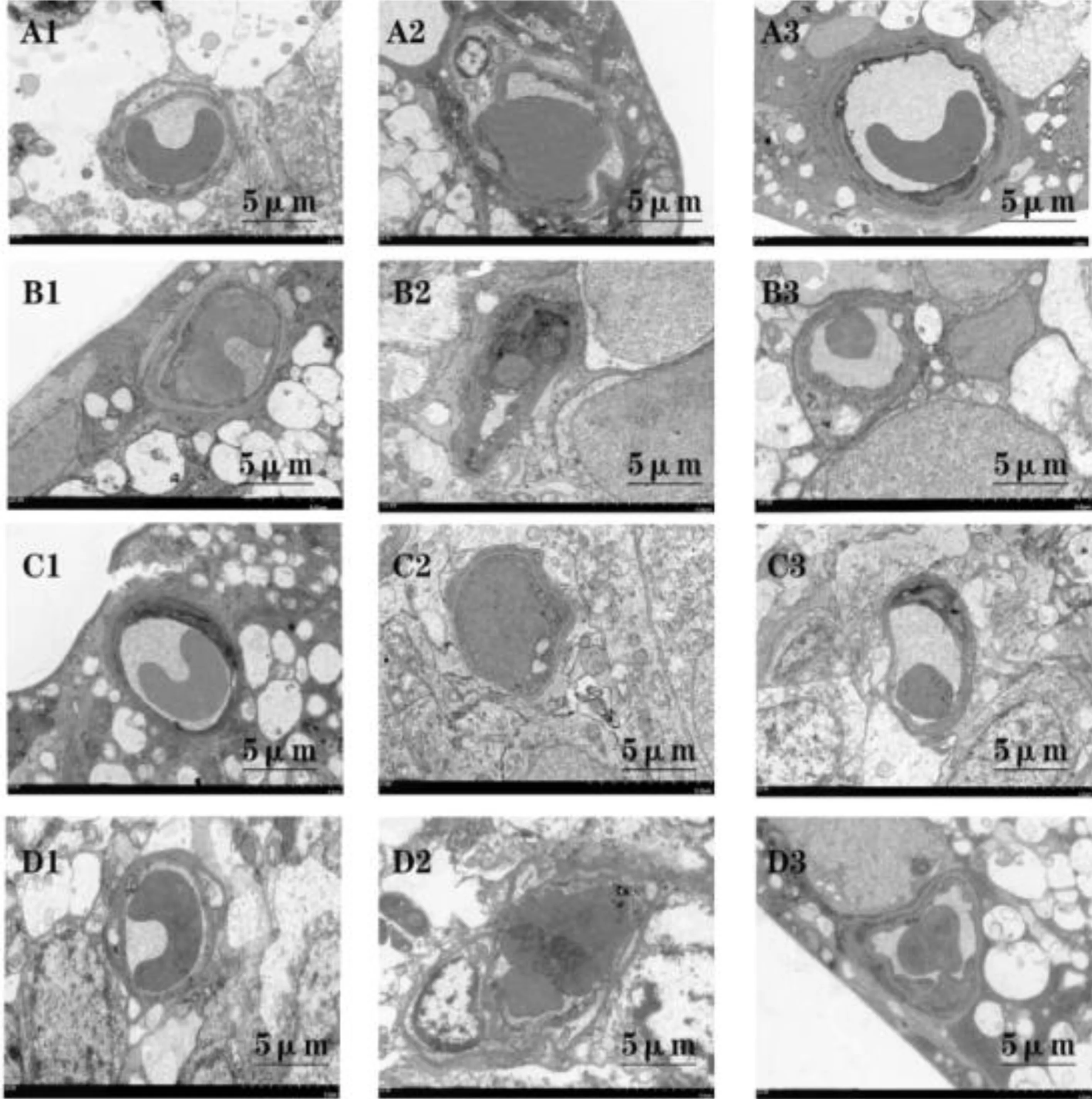
图6 各组大鼠视网膜毛细血管的透射电镜结果 A1~A3:病程3mo;A1:空白对照组A;A2:T2DM组;A3:二甲双胍干预组A;B1~B3:T2DM病程4mo;B1:空白对照组B M4组;B2:DR组 M4组;B3:二甲双胍干预组B M4组;C1~C3:T2DM病程5mo;C1:空白对照组B M5组;C2:DR组 M5组;C3:二甲双胍干预组B M5组;D1~D3:T2DM病程6mo;D1:空白对照组B M6组;D2:DR组 M6组;D3:二甲双胍干预组B M6组。
3 讨论
T2DM是近年来患病率较高的一种慢性炎症性疾病,长期的高血糖可以导致血管的结构和功能发生改变,引发一系列并发症。DR是T2DM最常见的微血管病变之一,主要表现为免疫、炎性反应等多种机制共同作用引起的视网膜微血管瘤和眼底出血、渗出,进而导致视物模糊,严重时出现永久性视力丧失[8-9]。STZ糖尿病大鼠模型是研究DR的常用动物模型,可以用于研究该病的病理机制以及防治策略[10]。本研究采用高脂高糖饲料喂养4wk联合小剂量STZ 30mg/kg腹腔注射建立T2DM大鼠模型,结果发现T2DM模型大鼠多食、多饮、多尿、体质量减轻,所有大鼠空腹血糖均≥16.7mmol/L,且HOMA-IR升高,成功复制出了大鼠胰岛素抵抗模型,即T2DM模型。饲养3mo后,T2DM模型大鼠FFA结果显示,眼底可见稀疏的分支小动脉形成的浅层毛细血管网,毛细血管迂曲并可见荧光渗漏;HE染色结果显示,视网膜各层细胞排列稀疏,细胞间隙明显增宽,内核层和外核层细胞密度明显减少,排列稀疏,厚度变薄;透射电镜结果显示,内皮细胞与周细胞的细胞核异染色质凝聚并靠边,核膜凹陷褶皱,线粒体嵴部分消失,个别呈空泡变,内皮细胞的胞质内饮泡增多且胞质向管腔突出,基底膜增厚。这些结果均提示本研究DR模型大鼠建立成功。而DR的发病机制非常复杂,炎症反应和氧化应激在DR的发生发展中具有重要作用。
Cys C是一类半胱氨酸蛋白酶抑制剂,研究发现,它在大鼠玻璃体、视网膜的各层细胞中均有表达[4]。有研究表明,随着DR的发展,血清Cys C水平显著升高[11],其参与DR的机制可能有:(1)Cys C及其降解产物能够激活并介导炎症反应[12]。文献报道Cys C与伴随有TNF-α、IL-8和VEGF等炎性细胞因子升高的炎症反应呈正相关[13-18]。可能的机制为,Cys C通过干扰素γ(interferon-γ, IFN-γ)介导的信号转导通路发挥了重要的致炎作用。IFN-γ是一种由NK细胞和活化的T细胞产生可溶性细胞因子,通常作为巨噬细胞的重要激活因子,也是主要组织相容性复合物Ⅱ(MHC-Ⅱ)分子表达的诱导剂,IFN-γ异常高表达通常会导致自身炎症的产生。现有研究发现,向Cys C-/-小鼠巨噬细胞中加入Cys C会促进诱导的核转录因子κB(NF-κB)的激活,进而启动多种细胞因子特别是TNF-α、IL-6、IL-8及VEGF等[19-21]基因的转录,而使炎症反应放大;(2)同时,糖尿病患者体内原本就已经存在的慢性炎症,在Cys C水平异常升高时,反之亦可引起患者视网膜血管内皮出现损伤,并引起硬化[22-24];(3)同型半胱氨酸具有损伤血管内皮细胞、导致微血管病变的作用,而Cys C对同型半胱氨酸的表达及分泌可产生一定的激发作用[25],Cys C可通过影响蛋白水解酶的活性及对同型半胱氨酸的作用参与血管内皮细胞损伤、血管重塑、血管新生等病变过程,参与DR的发生[26]。本研究结果发现,分别与空白对照组A和空白对照组B相比,对应的T2DM组和DR组大鼠血清中Cys C含量明显升高,同时伴有TNF-α、IL-8、VEGF和ROS含量均明显升高,且随着病程的延长,DR组大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量也均逐渐升高。本实验与其他研究结果一致,提示血清Cys C在DR的发生和发展中都起了重要作用,并通过炎症和氧化应激两者所涉及的共同通路有关,可能为DR探讨新的治疗策略提供思路。
二甲双胍来源于山羊豆碱,指南推荐其可以作为治疗T2DM的一线和全程用药[27]。研究发现,二甲双胍不仅可以通过提高胰岛素敏感性降低血糖,还可以通过减少视网膜损伤、抑制视网膜的炎症反应和改善胰岛素抵抗等,减少或延缓DR的发生与发展[28]。近年来多篇研究已报道二甲双胍还具有抗氧化特性,通过促进SOD分泌,抑制超氧阴离子自由基分泌,最终改善患者的氧化应激[29]。本研究发现,与T2DM组比较,二甲双胍干预组A大鼠HOMA-IR、Cys C、TNF-α、IL-8、VEGF和ROS含量均显著降低,FFA、HE和透射电镜结果均显示与空白对照组A基本相似,视网膜均未出现明显的异常改变,该结果提示二甲双胍可有效改善胰岛素抵抗及炎症反应对视网膜的损伤,可预防DR的发生。在研究中还发现,在各时间点与DR组比较,二甲双胍干预组B大鼠血清中Cys C、TNF-α、IL-8、VEGF和ROS含量均明显下降,且随着病程的延长,这些指标的增高也都不如DR组明显,FFA、HE和透射电镜结果示眼底改变较DR组各亚组均较轻,且眼底病变都明显逐渐好转,其机制可能是T2DM大鼠经二甲双胍治疗后,使得NF-κB的亚单位无法从失活状态活化,从而无法从细胞质转移到细胞核内与相应的炎症相关基因结合,进而抑制了炎性细胞因子的转录以及炎性因子或递质的合成和释放[30-31],通过抑制NF-κB介导的炎症通路降低血清Cys C,延缓和改善了炎症反应对视网膜的破坏,从而达到保护视网膜的效果[32],从而提示二甲双胍可能是通过下调血清Cys C介导的炎症和氧化应激水平来预防和减缓T2DM大鼠发生DR。
综上所述,二甲双胍能够有效下调血清中Cys C和其介导的TNF-α、IL-8、VEGF和ROS的含量,从而抑制T2DM大鼠的视网膜发生炎症反应和氧化应激,提示二甲双胍可能是预防和治疗DR的有效药物。本研究尚存在几处不足:(1)本研究由于实验周期较长,设亚组较多,且采用HE和透射电镜两种方法将视网膜组织制样,故组织样本数量有限,无法从局部检测,后续有条件时将从视网膜组织进一步加以验证;(2)本研究仅设立了安慰剂对照,如有条件后期将设立接受其他对DR有效的药物治疗的大鼠作为同期对照。
