PurB过表达对大肠杆菌氨基糖苷类抗生素耐药性的影响
2023-01-13高媛媛
林 婧,汤 琪,高媛媛
(细胞逆境响应与代谢调控福建省高校重点实验室/福建师范大学生命科学学院, 福建 福州 350108)
随着抗生素在畜牧养殖业的滥用情况加剧,越来越多的问题逐渐暴露,例如:打破畜禽体内微生态平衡引起的二重感染、造成畜禽集体免疫减退、对畜禽生存环境造成潜在的危害等[1-3]。滥用造成的耐药细菌(antibiotic-resistant bacteria)和耐药基因(antibiotic resistance genes)快速出现,导致抗生素对畜禽的治疗效率大幅度降低[4]。在金黄色葡萄球菌中已出现了耐青霉素、四环素、红霉素、万古霉素、甲氧西林的抗生素菌株[5],在对畜禽共生大肠杆菌的抗生素耐药性常规监测中,也发现了对多粘菌素耐药性的大肠杆菌[6],细菌耐药问题愈发棘手。为解决该问题,大部分研究人员把目光聚焦于新药的研发,然而新药研发周期长[7],仅仅依靠新药研发并不能及时解决细菌耐药问题,同时寻找新的药理靶点才是问题解决的双全的策略。在探索新耐药靶点的过程中,研究者发现了一些理想的靶点[8],通常聚焦于细菌一些独特的能量代谢途径中,其中涉及到的一些关键酶往往发挥着不可替代的作用[9-10]。而腺苷酸琥珀酸裂解酶PurB(Purine-element-binding protein B)作为大肠杆菌中高度保守的酶[11],是嘌呤合成中不可或缺的一部分[12],被预测可作为大肠杆菌的一个的新耐药靶点。
近年来,已有研究发现腺苷酸琥珀酸裂解酶突变在耐甲氧西林金黄色葡萄球菌(MRSA)中对β-内酰胺类抗生素的耐药具有重要作用[13]。同时,在肠炎沙门氏菌(S.Enteritidis)的研究中发现氟喹诺酮类药物(FQs)的耐药性也与purB基因有关[14-15]。然而目前尚未有研究发现腺苷酸琥珀酸裂解酶在大肠杆菌中对氨基糖苷类抗生素的耐药具有贡献。因此,本试验拟探讨腺苷酸琥珀酸裂解酶对大肠杆菌氨基糖苷类抗生素耐药性的影响,以评估腺苷酸琥珀酸裂解酶在氨基糖苷类抗生素应激环境中的作用,希望为解决大肠杆菌耐药问题提供新的药理靶点。
1 材料与方法
1.1 试验材料
本研究选用大肠杆菌BW25113菌株以及过表达载体pCA24N。
卡那霉素(50 mg·mL-1)、庆大霉素(25 mg·mL-1)用无菌超纯水配制而成,氯霉素(35 mg·mL-1)用分析乙醇配制而成。以上抗生素储液均用0.22 μm滤膜过滤除菌后备用。
LB液体培养基(每1 L包含氯化钠10 g、酵母粉5 g、蛋白胨10 g)、0.01 mol·L-1PBS缓冲液(每1 L包含NaCl 8 g、KCl 0.2 g、Na2HPO41.42 g、KH2PO40.27 g),以上溶液均经过高温高压灭菌。LB固体培养基需在LB液体培养基中加入7.5 g琼脂后高温高压灭菌,在培养基温热时倒入无菌培养皿中,待凝固后备用。
Western Blot试验试剂:0.45 μm PVDF Transfer Membranes、1.5 mol·L-1Tris-HCl (pH 8.8)、0.5 mol·L-1Tris-HCl (pH 6.8)、20% Ara溶液、10% SDS溶液、1×TBST缓冲液、6×loading buffer、4% SDS-PAGE浓缩胶、10% SDS-PAGE分离胶、1×转膜缓冲液、1 mol·L-1IPTG溶液、1×SDS电泳缓冲液、Western Blot封闭液和(PR1100)BCIP/NBT显色试剂。抗体为ProteinFind Anti-His Mouse Monocional Antibody和Alkaline Phosp hatase-conjugated Affinipure Goat Anti-Mouse lgG(H+L)。
1.2 试验方法
1.2.1PurB过表达菌株的构建 在本实验室保藏的ASKA文库中选取表达载体携带PurB基因的JM109菌株,划线于氯霉素平板后,挑取单克隆于含氯霉素的液体LB中,过夜培养16 h,用EasyPure Plasmid MiniPrep Kit试剂盒提取质粒。在野生型大肠杆菌BW25113感受态细胞中加入1 μL质粒,混匀后冰上静置30 min。用预热完全的42℃金属浴热激90 s,冰上静置2 min,加入1 mL液体LB,37℃摇床恢复1 h。恢复后的菌液全量涂布在氯霉素(35 μg·mL-1)抗性板上。过夜培养后挑取携带purB基因过表达载体的单克隆菌株。将PCR结果长度正确的菌株送尚亚测序公司进行测序,测序结果与NCBI上E.coli K-12菌株的purB基因进行比对。挑取测序成功的单克隆过夜培养后保存备用。
1.2.2免疫印迹法检测PurB过表达情况 将BW25113-pCA24N、BW25113-pCA24N(purB)按1∶100的接菌比例转接至含氯霉素抗性的液体LB中,在摇床中培养至OD600≈0.45时加入IPTG(1 mmol·L-1),继续放置在摇床中诱导至OD600≈0.8。诱导后取菌液1 mL,离心机转速12 000 r·min-1离心2 min,弃上清加入30 μL的10% SDS溶液和30 μL的6×loading buffer,混合均匀,置于100℃的金属浴上煮沸15 min。用10%的SDS-PAGE凝胶电泳将样品进行分离,电泳液为1×SDS电泳缓冲液。凝胶电泳结束后,使用PVDF膜进行转膜。转膜结束后封闭液封闭1 h。封闭结束后,加入一抗,置于水平摇床上反应30 min后,置于4℃冰箱过夜静置12 h。过夜后的膜置于垂直脱色摇床上,用1×TBST缓冲液洗涤3次,每次间隔8~10 min。洗涤后置于水平摇床上,加入二抗反应1.5 h,再换置于摇床上,用1×TBST缓冲液洗涤3次,每次间隔8~10 min。最后进行BCIP/NBT试剂显色。
1.2.3PurB过表达菌株抗生素耐受性检测 将BW25113-pCA24N、BW25113-pCA24N(purB)预先活化。将活化好的菌液1∶100转接至含氯霉素液体LB中,置于摇床中培养至OD600≈0.45时加入终浓度为1 mmol·L-1的IPTG,继续放置于摇床中诱导至OD600≈0.8。取菌液100 μL于EP管中,12 000 r·min-1离心2 min,去上清,用等体积的0.01 mol·L-1PBS缓冲液重悬作为对照样品备用。取1 mL诱导至OD600≈0.8的菌液于玻璃摇菌管中,分别加入卡那霉素(终浓度为10 μg·mL-1)、庆大霉素(终浓度为5 μg·mL-1),继续置于摇床中培养,1、2 h后取100 μL于EP管中,离心后去上清,用等体积的0.01 mol·L-1PBS缓冲液重悬作为试验样品,将以上样品用缓冲液梯度稀释后点板,平板在37℃过夜培养12 h,观察细菌存活情况,根据菌落计数,计算存活率。取3次平行试验的结果进行显著性分析。
1.2.4PurB过表达菌株最小抑菌浓度(MIC)测试 将活化好的BW25113-pCA24N、BW25113-pCA24N(purB)按1∶100转接至含氯霉素液体LB中,置于摇床中培养至OD600≈0.45时加入浓度为1 mmol·L-1的IPTG,继续放置于摇床中诱导至OD600≈0.8。将抗生素用2倍稀释法稀释成相应浓度(0、0.5、1、2、4、8、16、32、64 μg·mL-1),在无菌96孔板上按照浓度梯度顺序每孔加入200 μL抗生素稀释液,将诱导后的菌液稀释5倍后,每个孔中加入2 μL稀释后的菌液即每孔菌量约为105~106Cfu·mL-1,全部上样完成后,37℃静置培养24 h。取出96孔板,用枪头轻轻吹打混匀菌液,在肉眼条件下对光观察,清澄透光的孔对应的最低抗生素浓度为该菌体外培养最低抑菌浓度(MIC)。
2 结果与分析
2.1 PurB过表达菌株的构建
由图1可知,所构建的PurB过表达菌株基因长度正确。由图2可知,目的片段PurB基因测序结果与NCBI上大肠杆菌K-12菌株purB基因一致。由图3可知,免疫印迹检测结果显示BW25113-pCA24N(purB)能够表达目的蛋白腺苷酸琥珀酸裂解酶。综上结果表明PurB过表达菌株构建成功。
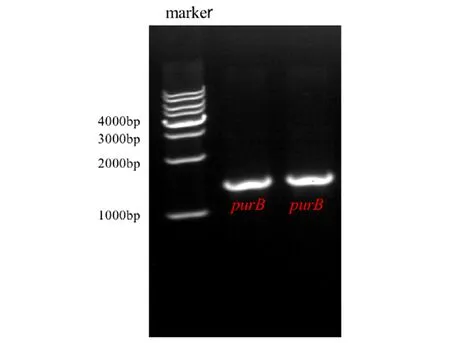
注:大肠杆菌purB基因长度为1371 bp图1 BW25113-pCA24N(purB)菌株基因验证Fig.1 Gene validation of BW25113-pCA24N(purB) strain
注:黑色序列为K-12大肠杆菌purB基因,蓝色序列、红色序列为上下游引物测序结果图2 BW25113-pCA24N(purB)菌株测序结果Fig.2 Sequencing results of BW25113-pCA24N (purB) strain
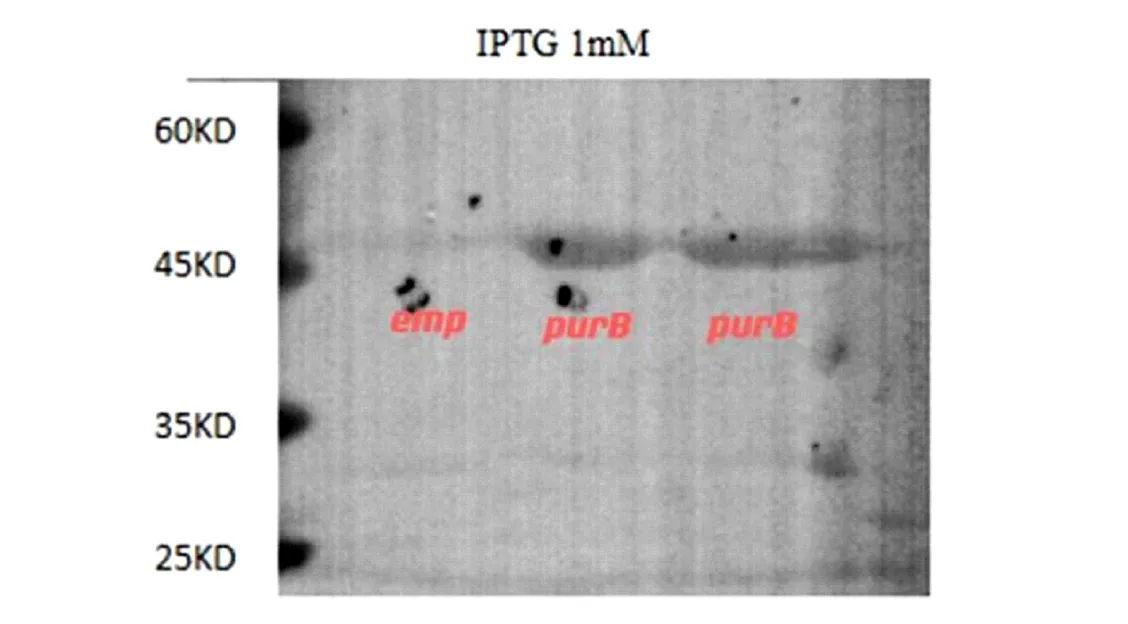
注:腺苷酸琥珀酸裂解酶大小约为50.27 kDa图3 BW25113-pCA24N(purB)菌株Western Blot检测Fig.3 Western Blot detection of BW25113-pCA24N (purB) strain
2.2 PurB过表达增强大肠杆菌氨基糖苷类抗生素的耐受性
2.2.1庆大霉素处理下BW25113-pCA24N(emp)、BW25113-pCA24N(purB)表型结果 由图4可知,BW25113-pCA24N(emp)、BW25113-pCA24N(purB)经浓度为5 μg·mL-1的庆大霉素处理0、1、2 h后细胞存活数的情况。结果显示:在未处理情况下,PurB过表达株的细胞存活数与空质粒株生长一致。在庆大霉素处理1 h后,PurB过表达株细胞存活数比空质粒株多1个数量级。而处理2 h后,PurB过表达株的细胞存活数比空质粒株多近100倍。这些结果证明,过表达腺苷酸琥珀酸裂解酶可以提高大肠杆菌提高对庆大霉素的耐受性。
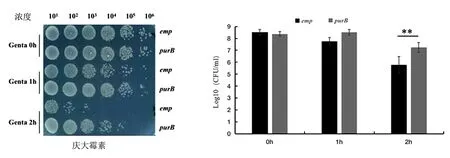
注:**表示P<0.01,差异较显著。图4 庆大霉素处理下emp、purB菌株存活率测定Fig.4 Determination of the survival rate of emp and purB strains treated with gentamicin
2.2.2卡那霉素处理下BW25113-pCA24N(emp)、BW25113-pCA24N(purB)表型结果 由图5可知,BW25113-pCA24N(emp)、BW25113-pCA24N(purB)经浓度为10 μg·mL-1的卡那霉素处理0、1、2 h后细胞存活数的情况。结果显示:在未处理情况下,PurB过表达株的细胞存活数与空质粒株生长一致。在卡那霉素处理1 h后,PurB过表达株细胞存活数与空质粒株无显著差异。而处理2 h后,PurB过表达株的细胞存活数比空质粒株多近100倍。这些结果证明,过表达腺苷酸琥珀酸裂解酶可以提高大肠杆菌对氨基糖苷类抗生素的耐受性,提高菌群的生存率。
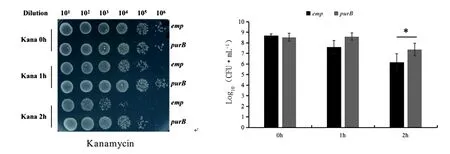
注:*表示P<0.05,差异显著图5 卡那霉素处理下emp、purB菌株存活率测定Fig.5 Determination of the survival rate of emp and purB strains treated with kanamycin
2.3 PurB过表达菌株MIC(最小抑菌浓度)的测定
由图6可知,在卡那霉素处理条件下BW25113-pCA24N(emp)与BW25113-pCA24N(purB)的MIC都为2 μg·mL-1,在庆大霉素处理条件下BW25113-pCA24N(emp)与BW25113-pCA24N(purB)的MIC都为1 μg·mL-1。说明过表达PurB并未改变菌株耐药性,只是增强了菌株的耐受性。

注:A为卡拉霉素处理,B为庆大霉素处理图6 emp、purB最小抑菌浓度(MIC)测定Fig.6 Determination of the minimum inhibitory concentration (MIC) of emp and purB strains
3 结论与讨论
自1928年弗莱明发现青霉素到现在[16],抗生素已成为人类不可或缺的药物。然而随着抗生素的过度使用,细菌耐药在畜牧养殖业中出现且势不可挡。细菌主要以3种方式来应对抗生素应激环境:耐受、耐药、持留菌,而耐受的产生先于耐药性[17]。因此为尽早遏制更多的细菌耐药产生,有必要挖掘出更多的耐受基因,找到合适的新靶点。在耐受菌以及耐药菌的分类上,主要以MIC来界定。耐受菌能在有效抗生素浓度下存活,但MIC不变,而耐药菌MIC增加[18]。
本研究发现PurB过表达后能增加大肠杆菌在氨基糖苷类抗生素处理下的存活率,并且进一步研究发现过表达PurB后,与对照相比,其最小抑菌浓度(MIC)并无增加。因此认为过表达PurB能增加大肠杆菌对氨基糖苷类抗生素耐受性,而不是耐药性。结合本试验研究结果,以及之前研究者们发现的PurB对金黄色葡萄球菌以及肠炎沙门氏菌耐药性的贡献,认为PurB在耐药细菌产生的进程中发挥了巨大的作用。
目前,已有研究预测,purB基因编码金黄色葡萄球菌的必须酶,并且研究人员进一步验证该酶可作为一个潜在的治疗靶点[19]。鉴于该酶在大肠杆菌中对氨基糖苷类抗生素耐受性的贡献,认为这可为细菌耐药机制研究和靶点问题提供新的思路。
