颞下颌关节盘组织再生的研究进展
2023-01-13向超丽俞律峰
向超丽 俞律峰
【提要】 颞下颌关节盘穿孔是颞下颌关节紊乱病(Temporomandibular disorders,TMD)中的严重结构紊乱类型之一,主要临床表现为疼痛、关节杂音和下颌运动障碍。目前的临床治疗手段预后欠佳,难以恢复关节盘正常解剖形态及功能,而组织工程技术的发展,使关节盘再生成为可能。研究发现,将间充质干细胞接种在具有一定强度的可生物降解支架上,在生长因子的刺激下可向纤维软骨分化,分泌胶原纤维和糖胺聚糖,最终支架被新生组织取代,关节盘实现再生。本文对近年来组织工程技术在关节盘再生方面的研究进展进行综述。
颞下颌关节(Temporomandibular joint,TMJ)是口颌系 统的重要组成部分,其主要功能是支持复杂的下颌运动,并在运动中承受一定的负荷[1]。关节盘是TMJ 中主要的应力分布组织,提供润滑和缓冲,最大限度地减少运动过程中髁突与关节窝之间的承载力(如压缩力、拉力和剪切力)[2]。颞下颌关节紊乱病是肌骨骼类紊乱疾病,包括关节盘移位、骨关节炎、退行性关节病和肌肉疼痛[3]。关节盘相关TMD 涉及内部紊乱或关节盘移位、关节盘变薄和关节盘穿孔。关节盘的穿孔使髁突和关节窝直接接触,滑液发生变化,关节内摩擦增加,从而引发关节结构的退行性变化。目前已有地关于关节盘穿孔的治疗手段预后欠佳,药物及微创手术不能恢复受损的关节盘,关节盘切除会导致髁突重塑,组织工程技术有望成为修复或替代TMJ 病变组织的选择[4]。通过在关节盘穿孔区域植入组织工程材料,或者病变关节盘切除术后置换工程化关节盘,可以修复缺损,随着支架的缓慢降解和新的纤维软骨组织形成,可以恢复关节盘的稳定性及生理功能。组织工程的主要元素包括细胞、生长因子和支架[5]。本文讨论了颞下颌关节盘的解剖学和生理学特征,用于关节盘再生的细胞、生物工程支架、生长因子和3D 生物打印技术,总结分析组织工程在关节盘再生中的应用前景及面临地问题。
1 关节盘的解剖和生理特征
关节盘是一种多孔黏弹性材料[2],呈双凹圆盘状,中央区域较薄,周边区域较厚,无血管和神经支配,因此必须通过关节盘周围滑液和血管的扩散来维持营养,自愈能力极差。关节盘是一种异质纤维软骨结构,由胶原纤维、弹性蛋白纤维和蛋白多糖组成[6-7],形成关节盘结构的细胞是纤维软骨细胞(30%)和成纤维细胞(70%)[8],主要分泌Ⅰ型胶原蛋白。胶原纤维走行呈现各向异性变化,与关节盘的拉伸特性高度相关[9],内部的环状胶原网络结构是其抗压性能的基础,中间带表现出比前带和后带更高的抗压性能[10]。弹性蛋白纤维的走行通常与胶原纤维平行,被认为有助于在荷载后恢复关节盘的形状,随着年龄的增长弹性纤维数量减少[6]。这些纤维在关节盘-关节囊过渡区形成网状结构。蛋白聚糖在促进和调节胶原纤维和其他细胞外基质成分的发育,维持纤维空间结构方面发挥着重要作用[11]。关节盘的这些微观特征表明其在抵抗咀嚼力作用下的压缩和拉伸方面的性能。
天然组织的生物力学特性是创建功能性组织工程替代物的重要设计参数。Kuo 等[12]对人类关节盘进行区域生物力学和生化表征分析,关节盘周边带的聚合模量约为中、外侧区域的1/3。水力渗透率也存在显著差异,前部和后部区域的渗透性比关节盘中央区域高约40%。聚合模量和渗透率呈反比关系,具有显著的区域差异。关节盘的平均聚合模量为50.66 kPa,平均渗透率为5.652×10-15m4·N-1,平均水体积分数为80%,聚合模量与含水量呈负相关,而水力渗透率与含水量呈正相关。与前部和后部区域相比,关节盘的中心区域具有较高的聚合模量和较低的渗透性,这与相关区域的含水量有关。关节盘的动态压缩行为高度依赖于频率。复模量(即动态应力与动态应变的比率)在关节盘中随着频率的增加(0.01~3.0 Hz)而增加。中心区域的复模量(454.6~1613.0 kPa)比前部和后部区域(171.8~609.3 kPa)大2.5~3 倍。即使在0.01 Hz 的低频下,关节盘的动态模量也远大于其平衡模量,这是因为动态负载条件下组织内发生间质液加压效应[13]。由于组织的双相性质,受限压缩中关节盘的动态模量与组织的聚合模量和水力渗透性有关。关节盘具有较高聚合模量和较低渗透率的区域具有较高的动态模量。流体加压在动态负载条件下对关节盘的负载支撑起重要作用。
2 细胞来源
许多细胞类型可用于关节盘再生,包括软骨细胞、干细胞和诱导多能干细胞(Induced pluripotent stem cells,iPSC)等。关节盘组织工程中使用的细胞类型及其优缺点详见表1。
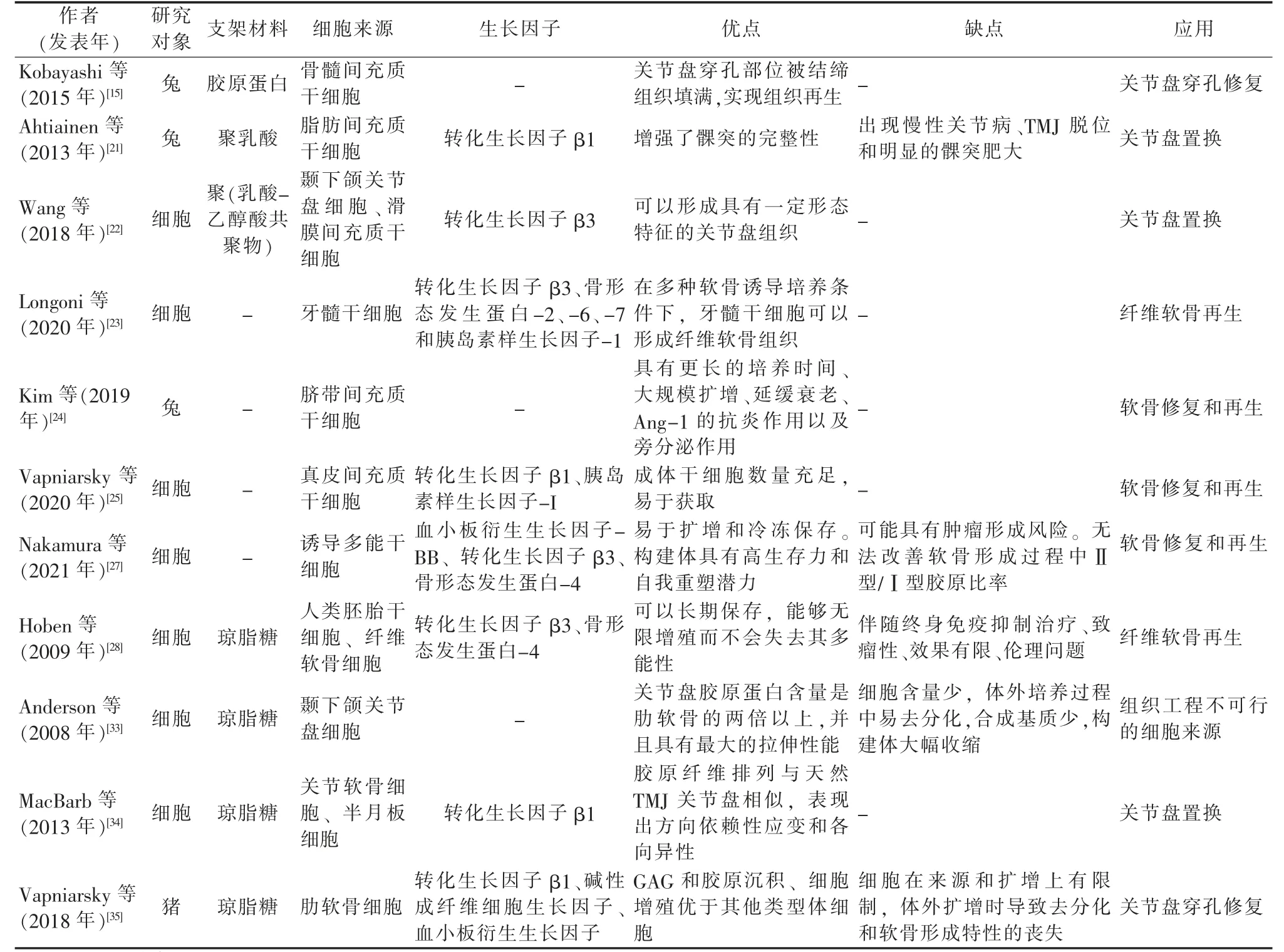
表1 关节盘组织工程的细胞来源
2.1 干细胞
干细胞可以来自成体组织或胚胎组织,但因伦理问题,多数研究都聚焦于成体干细胞[14]。间充质干细胞(Mesenchymal stem cells,MSCs)在组织工程中最受关注,几乎存在于所有组织中,可以从骨髓[15]、脂肪[16]、滑膜[17]、人脐带血[18]等多种组织中分离得到。MSCs 的三个特性使其成为组织再生的理想细胞来源:①有利于减轻异常免疫反应的免疫调节能力;②产生生长因子的旁分泌或自分泌功能;③分化为靶细胞的能力[19]。不同来源的MSCs 的转录组、蛋白质组、免疫表型和免疫调节活性不同,这意味着MSCs 具有独特的分化潜能[20]。
骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)已被用于关节盘穿孔部位的修复。在兔关节盘穿孔模型中,从股骨收集自体BMSCs 并接种到胶原支架中,将其植入穿孔部位8 周后,关节盘穿孔部位被结缔组织填满,实现组织再生,而植入空支架组未完全闭合[15]。
脂肪间充质干细胞(Adipose-derived mesenchymal stem cells,ADSCs)表现出优于BMSCs 的几个优势,包括侵入性较小的采集程序、从等量采集的组织中获得更多数量的干细胞、增殖和分化能力增强,以及更好的血管生成和体内成骨特性[16]。将分化的ADSCs 接种到聚乳酸支架中,植入体内取代关节盘,对髁突软骨有保护作用,但支架的位移可能会影响结果[21]。
用于关节盘再生的研究较少的干细胞是滑膜间充质干细胞(Synovial mesenchymal stem cells,SMSC)和牙髓干细胞(Dental pulp stem cells,DPSCs)。SMSC 比BMSCs 和ADSCs具有更显著的增殖和成软骨潜能,并且比BMSCs 具有更少的肥大分化[17]。Wang 等[22]将兔颞下颌关节盘细胞和SMSC 以1∶1 的比例共培养14 d,可以观察到软骨形成相关基因(Col2a1、Sox-9)的表达和细胞外基质(糖胺聚糖、Ⅱ型胶原)的分泌,形成具有一定形态特征的关节盘组织。DPSCs 因其易于分离、巨大的扩增潜力以及多向分化潜能,被认为是关节盘的潜在干细胞来源。Longoni 等[23]从人类磨牙获得的DPSCs 在3D 颗粒培养模型中进行了扩增和软骨分化。在软骨形成刺激下分化21 d 后,细胞呈现伸长的形态并产生富含胶原蛋白的细胞外基质。
脐带间充质干细胞(Umbilical cord mesenchymal stem cells,UCMSCs)不受伦理问题的限制,相对于其他来源的MSCs表现出生物学优势,包括具有更长的培养时间、大规模扩增、延缓衰老和Ang-1 的抗炎作用[18]。此外,UCMSCs 可以上调生长因子、细胞外基质标志物和抗炎细胞因子的表达,减少促炎细胞因子的表达,具有显著的软骨保护作用和软骨再生潜力[24]。
干细胞的其他潜在来源包括真皮间充质干细胞(Dermal mesenchymal stem cells,DMSCs)和诱导多能干细胞(Induced pluriporent stem cells,iPCS)。真皮分离的成体干细胞数量充足,是近年来再生医学中常用的干细胞来源之一,通过软骨诱导DMSCs 可以进行软骨修复和再生[25]。由于其新颖性,DMSCs尚未用于关节盘组织工程。iPCS 的发现使终末分化细胞重编程为具有多能性的原代干细胞成为可能,并为软骨缺损的再生和修复提供了潜力[26]。Nakamura 等[27]将3D 生物打印方法与iPSC 衍生的软骨细胞结合用于关节软骨再生,提高了构建体的机械强度(压缩和拉伸特性),并诱导了糖胺聚糖(Glycosaminoglycan,GAG)和Ⅱ型胶原蛋白的表达,改善了组织功能。虽然iPSC 尚未直接用于再生纤维软骨,但使用iPSC 再生关节软骨的成功[26],使其有可能用于关节盘的组织修复。
人类胚胎干细胞(Human embryonic stem cells,hESCs)是用于纤维软骨组织工程的新兴细胞来源[28]。胚胎干细胞可以长期保存,能够无限增殖而不会失去其多能性[29],但相关伦理问题阻碍了其在组织工程中的广泛使用,目前还没有研究在TMJ 组织工程中使用胚胎干细胞。
虽然许多关于使用MSCs 进行组织修复的研究都是基于移植的MSCs 分化为靶细胞并替换受损组织的假设,但越来越多的证据表明MSCs 通过分泌营养因子来协调组织发挥修复再生功效[30]。MSCs 衍生的外泌体模拟了MSCs 的主要治疗作用,可抑制TMJ 软骨细胞的炎症,能够再生软骨和骨组织,修复受损部位,并可治疗由颞下颌关节骨关节炎引起的功能障碍和疼痛[31]。外泌体在颞下颌关节盘领域尚未得到广泛研究,但最近的一些研究显示干细胞衍生的外泌体在诱导祖细胞迁移、软骨和骨骼修复以及疼痛减轻方面效果良好[30]。因此,外泌体可能是关节盘修复的潜在新策略,为“无细胞”疗法的发展奠定基础。
2.2 体细胞
关节盘组织工程的潜在主要体细胞来源包括关节盘细胞、关节软骨细胞、半月板细胞和肋软骨细胞[32]。TMJ 关节盘结构的胶原蛋白含量是肋软骨的两倍以上,并且具有最大的拉伸性能,然而构建体的大幅收缩和有限的细胞数量使其不可能成为组织工程的细胞来源[33]。将关节软骨细胞和半月板细胞共培养,其胶原纤维排列与天然关节盘相似,在有限元分析中表现出方向依赖性应变和各向异性[34]。使用同种异体、传代的肋软骨细胞可以制造无支架的组织工程植入物,通过压缩和生物活性刺激方案,使其机械性能类似于天然关节盘,体内植入后,穿孔的关节盘出现再生[35]。比较来自关节盘细胞、关节软骨细胞和肋软骨细胞的GAG 和胶原沉积、细胞增殖,发现肋软骨细胞优于前两者[33,36]。肋软骨细胞似乎是关节盘组织工程中最有希望的体细胞来源。然而,与干细胞相比,体细胞在来源和扩增上的限制,使其在组织工程中的应用受限。
3 支架材料
用于关节盘再生的支架材料需要有足够的机械强度、生物相容性和长期稳定性,以确保新组织能够正常形成。TMJ 关节盘通常处于运动状态,承受大量压力,并且大部分是无血管的,因此开发适合长期使用的支架材料对于关节盘再生至关重要。关节盘替代材料主要分为两类:天然材料和合成材料。
3.1 天然材料
用于关节盘支架的天然材料包括胶原蛋白、纤维蛋白、壳聚糖、藻酸盐和脱细胞细胞外基质(Decellularized extracellular matrix,dECM)等(表2)。

表2 关节盘组织工程的天然支架材料
胶原蛋白是天然关节盘的主要成分之一,为细胞浸润创造了多孔结构,GAGs 很容易沉积在其表面[37]。将多孔胶原海绵支架与合适的生长因子或细胞因子相结合,具有促进干细胞募集、增殖和分化的能力[38]。
纤维蛋白凝胶也被用做细胞支架[39]。然而,纤维蛋白凝胶存在机械强度差、形成过程中快速降解和体积收缩的问题。Foroushani 等[40]合成的明胶-糖胺聚糖基质和纤维蛋白的混合支架,成功改善了纤维蛋白样支架的机械性能、降解时间和细胞反应。纤维蛋白凝胶和冻干壳聚糖的复合支架也可以形成稳定的结构,具有增强细胞增殖和关节盘ECM 沉积的作用[41]。
壳聚糖由氨基葡萄糖组成,具有优良的生物相容性和可生物降解特性,但作为支架使用受到生物活性和机械性能低的限制。将壳聚糖与其他天然或合成聚合物和/或生物材料混合,可有效地控制这些生物复合材料支架的孔隙率和保水性,降低其生物降解率,增强生物活性和生物相容性,并提高机械性能[42]。壳聚糖与海藻酸盐结合形成的支架,具有支持干细胞黏附和长期增殖,并促进干细胞纤维/软骨分化和形成丰富纤维软骨组织的特性,负载干细胞的支架机械性能与天然关节盘相似[43]。
藻酸盐也是用于关节盘组织工程的热门支架材料。通过使用碳二亚胺化学共价交联藻酸盐引入形状记忆特性,使用定向冷冻技术修改支架结构,在形状记忆藻酸盐支架中调整支架结构和组成,可以用于指导干细胞分化并支持复杂软骨组织的发育[44]。
脱细胞ECM 支架通常来自猪膀胱、关节盘、小肠黏膜下层。基于猪膀胱的支架是通过将粉状猪膀胱夹在两个水合的膀胱片之间构建枕头状结构,其GAG、胶原蛋白浓度、机械性能与天然关节盘相似,植入体内后防止了关节窝和髁突的严重退行性变化[45]。然而,这些支架固定在关节窝上,不可能实现TMJ 的自然运动。将关节盘去细胞化后通过激光烧蚀制成多孔结构,微孔化可以增强支架的孔隙率,增加水力传导性,提高细胞对支架的黏附,增加整个支架核心的细胞密度,改善细胞的黏附、扩散和迁移[46]。将小肠脱细胞ECM 支架体内植入后,可以促进关节间隙内新组织形成,宿主细胞填充,形成类似于天然组织的、新的、致密排列的纤维软骨,外周肌肉和肌腱附着物形成,同时髁突表面未见退化[47],这种无细胞生物支架在关节盘重建中疗效显著。
3.2 合成材料
与天然产品相比,合成材料缺乏固有分化特性,但能在保持生物相容性的同时实现对机械特性的增强控制。表3 显示的是目前已用于关节盘构建的聚合物,包括聚四氟乙烯(PTFE)、聚乙醇酸(PGA)、聚乳酸(PLA)、聚(乳酸-乙醇酸共聚物)(PLGA)、聚己内酯(PCL)、聚癸二酸甘油酯(PGS)、聚癸二酸甘油酯丙烯酸酯(PGSA)、聚乙二醇二丙烯酸酯(PEGDA)以及聚乙烯醇(PVA)等。
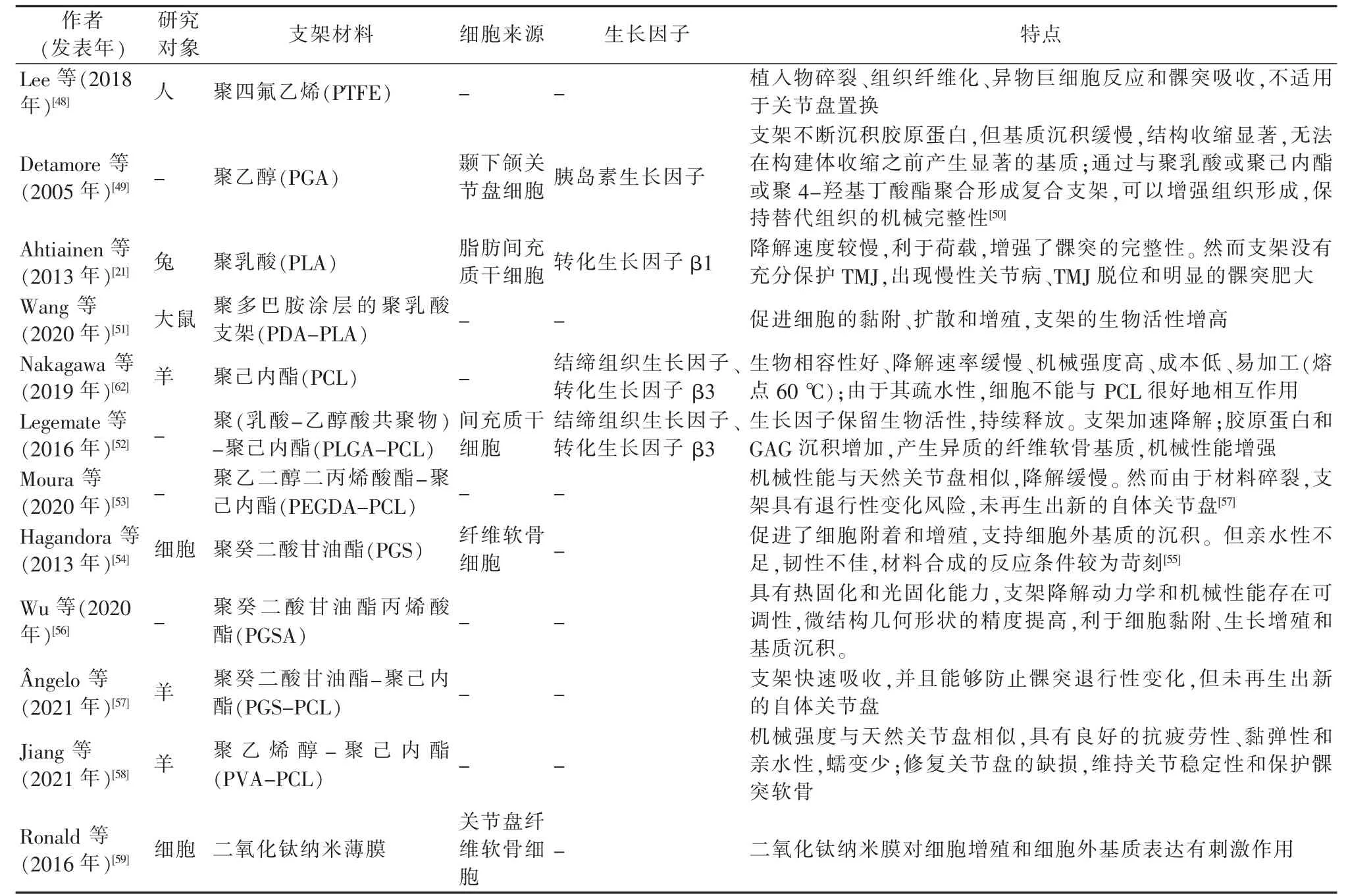
表3 关节盘组织工程的合成支架材料
第一个关节盘替代物是由碳纤维结合聚四氟乙烯制成的,然而由于植入物碎裂,导致组织纤维化、异物巨细胞反应和髁突吸收,该材料被证明不适用于替代关节盘[48]。PGA 支架可以接种关节盘细胞,使其不断沉积胶原蛋白,然而至少需要6 周才能形成有组织的结构[49]。将PGA 与PLA 或PCL 或聚4-羟基丁酸酯(P4HB)聚合形成支架,能加快组织形成,在支架降解率和组织形成之间实现平衡,以保持替代组织的机械完整性[50]。
PLA 支架的降解速度较慢,支架为双相圆盘状结构,一侧是用于细胞接种的无纺多孔垫,另一侧是作为关节面的实心PLA 层,有利于荷载。然而,关节中存在的脱位和骨关节炎表明支架没有充分保护TMJ[21]。将PLA 支架通过化学改性和聚多巴胺(PDA)涂层后,可以增强细胞黏附、扩散和增殖,提高支架的生物活性[51]。
PCL 单独使用无法满足关节盘再生所需支架的性能,通常与PGA、PLGA、PEGDA、PGS、PVA 聚合,形成复合支架。由嵌入PLGA 微球的PCL 制成支架,可以改善纤维软骨的生成。由于PCL 和PLGA 之间的熔解温度存在显著差异,PLGA可以在熔解的PCL 中保持稳定,保护包裹在PLGA 中的生长因子蛋白。与单独的PCL 支架相比,PLGA+PCL 支架显示出胶原蛋白生成增强、GAG 沉积增加以及机械性能增强的特性[52]。涂有PEGDA 水凝胶的3D 打印PCL 支架也能更好地模拟天然关节盘的机械性能[53]。
PGS 是一种用于关节盘组织构建的新型支架材料,纤维软骨细胞能在其上大量增殖,并且分泌出丰富的胶原蛋白和糖胺聚糖,表明支架促进了细胞附着和增殖,支持细胞外基质的沉积[54]。PGS 是具有生物相容性和可生物降解的弹性体,但材料亲水性不足,韧性欠佳,合成的反应条件较为苛刻,存在固化反应需要温度高、真空度高、持续时间长等缺点[55]。将PGS 丙烯酸化得到PSGA,其固化条件降低,操作更加简单易行,具有热固化和光固化能力,同时支架降解动力学和机械性能存在可调性,微结构几何形状的精度提高,利于细胞黏附、生长增殖和基质沉积[55-56]。
与聚合物相比,二氧化钛对细胞增殖和细胞外基质表达有刺激作用,通过逐层组装制造的二氧化钛纳米薄膜可能具有作为TMJ 支架材料的潜力[59]。
4 生长因子
与TMJ 关节盘相关的生长因子是碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)、转化生长因子β(Transforming growth factor beta,TGF-β)、胰岛素生长因子I(Insulin growth factor I,IGF-I)、结缔组织生长因子(Connective tissue growth factor,CTGF);其他包括血小板衍生生长因子(Platelet-derived growth factor,PDGF)、表皮生长因子(Epidermal growth factor,EGF)、白介素1(Interleukin 1,IL-1)、高迁移率族蛋白1(High mobility group 1 protein,HMG-1)和肿瘤坏死因子α(Tumor necrosis factor alpha,TNF-α)[5,60-62]。
TGF-β1 可以增强细胞嵌入支架的机械性能。用TGF-β1连续处理纤维软骨细胞和关节软骨细胞的共培养物,增加了约20%的胶原沉积、约130%的压缩刚度和约170%的杨氏模量,显著增加了构建体的功能特性[61]。bFGF 可以增强关节盘后结缔组织的压缩应力耐受性,阻止由盘前移位引起的退行性变化[63]。将CTGF 和TGF-β3 负载微球PLGA 分区嵌入PCL支架中,可以诱导BMSCs 分化为纤维软骨细胞,合成区域特异性Ⅰ型和Ⅱ型胶原蛋白,再生半月板,使膝关节功能恢复。同时,时空传递的CTGF 和TGFβ3 也恢复了再生半月板的不均匀机械性能[62]。
PDGF 是伤口愈合和组织修复必不可少的信号分子。Hanaoka 等[64]将PDGF 置于关节盘细胞的培养基中发现,细胞增殖率、胶原蛋白合成量和透明质酸合成量显著升高,表明PDGF 能增强关节盘细胞的增殖和基质合成。Detamore 等[60]比较了PDGF、bFGF 和IGF-I 对TMJ 关节盘细胞的增殖和生物合成的影响。总体而言,最有益的生长因子是bFGF,它在增加细胞增殖和GAG 合成方面最有效,也能有效促进胶原蛋白合成。PDGF 是有效的GAG 合成上调剂,但对胶原蛋白的产生没有显著影响。IGF-I 在较高的浓度下能有效促进胶原蛋白合成,但对GAG 的产生没有显著影响。
基于这些研究,许多生长因子增加了与关节盘相关的参数,如细胞增殖、胶原蛋白生成和GAG 生成。然而,只有TGF-β1 被证明可以增强细胞嵌入支架的机械性能[61]。为了改善关节盘结构,相关研究在涉及伴随递送、顺序递送或空间递送的组合应用中使用了生长因子。多种生长因子的受控递送可以改善愈合过程,因为自然愈合需要一种以上的生长因子被上调,并且通常涉及以时间依赖性方式变化的生长因子浓度[65]。同样值得注意的是,这些研究只涉及生长因子蛋白,基于基因层面的生长因子在关节盘细胞中的作用仍未被研究[66]。对于未来的工作,可以研究基于基因表达的信号传递和时空参数,以进一步提高生长因子对TMJ 关节盘再生的功效。
5 关节盘3D 生物打印
除了选择合适的材料外,还必须优化支架的结构,以最大限度地提高细胞和营养物质的浸润,同时保留维持TMJ 功能所需的机械性能。在支架设计过程中要考虑的重要因素包括孔径、孔隙率、整体形状、机械强度、柔韧性和特定区域的变化[67-68]。
TMJ 关节盘支架的制造方法包括脱细胞ECM 层压、水凝胶、模具铸造、增材制造、3D 生物打印和4D 打印[5,69]。其中,3D 生物打印是关节盘支架制造中常用的技术。从本质上讲,生物打印是快速成型或增材制造技术的扩展应用,当嵌入细胞相容性生物材料时,以逐层的方式在基板上打印生物功能材料[70]。由细胞、基础结构材料和其他必要成分组成的生物材料被称为“生物墨水”[71]。然后将基于细胞的生物墨水制成具有几何复杂性的所需形状和尺寸,以创建多面的3D 模拟组织结构。这为器官和组织打印提供了一个很有前途的途径,可以从细胞来源创建新的功能性3D 组织[72]。
使用3D 生物打印机可以正确分布和定位高密度的生物材料、信号因子和异质细胞,以形成组织工程结构。最终生物打印支架的质量受其生物相容性、生物降解性、细胞反应和暴露的组织微环境的影响[73]。此外,具有互连孔隙和大表面积的3D 生物打印结构支持细胞附着、生长、细胞间通信以及气体和营养物质的交换,这比传统的溶剂浇铸、相分离和熔体成型技术具有显著优势[74]。
根据制造功能性组织结构的基本工作原理,有不同的生物打印策略,即基于喷墨的生物打印、激光辅助生物打印、基于压力辅助的生物打印、声学生物打印、基于立体光刻的生物打印和磁性生物打印[73-74]。这些生物打印策略可以单独使用或组合使用,以实现所需的增材制造目标和组织构建。
生物墨水必须具有独特的特性才能在临床使用中进行优化,包括在体内和培养中的不溶解性、结构稳定性、与组织再生一致的降解速率、促进细胞生长和无毒特性,还必须与细胞整合[75]。尽管取得了很大进步,但设计合适的生物墨水和复杂的组织制造仍然具有挑战性。保持封装在生物墨水中的细胞的活力并确保它们免受打印过程的损害需要新的生物墨水配方、新的细胞来源和先进的打印技术。因此,需要建立标准化流程和质量控制方法。
生物打印技术具有生产结构与天然组织相似的复杂3D支架的潜力,非常适合应用于关节盘组织工程。然而开发能够承受负荷的功能性关节盘仍然具有挑战性。3D 生物打印还没有大规模的临床转化,目前的进展仅限于临床前研究[75]。
4D 打印是一种新的制造概念,涉及使用由响应性聚合物制成的3D 打印结构,可以受到pH、湿度、光和温度等外部因素的刺激。这些材料可以通过改变其形状或颜色、产生电刺激、变得具有生物活性、自组装或执行预期功能来对体内条件作出动态响应[69,76]。生成的3D 结构代表了一个更逼真的模型,模拟了原生人体环境并确保了生物实体的良好性能。尽管响应材料已经研究多年,但只有少数被用于组织工程的4D 打印。
6 总结与展望
由于TMJ 关节盘的自我修复能力有限,修复受损的关节盘仍然是一个长期的挑战。随着支架制造、细胞化策略和生长因子递送技术的不断发展,许多研究已应用于TMJ,但仍缺乏大量的临床试验来验证其在关节盘再生中的疗效。目前,通过3D 生物打印以关节盘的解剖形状进行支架制造方面已取得了显著进展,并且所使用的材料已被证明可以增加关节盘穿孔模型及关节盘置换术后的组织再生。将MSCs 与支架结合,在生长因子的调控下,可以增加纤维软骨组织的再生和机械强度,提供关节盘的功能性替代物,以保护髁突软骨免受损伤。然而,仍有一些具有挑战性的问题尚未解决,包括纤维软骨在组织工程化关节盘表面的修复和结合,关节盘再生的细胞选择,生长因子的调控机制、适宜浓度和组合应用方式,支架在TMJ 微环境中的生物力学性能,植入材料的移位以及长期疗效评估等。相信随着组织工程研究的不断深入,关节盘再生的临床应用将会走向成熟,成为TMD 可靠的治疗手段之一。
