兼具抗菌及促细胞黏附特性的钛表面光热涂层的研究
2023-01-13陆军曾德良
陆军 曾德良
光热疗法(PTT)被视为一种替代抗生素的细菌感染控制策略[1-2]。光热纳米颗粒在适当的近红外光(NIR)辐照下被激活,可局部释放热量[3]。PTT 的显著优势就是抗菌效果具有较强的普适性,对菌株的革兰氏菌特征或抗生素耐药性没有明显区分。临床上,细菌感染很少由浮游细菌引起,主要由生物膜生长模式中的细菌引起,细菌通过基质产生黏附并适应基质表面[4]。植入物术后感染,如因侵入性手术或创伤引起的感染[5],是生物材料植入失败的主要原因,因为植入物相关感染难以用抗生素等抗菌药物有效控制[6]。据报道,基于光热纳米颗粒的PTT 技术需要将其富集到感染部位并进行近红外辐射,方能产生更好的效果[7-9]。若将光热纳米颗粒用作植入物的涂层,则可保证光热纳米颗粒直接接触感染部位,从而提升PTT 疗效,有效控制感染。然而,通过近红外辐射杀死植入物表面上的细菌对植入物周围的细胞及组织也可能造成附带损害。寻求植体表面的抗菌光热涂层,同时也须强调涂层对周围细胞黏附及组织整合的保护与促进作用。本研究中,我们在钛表面制备了可被NIR 激活的聚多巴胺纳米颗粒(PDA-NP)涂层,进一步验证了其用于预防和治疗生物材料相关感染并维持组织整合的潜能。临床上,植入物组织整合的成败受到金黄色葡萄球菌(S.aureus)感染的挑战,因此本研究选择S.aureus 作为病原体,因其是种植体周围炎的主要致病病原体[10]。PDA-NP 具有良好的生物相容性、生物降解能力和较强的近红外吸收能力而被选择用作钛表面涂层[11-13]。本研究通过细菌和细胞共培养的模型评估钛表面的PDA-NP 涂层杀菌效果和细胞黏附效果。
1 材料与方法
1.1 主要材料和仪器
直径10 mm、厚度1 mm 的生物医用级Ti6Al4V圆盘材料(中国宝鸡君航金属材料有限公司)。NH4OH,无水乙醇,KOH 和盐酸多巴胺(上海阿拉丁生化科技股份有限公司)。FITC-phalloidin、DAPI 和CCK-8 试剂盒(上海碧云天生物技术有限公司)。小鼠前成骨细胞系(MC3T3-E1)购自中科院细胞库。
扫描电子显微镜(复纳科学仪器上海有限公司),红外成像摄像机(Fluke TiX580,荷兰),多功能全波长微孔板读取器(Multiskan GO,Thermo Fisher Scientific,美国),荧光显微镜拍照分析(Leica DM4000,Leica Microsystems Ltd.,德国)。
1.2 方法
1.2.1 钛表面光热PDA-NP 涂层的制备及其表征
钛表面首先经碱热处理:将钛片置于含有4 mol/L的KOH 溶液的反应釜中,80 ℃恒温反应2 h,自然冷却至室温,取出钛片,去离子水冲洗后干燥,处理完后的钛片标记为Ti。
在碱热处理后的钛表面合成光热纳米颗粒PDA-NP:7 mL NH4OH(28%~30%)与40 mL 无水乙醇和90 mL 超纯水室温下搅拌30 min。然后,向溶液中添加10 mL 多巴胺(50 mg/mL)溶液,并在30℃下搅拌24 h,将上述Ti-OH 钛片置于溶液内以形成PDA 纳米颗粒。用96%乙醇洗涤3 次,并用去离子水清洗3 次,在60 ℃的烘箱中干燥样品。处理后的钛片标记为Ti-PDA。
使用扫描电子显微镜(SEM),加速电压10 kV,检测钛样品上PDA-NP 涂层的形貌。表面喷涂10 nm厚的金层。
1.2.2 钛表面PDA-NP 涂层的光热效应
为了确定钛表面PDA-NP 涂层的光热效应,在808 nm(Thorlabs,Newton,NJ)下以1 W/cm2的功率密度进行近红外辐射3 min。在辐照期间,使用红外成像摄像机记录温度,完成整个样品表面成像。
1.2.3 细胞培养
使用小鼠前成骨细胞系(MC3T3-E1)对Ti-PDA 进行体外评价,并与Ti 进行比较。在37 ℃下,使用含有10%胎牛血清(FBS)和1%青霉素/链霉素的α-MEM 培养基在加湿环境中,37 ℃和5% CO2条件下培养细胞。样品在121 ℃下高压灭菌20 min,并放置在24 孔培养板中进行细胞接种。
1.2.4 细胞黏附
每个样品上接种1×105个细胞,培养12 h 后,固定细胞,梯度脱水干燥,扫描电镜成像。
1.2.5 细胞增殖
将MC3T3-E1 细胞以5×104细胞/样品的密度接种在24 孔板中的样品上,分别培养1、3 和7 d。在每个时间点,根据说明书加入CCK-8 工作液,并在37 ℃下培养2 h,在450 nm 处读取光密度值。
1.2.6 抗菌效果
1.2.6.1 光热抗菌效果
为了进行光热杀菌,将金黄色葡萄球菌ATCC12600 菌液稀释至5×104个细菌/mL 的浓度。向含有PDA-NP 涂层钛样品(Ti-PDA)的24 孔板中添加1 mL 细菌悬浮液,葡萄球菌黏附于PDA-NP涂层钛表面。1 h 后,PBS 洗涤样品并转移到新的孔中,进行3 min 的NIR 辐照。辐照后,将样品进行超声后,取表面黏附细菌,置于血液琼脂平板,37 ℃下培养48 h,然后计数所形成的菌落单位(CFU)。
1.2.6.2 光热抗菌对细胞黏附的影响
为了模拟手术植入过程中的污染,取1 mL 葡萄球菌悬液(5×104个细菌),接种在24 孔板中的样本表面。1 h 后,将样品转移到新孔中,PBS 洗涤3次。随后,将500 μL MC3T3-E1 悬浮液(1×105个细胞)接种在样本表面,37 ℃和5% CO2下培养2 h后,以1 W/cm2的功率进行3 min 的近红外辐照(808 nm)。培养24 h 后,进行FITC-phalloidin 和DAPI 染色,并使用荧光显微镜拍照分析。
1.3 统计学分析
2 结果
2.1 钛表面涂层的制备
SEM 观察显示,经过碱热处理的Ti 表面形成了均匀一致的多孔结构,而Ti-PDA 表面明显展示出与Ti 不同的表面结构(图1),可见PDA 粒子在涂层中的聚集。
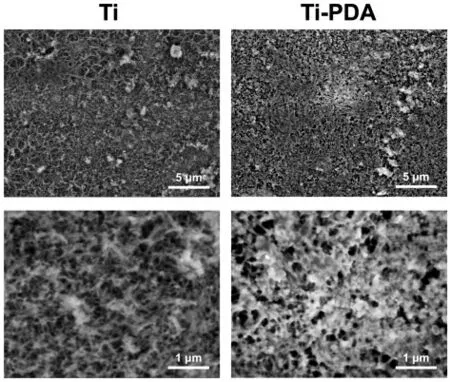
图1 SEM 图像:Ti 和Ti-PDA 的表面形貌Fig.1 SEM images: Surface morphology of Ti and Ti-PDA
2.2 钛表面涂层的光热效果
Ti 表面经NIR 辐照3 min 后,发生了接近4 ℃的轻微的光-热转换(图2)。相同条件下,Ti-PDA 的温度升高了约30 ℃。
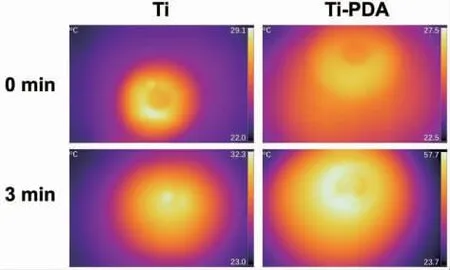
图2 Ti 和Ti-PDA 上808 nm(1 W/cm2)下NIR辐照3 min 后成像Fig.2 Irradiation imaging at 808 nm (1 W/cm2)for 3 min of NIR on Ti and Ti-PDA
2.3 钛表面涂层对细胞黏附的影响
接种早期的细胞的黏附和迁移对于之后的生长、增殖和分化至关重要。本研究中,MC3T3-E1 在Ti 和Ti-PDA 上培养12 h 后进行扫描电镜,结果显示MC3T3-E1 与两组钛基质结合均良好,细胞呈多边形,而Ti-PDA 组的钛表面细胞铺展更好,细胞聚集生长(图3)。
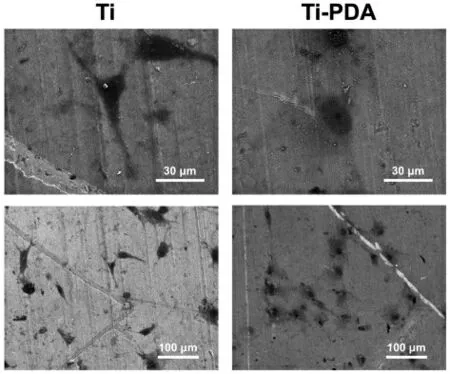
图3 细胞黏附:在Ti 和Ti-PDA 上培养12 h 的MC3T3-E1 细胞的SEM 照片Fig.3 Cell adhesion: SEM images of MC3T3-E1 cells cultured on Ti and Ti-PDA for 12 h
2.4 钛表面涂层对细胞增殖的影响
CCK-8 结果(图4)表明,在生长1、3 d 后,与对照组(CON)相比,Ti 和Ti-PDA 组均无显著差异。但在第7 天,Ti-PDA 样品的细胞增殖明显高于Ti 组和对照组(P<0.001)。
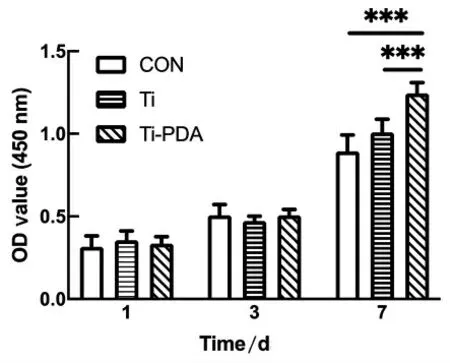
图4 不同样本表面分别培养1、3、7 天的MC3T3-E1 细胞增殖情况(***:P<0.001)Fig.4 The proliferation of MC3T3-E1 cells on the surface of different samples cultured for 1,3,7 days respectively(***: P<0.001)
2.5 钛表面涂层的抗菌效果
Ti 抑制细菌生长的能力有限,而在Ti-PDA 中可以清楚地观察到有效的生长抑制现象(图5A),Ti-PDA 中S.aureus 的菌落数明显小于Ti 组(图5B)。
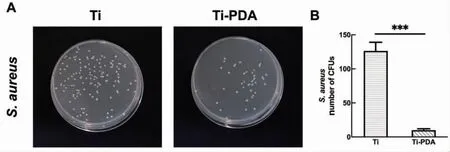
图5 抗菌活性检测(***:P<0.001)Fig.5 Antibacterial activity examination (***: P<0.001)
在模拟手术植入过程的污染模型中(图6A),当用NIR 照射至少3 min 后,Ti-PDA 组可见明显的细胞黏附,说明涂层可以在植入之前对黏附的葡萄球菌进行光热杀灭,从而显著改善细胞黏附(图6B)。
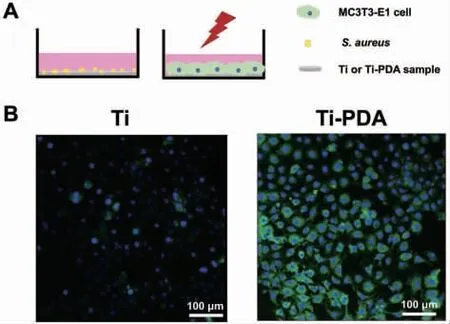
图6 MC3T3-E1 细胞与光热抗菌涂层的相互作用Fig.6 The interaction between MC3T3-E1 cells and the photothermal antibacterial coating
3 讨论
为了提高细胞在材料表面的黏附和生长,众多研究在植入材料表面制备纳米图形特征[14-15]。然而,部分研究结果适用性低、过于复杂和不实用的生产过程以及高制造成本,无法真正应用于临床。因此,在临床植入物表面产生纳米形貌的新技术开发应侧重于将功能性与适用性相结合。PDA 纳米涂层因其易操作性和良好的生物相容性、可降解性,近年来受到越来越多的关注。
光热治疗不仅可以作为每次手术阶段的感染预防措施,也可以作为术后阶段的感染治疗措施。在每次手术的早期,光热治疗可以杀死手术早期可能污染植入物表面的细菌,而散热引起的组织损伤并不重要[16-17]。而在术后阶段,使用光热治疗必须考虑散热引起的组织损伤。因此本研究从预防散热导致的损伤出发,在植入物表面增加具有良好细胞黏附性能的光热抗菌涂层,成功制备出Ti-PDA 样品。
虽然钛基合金是最常用的生物医学植入材料,但其固有的惰性并不能促进植入物表面与周围骨的牢固结合。钛合金不能增强宿主组织中成骨细胞的成骨活性是导致种植体松动的主要原因[18-19]。本研究中,Ti-PDA 显示出优异的促成骨细胞黏附和增殖的能力,有望显著促进植体的骨整合效果。
4 结论
研究证实,具有聚多巴胺纳米粒子光热涂层的生物植入物Ti-PDA 具有良好的生物相容性,能够促进成骨细胞的增殖;同时,该涂层在光热效果下具有良好的抗菌性能,杀死污染表面的细菌并同时有效维持细胞黏附,促进组织整合。
