泰山蛹虫草多糖对高脂高胆固醇诱导ob/ob小鼠非酒精性脂肪肝的影响
2023-01-12贾修滨司艳红李彩柳
陈 昊,贾修滨,司艳红,李彩柳,张 颖
(山东第一医科大学·山东 济南 250117)
目前,非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)发病率和早期诊断率逐年上升,且呈低龄化趋势,全球患病率约25%,已成为发病最为普遍的一种慢性肝脏疾病,是世界性的公共的卫生问题[1]。NAFLD与肝损伤和代谢紊乱密切相关[2],主要源于肝脏内脂肪堆积与变性以及由此引发的氧化应激和炎症反应,其中肝脏三酰甘油(TG)的含量增多是NAFLD的标志性特征[3],而游离脂肪酸(FFA)的过度摄取,最终会导致肝脏TG 增多[4]。NAFLD主要通过改变饮食和生活方式、去除疾病诱因等基础防治手段进行干预,临床上仍缺乏特效药物[5]。因此,NAFLD的新药开发具有重要的现实意义。
蛹虫草又称北虫草、北冬虫夏草、蛹草、蛹草菌、东北虫草等[6],蛹虫草多糖(Cordyceps militaris polysaccharide, CMPS)是其主要活性成分,具有多种生物活性。课题组前期研究证实,CMPS可显著降低细胞胆固醇(TC)水平[7],促进CETP-tg小鼠胆固醇逆转运(reverse cholesterol transport, RCT),调控脂质代谢[8]。基于上述研究,提示蛹虫草多糖对肝脏脂质具有调控作用。本实验拟选用高脂高胆固醇诱导的肥胖型ob/ob小鼠作为动物模型,评价CMPS纯品对脂质代谢及肝功能的影响。
1 材料与方法
1.1 材料 SPF级8 周龄雄性ob/ob小鼠购于北京华阜康生物科技有限公司,体质量(40±5)g,实验动物许可证号:SCXK(京)2019-0008。小鼠饲养于湿度50%~60%、温度(22±1)℃环境中,12 h/12 h循环光照。动物实验遵循山东第一医科大学实验动物道德伦理委员会有关规定。蛹虫草购于泰安市岱珍生物科技有限公司,经山东第一医科大学药学院苏延友教授鉴定为虫草属(Cordycps)真菌蛹虫草[Cordycepsmilitaris(L.)Link]的子实体。常温晾干,粉碎成粗粉(40目),多糖的提取参照课题组以往方法[6]。非诺贝特购于索莱宝生物科技有限公司(纯度≥99%)。小鼠高脂高胆固醇饲料订制于北京华阜康生物科技有限公司。SOD、MDA、ALT、AST试剂盒:南京建成生物科技有限公司;TG、TC试剂盒:中生北控生物科技有限公司;FFAs试剂盒:朗顿,BPE20248。Hei-VAP Expert Control/Ultimate Control旋转蒸发仪:德国Heidolph;FD8508真空冷冻干燥机:韩国Ilshin;Varioskan LUX多功能酶标仪:Thermo Fisher;BX51倒置荧光显微镜:日本奥林帕斯;F6/10匀浆器:上海氟鲁克;CUT4062石蜡切片机:德国莱卡。
1.2 动物分组、造模及给药 雄性 ob/ob 小鼠40 只随机分为模型组(Model)、非诺贝特组[20 mg/(kg·d)](Fenofibrate)及蛹虫草多糖[25、50、100 mg/(kg·d)](Low,Middle,High)组,每组8只,均以高脂高胆固醇饲料(脂肪34.90%,胆固醇26.20%)饲养。药物采用 3%羧甲基纤维素钠溶解后,经口灌胃给予相应剂量,模型组同时给予一定剂量 3%羧甲基纤维素钠,连续用药12 周后处死小鼠,进行相关指标检测。
1.3 观察指标及检测方法
1.3.1 小鼠一般情况记录 记录小鼠日食量、每周体质量变化,用药末处死小鼠,记录肝脏重量,计算肝指数。
1.3.2 血脂检测 末次给药后,小鼠禁食12 h,内眦取血,酶法检测血清TC、TG、HDL-C水平,TC 减去 HDL-C即为Non-HDL-C 水平。
1.3.3 肝组织相关指标检测 4 ℃条件下,称取适量新鲜肝脏于PBS中匀浆,离心匀浆液(1 000 g)15 min,取上清液,BCA测定肝组织蛋白含量;赖氏法检测肝组织中谷丙转氨酶(ALT)与谷草转氨酶(AST)活力;分别采用WST-1法和TBA法检测肝组织(SOD)活性和(MDA)含量;酶法测定上清液中TG、TC含量,ELISA方法检测游离脂肪酸(FFAS)含量;另取部分新鲜肝脏10%甲醛固定,石蜡包埋,组织切片(5 μm),HE染色后进行病理学检测。
1.4 统计学方法 统计学分析采用t检验,实验结果采用平均数±标准差表示,P<0.05视为有显著性差异。
2 结果
2.1 蛹虫草多糖对高脂高胆固醇ob/ob小鼠日食量和体质量的影响 各组小鼠平均日食量基本相同,与模型组相比,无显著变化。前5周,各组体质量差异不明显。自第6~12周末,多糖高剂量组与非诺贝特组体质量明显低于模型组(P<0.05)。见图1~图2。
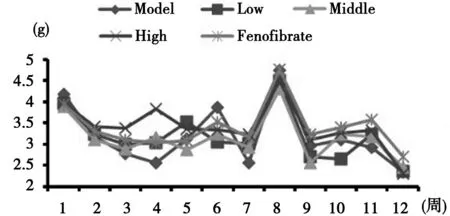
图1 各组ob/ob小鼠日食量变化

注:与模型组比较,*P<0.05图2 各组ob/ob小鼠体质量变化
2.2 蛹虫草多糖对高脂高胆固醇饮食ob/ob小鼠血脂的影响 见表1。
表1 各组ob/ob小鼠血脂水平比较
2.3 蛹虫草多糖对高脂高胆固醇饮食ob/ob小鼠肝脏指数及脂质的影响
2.4 蛹虫草多糖对高脂高胆固醇饮食ob/ob小鼠肝组织病理变化的影响 HE染色结果显示,模型组肝细胞内出现大量脂滴,部分肝细胞甚至出现坏死。

表2 各组ob/ob小鼠肝脏指数和肝组织TC、TG、FFA水平比较
蛹虫草多糖剂量依赖性地改善肝组织脂肪变性,高剂量多糖组肝组织中央静脉和小叶结构清晰可见。见图3。

图3 各组ob/ob小鼠肝组织病理变化(HE,×200)
2.5 蛹虫草多糖对高脂高胆固醇饮食ob/ob小鼠肝组织氧化应激的影响 见表3。

表3 各组ob/ob小鼠肝组织SOD活性、MDA含量的比较
2.6 蛹虫草多糖对高脂高胆固醇饮食ob/ob小鼠肝功能的影响 见表4。

表4 各组ob/ob小鼠肝组织ALT、AST水平的比较
3 讨论
NAFLD 被认为是代谢性疾病。2020年国际上将 NAFLD 更名为代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)[9]。肝脏作为脂质代谢的重要器官,主要负责脂肪酸的摄取、脂肪酸的合成以及脂肪酸向其他组织的输出及重新分布[3]。肝脏脂肪变性是导致非酒精性脂肪肝的最主要因素,主要表现为肝脏 TG 增多[10-11]。而肝脏脂肪酸的摄取增多和氧化易导致肝脏 TG 异常增多和脂肪变性,在氧化应激和脂质过氧化等作用下肝细胞最终发生损伤、炎症、纤维化等病理改变[12]。因此,非酒精性脂肪肝的主要诱因之一就是肝细胞脂肪酸摄取增多导致的脂肪变性。
目前,临床仍缺乏 NAFLD 的有效治疗药物,主要通过饮食、运动等生活方式调控和防治。我国地域辽阔,药用植物资源丰富,部分天然药物富含活性成分,在调控脂质代谢和非酒精性脂肪肝方面功能显著[13-16]。本实验结果显示,泰山蛹虫草多糖可显著抑制肝脏摄取FFA,降低肝组织TG 含量。另外,通过减少氧化物质MDA含量和升高抗氧化物质SOD活性抗氧化应激反应。因此,泰山蛹虫草多糖可通过调控血脂代谢和氧化应激,改善高脂高胆固醇饮食诱导的脂质蓄积和肝脏功能,降低NAFLD患病风险。今后将进一步明确其防治非酒精性脂肪肝的分子机制和作用靶点。
