拟南芥酪氨酸蛋白磷酸酶PTP135基因克隆及功能分析
2023-01-12刘静
刘静
拟南芥酪氨酸蛋白磷酸酶基因克隆及功能分析
刘静
广东职业技术学院, 广东 佛山 528041
拟南芥T-DNA插入突变体ptp135具有与phyB突变体相似的特征,萌发时下胚轴伸长、子叶张开角度小、展开慢,后期表现为开花早、叶色浅、叶柄长、叶面积增大。采用PCR法从拟南芥叶片中克隆启动子基因,启动子连接到载体pCAMBIA1391,构建植物双元表达载体pCAMBIA1391-135p,构建的载体经过鉴定后,运用农杆菌介导的沾花法将启动子转化野生型拟南芥,用潮霉素筛选转化阳性株,对阳性株进行GUS组织化学染色,结果表明基因定位在维管束、柱头和花丝。采用PCR方法从拟南芥叶片中克隆基因,连接到载体pEZS-NL,构建瞬时表达载体pEZS-NL-135e,采用基因枪法转化洋葱表皮,结果表明编码的蛋白定位在细胞核和细胞膜。拟南芥野生型、ptp135和phyB,待即开花时取样,做光周期特异性基因、的RT-PCR表达分析,结果表明和基因在ptp135突变体中表达时间延长,表达量增加,证明可以在转录水平上调控和,参与植物开花调控途径,作用位点在上游。
拟南芥; 酪氨酸蛋白磷酸酶; 基因克隆
高等植物的生活史包括种子萌发、营养生长、开花等一系列发育阶段,其中开花过程直接影响作物生育期,与作物产量品质密切相关,该领域相关研究对农业和园艺生产具有重要的意义。
高等植物花的形成是由一系列环境和内部因子调控的。20世纪90年代,拟南芥作为模式植物得到了广泛研究,通过拟南芥早花或晚花突变体,鉴定分离出相关开花时程基因。相关研究表明调控拟南芥开花时程的途径至少有4种,即光周期途径,春化途径,自主途径和赤霉素途径,这四条途径通过,,,,等调控开花的基因相互作用而联系在一起。
影响高等植物开花最重要的环境因子之一是光周期(Photoperiod),植物通过光受体感受光周期信号后,作用于生物钟,调控某些促进开花基因的表达,降解某些抑制开花因子的表达。光周期对高等植物开花的调控是通过相关基因间的相互作用来实现的,光敏色素(Phytochrome, Phy)是光周期反应中一种重要的光受体,拟南芥中包含有4~5个不同生理功能的光敏色素基因,分别为,其中、在光周期途径种发挥不同的功能,在一定条件下促进开花,而则抑制开花。光受体接收光周期信号后,由光信号传导分子将光信号传递到内源的控时器——“生物钟”,生物钟将检测的光周期信号传输给主要信号分子,进而诱导其靶位基因的表达,从而实现了光周期对开花时间的调控。
实验中发现拟南芥突变体ptp135(T-DNA插入突变体)表现为早花,ptp135具有与phyB突变体相似的形态特征,编码酪氨酸蛋白磷酸酶,PTPases作为一种开关调控因子,在植物生长发育等很多方面发挥着重要的作用,推测可能参与开花信息传递。本研究就是在此基础上,通过分子操纵等多种手段,深入探讨基因的克隆及表达特性分析,揭示其信息传递的具体机制。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 拟南芥野生型种子,ptp135T-DNA插入突变体种子。在室温18~25 ℃,相对湿度80%,光照时间12 h条件下,将不同种类的拟南芥种子直接播种于营养土、蛭石和沙子(2:1:1)的混合基质中。
1.1.2 质粒及菌株 pCAMBIA1391,pCAMBIA1300-Super载体,pEZS-NL载体,pMD18-T simple载体,农杆菌菌株GV3101,大肠杆菌DH5α菌株由本实验室保存。
1.1.3 酶及试剂 所用的各种Taq酶,限制性内切酶,T4 DNA连接酶均购自TaKaRa公司;M-MLV反转录酶,Rnase抑制剂购于Promega公司,植物总RNA提取试剂盒购于OMEGA公司。潮霉素、利福平等抗生素购自鼎国生物公司。其他无机盐类试剂均为分析纯,购自北京化学试剂公司。
1.2 突变体ptp135表型观察分析
1.2.1 发育形态分析 将ptp135phyB和野生型拟南芥的种子,分别表面灭菌,播种于1/2MS培养基上(1/2MS+1%蔗糖+0.7%琼脂),待种子萌发后观察植株发育形态。
1.2.2 开花时间分析 将ptp135phyB和野生型拟南芥的种子,分别直接播种于营养土:蛭石:砂土(2:1:1)的基质中,短日照(12 h),观察植株开花时间。
1.3 PTP135基因定位分析
1.3.1 DNA提取 取野生型拟南芥新鲜叶片100 mg,液氮中研磨成粉末,CTAB法小提拟南芥基因组DNA。
1.3.2 基因克隆 以野生型拟南芥基因组DNA为模板,PCR扩增启动子基因序列,上游引物引入BamHI酶切位点,下游引物引入NcoI酶切位点。PCR引物:5’-GCGGATCCAATGGGCAACGGTATGG-3’,5’-ATCCATGGGCTTCATCTCTGAATTGGGA-3’。PCR体系为:2.5 μL 10×buffer,0.5 μL dNTP,1 μL引物,0.5 μL DNA,0.25 μL LA Taq酶,加ddH2O至25 μL。PCR程序设置为:94 ℃预变性4 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸2 min,循环次数30,72 ℃延伸7 min。
1.3.3∷GUS植物双元表达载体构建启动子基因克隆片段电泳纯化回收,连接pMD18T-Simple载体,转化大肠杆菌DH5α感受态,挑选阳性克隆进行测序检测。用限制性内切酶BamHI和NcoI进行双酶切pMD18T-Simple载体和pCAMBIA1391载体,连接,转化大肠杆菌,筛选出阳性克隆,得到启动子启动GUS基因的植物双元表达载体∷GUS(pCAMBIA1391-135p)。
1.3.4 冻溶热击法转化农杆菌 把1 μL pCAMBIA1391-135p质粒加入50 μL农杆菌感受态菌液中,冰冻20~30 min,菌液液氮中冷冻1 min,然后37 ℃水浴融化,加入800 μL LB液体培养基,28 ℃温育4 h,6000 rpm离心5 min,剩余200 μL涂板(LB固体培养基加相应抗生素)。
1.3.5 根癌农杆菌介导的沾花法转化拟南芥植株 取分离单菌落置于含卡那霉素(50 μg/mL)、庆大霉素(40 μg/mL)、四环素(2 μg/mL)、利福平的10 mL LB液体培养基中,摇菌培养18 h。取摇好的菌液按照1:100的比例转接到含有相同抗生素的LB液体培养基,过夜培养,收集菌体,用渗透缓冲液重悬,调节OD600=0.8。当野生型拟南芥的花序露白时,对生长状态良好的植株进行农杆菌侵染,并将侵染的植株密闭暗培养24 h,后继续常规培养。共重复转化3次,每隔6 d1次。
1.3.6 转化阳性株的筛选 转化后的拟南芥种子在1/2MS (+潮霉素50 μg/mL)培养基播种,4 ℃培养3 d,温室条件继续培养。种子萌发后,选择2片绿色子叶、生长良好的转基因阳性株,移栽至营养土、蛭石和沙子比例为2:1:1的混合基质中,进行常规温室管理。
1.3.7 GUS组织化学染色 配制新鲜染色液,取20 µL X-gluc(5 mg X-gluc溶于410 μL DMF),加入760 µL 0.05 mol·mL-1磷酸钠缓冲液(pH7.0),10 μL 50 mmol·L-1K3[Fe(CN)6],10 μL 50 mmol·L-1K4[Fe(CN)6],10 μL 0.5 mol·L-1EDTA,1 μL Triton X-100,200 µL甲醇。将材料放入染色液中染色,低龄小苗子不需加负压,染色0.5 h;苗龄较大或成株需加负压2 min,染色5~6 h。染色后用70%酒精脱色数小时,并在显微镜下观察染色情况。
1.4 PTP135蛋白表达定位分析
1.4.1基因序列克隆 以野生型拟南芥基因组cDNA为模板,PCR扩增基因序列(全长631 bp),上游引物引入EcoRI酶切位点,下游引物引入SalI酶切位点。PCR引物:5’-ATGAATTCATGAAGCTTGTGGAGAAGACGAC-3’,5’-ATGTCGACCGCCTGATGGAACAAGAG-3’。PCR体系同上。PCR程序设置为:94 ℃预变性4 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸1 min,循环次数30,72 ℃延伸7 min。
1.4.2 35S∷∷GFP瞬时表达载体构建 载体构建程序同上,基因序列连接到载体pEZS-NL,得到瞬时表达载体载体35S∷∷GFP(pEZS-NL-135e)。
1.4.3 基因枪法转化洋葱表皮 取洁净洋葱内表皮1 cm2,放置于1/2MS培养基上。用8.5 µL金粉悬浮液(60 mg金粉悬浊于1 mL无菌水中),3.5 µL 0.1 mol·L-1亚精胺,8.5 µL 2.5 mol·L-1CaCl2,1~5 µg DNA(pEZS-NL-135e),加10 µL无水乙醇,制备DNA-金粉复合体微粒载体。用DNA-金粉复合体微粒轰击洋葱表皮,在黑暗中培养20 h左右,在荧光显微镜下进行观察。
1.5 突变体ptp135的基因表达分析
1.5.1 表达半定量 RT-PCR Plant RNA Kit提取拟南芥野生型总RNA,M-MLV Reverse Transcriptase反转录合成cDNA,以cDNA为模板进行PCR扩增。具体方法为:1.3 μg RNA,加2 μL Oligo(dT)15,70 ℃变性5 min;之后加入5 μL M-MLVbuffer,1.25 μL dNTPMix,1 μL M-MLV,0.6 μLRNaseinhibitor,补充DEPC水至25 μL,37 ℃反应1 h。PCR相关引物为克隆基因片段引物,PCR程序为:94 ℃预变性5 min,94 ℃变性45 s,58 ℃退火50 s,72 ℃延伸1 min,30个循环,72 ℃延伸7 min。
1.5.2,光周期基因的表达分析 短日照(12 h)条件下种植拟南芥野生型、ptp135和phyB,待即开花时采集样品,从早上8时到凌晨4时,每隔4 h取一次样,上午8时(光照前1 h)、上午12时(光照前3 h)、下午16时(光照后7 h)、晚上午20时(光照后11 h)、凌晨24时(黑暗3 h),凌晨4时(黑暗7 h)采,采集拟南芥叶片,提取总RNA,反转录,做,基因的RT-PCR,检测,的基因表达。
2 结果与分析
2.1 突变体ptp135表型观察分析
2.1.1 发育形态分析 突变体ptp135萌发时呈现与phyB非常相似的形态特征,具体表现为下胚轴伸长、子叶展开慢、张开角度小(如图1所示)。

图1 拟南芥野生型,phyB,ptp135胚轴伸长比较
1: 野生型 2: phyB 3: ptp135
2.1.2 开花时间分析ptp135、phyB与野生型在12 h短日照下开花时间具有明显差异 ptp135突变体发芽后约3~4周,莲座叶数为8~9片时即抽苔开花(如图2所示),ptp135开花时间与phyB相一致,远远早于野生型。

图2 拟南芥野生型,phyB,ptp135开花时间的比较
1: 野生型 2: phyB3: ptp135
2.2 PTP135基因定位分析
2.2.1启动子基因克隆 如图3所示,以野生型拟南芥基因组DNA为模板,在2000 bp的位置上扩增出启动子基因PTP135p目的条带。

图3 PTP135启动子基因PCR扩增片段的电泳检测
1.启动子
2.2.2 植物双元表达载体pCAMBIA1391-135p构建 把PTP135p连接到表达载体pCAMBIA1391,酶切和PCR验证结果如图4所示,证明载体pCAMBIA1391-135p构建成功。

图4 酶切、PCR验证pCAMBIA1391-135p
1. pCAMBIA1391-135p的酶切验证 2. pCAMBIA1391-135p的PCR验证
2.2.3 拟南芥的转化和阳性株的筛选 构建的pCAMBIA1391-135p载体采用沾花法用于野生型拟南芥的转化。抗性筛选结果如图5所示,种子萌发后可以继续生长,且叶子为绿色的是阳性株,每皿可筛选出3~10株阳性株。进一步对筛选植株株进行PCR鉴定,取生长期10 d左右的植株叶片,用玻片磨碎,加入100 μl ddH2O稀释,取3 μL作为PCR扩增模板进行检测。

图5 转基因拟南芥种子的筛选
箭头所指为转基因阳性株
2.2.4基因定位分析 对转启动子基因的T3代阳性植株,分别在两片子叶、四片真叶和花期时进行GUS染色。幼苗时整株进行染色;开花后对花序进行染色。染色如图6所示,幼苗时期叶片、茎和根系维管束表现为蓝色;花期花柱和花丝表现为蓝色,表明基因定位在维管束和叶肉细胞,花柱以及花丝、花托。

图6 转PTP135启动子植株的GUS染色
1. stage2整株; 2. stage2叶片; 3. stage4整株; 4.stage4根系局部; 5. stage13花序; 6. stage13雄蕊雌蕊; 7. stage13雄蕊; 8. stage13后期花序; 9. stage13后期雄蕊雌蕊
2.3 PTP135蛋白表达定位分析
2.3.1基因克隆 以野生型拟南芥基因组cDNA为模板,在600 bp左右的位置上扩增出基因序列PTP135e,如图7所示。
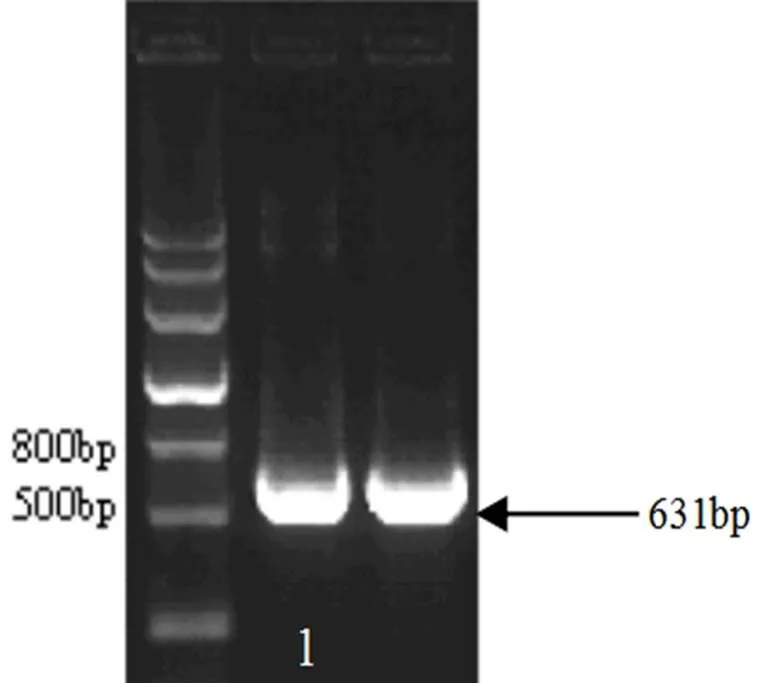
图7 PTP135基因PCR扩增片段的电泳检测
1.基因
2.3.2 瞬时表达载体pEZS-NL-135e构建 将克隆的基因连接到pEZS-NL载体,限制性内切酶酶切和PCR方法验证结果如图8所示,证明载体pEZS-NL-135e构建正确。
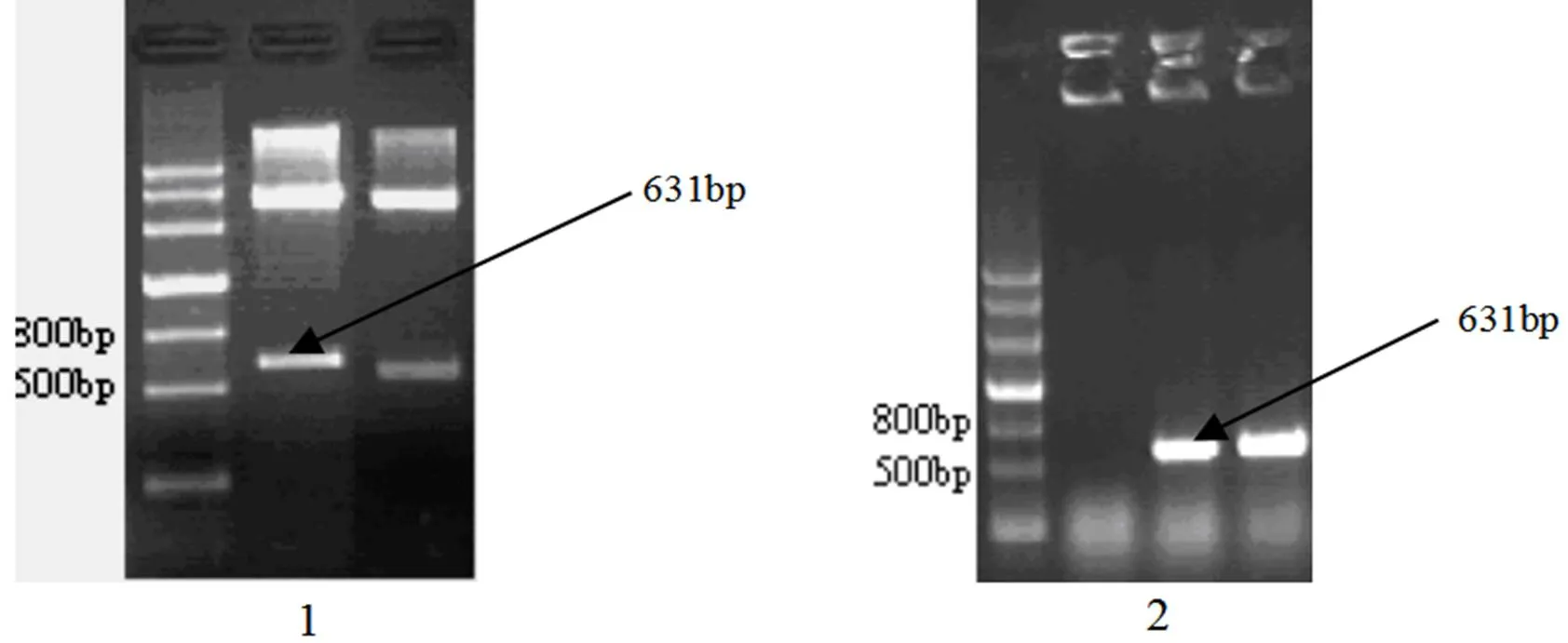
图8 酶切、PCR验证pEZS-NL-135e
1. pEZS-NL-135e的酶切验证 2. pEZS-NL-135e的PCR验证
2.3.3基因亚细胞定位分析 DNA(pEZS-NL-135e)-金粉复合体微粒,利用基因枪轰击洋葱表皮,暗培养后荧光显微镜下观察,洋葱细胞的细胞质发出绿色荧光(如图9所示),说明基因编码的蛋白定位在细胞核和细胞膜。
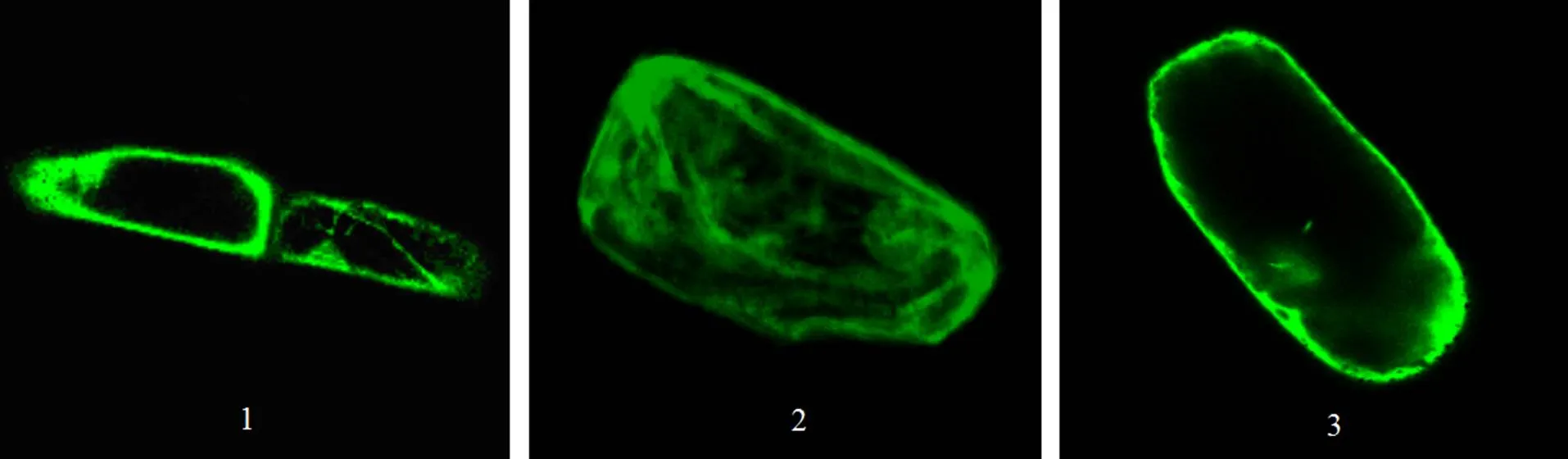
图9 PTP135:GFP在细胞质的特异分布
Fig.9Subcellular localization of:GFP
1. 20倍放大; 2. 20倍放大下细胞立体图; 3. 60倍放大
2.4 突变体ptp135的基因表达分析
在光周期途径中,基因在表达水平上受到的调控,基因的表达在光照下受到的抑制,而的靶基因基因相应的受到的诱导。野生型中正常存在,使蛋白降解,phyB中由于的缺失,丧失了对调控的能力,致使蛋白过量表达,造成植株早开花。实验检测了野生型、ptp135和phyB中、基因的表达,实验结果如图10所示,植株中基因在光照开始前有表达,光照开始后表达量非常低,在光照7 h后有少量表达,而后表达量逐渐增加,黑暗条件下表达量最大。光照前1 h,照光3 h,照光7 h,照光11 h,黑暗3 h,表达量在ptp135、phyB突变体中强于野生型,基因的表达也呈现类似特征。实验结果表明突变体ptp135中和表达时间延长,表达量增加,导致突变体植株早开花。证明可以在转录水平上调控和,参与了植物开花调控途径,作用位点在上游。

图10 不同基因型拟南芥中CO、FT基因的表达分析
Fig.10Expression ofin different genotypes
1. 野生型; 2. ptp135; 4. phyB
A.光照前1 h; B.照光3 h; C.照光7 h; D.照光11 h; E.黑暗3 h; F.黑暗7 h
3 结论与讨论
高等植物在进化发展过程中形成了一套光信号接受和信号转导系统。拟南芥中重要的光受体参与了一系列重要的光形态建成反应。在正常栽培条件下,缺失基因的phyB突变体植株,幼苗出现胚轴伸长,叶片变小变黄,展开缓慢等形态特征,成年植株表现出叶片叶柄伸长,叶片表面积增大,早开花等特征。有研究表明在光周期途径中,植株中基因的转录丰度和蛋白的稳定性最终决定了植株的开花时间。而蛋白的表达水平受到光照在转录后水平的调控,这种调控主要通过,等光受体实现。和隐花色素在白天促进蛋白的稳定,促进植物开花,而在清晨时被激活,抑制和隐花色素的活性,使蛋白降解,抑制植物开花。在不同条件下表达的差异,最终决定了植物开花时间的差异。
我们在实验过程中发现,在短日照(12 h)条件下,ptp135突变体萌发时下胚轴伸长,叶柄伸长,叶片变小变黄,ptp135开花时间明显早于野生型,出现了与phyB突变体相似的表型特征,表明基因可能参与了介导的光周期信号传递系统。
为了更好的研究的功能和作用机理,首先研究了的基因定位和蛋白定位。实验结果证明基因定位在维管束,叶肉细胞,花柱和柱头的连接处,花丝和花托,基因编码的蛋白定位在细胞质。
在光周期途径中,及其直接作用基因已被广泛认同是拟南芥开花的特异性基因,野生型拟南芥中、基因的表达受光周期的影响呈现一定的规律。我们对ptp135突变体中的、基因表达进行分析,并与野生型拟南芥和phyB中进行比较,表明ptp135中和表达时间延长,表达量增加,ptp135中的缺失促进了植株,的表达,导致突变体植株早开花。这一结果初步证明可以在转录水平上调控和,参与了植物开花调控途径,作用位点在上游。
综上所述,基因参与了光周期途径,其作用位点是在的上游还是下游,是如何与起作用,是否与有相互作用,这些都需要进一步的分子生物学和蛋白相关的实验来阐释。
[1] 郑玉娟,周文化,张党权,等.月月桂基因的cDNA全长克隆及生物信息学分析[J].中南林业科技大学学报, 2015,35(6):87-92
[2] 沙爱华,王英,刘志文,等.植物开花光周期反应的分子调控机制[J] .华北农学报,2006.21(增刊):12-15
[3] 刘嘉荔,刘红达,汪宏涛,等.番茄DNA甲基转移基因SIDRM2L的克隆及表达分析[J].合肥工业大学学报(自然科学 版),2022,45(3):406-410
[4] 王婉茹,刘莹,刘红利,等.荷花NnWRKY22基因的克隆与表达分析[J].福建农业学报,2022,37(4):486-491
[5] 李淳,刘学辉,卜昶栋,等.侵染番茄的苎麻花叶病毒分子特征及其基因序列分析[J].中国瓜菜,2022,35(1):9-15
[6] Lin C. Photoreceptors and regulation of flowering [J]. Plant Physiol, 2000,123(1):17-27
[7] Jaeger KE, Pullen N, Lamzin S,. Interlocking feedback loops govern the dynamic behavior of the floral transition in Arabidopsis [J]. Plant Cell, 2013,25(3):820-833
[8] Rosas U, Mei Y, Xie QG,. Variation in Arabidopsis flowering time associated with cis-regulatory variation in CONSTANS [J]. Nat Commun, 2014,5:3651
[9] Song YH, Estrada DA, Johnson RS,. Distinct roles of FKF1, GIGANTEA, and ZEITLUPE proteins in the regulation of CONSTANS stability in Arabidopsis photoperiodic flowering [J]. ProcNatl Acad Sci USA, 2014,111(49):17672-17677
[10] Song YH, Smith RW, To BJ,. FKF1 conveys timing information for CONSTANS stabilization in photoperiodic flowering [J]. Science, 2012,336(6084):1045-1049
Expression and Function Analysis onGene of Protein Tyrosine Phosphatase in
LIU Jing
528041,
The characteristics of ptp135 mutant of Arabidopsis thaliana was similar to phyB mutant. The young seeding had a higher hypocotyl, opening cotyledon with a smaller angle, and slower expansion. At the later stage, it showed early flowering, lighter leaf color. We cloned thepromoter gene from typeleaves by PCR. Thepromoter gene was connected to the vector pcambia1391, and the vector pcambia1391-135p was constructed. Then the vecter was transformed into wild type A. thaliana by Agrobacterium-mediated flower dipping method. The results showed that ptp135 gene was located in vascular bundle, stigma and filament. We cloned the PTP135 gene from Arabidopsis thaliana leaves by PCR. Thegene was connected to the vector pEZS-NL, and the vector pEZS-NL-135e was constructed and transformed into onion epidermis by particle bombardment. The results showed that the protein of ptp135 was localized in the nucleus and cell membrane. The RT-PCR results showed that the expression time ofandin ptp135 was longer and the expression level was more than in the wild. It was proved thatcould regulateandat the transcriptional level.worked in the flowering regulation pathway, and the action site was in the upstream ofgene.
; protein tyrosine phosphatase; gene cloning
Q943.2
A
1000-2324(2022)05-0803-08
2022-03-28
2022-04-10
广东省2021年度教育科学规划课题(2021GXJK144)
刘静(1981-),女,硕士研究生,讲师,研究方向:植物信号传导. E-mail:444875816@qq.com
