超声辅助酶法提取咖啡果皮果胶工艺的优化及其理化特性分析
2023-01-12李泽林邬文君高艳赵春燕范江平沈晓静郑婷婷
李泽林,邬文君,高艳,赵春燕,范江平,沈晓静,2,3*,郑婷婷
(1.云南农业大学,食品科学技术学院/理学院,云南昆明 650201)(2.云南省天然药物重点实验室,昆明医科大学,云南昆明 650500)(3.云南省有机茶产业智能工程研究中心,云南省高校智能有机茶园建设重点实验室,云南昆明 650201)(4.普洱茶研究院,云南普洱 665099)
咖啡是世界三大饮料作物之一,是国际贸易中最重要的农产品[1]。近年来,中国的咖啡消费量快速增长,是潜在的世界咖啡贸易和消费市场。云南种植的咖啡主要为小粒种咖啡,占全国咖啡豆产量的98.80%[2],因其独特的气候条件,所产的小粒咖啡品质优异,以普洱市、保山市、临沧市和德宏州为主要种植区[3]。咖啡加工过程中会产生大量的咖啡果皮,这些果皮通常会被直接丢弃,只有小部分用于堆肥和制作咖啡果皮茶等再利用[4];被直接丢弃的咖啡果皮不仅造成资源浪费,而且在一定程度上还会对环境造成污染,因此对咖啡果皮进行无害化处理或者再利用非常有必要[5]。研究报道显示,咖啡果皮中含有25%~30%的果胶[6],从咖啡果皮中提取咖啡果胶,可达到分解咖啡果皮的效果,且产物对环境无污染,提取的果胶可用于开发新产品,如食品添加剂、制作面膜等,推动当地农业经济的发展。
果胶是一种普遍存在于高等植物的酸性杂多糖,大多由α-1,4-糖苷键连接D-半乳糖醛酸残基组成[7],以多聚半乳糖醛酸链构成主链骨架,侧链由中性糖连接而成[8]。果胶具有良好的抗氧化、抗炎症、抗凝血、降脂、抑菌和免疫调节等生理和药理活性作用,是天然的活性成分[9,10]。因上述结构和功能特性,使其在工业生产、天然食品添加剂及功能食品的开发中得到了广泛的应用,具有较大的研究价值和发展前景[11,12]。咖啡果胶已被证明了有较好的抑菌作用[6],但是目前还尚未见到相关其起泡性、泡沫稳定性、持水性和持油性等理化特性的研究报道;对咖啡果胶理化特性的深入研究可有助于其作为一种天然添加剂或者基料应用在食品、工业、材料等领域,提高其经济和应用价值。
此外,目前咖啡果胶的提取以热水和酸提取法为主,比较单一而且还鲜有研究报道超声辅助酶提取咖啡果皮果胶。因此,本研究拟采用响应面法优化云南小粒咖啡果皮果胶的最佳超声辅助酶提取工艺条件,采用傅里叶红外光谱(FT-IR)表征粗果胶官能团组成;再经纯化后比较粗果胶和精果胶的理化特性。旨在为云南小粒咖啡果皮果胶的多元化提取、综合利用和开发提供理论依据和试验基础。
1 材料与方法
1.1 材料与试剂
云南小粒咖啡(卡蒂姆种)果皮,购买自云南省保山市;纤维素酶(10 000 U/g),玛雅试剂有限公司;透析袋MD34(7 000 u),上海源叶生物有限公司;AB-8大孔树脂,河北美凯化工有限公司;三氯甲烷(AR),重庆川东化工有限公司;正丁醇(AR),广东光华科技股份有限公司。
1.2 仪器设备
SCIENTZ-48 高通量组织研磨器,宁波新芝生物科技股份有限公司;DHG-9070A 电热鼓风干燥箱,上海一恒科学仪器有限公司;H3-18K 台式高速离心机,湖南可成仪器设备有限公司;RE-2000A 旋转蒸发器,上海亚荣生化仪器厂;SCQ-9201B 超声波提取仪,上海声彦超声波仪器有限公司。
1.3 果胶的提取方法
将咖啡果皮在45 ℃鼓风干燥箱中干燥至含水率低于5%,打粉、过80 目筛,备用。准确称取120 g 咖啡果皮干粉加入3 000 mL 超纯水中加入纤维素酶,调节pH值至4.9后水解90 min,沸水灭酶15 min,超声15 min后过滤得到滤液,将浸提液旋蒸浓缩至原体积的1/3。加入等体积的乙醇,于4 °C 冰箱中冷藏,过夜醇沉、离心15 min(5 000 r/min),真空冷冻干燥后得到粗果胶,并按照公式(1)计算果胶得率。

式中:
G——果胶得率,%;
m——果胶质量,g;
m0——咖啡果皮质量,g。
1.4 果胶提取单因素试验
1.4.1 酶添加量对果胶得率的影响
考察酶添加量对咖啡果皮中果胶得率的影响:固定pH 值4.9、酶解温度45 ℃、酶解时间90 min、超声温度50 ℃、超声时间15 min、超声功率120 W 和料液比1:25,设置纤维素酶添加量分别为原材料的0.1%、0.5%、1.0%、1.5%、2.0%,对果皮果胶进行提取,计算果胶得率。
1.4.2 酶解时间对果胶得率的影响
考察酶解时间对咖啡果皮中果胶得率的影响:固定纤维素酶添加量1.5%、pH 值4.9、酶解温度45 ℃、超声温度50 ℃、超声时间15 min、超声功率120 W 和料液比1:25,设置酶解时间分别为6、30、60、90、120 min,对果皮果胶进行提取,计算果胶得率。
1.4.3 超声时间对果胶得率的影响
考察超声时间对咖啡果皮中果胶得率的影响:固定纤维素酶添加量1.5%、pH 值4.9、酶解温度45 ℃、酶解时间1.0 h、超声温度50 ℃、超声功率120 W 和料液比1:25,设置超声时间分别为5、10、15、20、25 min,对果皮果胶进行提取,计算果胶得率。
1.5 响应面试验
在单因素试验基础上,运用Box-Benhnken 设计三因素三水平响应面试验,并以果胶得率为响应指标(%),详情见表1。

表1 响应面分析因素水平表Table 1 Response surface analysis factor level table
1.6 红外光谱表征
准确称取粗果胶样品1 mg,采用KBr 压片法进行检测,在500~4 000 cm-1范围内进行扫描。
1.7 纯化
配制为1.5 mg/mL 的粗果胶溶液100 mL,添加7 g AB-8 大孔树脂充分摇匀后,在55 ℃、130 r/min 的恒温振荡箱中振荡5 h 脱色,过滤,滤液在50 ℃下减压浓缩至原体积的一半[13-15];按Sevage 溶液(V氯仿:V正丁醇=4:1)为1/4 果胶液的比例加入Sevage 溶液后剧烈振荡20 min 脱蛋白,4 000 r/min 离心,取上层水层,重复此步操作,直至没有白色蛋白沉淀层产出为止。减压浓缩去除有机溶剂,超纯水透析48 h,真空冷冻干燥得到精果胶。
1.8 理化指标检测
参照Catalina 等[16]的方法,采用苯酚-硫酸法测定果胶的总糖含量。参照Antonela 等[17]的方法,采用福林酚比色法测定果胶的多酚含量。参照Ermias 等[18]的方法,采用考马斯亮蓝法测定果胶的蛋白质含量和测定果胶的酯化度和乙酰化度。含水量测定参考GB/T 5009.3-2016。
1.9 理化特性检测
参照冀世敏等[19]的方法,测定果胶的理化特性。
1.9.1 持水性的测定
称取0.1 g(m1)果胶样品置于离心管中并称重(m2),以1:20 质量比的比例加入蒸馏水,搅拌30 min后于3 000 r/min 条件下离心10 min,倒去上清液记录离心管和沉淀物的质量(m3)。根据式(2)计算果胶的持水性(H,g/g)。

1.9.2 持油性的测定
称取0.5 g(m1)果胶样品置于离心管中并称重(m2)。加5 mL纯芝麻油,用玻璃棒搅均,于2 200 r/min条件下离心25 min,倒去上层液体记录离心管和沉淀物的质量(m3)。根据式(3)计算果胶的持油性(I,g/g)。

1.9.3 起泡性与泡沫稳定性的测定
起泡性(FC)的测定:配制1%(m/V)的果胶样品溶液120 mL,10 000 r/min 剪切2 min,然后立刻将溶液倒入量筒中,并记录泡沫与液体的总体积(v0)。按式(4)计算FC。

泡沫稳定性(FS)的测定:将上述剪切后的溶液室温静置30 min 后,记录沫与液体的总体积(v30),按照式(5)计算FS。

1.9.4 乳化性与乳化稳定性的测定
乳化性的测定:配制0.2%(m/V)的样品溶液120 mL于离心管中,加入60 mL 芝麻油,10 000 r/min 剪切60 s,于1 500 r/min 离心300 s 后静置,记录液体总高度(h,mm)和乳化层高度(h1,mm)。按式(6)计算乳化性(J)。

乳化稳定性的测定:将上述离心管置于85 ℃水浴锅中加热30 min,室温静置20 min,再次在离心机上用1 500 r/min 离心5 min,记录此时的离心管中乳化层高度(h2,mm)及总高度(h3,mm)。按式(7)计算乳化稳定性(K)。

1.10 数据处理
采用Microsoft Excel 2010 数据统计软件分析处理试验数据,采用Design-expert 8.0.6 件进行响应面实验设计与分析;每组试验均重复三次,试验结果求平均值并以均值±标准差(SD)表示。
2 结果分析
2.1 单因素试验结果分析
2.1.1 不同酶添加量对果胶得率的影响
酶添加量对果胶得率的影响如图1a 所示,随着酶添加量的增加果胶得率增加,得率达到最大值(8.2%)时,所需酶添加量为1.5%;当酶添加量大于1.5%时,果胶得率降低。当酶添加量少于1.5%时,酶活性较小对细胞壁的分解少,使果胶溶出量少;当增加纤维素酶用量时,由于纤维素酶分解破坏了咖啡果皮细胞的细胞壁结构,使得咖啡果胶更易溶出,从而使果胶得率增加,但是随着纤维素酶用量不断增多,部分酶会相互附着在一起反而使酶的活性降低;同时,本研究的纤维素酶由木霉发酵生产,为多组分酶系含有的少量半乳糖醛酸酶和β-葡聚糖酶等酶,当酶添加量增加时半乳糖醛酸酶积累可能会加速水解果胶链,使果胶得率降低[20]。所以,选择酶添加量1.5%为最优值。
2.1.2 不同酶解时间对咖啡果胶得率的影响
酶解时间对咖啡果胶得率的影响如图1b 所示,在0~60 min 内随着酶解时间的增加果胶得率逐渐增大;当酶解60 min 时,果胶得率最高为15.45%,但之后随着酶解时间的继续延长,果胶得率又呈现缓慢下降的趋势。当酶解时间过短时,酶解作用不充分果胶未能完全溶出,随着酶解时间延长,纤维素酶作用时间增长反应充分进行,果胶得率达到最大值,但随着酶解时间的增加,果胶长时间在酸性和45 ℃条件下其分子会被破坏导致果胶内部糖醛酸链发生断裂,引起果胶分解从而使得率降低[21]。所以,选择酶解时间60 min时为最优值。
2.1.3 不同的超声时间对咖啡果胶得率的影响
超声时间对咖啡果胶得率的影响如图1c 所示,超声时间在5~15 min 之间果胶的得率随超声时间延长而增大,当超声时间为15 min 时,果胶得率最高为18.1%。在超声超过15 min 后得率下降,这可能是因为超声波具有强力的机械切割作用,长时间的作用可能使果胶被破坏,从而减少得率。所以,选择超声时间15 min时为最优值。
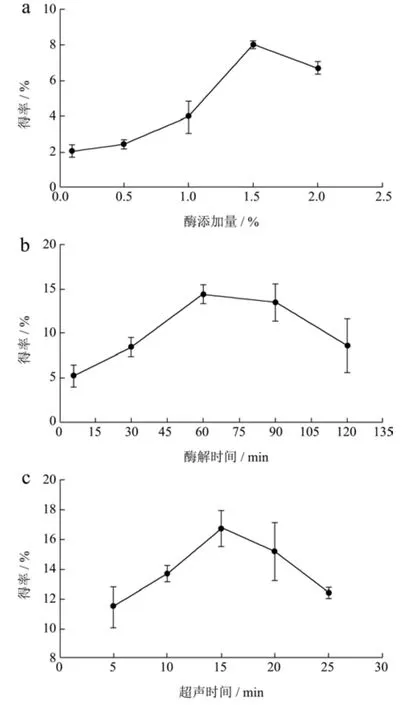
图1 单因素试验结果Fig.1 The results of single factor experiments
2.2 响应面试验结果分析
2.2.1 模型建立及显著性检验
果胶提取响应面试验设计与结果见表2。
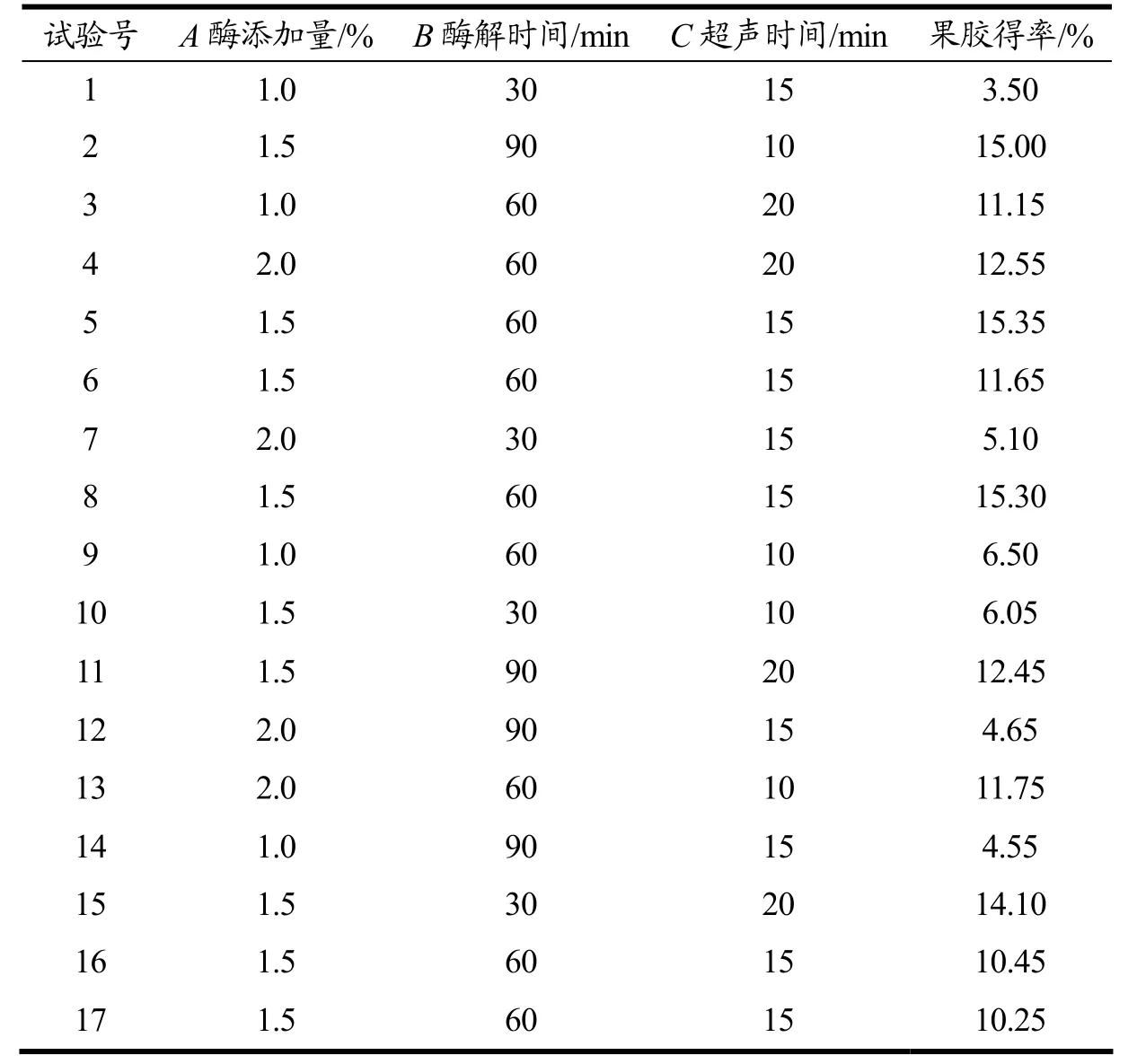
表2 响应面试验设计及结果Table 2 Response surface test design and results
由表3 回归分析和方差分析结果可知,该回归模型显著(p<0.05);在各响应因素中,二次项A2的p值小于0.01,表明该因素对粗果胶得率有极显著的影响。交互项BC、二次项B2、C2的p值小于0.05,表明B(酶解时间)和C(超声时间)的交互作用以及二次项B2、C2对粗果胶得率影响显著。
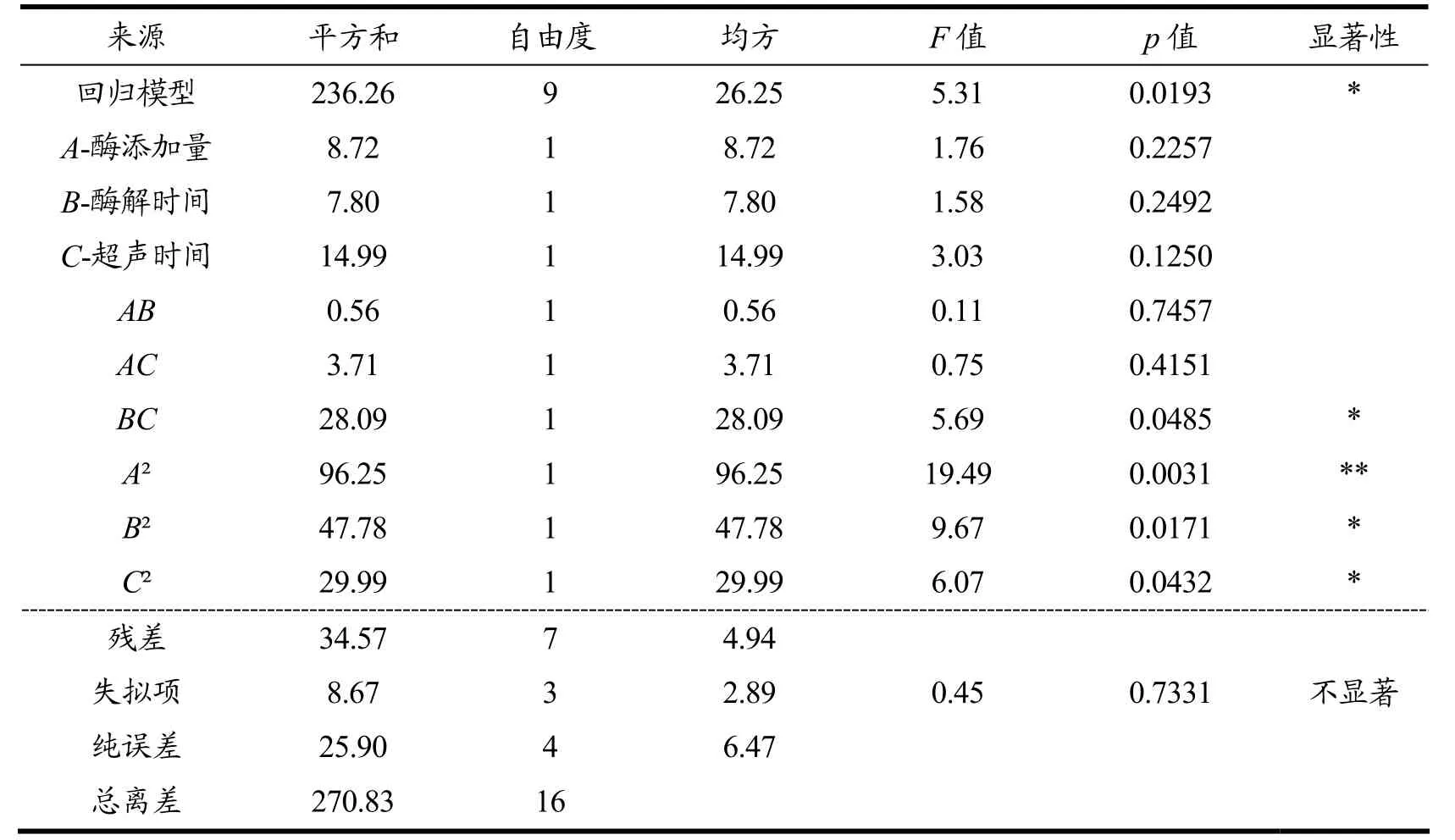
表3 回归统计分析结果Table 3 Regression statistical analysis results
模型的失拟项不显著(p>0.05),说明实际值与预测值之间无过度拟合,表明方程拟合性好,实验误差小。根据各因素显著水平,结合F值大小可以判断各单因素对粗果胶得率影响程度的主次顺序为C(超声时间)>A(酶添加量)>B(酶解时间)。以酶添加量(A)、酶解时间(B)、超声时间(C)为自变量,咖啡粗果胶得率为因变量,对各组合处理得到的咖啡粗果胶得率进行二次回归分析,建立多元二次响应面回归模型:果胶得率=-55.91+66.74A+0.78B-1.29C-0.03AB-0.39AC-0.02BC-19.13A2-3.74E-0.03B2+0.11C2。
2.2.2 交互作用分析
响应面图的弧度与等高线图的密集程度反映了各因素作用的大小。各个因素的交互作用对响应值的影响可通过等高线图直观的反映出来,等高线图的形状可以反映出各因素交互效应的强弱,椭圆形的等高线图表明两因素的交互作用对果胶得率的影响作用显著,当等高线图呈现圆形时,则表明两因素之间的交互作用不显著[22,23]。但随着酶解时间的增大果胶得率缓慢增大,在达到最大值后逐渐降低;随着超声时间的增加果胶得率先迅速升高到最大值,之后迅速降低,如图2c 所示,酶解时间和超声时间的等高线图更接近椭圆形,说明酶解时间(B)和超声时间(C)的交互作用显著(p<0.05),交互作用分析结果与方差分析表中的结果相一致。
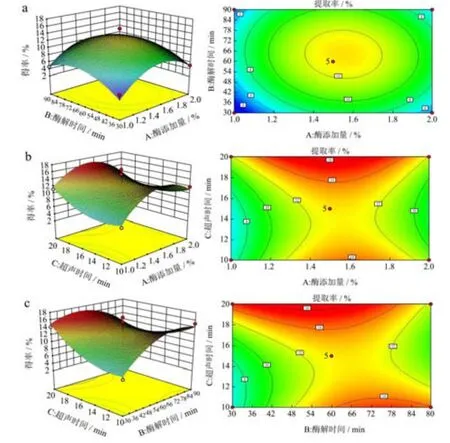
图2 各因素交互作用对果胶得率影响的三维曲面和等高线Fig.2 Three-dimensional surface plot and contour map of the interactive effects extraction yield of pectin
2.2.3 最佳工艺条件的预测与模型验证
根据以上模型得到最佳咖啡果胶提取工艺条件:纤维酶添加量1.49%,酶解时间45.78 min,超声时间19.30 min,理论上得到咖啡果胶得率为16.43%。在此条件下进行3 组平行试验验证,得到实际的咖啡粗果胶得率为16.42%与模型理论值相接近且无显著差异,证明该数学模型优化的最佳工艺参数具有可行性和重现性。
2.3 红外光谱结果分析
对优化提取的粗果胶进行傅里叶红外光谱测定,结果如图3 所示,在3 375 cm-1处有一个很明显的果胶多糖特吸收峰是由O-H 键伸缩振动造成[24,25];2 927 cm-1处的较弱吸收峰是由甲基的C-H 键的伸缩振动造成[26];在1 616 cm-1、1 425 cm-1处的吸收峰则分别由于C=O 和C=C 基团的对称伸缩振动造成的,是羧基的特征峰[27,28];碳水化合物的C-O、C-C-H、C-C 和OCH基团在1 336 cm-1、1 248 cm-1、1 149 cm-1、1 105 cm-1、1 016 cm-1附近会有伸缩振动,而且1 010~1 150 cm-1范围内是阿拉伯半乳聚糖的特征峰[29],本研究结果在1 105 cm-1、1 016 cm-1处也检测到了特征吸收峰。结果表明,使用超声辅助酶提取的咖啡粗果胶含有典型的多糖结构。

图3 咖啡粗果胶的FT-IRFig.3 FT-IR of crude coffee pectin
2.4 咖啡果胶理化指标检测结果
进一步对咖啡粗果胶和脱色、脱蛋白后精果胶的理化指标进行对比,结果由表4 可知,精果胶的得率仅为粗果胶的22.20%,说明果胶在纯化过程中的损失较大,是因为脱蛋白过程中Sevage 试剂在使蛋白质变性沉淀的同时正丁醇会使部分果胶沉淀造成损失,且脱蛋白次数越多果胶的损失越多[30,31];精果胶的总糖含量达到了75.83%,较纯化前增加了17.51%;粗果胶中多酚和蛋白的含量为6.09%和0.17%,纯化后分别下降到1.68%和0.13%,下降了72.41%和23.53%,其中多酚的减少是因为纯化过程中氧化和受热分解造成的;粗果胶含水量为6.32%,纯化后增加到了12.09%,增加了91.30%,原因可能咖啡果胶属于多糖的一种,多醣具有一定的持水能力,纯化之后精果胶总糖含量增加,所以持水能力增强,含水量也就增大;粗果胶酯化度和乙酰化度分别是31.77%和17.43%,纯化后分别下降到7.17%和1.54%,下降了77.43%和91.16%,一个原因可能是中温提取不能钝化内源酶,在提取过程中引起的,另一个原因可能是粗果胶的检测时伴有杂质干扰造成的,且由于酯化度与果胶甲酯酶活性呈负相关,可能纯化过程中在果胶的内源甲酯酶的作用下,导致的果胶酯化度降低[30,31];以上结果表明,咖啡果胶是一种低酯果胶,纯化增加了咖啡果胶的纯度,但是还可以使用其他方法进一步纯化。
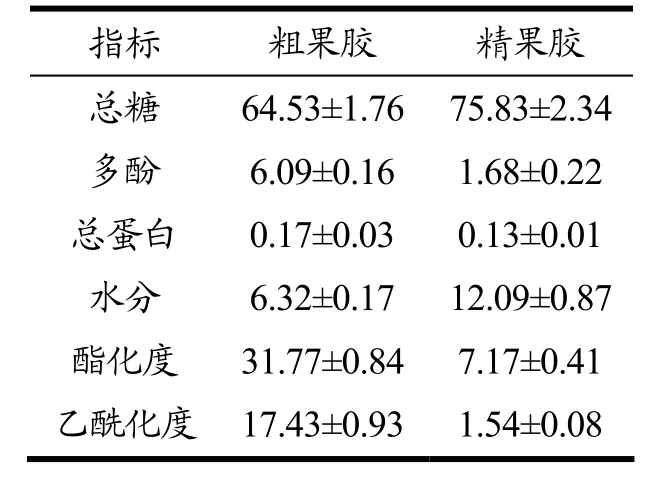
表4 咖啡果胶理化指标(%)Table 4 Physicochemical characterization of coffee pectin
2.5 咖啡果胶理化特性测试结果
果胶是水溶性多糖,具有较强的亲水和亲油性;由表5 可知,咖啡粗果胶也检测到具有一定程度的持水性、持油性、起泡性、泡沫稳定性和乳化性、乳化稳定性。果胶经纯化后这些理化特性发生了改变,其中持水性增加了4.70 倍,原因可能是果胶是亲水性大分子聚合物,经纯化后果胶内部有更多亲水基团暴露使其持水性增大;持油性增加了52.25%,原因可能是果胶中含有一定量的水分,在搅拌过程中形成了乳液造成的;纯化之后果胶的起泡性和泡沫稳定性消失,原因是脱蛋白导致果胶纯度增加,果胶体系的黏度也随着增加,而泡沫结构中薄层液体的排出速度随着其黏度增加而降低,最终导致起泡性消失[32];纯化后果胶黏度增加的同时也增加了参与乳化作用的基团数量,使其乳化性和乳化体系稳定性也随着增加[33],相比于粗果胶分别增加了26.31%和9.64%。
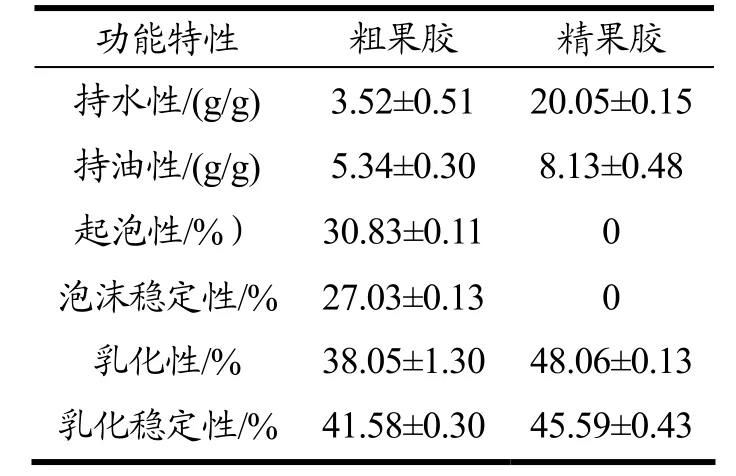
表5 咖啡果胶中功能特性测试结果Table 5 Test results of functinal characteristics in coffee pectin
3 结论
采用超声波辅助酶提取咖啡果皮粗果胶得到最佳提取条件为:纤维素酶添加量1.49%,酶解时间45.78 min,超声时间19.30 min,得到咖啡果胶实际得率为16.43%;咖啡粗果胶含有典型的多糖结构;纯化使果胶总糖含量增加了17.51%,多酚和蛋白质含量减少了72.41%和23.53%含水量为增加了91.30%,酯化度和乙酰化度分别下降了77.43%和91.16%;而且,纯化可以增加咖啡果胶的持水性、持油性、稳定性和乳化性、乳化稳定性,但是会降低果胶的起泡性、泡沫稳定性。本研究可为云南小粒咖啡果皮的综合利用和其果胶结构特性和理化特性研究提供前期基础和理论依据。
