莲藕渣多糖通过MAPK/NF-κB 途径调节小鼠腹腔巨噬细胞的免疫应答
2023-01-12管雪婷韩胜强谢元胡卫成沈婷
管雪婷,韩胜强,谢元,胡卫成*,沈婷*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)(2.淮阴师范学院生命科学学院,江苏淮安 223300)
免疫是机体对于外界抗原的侵入及疾病预防的一道必不可少的防线[1],因此,调节机体免疫受到广泛的关注。免疫反应需要免疫细胞,包括巨噬细胞、淋巴细胞和树突状细胞,这些细胞在增强免疫和通过信号分子有效对抗感染发挥重要作用[2]。巨噬细胞是一种多功能免疫细胞[3],在先天免疫系统中占据一个独特的生态位,负责清除入侵的病原体和死亡细胞[4]。活化的巨噬细胞通过触发不同的信号通路有效地降低疾病的易感性。当巨噬细胞被激活时,它们表达表面识别受体,如Toll 样受体TLR2/TLR4,触发多个信号通路,如丝裂原激活蛋白激酶(MAPK)、磷酸肌醇3 激酶(PI3K)-Akt 和Janus 激酶/信号转换器,释放炎症因子(如一氧化氮NO)和促炎细胞因子(如白细胞介素IL-6、IL-1β和肿瘤坏死因子TNF-α)[5]。最近的证据表明,有效增强免疫系统是治疗免疫抑制、微生物感染和肿瘤的一种新兴治疗方法[6]。
多糖是由大量单糖组成的一类重要的天然生物大分子,广泛分布于植物、动物、藻类和微生物中[7]。它们对人体几乎没有危害,因此人们对多糖的生物活性越来越感兴趣,包括免疫调节、抗肿瘤、抗感染、抗病毒等治疗应用[8,9]。而在这些生物活性中,免疫刺激活性受到了广泛的关注。刺槐花多糖可以与巨噬细胞表面的TLR2/4 结合,诱导其释放NO 和TNF-a、IL-18和IL-6,上调MAPKS 和NF-KB 信号通路中关键蛋白及各自磷酸化蛋白的表达[10]。因此,多糖可以与巨噬细胞表面受体结合,激活巨噬细胞释放NO 及细胞因子,通过受体激活巨噬细胞内的信号通路,发挥多糖的免疫活性。
莲(Nelumbo nuciferaGaertn.),属莲科[11],多年水生植物,莲藕是莲的膨大根茎[12],作为食物和药物在东南亚广泛种植多年[13]。莲藕具有抗氧化、抗癌、抗炎和免疫刺激活性[14-16]。在莲藕加工过程中,产生了大量的莲藕渣。然而,只有少量莲藕渣被用作饲料,大部分被丢弃,导致环境污染和资源浪费[16]。若加以利用,不仅能科学合理地解决资源浪费问题,还能将废物实现价值最大化。莲藕渣中含有多糖[17],但由于缺乏相关研究,严重限制了对这一资源的有效开发。实验室前期研究[18]发现,莲藕渣多糖(LRP)平均分子量为1.24×104ku,结构为α-D-(1→4)连接的葡萄糖吡基,在O-6 处的非还原端α-D-Glcp 大约每6 个残基作为分支。LRP 具有免疫刺激活性,显著促进NO、IL-6 和TNF-α的产生,促进环磷酰胺诱导的免疫抑制小鼠中TNF-α和IL-2 的分泌。张梦洁等[19]发现莲藕多糖能够促进巨噬细胞增殖,诱导巨噬细胞产生NO,具有激活免疫细胞的潜能。但LRP 对小鼠腹腔巨噬细胞的免疫应答途径及信号通路尚不可知。此外,小鼠腹腔巨噬细胞接近于小鼠体内细胞环境[20,21],一方面可以更好的还原动物体内的结果,另一方面可相对减少对试验动物的杀害。阿拉伯木聚糖可以活化小鼠腹腔巨噬细胞,增加NO 产生,促进免疫关联基因mRNA 的表达,激活MAPK 和Akt 信号通路,调节免疫[22]。因此,本试验取用小鼠原代腹腔巨噬细胞,观察LRP 对巨噬细胞产生NO 的影响,通过PCR 与Western Blot 检测免疫关联基因mRNA与MAPK/NF-κB通路相关蛋白的表达量,初步探讨LRP 对小鼠腹腔巨噬细胞的免疫调节活性及其信号机制,为LRP 的开发与利用提供新思路。
1 材料与方法
1.1 材料与试剂
莲藕渣购买于江苏淮安本地市场,莲藕渣多糖(LRP)按照前期文献的方法分离纯化[18]。RPMI 1640培养基,美国Gibco 公司;台盼蓝、脂多糖(LPS)、甲氮甲唑蓝(MTT)、对氨基苯磺酰胺、亚硝酸钠(NaNO2)、N-1-萘乙胺盐酸盐,美国Sigma 公司;PVDF膜(0.2 μm),美国Bio-Rad 公司;抗体p-Akt、p-ERK、p-JNK、p-p38、Akt、ERK1/2、JNK、p38,美国CST公司;山羊抗兔 IgG-HRP,美国 abcam 公司;Anti-β-Actin pAb-HRP-Direct,日本MBL 公司;反转录试剂盒,美国Thermo 公司;Trizol 试剂,美国ambion公司;30% Acr-Bis(29:1)、2×Taq Master Mix、化学发光检测试剂盒,北京cwbio 公司;异丙醇、甲醇、十二烷基硫酸钠、三羟甲基氨基甲烷、甲醛、氯化钠、三氯甲烷、无水乙醇等试剂为分析纯,上海国药集团化学试剂有限公司。
1.2 仪器与设备
HERACELL I50i 二氧化碳细胞培养箱,美国Thermo 公司;JY88-IIN 细胞超声破碎仪,宁波新芝生物科技公司;5414R 小型高速离心机、5810R 台式高速冷冻离心机,德国Eppendorf 公司;Tecan Infinite M200 Pro 酶标仪,瑞士Tecan 公司;PowerPacTMHC 电泳槽、T100 Thermal PCR 扩增仪,美国BIO-RAD 公司;5200 multi 数码凝胶图像处理系统,上海天能科技有限公司。
1.3 方法
1.3.1 小鼠腹腔巨噬细胞培养
从SPF 级BALB/c 小鼠中分离小鼠腹腔巨噬细胞[22],分离后的细胞培养在湿度适宜,温度为37 ℃,CO2含量为5%(V/V)的细胞培养箱中。细胞培养基为1%的青霉素和链霉素(V/V)以及10%(m/V)胎牛血清的RPMI 1640 培养基。
1.3.2 LRP 对小鼠腹腔巨噬细胞的毒性
将小鼠腹腔巨噬细胞计数后加入RPMI 1640 培养基中,细胞稀释至每毫升1×106个后接种于96 孔培养板,每孔100 μL,每组3 个重复孔,培养过夜。向96孔培养板中加入不同浓度的LRP(0、12.5、25、50、100、200 μg/mL),于湿度适宜、温度为37 ℃、体积分数5% CO2培养箱中继续培养24 h。弃掉孔内上层培养液,每孔加入100 μL 的0.5 mg/mL MTT 工作液,在培养4 h 后每孔立即加入100 μL 的stopping buffer,在16~20 h 后混匀,酶标仪在570 nm 处测定吸光度值。
1.3.3 LRP对小鼠腹腔巨噬细胞释放NO的影响
取细胞密度为每毫升1×106个的小鼠腹腔巨噬细胞,每孔100 μL 接种于96 孔培养板中,在细胞培养箱中培养24 h。在培养板中加入不同浓度的LRP(0、12.5、25、50、100、200 μg/mL),以未添加LRP 组作为阴性对照组,同时以1 μg/mL 的LPS 将其设置为阳性对照组,24 h 后用Griess 法检测细胞上清液中NO 含量。在培养板中加入200 μg/mL 的LRP,在不同时间段(0、1、3、6、12、24 h)取细胞上清液测定NO 的释放量。
1.3.4 LRP 对免疫关联基因mRNA 表达的影响
用RPMI 1640 培养基将细胞密度调整为每毫升5×106个后接种至培养皿中,用200 μg/mL 的LRP 分别处理细胞0、0.5、1、3、6 h。在不同的时间段弃去培养皿中上清液,加入1 mL Trizol 裂解细胞,收集不同时间段的样品待用。上述溶液中加入100 μL 三氯甲烷,混匀、离心,取水层加入等体积异丙醇,充分振荡,静置、离心,管底出现胶状沉淀即为RNA,用0.1%(m/V)DEPC(焦炭酸二乙酯)水配制的体积分数75%乙醇清洗RNA 后置于通风橱中晾干,再加入30 μL DEPC 水溶解RNA,置于-80 ℃超低温冷冻箱中待测。RNA 使用反转录试剂盒进行逆转录,得到cDNA,使用不同的引物(上海生工生物工程股份有限公司)在PCR 扩增仪中检测不同免疫因子mRNA 的表达量。其中PCR 反应体系如下:6 μL 的无菌超纯水,10 μL 的2×Taq Master Mix、1 μL 的上游引物、1 μL 的下游引物、2 μL 的cDNA。引物序列及PCR 扩增条件如表1 所示。
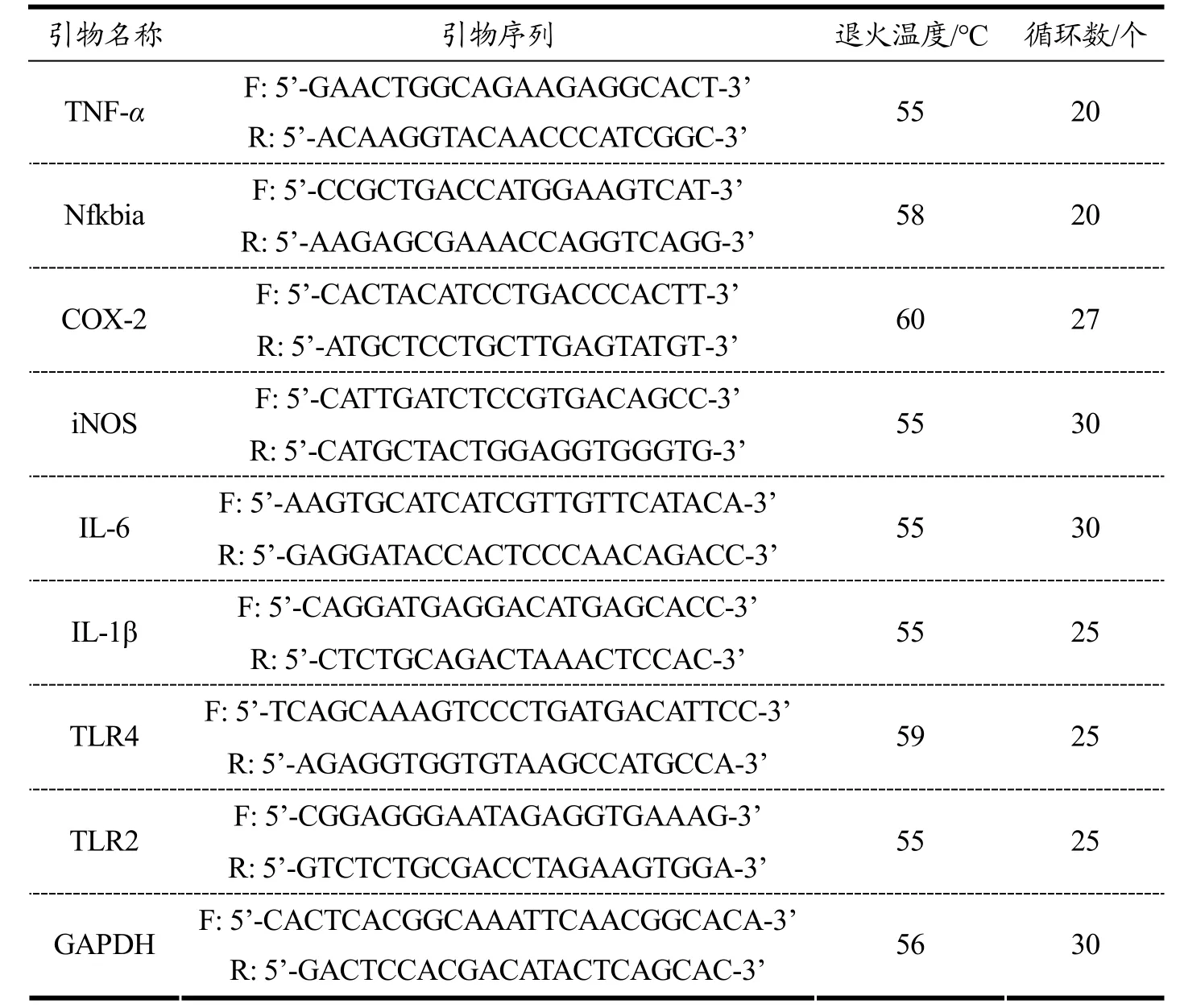
表1 引物序列及PCR 条件Table 1 Primer sequence and conditions for PCR
1.3.5 Western Blot 检测MAPK/NF-κB 和Akt通路相关蛋白表达量
在培养皿中接种小鼠腹腔巨噬细胞,细胞密度为5×106个,使用200 μg/mL 的LRP 培养细胞,在不同时间段获取样品(0、0.5、1、3、6 h)。将培养基上清吸除后用1 mL 的PBS 冲洗并收集细胞,离心后取沉淀加入250 μL 蛋白酶裂解液充分混匀,使用超声破碎仪破碎细胞后,4 ℃、12 000 r/min 离心10 min,得到上清液。BCA 试剂盒检测蛋白浓度,通过Western Blot 检测MAPK/NF-κB 和AKt 通路相关蛋白表达。将样品蛋白在95 ℃下变性5 min 后,SDS-PAGE 电泳分离蛋白并转至PVDF 膜。将膜移至封闭液(5% BSA,m/V)中,加入一抗孵育过夜,二抗孵育2 h,室温下在摇床上用TTBS 洗涤后加入曝光液采集图像。
1.4 数据处理
本研究的数据分析使用SPSS 23.0 统计分析软件,结果表示为Mean±SD,p<0.05 表示差异显著,绘图软件为Sigma Plot。
2 结果与讨论
2.1 LRP 对小鼠腹腔巨噬细胞活力的影响
如图1 所示,考察LRP 对小鼠腹腔巨噬细胞活力的影响。使用不同浓度梯度的LRP 培养细胞24 h,结果显示,浓度为25~50 μg/mL 的LRP 对细胞生长活力有促进作用(p<0.05),细胞存活率分别为104.82%和102.53%,200 μg/mL 浓度以内细胞活力没有降低趋势。小麦麸皮中阿拉伯木聚糖与小鼠腹腔巨噬细胞共培养,结果显示6.25 和12.5 μg/mL 多糖处理后细胞存活率分别为90.42%和89.99%,证实阿拉伯木聚糖对细胞没有显著毒性[22]。因此,200 μg/mL 浓度范围内,LRP对小鼠腹腔巨噬细胞无毒性作用。
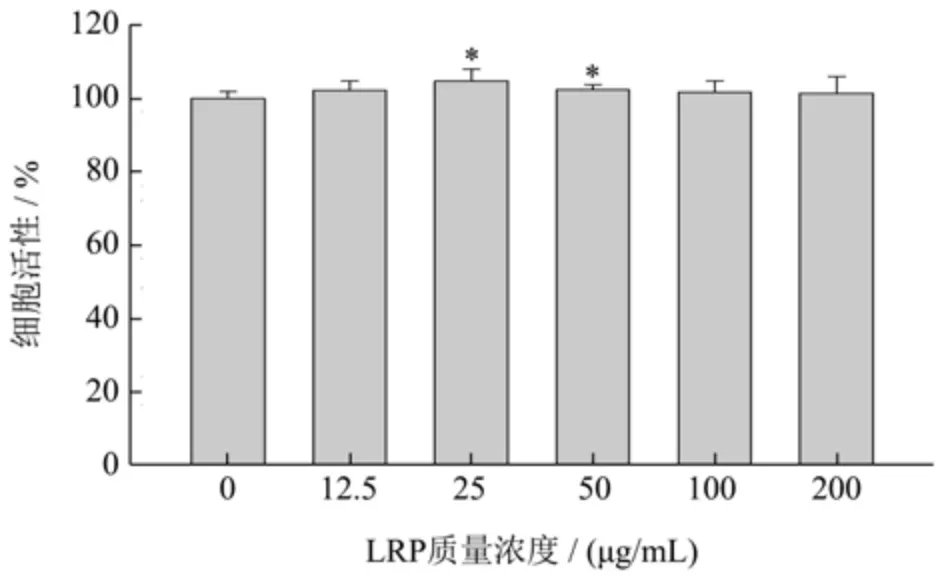
图1 LRP 对小鼠腹腔巨噬细胞活性的影响Fig.1 Effect of LRP on the activity of mouse peritoneal macrophages
2.2 LRP对小鼠腹腔巨噬细胞NO释放量的影响
小鼠腹腔巨噬细胞培养接近动物体内的环境,可研究对病原体的先天免疫应答[22]。一氧化氮(NO)是巨噬细胞的主要介质,对细菌和肿瘤细胞具有杀伤作用[23]。为了确定巨噬细胞的活性,用不同浓度的LRP刺激腹腔巨噬细胞后,测定细胞上清中NO 的浓度。巨噬细胞中NO 浓度随LRP 浓度的提高显著增加(p<0.05),LRP 浓度为200 μg/mL 时NO 产量为36.47 μmol/L,略低于阳性对照组LPS 中NO 浓度46.58 μmol/L,如图2 所示。为了监测NO 释放的具体时间段,使用200 μg/mL 的LRP 处理腹腔巨噬细胞。如图3,随着时间的延长,NO 产量逐渐增多,培养时间至24 h 时NO 产量为44.18 μmol/L。不难看出,NO的释放量由6 h 开始显著增加(p<0.05),处理24 h 后的NO 释放量大致与之前处理结果吻合。研究表明,NO 调节细胞的增殖和分化,在细胞中,NO 浓度在(0.01~0.25)mmol/L 的低浓度下,细胞增殖增加,在>0.5 mmol/L 的浓度时,细胞生长停滞[24]。图2~3 中,200 μg/mL 的LRP 处理巨噬细胞24 h 产生NO 的量处于(0.01~0.25)mmol/L 间,即LRP 可促进细胞生长。玉米麸皮中阿拉伯木聚糖的体外结果显示阿拉伯木聚糖促进人U937 单细胞细胞株NO 合成,从53.7 μmol/L增加至62.9 μmol/L,研究表明来自玉米麸皮膳食可能会增强先天免疫反应[25]。因此,LRP 激活腹腔巨噬细胞释放NO,促进细胞生长,提高巨噬细胞对细菌和肿瘤细胞的杀伤作用,发挥LRP 的免疫刺激活性。

图2 LRP 的不同处理浓度对小鼠腹腔巨噬细胞释放NO 的影响Fig.2 Effect of different treatment concentration of LRP on the release of NO from mouse peritoneal macrophages
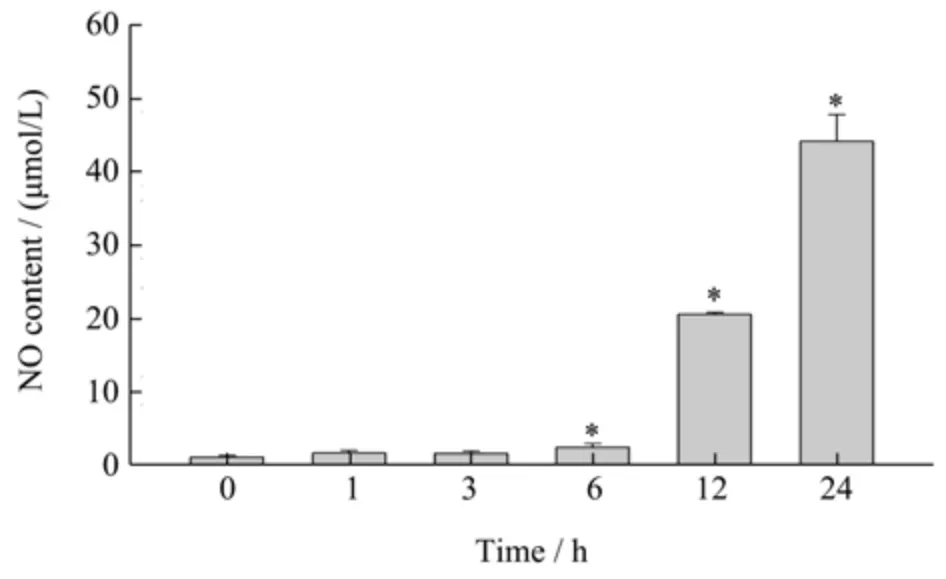
图3 LRP 的不同处理时间对小鼠腹腔巨噬细胞释放NO 的影响Fig.3 Effect of different treatment time of LRP on the release of NO from mouse peritoneal macrophages
2.3 LRP 对小鼠腹腔巨噬细胞TLR4/TLR2 及免疫关联因子表达的影响
多糖具有免疫刺激活性,巨噬细胞已被报道为多糖反应的靶点[26]。多糖对免疫细胞的直接刺激作用涉及到特定的识别受体,这些识别受体可以决定最终的反应。多糖与这些受体结合时,可能会触发不同的信号通路,使反应可以被检测到。多糖可以通过激活toll样受体对细胞产物如脂多糖和脂磷壁酸产生反应,从而产生各种细胞因子,可能在炎症中诱发T 细胞介导的免疫反应[27,28]。TLR2 和TLR4 在多种免疫细胞中表达[29],TLR2 被多糖激活后,TGF-激活激酶被磷酸化,激活由丝裂原活化蛋白激酶(MAPK)组成的激酶复合物,分别激活NF-κB 和c-Jun 端激酶(JNK)信号通路,从而触发细胞因子(IL-6、IL-1β、TNF-α)的表达[30]。同时,TLR4 已被确定为巨噬细胞对植物多糖的重要膜受体,利用转接分子传递信号至细胞内,激活下游相关分子,如NF-κB,从而促进炎性因子的分泌[31]。iNOS是免疫中最重要的内源性免疫介质之一,在正常免疫功能中起着关键作用,包括巨噬细胞活化和宿主对细胞内病原体的防御[32]。
为了探讨LRP 对小鼠腹腔巨噬细胞Toll 样受体及免疫关联因子表达的影响,使用PCR 仪半定量检测细胞中Toll 样受体(TLR4、TLR2)以及免疫关联因子(TNF-α、IL-6、iNOS、1L-1β、COX-2、Nfkbia)等基因的表达。
如图4~5 所示,在细胞中,TLR4 和TLR2 的表达随LRP 刺激时间延长而增加,因此,LRP 与巨噬细胞表面的TLR4、TLR2 结合,使其表达量提高;而TNF-α、IL-6、iNOS、1L-1β、COX-2、Nfkbia 等基因的mRNA在前1 h 内几乎不表达,而在LRP 处理3 h 之后的表达量显著增加,其中,TNF-α与IL-1β在6 h 表达降低。因此,LRP 与巨噬细胞表面受体结合,刺激巨噬细胞分泌细胞因子,3 h 时达到峰值,此时条带较亮。大量研究表明,在机体发生炎症反应的过程中,TLR2 与TLR4 介导的信号转导通路发挥着最为重要的作用,植物多糖可以通过Toll 样受体介导巨噬细胞激活细胞内信号通路,促进相关细胞因子的释放,发挥其免疫调节功能[33]。β2GPI/抗β2GPI 复合物激活小鼠腹腔巨噬细胞过程中,TLR2 表达增加[34];蘑菇多糖在腹腔巨噬细胞中通过激活TLR4/NF-κB 途径,致其细胞因子的分泌量显著增强[35];大黄多糖刺激巨噬细胞激活TLR4/MyD88/NF-κB 途径,诱导IL-1β、IFN-β、IL-6及TNF-α等细胞因子表达[36]。这些研究结果与此结果皆显示诱导TLR2与TLR4受体及其下游免疫相关因子表达的增加是植物多糖发挥免疫调节作用的重要途径之一。因此,免疫关联细胞因子mRNA 表达上调结果显示,LRP 结合巨噬细胞表面免疫关联Toll 样受体,刺激巨噬细胞分泌细胞因子,从而激活细胞产生免疫应答。

图4 LRP 对小鼠腹腔巨噬细胞免疫关联Toll 样受体mRNA 表达的影响Fig.4 Effect of LRP on mRNA expression of immune-associated Toll-like receptors in mouse peritoneal macrophages
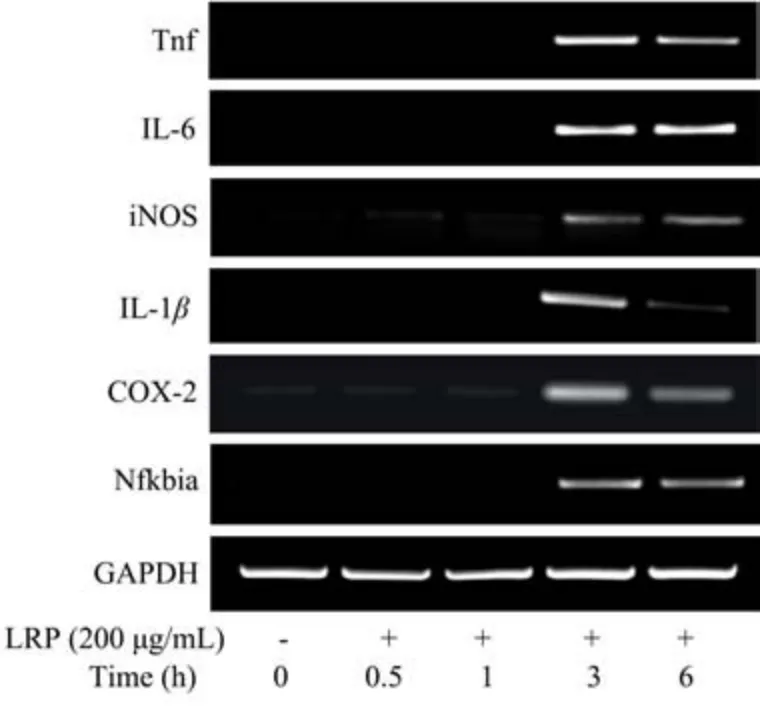
图5 LRP 对小鼠腹腔巨噬细胞免疫关联因子mRNA 表达的影响Fig.5 Effect of LRP on mRNA expression of immune-related factors in mouse peritoneal macrophages
2.4 LRP 对小鼠腹腔巨噬细胞MAPK/NF-κB及Akt 信号通路的影响
据报道,MAPK/NF-κB 信号通路参与刺激免疫应答中的基因表达(如iNOS、IL-6、TNF-αmRNA)和细胞因子分泌(如NO、IL-6 和TNF-α)[37]。MAPK通路与激活蛋白1(AP-1)信号通路相关,它在巨噬细胞激活过程中介导免疫关联基因的表达[38]。p38 MAPK、细胞外信号调节激酶(ERK)和c-Jun NH2末端激酶(JNK)的磷酸化和激活已在免疫细胞中通过各种炎症刺激得到证实[39,40]。NF-κB 是参与炎症过程的转录因子,通过IκB 亚基磷酸化和从非活性细胞质复合物分离而激活,p65 的活性二聚体易位到核[41]。这些免疫细胞的激活对免疫系统炎症反应的调节可能是治疗各种疾病的有前途的治疗策略之一。为了检测MAPK/NF-κB 通路是否介导了LRP 处理后的小鼠腹腔巨噬细胞的基因表达和细胞因子的产生,用200 μg/mL的LRP 处理细胞0、0.5、1、3、6 h,测定了ERK1/2、JNK、p38 的磷酸化及核蛋白中c-Jun 和p65 的水平。另外,Akt 参与细胞生长,调节细胞代谢及凋亡。有研究表明Akt 可能激活MAPK 信号通路[42],因此,测定Akt 的磷酸化水平,确定Akt 信号通路是否与介导LRP处理小鼠腹腔巨噬细胞产生免疫关联因子相关。
在LRP 刺激的腹腔巨噬细胞中,如图6 所示,核蛋白p65 的水平在0~3 h 逐渐增多,在3 h 后略有降低;c-Jun 的水平也在3 h 达到峰值后降低。结果显示,LRP对腹腔巨噬细胞的刺激上调其核蛋白中p65 及c-Jun 表达的水平,c-Jun 的表达与AP-1 有关[38],证明LRP 可激活巨噬细胞介导免疫相关因子表达,p65 的活性二聚体易位至核,这说明参与此过程的转录因子NF-κB 也被激活。在图7 中,磷酸化的ERK1/2 在0.5 h 显著增多,随后逐渐降低;磷酸化的JNK 在1 h 时显著增多,随后降低;磷酸化的p38 具体来说,在0~1 h 呈现逐渐增多的趋势,而1~6 h 逐渐降低。值得注意的是,巨噬细胞中Akt 的磷酸化水平没有显著变化趋势。这些结论在其他研究中也得到了证明。玫瑰茄(Hibiscus sabdariffaLinn.)多糖通过MAPKs 信号通路激活巨噬细胞,进而激活ERK、JNK、p38 和p65 的磷酸化,显著增加细胞因子mRNA 表达[31]。蘑菇多糖通过TLR/NF-κB 途径增强小鼠巨噬细胞的免疫应答,调节一系列细胞因子的mRNA 的表达[35]。与其他同类型多糖相比,LRP 实现废物利用,而小鼠原代腹腔巨噬细胞比其他来源巨噬细胞更接近小鼠体内反应。这些结果证实LRP 激活MAPK 和NF-κB 信号通路,上调通路中关键蛋白p38、ERK1/2 和JNK 及其磷酸化,发挥其免疫调节作用。

图6 LRP 对小鼠腹腔巨噬细胞p65 及c-Jun 蛋白表达的影响Fig.6 Effects of LRP on the expression of p65 and c-Jun proteins in mouse peritoneal macrophages
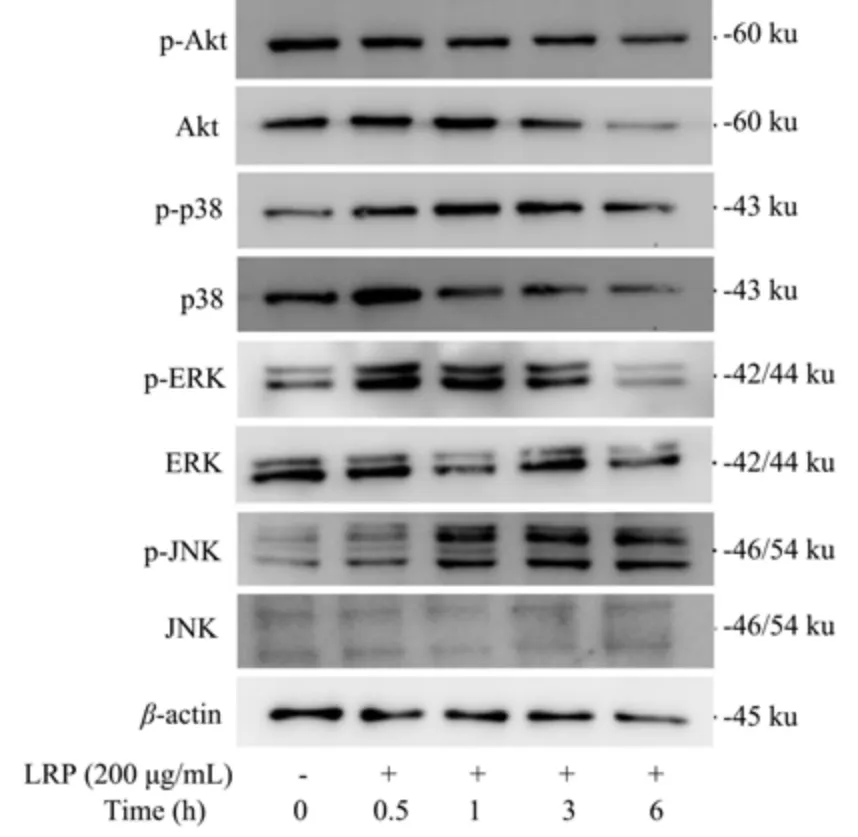
图7 LRP 对小鼠腹腔巨噬细胞MAPK 和Akt 信号通路表达的影响Fig.7 Effects of LRP on the expression of MAPK and Akt signaling pathways in mouse peritoneal macrophages
3 结论
本试验通过LRP 与小鼠腹腔巨噬细胞共培养,探究LRP 对小鼠腹腔巨噬细胞产生免疫应答的信号通路。研究结果表明,LRP 通过激活MAPK/NF-κB 信号通路发挥其免疫作用。LRP 结合巨噬细胞表面受体TLR4 及TLR2,刺激腹腔巨噬细胞分泌NO,促进TNF-α、IL-6、iNOS、1L-1β、COX-2、Nfkbia 等细胞因子的释放,上调MAPK/NF-κB 信号通路中核蛋白c-Jun 和p65 的表达,增强关键蛋白ERK1/2、JNK、p38及其磷酸化。因此,LRP 在预防疾病及增强免疫中可发挥重要作用,但需要更多的研究来阐明LRP 在体内免疫应答中的作用。
