氮素缓解花生干旱胁迫的生理和转录调控机制
2023-01-12张智猛张冠初秦斐斐戴良香
丁 红 张智猛 徐 扬 张冠初 郭 庆 秦斐斐 戴良香
氮素缓解花生干旱胁迫的生理和转录调控机制
丁 红 张智猛 徐 扬 张冠初 郭 庆 秦斐斐 戴良香*
山东省花生研究所, 山东青岛 266100
干旱胁迫下氮素施用对植物生长发育具有重要的影响。为明确氮素提高花生抗旱性的生理和转录调控机制, 本研究对施氮、干旱及旱氮同存处理下的花生生理指标和根系转录组进行了测定。结果表明, 旱氮同存处理提高了干旱胁迫下花生生物量和叶片相对含水量。施用氮肥增加了干旱胁迫下花生根系的总酚和类黄酮含量, 提高其过氧化物酶(POD)和过氧化氢酶(CAT)活性, 降低其丙二醛(MDA)含量, 提高花生抗旱性。转录组分析表明, 施用氮肥产生5396个差异表达基因, 这些基因主要参与谷胱甘肽代谢、氮代谢和碳代谢相关过程及应激和防御反应。干旱处理和旱氮同存处理下, 次生代谢物生物合成、运输和分解代谢及碳水化合物运输和代谢这两类功能差异表达基因富集。旱氮同存处理下酚类代谢物质相关的3种途径中有51个差异基因上调表达, 207个基因下调表达。由此表明, 施用氮肥通过调控花生次生产物代谢、碳水化合物代谢等途径提高干旱胁迫下花生植株的抗氧化能力, 从而提高花生的抗旱性。
花生; 干旱; 氮素; 抗氧化系统; 转录组
花生是重要的油料作物和经济作物, 干旱和养分缺乏是限制其生长发育的2个主要因素[1]。由于全球气候变暖, 预计干旱造成的损失将变得更加严重[2]。氮是植物生长必需的大量营养素之一, 由于氮素须溶解在水中被根系吸收, 因此缺氮通常与干旱同时发生。水分缺乏条件下, 植物通过形态、生理、生化、细胞和分子等过程抵御外界非生物胁迫。植物在干旱胁迫后产生大量的活性氧, 从而伤害其细胞和组织。为抵抗干旱胁迫造成的伤害, 植物通过一系列复杂的酶促和非酶促抗氧化防御系统来维持细胞内氧化还原稳态。干旱胁迫会造成酶促系统中抗氧化酶如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)等活性降低, 积累活性氧, 使膜脂过氧化产物丙二醛(malondialdehyde, MDA)增加, 降低其光合能力[3-4]。抗坏血酸、谷胱甘肽、生物碱、生育酚和酚类化合物作为非酶抗氧化防御系统, 是强大的活性氧清除剂, 可保护植物细胞免受氧化损伤。酚类化合物是植物体内次生代谢重要产物之一。干旱胁迫处理下, 棉花叶片、丹参等作物中酚类物质含量显著增加[5-6], 且酚类可以通过提高过氧化物酶的活力和减少MDA含量来消除和减轻因干旱引发的活性氧伤害, 增强作物的抗旱性[7-8]。适度干旱胁迫提高紫花苜蓿叶片中黄酮合成途径上游关键酶活性, 促进地上部黄酮类化合物的积累[9]。
转录组测序技术已被广泛用于识别不同组织、品种和处理之间差异表达的基因。利用转录组测序技术, 对作物干旱胁迫和缺氮条件下的转录组进行了分析[10-11]。Bhogireddy等[12]认为干旱胁迫下耐旱型花生激活了脱落酸(abscisic acid, ABA)和蔗糖代谢途径中关键基因以保持较高的抗旱性, 另有研究表明, 耐旱型花生利用发达的根系系统、能量代谢的提升、次生代谢的加强和生长的抑制4个方面共同应对干旱胁迫[13]。提高根系发育和叶片光合系统稳定性是玉米耐受低氮的主要因素[14]。
干旱胁迫影响植物生长和氮代谢, 而氮素的施用在一定程度上有助于提高植物的抗旱性[15]。干旱胁迫下, 氮素供应通过促进根系生长、保护光合系统、激活抗氧化防御系统和改善渗透调节等增强作物的抗旱性[16-17]。适量施用氮肥增加了干旱胁迫下棉花叶片的保护酶活性, 降低MDA含量, 提高抗旱性[18]。适度氮素供给能够提高水稻植株酚类物质合成代谢相关的苯丙氨酸裂解酶基因和肉桂酰基因的表达[19], 增加植株叶片总酚、类黄酮含量[20]。植物对单一的干旱或施用氮肥的反应机制已被广泛研究[1,7-9], 氮肥施用对干旱胁迫下作物的抗氧化酶活性及产量等影响已有报道[21-23], 但对其可能的调节机制及施用氮肥提高干旱胁迫下作物抗旱性的分子机制尚不明确。本试验通过对施氮、干旱及旱氮同存处理下的花生农艺性状、生理性状和根系转录组分析, 探究施用氮肥提高花生抗旱性的调控机制, 挖掘重要的候选调控基因, 为干旱胁迫下氮肥施用及花生抗旱育种提供理论基础。
1 材料与方法
1.1 试验设计
以花生品种‘花育25号’为试验材料, 在光照16 h/8 h黑暗(28℃/22℃)条件下进行盆栽试验。试验盆直径23 cm, 高度25 cm, 每盆装土5.5 kg, 种植2株花生。供试土壤为轻壤土, 中等供氮水平(碱解氮56.7 mg kg–1)。设置2个水分条件: 正常供水(well- watered, WW; 75%±5%田间持水量)和花针期干旱胁迫(drought stress, DS; 45%±5%田间持水量)。设置2种氮肥水平: 不施氮(none nitrogen, NN)和施用氮肥(nitrogen application, NA; 90 kg hm–2), 同时施用过磷酸钙(450 kghm–2)和硫酸钾(300 kghm–2), 肥料以基肥方式施入。花针期(播种后40 d)进行干旱胁迫, 水分降低至45%田间持水量后持续胁迫5 d再进行样品采集。
设置4个处理: (1) 对照(正常供水+不施氮, WWNN); (2) 施氮处理(正常供水+施用氮肥, WWNA); (3) 干旱处理(干旱胁迫+不施氮, DSNN); (4) 旱氮同存处理(干旱胁迫+施用氮肥, DSNA)。农艺性状、抗氧化特性(酚类物质及抗氧化酶活性)测定及转录组文库构建各3次重复。2020年6月进行第1次试验, 对花生农艺性状、转录组文库及酚类物质含量进行测定。2021年6月进行重复试验, 对农艺性状和抗氧化特性进行测定。各处理植株按地上部和根系分开采集, 进行农艺性状、抗氧化特性及转录组文库的测定。抗氧化酶活性及转录组文库构建所采集的根系样品液氮速冻后–80℃冰箱保存备用。
1.2 主茎高、干物质和叶片相对含水量的测定
主茎高为子叶节到主茎生长点的距离。采用烘干法测定植株干物质量。选取每株主茎倒三叶利用烘干法进行测定叶片相对含水量(relative water content, RWC), 计算公式如下:
RWC%=(叶片鲜质量–叶片干质量)/(叶片饱和鲜质量–叶片干质量)×100%
1.3 抗氧化特性指标的测定
将花生地上部和根系烘干测定干物质量后进行粉碎, 分别取0.1 g花生地上部和根系粉碎样品进行酚类相关物质的测定。采用福林酚法[24]测定总酚含量, 60%乙醇浸提样品后取上清液进行反应, 利用分光光度计测定各样品反应液在760 nm的吸光值。利用亚硝酸钠-硝酸铝显色法[25]测定类黄酮含量, 测定各样品反应液在470 nm的吸光值。
参考张蜀秋[26]的方法测定根系SOD、POD、CAT及MDA含量; 利用氮蓝四唑法测定SOD活性, 紫外吸收法测定CAT活性, 愈创木酚法测定POD活性, 硫代巴比妥酸法测定MDA含量。
1.4 RNA的提取、文库构建和测序
采用Trizol试剂(Invitrogen)提取根系总RNA, 挑选合格RNA样品进行高通量测序。委托上海美吉生物科技有限公司完成转录组测序。简要流程如下: 利用带有Oligo(dT)的磁珠对样品总RNA进行mRNA分离, 然后将mRNA随机断裂。以片段化的mRNA为模板, 在逆转录酶的作用下合成双链cDNA, 经末端修复、加碱基A形成接头。通过PCR扩增进行文库富集, 进行文库制备工作, 将构建好的文库上机进行测序。
1.5 转录组分析
将测序数据提交至NCBI (National Coalition Building Institute)数据库, 提交ID为PRJNA812634。测序数据进行生物信息学处理, 首先过滤得到高质量的clean data, 将数据序列与花生基因组数据库Peanutbase (https:/www.peanutbase.org/)进行比对, 基于定位序列进行测序质量的评估和基因表达量等分析。利用StringTie软件的最大流量算法, 采用FPKM作为衡量转录本或基因表达水平的指标。表达水平差异基因(differentially expressed genes, DEGs)的筛选阈值为-value≤0.01且|log2(FC)|≥1。筛选完成后以WWNN处理为对照, 将4个处理分为3组进行后续比对分析: (1) 施氮处理, WWNN vs WWNA; (2) 干旱处理, WWNN vs DSNN; (3) 旱氮同存处理, WWNN vs DSNA。
利用Gene Ontology (GO)数据库和Kyoto Encyclopedia of Genes and G enomes (KEGG)数据库对DEGs进行差异表达基因的GO分析和KEGG Pathway富集分析。
1.6 差异表达基因的qRT-PCR验证
随机挑选6个基因采用qRT-PCR的方法对转录组测序的结果进行验证, 利用Primer 5.0软件设计扩增引物(表1)。每个样品进行3次生物学重复, 利用基因均一化, 采用2–ΔΔCt方法计算差异基因相对表达量[27]。
1.7 数据分析
使用SPSS 19.0数据处理系统软件进行方差分析, 利用Duncan’s法进行差异显著性分析。
2 结果与分析
2.1 不同处理对花生农艺性状的影响
由表2可知, 与WWNN处理相比, WWNA处理增加花生整株生物量, 2020年和2021年增加幅度分别为15.7%和7.1%, DSNN处理降低花生整株生物量, 2020年DSNA处理增加整株生物量, 增加幅度为8.0%。不同水分和氮肥水平对花生根冠比无显著影响, 但施用氮肥降低了不同水分条件下的根冠比。与WWNN处理相比, DSNN及DSNA处理下叶片相对含水量显著降低, 2020年和2021年降低幅度分别为21.2%、8.8%和33.1%、12.2%。由此表明, 施用氮肥提高了干旱胁迫下的叶片相对含水量, 增强了花生的抗旱性。方差分析表明, 2年间氮素水平对花生生物量、根冠比及叶片相对含水量均具有显著效应, 水分和氮素互作处理对叶片相对含水量具有显著效应。
2.2 不同处理对酚类代谢物质含量的影响
不同水分和氮肥水平下, 花生植株的总酚含量和类黄酮含量呈不同变化趋势(表3), 各处理地上部和整株总酚含量和类黄酮含量变化趋势相同。与WWNN处理相比, WWNA处理显著降低地上部和整株总酚含量, 2020年降低幅度均为6.9%, 2021年降低幅度分别为9.2%和8.6%; DSNN处理降低了地上部、根系及整株总酚含量, 2021年根系降低幅度最大, 为26.2%。与DSNN处理相比, DSNA处理增加花生总酚含量, 2年平均, 地上部、根系和整株增加幅度分别为7.1%、15.3%和6.2%。
与WWNN处理相比, 2年条件下WWNA和DSNN处理降低了花生地上部及整株类黄酮含量, 2020年降低幅度分别为18.2%、21.5%和17.7%、27.9%; 2021年降低幅度分别为14.1%、15.8%和9.6%、14.8%。与WWNN处理相比, DSNA处理对地上部、根系及整株类黄酮含量无显著影响, 但与DSNN处理相比, DSNA处理增加花生各器官类黄酮含量, 2020年和2021年地上部、根系及整株类黄酮含量的增加幅度分别为28.6%、7.8%、38.2%和6.2%、33.6%、7.5%。方差分析表明, 2021年氮素水平对花生各器官总酚含量具有显著影响, 2020年水分和氮素对地上部和整株类黄酮含量互作效应显著。
2.3 不同处理对花生根系抗氧化酶活性及丙二醛含量的影响
与WWNN相比, WWNA处理增加花生根系SOD、CAT和POD活性, 增加幅度分别为12.0%、7.9%和63.6%; DSNN和DSNA处理均显著增加根系POD活性, 增加幅度分别为72.7%和81.8%。与DSNN相比, DSNA处理增加花生根系CAT和POD活性, 增加幅度分别为9.4%和5.3%, 降低了根系MDA含量, 其降幅为6.3% (图1)。表明干旱胁迫条件下施用氮肥对花生根系CAT和POD活性影响较大。
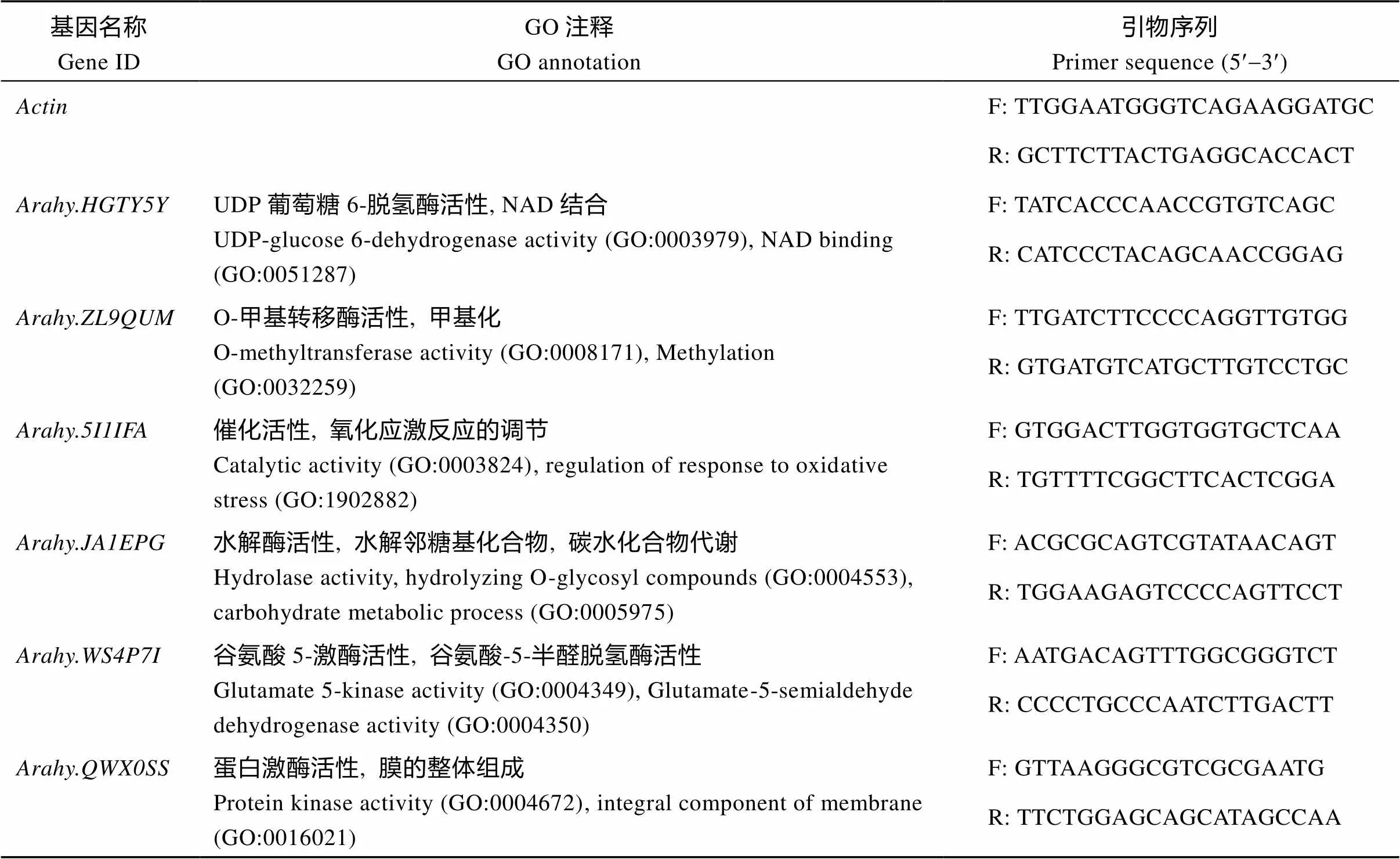
表1 qRT-PCR引物信息
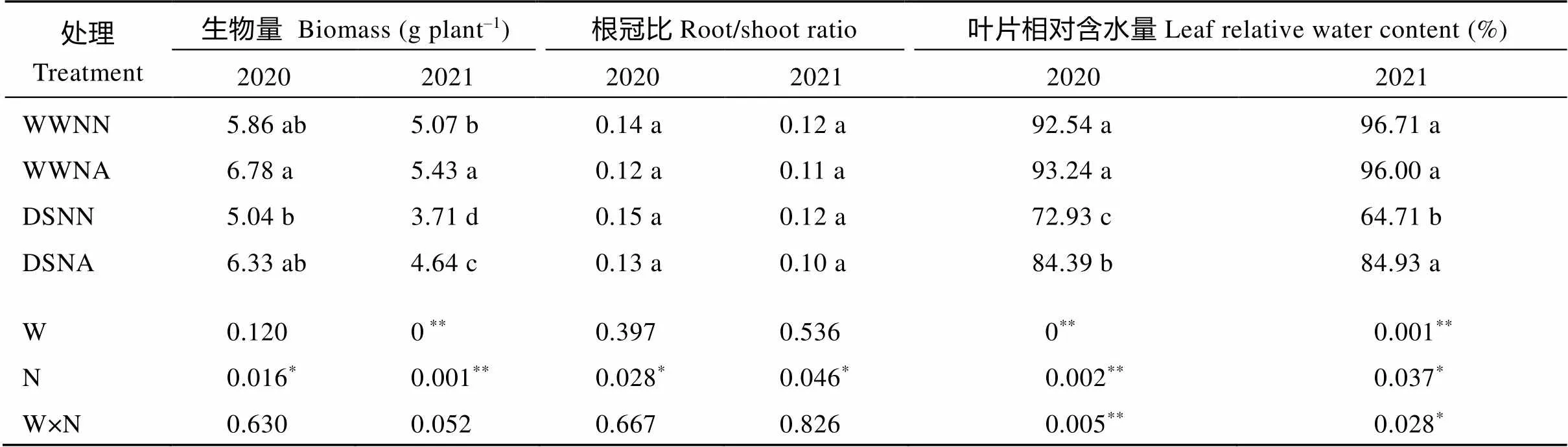
表2 不同处理对花生农艺性状的影响
同列数据后不同字母表示处理间差异显著(< 0.05)。*和**分别代表< 0.05和< 0.01显著水平。WW: 正常供水条件; DS: 干旱胁迫; NN: 不施氮肥; NA: 施用氮肥, 90 kg hm–2; W: 水分; N: 氮素; W×N: 水分×氮素。
Mean values followed by different letters within a column are significantly different among treatments at< 0.05.*and**mean significant difference at< 0.05 and< 0.01, respectively. WW: well-watered condition; DS: drought stress; NN: no nitrogen application; NA: nitrogen application of 90 kg hm–2; W: water; N: nitrogen; W×N: water×nitrogen.
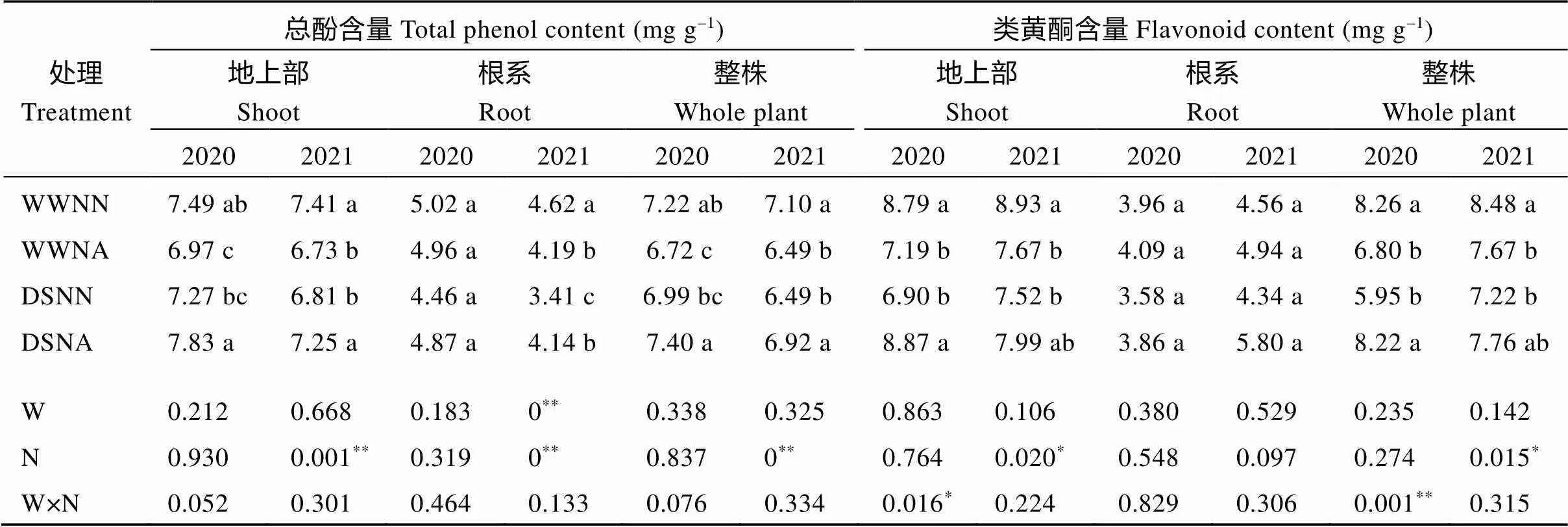
表3 不同处理对花生酚类物质含量的影响
同列数据后不同字母表示处理间差异显著(< 0.05)。*和**分别代表< 0.05和< 0.01显著水平。处理同表2。
Mean values followed by different letters within a column are significantly different among treatments at< 0.05.*and**mean significant difference at< 0.05 and< 0.01, respectively. Treatments are the same as those given in Table 2.
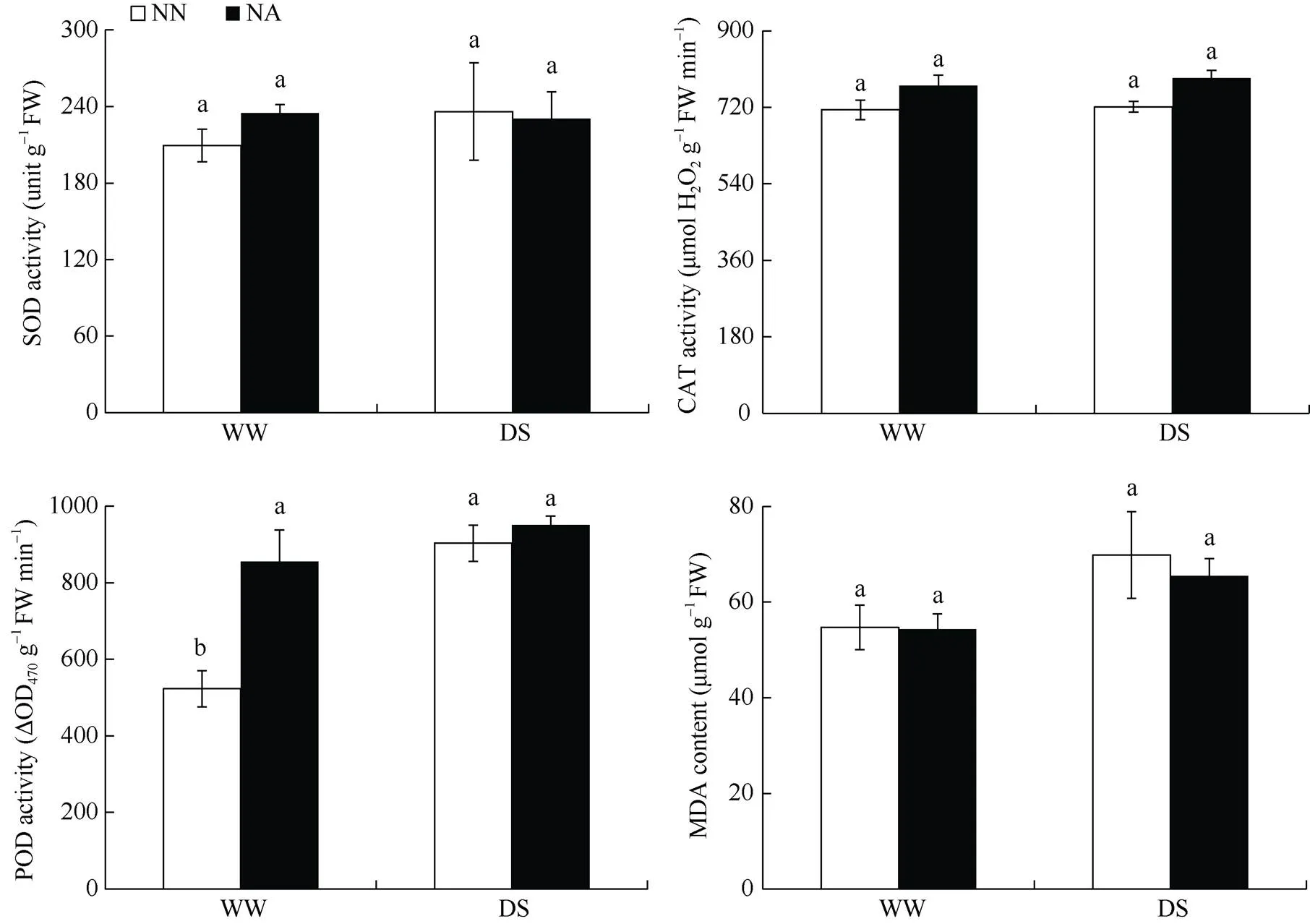
图1 不同处理对花生根系抗氧化酶活性及丙二醛含量的影响
标以不同小写字母的柱值表示处理间在0.05水平上差异显著。处理同表2。
Bars superscripted by different letters are significantly different at the 0.05 probability level. Treatments are the same as those given in Table 2.
2.4 基因表达谱
为了解样本之间的整体关系, 首先对基因表达矩阵进行分层聚类, 并使用Spearman相关系数进行分析, 12个样本分为2簇: 一簇包含施用氮肥处理的样本, 其他样本则聚合为另一簇(图2-A)。这些转录组在相同条件下具有良好的生物学重复性, 表明花生根系基因表达对处理具有稳定和独特的反应。为
系统地探索转录组动态, 对不同处理间进行了配对比较(图2-B), 并确定差异表达基因, 发现共有8907个基因代表至少一种表达水平的变化。干旱处理下共筛选出差异表达基因1731个, 施氮处理下筛选出差异表达基因5396个, 旱氮同存处理下筛选出差异表达基因7382个, 其中649个基因在所有处理中均差异表达。

图2 不同处理间样本相关性分析及花生根系差异表达基因维恩图
处理同表2。Treatments are the same as those given in Table 2.
2.5 施氮处理下花生根系差异表达基因分析
正常供水条件下, 与不施氮肥条件的根系转录组样本相比, 施氮处理下分别有1626个基因表达上调和3770个基因表达下调。为推断这些差异基因的潜在功能, 本研究进行基因本体(GO)分析, 并对这些基因的序列注释进行了表征。5396个基因中有4423个(81.97%)被分配了GO通路(图3-A), 为生物过程、分子功能和细胞组成3个部分。这些途径分为53个类别, 前5类分别是“催化活性” (2319, 52.43%)、结合(2259, 51.07%)、膜(1568, 35.45%)、膜部分(1468, 33.19%)和“细胞过程” (1233, 27.88%)。GO分析显示, 碳水化合物代谢过程(GO:0005975)、脂肪酸结合(GO:0005504)、脂质代谢过程(GO:0006629)和氧化还原酶活性(GO:0016903)等途径相关基因在WWNA处理中显著上调富集。
与对照处理相比, 根据校正的值, 施氮处理下根系中3943个差异表达的DEGs被分配到130个KEGG途径, 其中显著富集通路28条(-value<0.01)。49个谷胱甘肽代谢途径(glutathione metabolism, ko00480)、22个氮代谢途径(nitrogen metabolism, ko00910)、37个半胱氨酸和蛋氨酸代谢途径(cysteine and methionine metabolism, ko00270)的相关基因在施氮后表现出显著的表达变化(图3-B)。此外, 本研究还鉴定到132个淀粉和蔗糖的代谢(starch and sucrose metabolism, ko00500)、88个碳代谢(carbon metabolism, ko01200)和27个果糖和甘露糖代谢(fructose and mannose metabolism, ko00051)等碳代谢途径相关基因显著变化。表明施用氮肥对正常供水条件下花生的碳氮代谢有显著影响。
2.6 干旱处理下花生根系差异表达基因的分析
干旱胁迫导致根中1176个基因上调, 555个基因下调。功能富集分析表明, DEG以GO形式富集, 大量DEGs与各种应激反应相关, 如刺激反应(GO:0050896)和催化活性反应(GO:0003824)、抗氧化活性反应(GO:0016209)、信号转导活性(GO:0004871)和结合(GO:0005488)。COG分类显示次生代谢物生物合成、运输和分解代谢(secondary metabolites biosynthesis, transport and catabolism)及碳水化合物代谢(carbohydrate transport and metabolism)这2类功能相关基因数量较多, 占比均在14%以上(图4-A)。此外, 观察到根中142种转录因子在干旱胁迫下表现出显著的表达变化, 其中80种转录因子上调表达, 62种转录因子下调表达。图4-B显示了前15个差异表达转录因子家族, 大部分AP2/ERF、GRAS和WRKY类转录因子上调表达, 而bHLH、C2H2和SRS类等转录因子家族在干旱胁迫下下调表达基因数目较多。

图3 施氮处理下差异表达基因的功能注释分析
AP2/ERF: AP2/ERF转录因子; GRAS: GRAS转录因子; WRKY: WRKY转录因子; G2-like: G2-like转录因子; LOB: 侧生器官边界结构域转录因子; bHLH: 碱性螺旋-环-螺旋转录因子; C2H2: 锌指结构转录因子; NAC: NAC转录因子; B3-ARF: B3-ARF转录因子; MYB: MYB类转录因子; MYB-related: MYB-related转录因子; B3: B3转录因子; C2C2-CO-like: C2C2-CO-like转录因子; bZIP: 碱性亮氨酸拉链类转录因子; SRS: SRS转录因子。
AP2/ERF: apetala 2/ethylene-responsive element binding factor; GRAS: GRAS transcription factor; WRKY: WRKY transcription factor; G2-like: G2-like transcription factor; LOB: lateral organ boundaries domain transcription factor; bHLH: basic Helix-Loop-Helix transcription facto; C2H2: zinc finger domain transcription factor; NAC: NAC transcription factor; B3-ARF: B3-ARF transcription factor; MYB: MYB (v-myb avian myeloblastosis viral oncogene homolog) transcription factor; MYB-related: MYB (v-myb avian myeloblastosis viral oncogene homolog) related transcription factor; B3: B3 domain transcription factor; C2C2-CO-like: C2C2-CO-like transcription factor; bZIP: basic region/leucine zipper motif ; SRS: SRS transcription factor.
2.7 旱氮同存处理下花生根系差异表达基因的分析
旱氮同存处理下火山图表明, 7382个DEGs发生表达变化(图5-A), 其中2585个DEGs上调表达, 4797个DEGs下调表达。COG分类显示DEGs蛋白功能主要集中在一般功能预测(general function prediction only)、次生代谢物生物合成、运输和分解代谢(secondary metabolites biosynthesis, transport and catabolism)、碳水化合物运输和代谢(carbohydrate transport and metabolism)和信号转导代谢(signal transduction metabolism)等方面(图5-B)。KEGG通路富集显示DEGs共富集在130个通路中, 其中显著富集通路27条(-value< 0.01), 这些通路涉及初生代谢中的氮代谢(nitrogen metabolism, ko00910)、淀粉和蔗糖代谢(starch and sucrose metabolism, ko00500)、半乳糖代谢(galactose metabolism, ko00052)等途径; 次生代谢中的苯丙烷生物合成(phenylpropanoid biosynthesis, ko00940)、类黄酮生物合成(flavonoid biosynthesis, ko00941)、异黄酮生物合成(isoflavonoid biosynthesis, ko00943)、异喹啉生物碱生物合成(isoquinoline alkaloid biosynthesis, ko00950)等途径; 以及ABC转运蛋白(ABC transporters, ko02010)、玉米素生物合成(zeatin biosynthesis, ko00908)、植物激素信号转导(plant hormone signal transduction, ko04075)等信号转导代谢途径(图5-C)。这表明干旱和氮肥交互作用下, 花生植株通过复杂的物质交换和信号转导来调节自身适应干旱逆境。
对旱氮同存处理下酚类物质相关的苯丙烷生物合成、类黄酮生物合成及异黄酮生物合成途径的差异表达基因进行分析。与对照处理相比, 旱氮同存处理下3种途径中有51个差异基因上调表达, 207个基因下调表达(图6-A)。聚类分析将4个处理分为2类(图6-B), 其中对照与干旱处理表现出相似的基因表达模式, 而施氮处理与旱氮同存处理表现出与之相反的调控模式。与对照相比, 干旱处理提高了次生代谢酚类相关物质合成相关基因表达, 而旱氮同存处理下次生代谢酚类相关物质合成基因表达呈相反趋势。表明, 与氮肥相比, 花生次生代谢酚类相关物质的合成对干旱的响应更敏感。
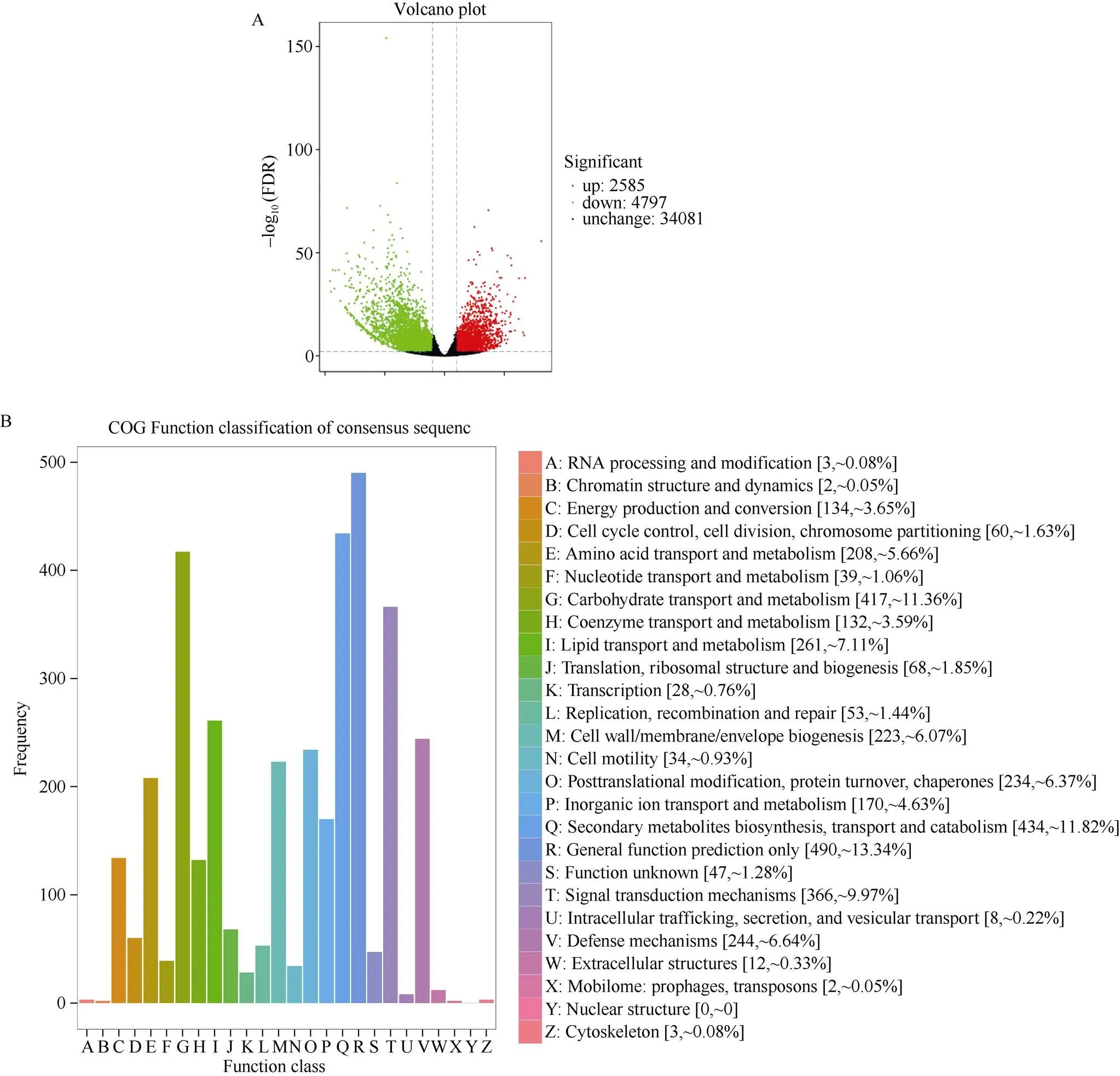
(图5)
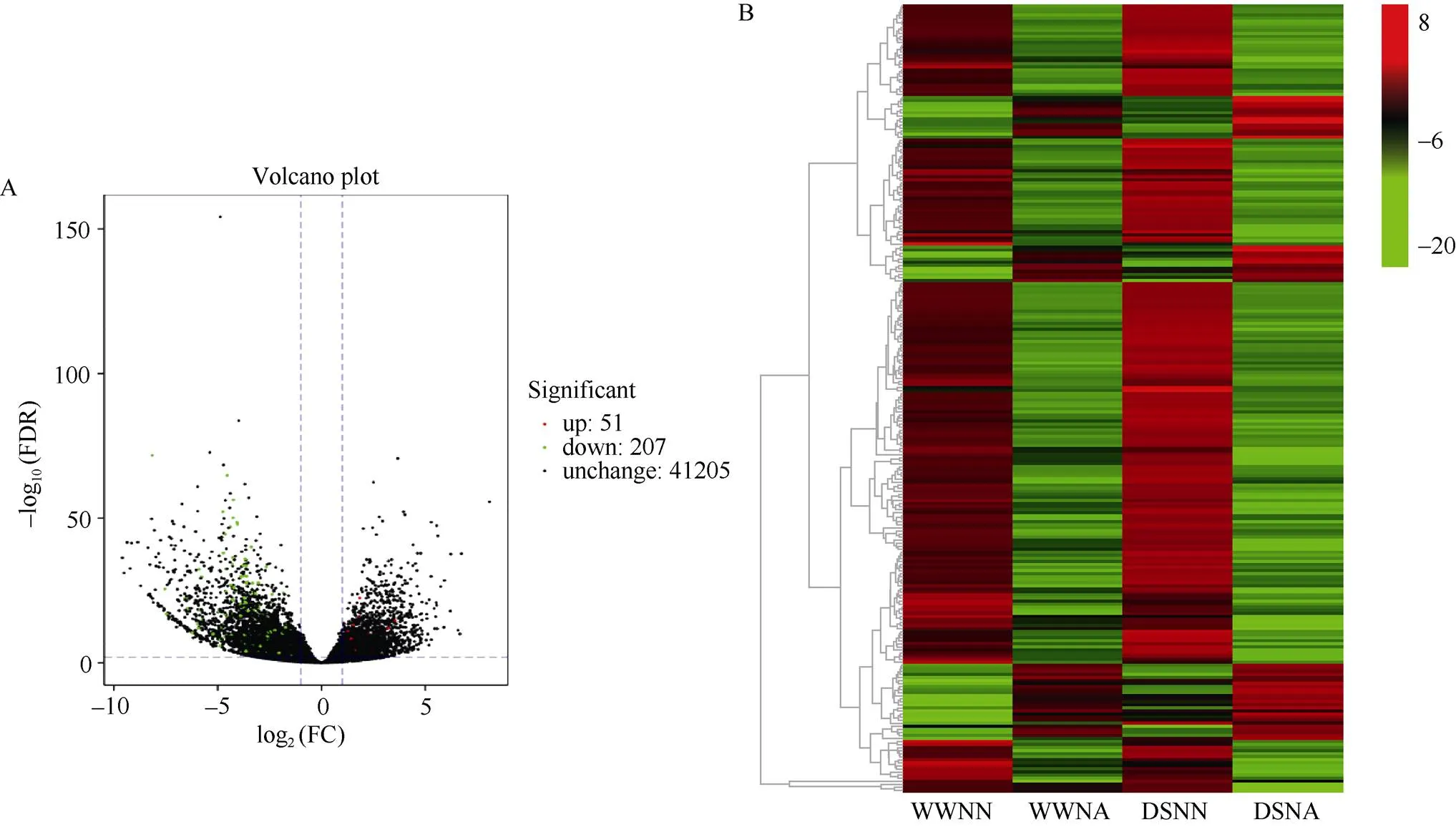
图6 不同处理下酚类物质相关途径DEGs表达分析
处理同表2。Treatments are the same as those given in Table 2.
2.8 差异表达基因的qRT-PCR验证
为验证转录组测序结果中基因表达量的准确性,随机挑选了6个基因进行不同处理下的qRT-PCR验证。将qRT-PCR结果与转录组测序数据比对发现, 6个差异表达基因与转录组数据基本一致(图7-A~F), 同时RNA-seq数据与qRT-PCR结果在0.01水平上线性关系良好,2达到0.61 (图7-G), 表明转录组测序数据的可靠性, 可以用来分析不同氮素水平下花生对干旱胁迫响应的差异表达基因。
3 讨论
干旱条件下的养分缺乏会加剧干旱胁迫的抑制作用[28]。已有研究表明, 适量施氮可以减轻干旱胁迫对植物生长的抑制作用, 显著缓解干旱胁迫的不利影响[29-30]。本试验中, 干旱胁迫显著降低了花生的生物量和叶片相对含水量。干旱胁迫下施氮增加了花生生物量和叶片相对含水量, 增强了花生的抗旱能力。酚类化合物是植物中重要的抗氧化物质, 植物可以通过增加酚类化合物的含量来消除环境胁迫下产生的氧自由基, 减少环境胁迫下细胞的损伤, 增强细胞的保护功能[31-32]。酚类物质含量的增加及POD和CAT活性的提高对茶树抵制干旱胁迫具有重要作用[33]。适量施用氮肥提高了干旱胁迫下棉花、小麦、玉米等作物叶片的抗氧化酶活性, 降低MDA含量[18,21,34]。本研究表明, 正常供水条件下, 施用氮肥降低花生地上部的总酚和类黄酮含量, 对根系的总酚和类黄酮含量无显著影响。施用氮肥增加了干旱胁迫下花生地上部和根系的类黄酮和总酚含量及POD和CAT活性, 降低了根中MDA含量。由此表明, 根系中类黄酮和总酚含量的增加激发了细胞抗氧化反应, 保护了细胞质膜的完整性, 增强了花生的抗旱性。
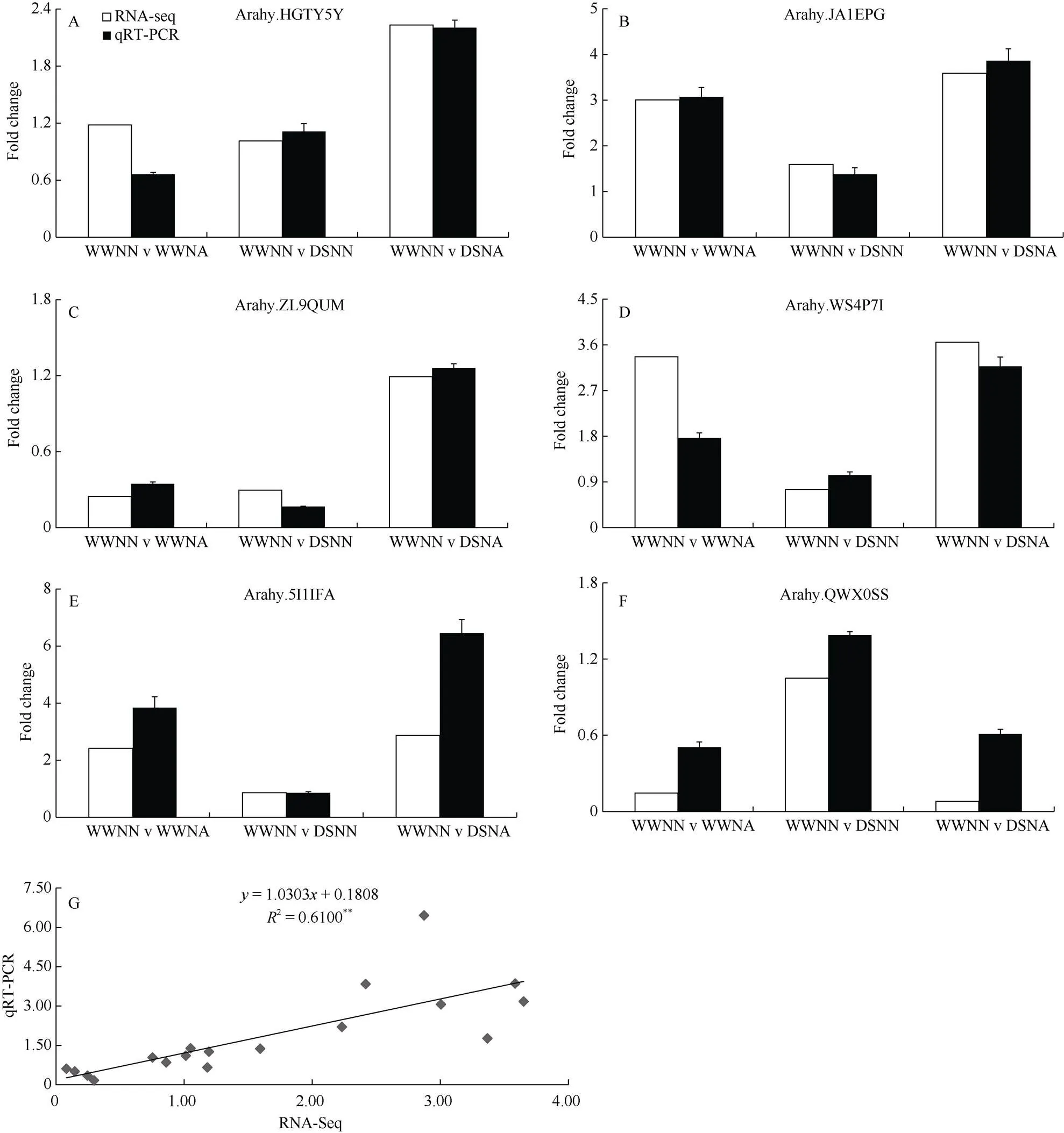
图7 转录组测序结果的qRT-PCR 验证
A~F为6个基因的表达趋势图; G为相关性分析图。处理同表2。**,< 0.01。
A–F are the relative expression profiles of six validated genes, respectively; G is the correlation diagram of validated gene. Treatments are the same as those given in Table 2.**,< 0.01.
转录组分析是鉴定植物响应环境变化关键基因和途径的重要手段之一。对不同处理获得的差异基因进行聚类分析表明, 12个样品分为施氮和不施氮2组, 表明施氮对花生根系基因表达有较大影响。施用氮肥影响了干旱胁迫下花生根系的基因表达。氮缺乏条件下, 与正常供水条件相比, 干旱胁迫下存在1731个差异表达基因, 而氮肥施用条件下干旱胁迫仅得到227个差异表达基因。由此表明, 氮肥施用使干旱胁迫下的花生的转录组图谱趋于对照转录组图谱, 表明花生对干旱胁迫的适应性反应依赖于氮素营养水平, 与前人在楸树中的研究结果一致[23]。本研究中鉴定的干旱胁迫响应基因数量远小于氮素响应基因数量, 这可能是由于花生的根瘤固氮特性使其对氮素的响应更为显著。不同氮肥水平下根系差异表达基因主要集中在氮代谢、碳水化合物代谢、脂质代谢和MAPK信号转导等过程, 与其他作物中氮素影响的基因表达相一致[35-36]。硝酸盐转运蛋白(nitrate transporter, NRT)和铵转运蛋白(ammonium transporter, AMT)是氮素吸收运输的2种基因家族。施氮处理下, 花生根系相关基因在上调和下调均有表达, 而相关基因仅上调表达。已有研究表明植物中不同基因家族表达受氮素水平的调控上调或抑制[37], 作物类型、氮素形态及处理时间等可能是影响结果不一致的原因。
干旱胁迫下, 植物会产生多种抗逆性响应, 如渗透调节、活性氧清除及碳水化合物转运等。本研究表明, 干旱胁迫影响了如过氧化氢分解过程、活性氧代谢过程、氧化还原酶活性和过氧化物酶活性等抗氧化酶相关基因的表达量。KEGG分析表明, 次生代谢物生物合成、运输和分解代谢与碳水化合物代谢等过程与干旱胁迫密切相关, 与前人在油菜等植物中的研究一致[38-39]。由此表明, 抗氧化系统、次生代谢物质及碳水化合物代谢在花生抗干旱胁迫中具有重要的作用。转录因子是植物应对非生物胁迫的重要调节因子[40]。本试验表明, 干旱胁迫下与AP2/ERF、GRAS和WRKY家族相关的转录因子上调表达数目最多, 而bHLH、C2H2和SRS类等转录因子家族下调表达的基因数目较多。已有一些研究表明bHLH和C2H2家族的几个成员的过度表达可以提高抗旱性[41-42]。本研究结果与前人研究不一致, 可能是干旱胁迫下不同植物中这些转录因子具有不同的作用。干旱胁迫下不同转录因子家族中的基因表达量受到调控, 这可能促进花生对干旱逆境的适应。
旱氮同存处理使根系差异表达基因集中在次生代谢物生物合成、运输和分解代谢、碳水化合物代谢和信号转导代谢等相关途径。次生代谢产物途径中与酚类物质相关分析表明, 与对照相比, 旱氮同存处理下41个与苯丙烷生物合成相关、11个类黄酮生物合成相关、7个异黄酮生物合成相关的基因上调表达。苯丙烷生物合成途径的激活有助于各种酚类化合物的积累, 具有清除有害活性氧物质的潜力。抗氧化特性测定结果表明, 施用氮肥增加了干旱胁迫下花生根系的总酚和类黄酮含量。茶树中研究表明干旱胁迫下外源施用ABA显著影响了叶片类黄酮合成相关基因的表达, 提高了叶片中类黄酮、异黄酮等物质含量, 提高了茶树的抗旱性[43]。杨树中研究亦表明干旱胁迫下施用氮肥增强了抗氧化系统和次生代谢相关基因的表达[44]。由此推测, 外源氮的施用提高了花生根系酚类物质合成相关部分基因的表达, 增加了其酚类物质含量, 使其抗氧化酶活性增强, 提高了干旱胁迫下花生的抗旱性。酚类物质对花生抗旱性的调控功能及其合成与代谢基因在花生抵御干旱胁迫中的作用需进一步研究。
4 结论
通过对施氮、干旱及旱氮同存处理下花生的植株表型及生理分析表明, 与对照相比, 旱氮同存处理提高了干旱胁迫下花生生物量与叶片相对含水量。氮肥施用增加了干旱胁迫下花生根系的总酚和类黄酮含量及其POD和CAT活性, 降低其MDA含量, 提高了花生抗旱性。根系转录组分析发现, 氮肥
施用使根系差异表达基因主要集中于氮代谢、碳水化合物代谢、脂质代谢和MAPK信号转导等途径, 而干旱胁迫处理下主要集中于酚类物质合成、淀粉和蔗糖代谢、MAPK 信号通路及玉米素生物合成等途径。旱氮同存处理下施用氮肥可能通过调控次生代谢物(抗氧化酶类、黄酮类、苯丙素等)代谢、碳水化合物代谢等途径缓解干旱胁迫。
[1] Ding L, Lu Z, Gao L, Guo S, Shen Q. Is nitrogen a key determinant of water transport and photosynthesis in higher plants upon drought stress?, 2018, 9: 1143.
[2] Mackay A. Climate change 2007: impacts, adaptation and vulnerability. Contribution of working group II to the fourth assessment report of the intergovernmental panel on climate change., 2008, 37: 2407.
[3] 张智猛, 戴良香, 宋文武, 丁红, 慈敦伟, 康涛, 宁堂原, 万书波. 干旱处理迫对花生品种叶片保护酶活性和渗透物质含量的影响. 作物学报, 2013, 39: 133–141.
Zhang Z M, Dai L X, Song W W, Ding H, Ci D W, Kang T, Ning T Y, Wan S B. Effect of drought stresses at different growth stages on peanut leaf protective enzyme activities and osmoregulation substances content., 2013, 39: 133–141 (in Chinese with English abstract).
[4] 李阿立, 冯雅楠, 李萍, 张东升, 宗毓铮, 林文, 郝兴宇. 大豆叶片响应CO2浓度升高、干旱及其交互作用的转录组分析. 作物学报, 2022, 48: 1103–1118.
Li A L, Feng Y N, Li P, Zhang D S, Zong Y Z, Lin W, Hao X Y. Transcriptome analysis of leaves responses to elevated CO2concentration, drought and interaction conditions in soybean [(Linn.) Merr.]., 2022, 48: 1103–1118 (in Chinese with English abstract).
[5] 邓婉月, 冷秋彦, 杨在君, 余燕, 吴一超. 干旱胁迫对盆栽“川丹参1号”生理指标及主要活性成分含量的影响. 作物杂志, 2021, (1): 74–81.
Deng W Y, Leng Q Y, Yang Z J, Yu Y, Wu Y C. Effects of simulated drought stress on the physiological indexes and contents of active components of potted “Chuandanshen 1”., 2021, (1): 74–81 (in Chinese with English abstract).
[6] 马惠, 王琦, 赵鸣, 王红艳, 纪祥龙, 董合忠. 非生物胁迫对棉花次生代谢及棉蚜种群消长的影响. 棉花学报, 2016, 28: 324–330.
Ma H, Wang Q, Zhao M, Wang H Y, Ji X L, Dong H Z. Effects of abiotic stress on cotton secondary metabolism and cotton aphid population dynamics., 2016, 28: 324–330 (in Chinese with English abstract).
[7] Gharibi S, Tabatabaei B E S T, Saeidi G, Goli S A H. Effect of drought stress on total phenolic, lipid peroxidation, and antioxidant activity of achillea species., 2015, 178: 796–809.
[8] Aninbon C, Jogloy S, Vorasoot N, Nuchadomrong S, Patanothai A. Effect of mid-season drought on phenolic compounds in peanut genotypes with different levels of resistance to drought., 2016, 187: 127–134.
[9] 李丹丹, 梁宗锁, 普布卓玛, 杨宗岐, 韩蕊莲, 徐学选. 干旱胁迫对紫花苜蓿黄酮类化合物含量及其合成途径关键酶活性的影响. 西北植物学报, 2020, 40: 1380–1388.
Li D D, Liang Z S, Pubuzhuoma, Yang Z Q, Han R L, Xu X X. Flavonoids contents and flavonoids synthetic key enzyme activities in alfalfa under drought stress., 2020, 40: 1380–1388 (in Chinese with English abstract).
[10] 秦天元, 刘玉汇, 孙超, 毕真真, 李安一, 许德蓉, 王一好, 张俊莲, 白江平. 马铃薯基因家族的鉴定及其对干旱胁迫的响应分析. 作物学报, 2021, 47: 780–786.
Qin T Y, Liu Y H, Sun C, Bi Z Z, Li A Y, Xu D R, Wang Y H, Zhang J L, Bai J P. Identification ofgene family and expression profile analysis of response to drought stress in potato., 2021, 47: 780–786 (in Chinese with English abstract).
[11] Wang K, Bu T, Cheng Q, Dong L, Su T, Chen Z, Kong F, Gong Z, Liu B, Li M. Two homologous LHY pairs negatively control soybean drought tolerance by repressing the abscisic acid responses., 2020, 229: 2660–2675.
[12] Bhogireddy S, Xavier A, Garg V, Layland N, Varshney R K. Genome-wide transcriptome and physiological analyses provide new insights into peanut drought response mechanisms., 2020, 10: 4071.
[13] 万丽云, 苏威, 李蓓, 雷永, 晏立英, 康彦平, 淮东欣, 陈玉宁,姜慧芳, 廖伯寿. 花生苗期干旱处理后转录和代谢通路分析. 中国油料作物学报, 2018, 40: 335–343.
Wan L Y, Su W, Li B, Lei Y, Yan L Y, Kang Y P, Huan D X, Chen Y N, Jiang H F, Liao B S. Molecular analysis of formation of drought tolerance traits in peanut., 2018, 40: 335–343 (in Chinese with English abstract).
[14] Du Q G, Yang J, Muhammad S, Shah S, Li W X. Comparative transcriptome analysis of different nitrogen responses in low-nitrogen sensitive and tolerant maize genotypes., 2021, 20: 2043–2055.
[15] Abid M, Tian Z, Tahir A, Cui Y, Yang L, Rizwan Z, Jiang D, Dai T. Nitrogen nutrition improves the potential of wheat (L.) to alleviate the effects of drought stress during vegetative growth periods., 2016, 7: 981.
[16] Gou W, Zheng P F, Tian L, Gao W, Zhang L X, Akram N A, Ashraf M. Exogenous application of urea and a urease inhibitor improves drought stress tolerance in maize (L.)., 2017, 130: 599–609.
[17] Agamia R A, Alamri S A M, Abd El-Mageedc T A, Abousekkend M S M, Hashemb M. Role of exogenous nitrogen supply in alleviating the deficit irrigation stress in wheat plants., 2018, 210: 261–270.
[18] 刘瑞显, 郭文琦, 陈兵林, 周治国. 氮素对花铃期干旱及复水后棉花叶片保护酶活性和内源激素含量的影响. 作物学报, 2008, 34: 1598–1607.
Liu R X, Guo W Q, Chen B L, Zhou Z G. Effects of nitrogen on the antioxidant enzyme activities and endogenous hormone contents of cotton leaf under drought stress and after soil re-watering during the flowering and boll-forming stage., 2008, 34: 1598–1607 (in Chinese with English abstract).
[19] 熊君, 王海斌, 方长旬, 邱龙, 吴文祥, 何海斌, 林文雄. 不同氮素供应下水稻酚类物质代谢关键酶基因差异表达. 植物生理与分子生物学学报, 2007, 33: 387–394.
Xiong J, Wang H B, Fang C X, Qiu L, Wu W X, He H B, Lin W X. The differential expression of the genes of the key enzymes involved in phenolic compound metabolism in rice (L.) under different nitrogen supply., 2007, 33: 387–394 (in Chinese with English abstract),
[20] 卢国理, 汤利, 楚轶欧, 周文利, 苏海鹏, 刘自红, 郑毅. 单/间作条件下氮肥水平对水稻总酚和类黄酮的影响. 植物营养与肥料学报, 2008, 14: 1064–1069.
Lu G L, Tang L, Chu Y O, Zhou W L, Su H P, Liu Z H, Zheng Y. Effect of nitrogen levels on the changes of phenol and flavonoid contents under rice monocropping and intercropping system., 2008, 14: 1064–1069 (in Chinese with English abstract).
[21] 刘志鹏, 陈曦, 杨梦雅, 赵颖佳, 肖凯. 氮量及减灌对冬小麦旗叶生理参数和细胞保护酶活性的影响. 麦类作物学报, 2018, 38: 175–182.
Liu Z P, Chen X, Yang M Y, Zhao Y J, Xiao K. Effect of nitrogen amount and limited irrigation on physiological features of flag leaf and cellular protective enzyme activities in wheat., 2018, 38: 175–182 (in Chinese with English abstract).
[22] Zhang L X, Li S X, Zhang H, Liang Z S. Nitrogen rates and water stress effects on production, lipid peroxidation and antioxidative enzyme activities in two maize (L.) genotypes., 2007, 193: 387–397.
[23] Shi H, Ma W, Song J, Lu M, Rahman S U, Bui T T X, Vu D D, Zhang H, Wang J, Zhang Y. Physiological and transcriptional responses ofto drought stress under sufficient- and deficient-nitrogen conditions., 2017, 37: 1457–1468.
[24] Wang Y, Gao S, He X, Li Y, Zhang Y, Chen W. Response of total phenols, flavonoids, minerals, and amino acids of four edible fern species to four shading treatments., 2020, 8: e8354.
[25] 张新业, 王雨欣, 孙艳香, 朱姝, 王聪艳, 李文静. 胡萝卜类黄酮含量的测定及基因家族的鉴定分析. 西北农业学报, 2021, 30: 572–581.
Zhang X Y, Wang Y X, Sun Y X, Zhu S, Wang C Y, Li W J. Determination of flavonoid content in carrot (subsp.) and identification ofgene family., 2021, 30: 572–581 (in Chinese with English abstract).
[26] 张蜀秋. 植物生理学实验技术教程. 北京: 科学出版社, 2011. pp 191–202.
Zhang S Q. Experimental Technology Course of Plant Physiology. Beijing: Science Press, 2011. pp 191–202 (in Chinese)
[27] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCtmethod., 2001, 25: 402–408.
[28] Farooq M, Wahid A, Kobayashi N, Fujita D, Basra S. Plant drought stress: effects, mechanisms and management., 2009, 29: 185–212.
[29] Teixeira E I, George M, Herreman T, Brown H, Fletcher A, Chakwizira E, de Ruiter J, Maley S, Noble A. The impact of water and nitrogen limitation on maize biomass and resource-use efficiencies for radiation, water and nitrogen., 2014, 168: 109–118.
[30] Prasertsak A, Fukai S. Nitrogen availability and water stress interaction on rice growth and yield., 1997, 52: 249–260.
[31] 郑瑞生, 封辉, 戴聪杰, 洪小斌, 宁秋蓉. 植物中抗氧化活性成分研究进展. 中国农学通报, 2010, 26(9): 85–90.
Zheng R S, Feng H, Dai C J, Hong X B, Ning Q R. Research progress on active antioxidant components from plants., 2010, 26(9): 85–90 (in Chinese with English abstract).
[32] Nouraei S, Rahimmalek M, Saeidi G. Variation in polyphenolic composition, antioxidants and physiological characteristics of globe artichoke (var.L.) as affected by drought stress.(Amsterdam), 2018, 233: 378–385.
[33] Upadhyaya H, Panda S K, Dutta B K. Variation of physiological and antioxidative responses in tea cultivars subjected to elevated water stress followed by rehydration recovery., 2008, 30: 457–468.
[34] Zhang L, Wang K, Zhang X, Zhang L. Role of nitrate nutrition in alleviation of the adverse effects of drought stress on maize cultivars: biomass production and antioxidative capacity., 2011, 43: 2869–2874.
[35] 张文云, 张建诚, 姚景珍. 氮胁迫下小麦叶片转录组分析. 中国农业科技导报, 2020, 22(11): 26–34.
Zhang W Y, Zhang J C, Yao J Z. Comparative transcriptome analysis of wheat leaf in response to low nitrogen stress., 2020, 22(11): 26–34 (in Chinese with English abstract).
[36] Xin W, Zhang L, Zhang W, Gao J, Yi J, Zhen X, Du M, Zhao Y, Chen L. An integrated analysis of the rice transcriptome and metabolome reveals root growth regulation mechanisms in response to nitrogen availability., 2019, 20: 5893.
[37] 刘婷, 尚忠林. 植物对铵态氮的吸收转运调控机制研究进展. 植物生理学报, 2016, 52: 799–809.
Liu T, Shang Z L. Research progress on molecular regulation of ammonium uptake and transport in plant., 2016, 52: 799–809 (in Chinese with English abstract).
[38] Wang J, Jiao J, Zhou M, Jin Z, Yu Y, Liang M. Physiological and transcriptional responses of industrial rapeseed () seedlings to drought and salinity stress., 2019, 20: 5604.
[39] Li S, Fan C, Li Y, Zhang J, Sun J, Chen Y, Tian C, Su X, Lu M, Liang C, Hu Z. Effects of drought and salt-stresses on gene expression inseedlings revealed by RNA-seq., 2016, 17: 200.
[40] Baillo E H, Kimotho R N, Zhang Z, Xu P. Transcription factors associated with abiotic and biotic stress tolerance and their potential for crops improvement., 2019, 10: 771.
[41] Seo J S, Joo J, Kim M J, Kim Y K, Nahm B H, Sang I S, Cheong J J, Lee J S, Kim J K, Yang D C. OsbHLH148, a basic helix-loop-helix protein, interacts with OsJAZ proteins in a jasmonate signaling pathway leading to drought tolerance in rice., 2011, 65: 907–921.
[42] Zhang X, Zhang B, Li M J, Yin X M, Huang L F, Cui Y C, Wang M L, Xia X.encoding a rice C2H2-type zinc finger protein confers enhanced drought tolerance in transgenic Arabidopsis., 2016, 59: 271–281.
[43] Gai Z, Wang Y, Ding Y, Qian W, Qiu C, Xie H, Sun L, Jiang Z, Ma Q, Wang L, Ding, Z. Exogenous abscisic acid induces the lipid and flavonoid metabolism of tea plants under drought stress.(UK), 2020, 10: 12275.
[44] Lu M, Chen M, Song J, Wang Y, Pan Y, Wang C, Pang J, Fan J, Zhang Y. Anatomy and transcriptome analysis in leaves revealed how nitrogen (N) availability influence drought acclimation of., 2019, 33: 1003–1014.
Physiological and transcriptional regulation mechanisms of nitrogen alleviating drought stress in peanut
DING Hong, ZHANG Zhi-Meng, XU Yang, ZHANG Guan-Chu, GUO Qing, QIN Fei-Fei, and DAI Liang-Xiang*
Shandong Peanut Research Institute, Qingdao 266100, Shandong, China
Nitrogen application has an important effect on plant growth and development under drought stress. The aim of this study is to clarify the physiological and transcriptional regulation mechanism of nitrogen for improving drought resistance in peanut. The physiological indexes and root transcriptome of peanut under nitrogen application, drought stress and drought and nitrogen application simultaneously exist treatments were determined. The results showed that the drought and nitrogen application simultaneously exist treatment increased peanut biomass and the relative water content of leaves under drought stress. The content of total phenols and flavonoids in peanut roots were increased by nitrogen application under drought stress. Meanwhile, the activities of POD and CAT were increased, the content of MDA was decreased, which improved the drought resistance of peanut. Transcriptome analysis showed that the relative expression of 5396 genes changed due to nitrogen application. These genes were mainly involved in glutathione metabolism, nitrogen metabolism, and carbon metabolism, as well as stress and defense responses. Under drought stress, the drought and nitrogen application simultaneously exist treatments, the differentially expressed genes of secondary metabolite biosynthesis, transportation and catabolism and carbohydrate transport and metabolism were enriched. Among the three pathways related to phenolic metabolites, 51 differential genes were up-regulated and 207 genes were down-regulated under the drought and nitrogen application simultaneously exist treatment. In conclusion, the application of nitrogen fertilizer could enhance the antioxidant capacity of peanut plants under drought stress through regulating secondary metabolites and carbohydrate metabolism, and thus improve the drought resistance of peanut.
peanut; drought stress; nitrogen; antioxidant system; transcriptome analysis
10.3724/SP.J.1006.2023.24020
本研究由国家自然科学基金项目(31971854, 31971856), 山东省花生产业技术体系(SDAIT-04-06)和山东省重大科技创新工程项目(2019JZZY010702)资助。
This study was supported by the National Natural Science Foundation of China (31971854, 31971856), the Shandong Peanut Industry Technology System (SDAIT-04-06), and the Major Scientific and Technological Innovation Projects in Shandong Province (2019JZZY010702).
通信作者(Corresponding author):戴良香, E-mail: liangxiangd@163.com
E-mail: dingpeanut@163.com
2022-01-15;
2022-05-05;
2022-05-13.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220512.1759.008.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
