施钙量对不同花生荚果发育时期光合碳在植株-土壤系统分配的影响
2023-01-12邹晓霞蔺益民赵亚飞王月福王维华
邹晓霞 蔺益民 赵亚飞 刘 燕 刘 娟 王月福 王维华
施钙量对不同花生荚果发育时期光合碳在植株-土壤系统分配的影响
邹晓霞1,*蔺益民1赵亚飞1刘 燕1刘 娟2王月福1王维华1,*
1青岛农业大学农学院 / 山东省旱作农业技术重点实验室, 山东青岛 266109;2河南省农业科学院经济作物研究所, 河南郑州 450002
探究施钙对不同花生荚果发育时期光合碳在植株-土壤系统分配的影响, 有利于改善钙肥管理, 提升花生产量和土壤有机碳含量。本研究选用普通大花生品种‘花育22’, 设置CaO 0、75、150和300 kg hm–24个施钙梯度, 分别记为T0、T1、T2、T3, 于盆栽条件下研究施钙量对花生产量和不同荚果发育时期光合碳在花生植株-土壤系统中分配的影响。结果表明, 不同施钙量对花生植株总干物质积累无明显影响。适宜施钙量可显著降低花生千克果数和千克仁数, 提升花生出仁率、饱果率和荚果产量, 在2018年和2019年, T2处理荚果产量较T0可分别提升17.5%和25.1%。基于施钙量与花生荚果和籽仁产量的拟合分析发现, 当钙肥施用量为165 kg hm–2和173 kg hm–2时, 可分别获得最高的花生荚果和籽仁产量。适宜施钙量可明显提升鸡咀幼果期和荚果膨大期花生植株光合13C的积累量, 提升各荚果发育时期13C在花生籽仁中的分配比例, 其中, 在荚果定型期和籽仁充实期, T2和T3处理下13C在花生籽仁中的分配比例分别可达33.4%~37.2%和38.7%~40.0%。适宜施钙量还可提高花生植株光合13C在土壤中的分配比例, 最高可达52.6% (T2), 但随着花生荚果发育进程的推进, 此分配比例逐渐降低。综上, 适宜施钙量可调控不同花生荚果发育时期光合13C在植株-土壤系统的分配, 显著提升花生产量和光合13C在花生籽仁和土壤中的分配比例; 本研究条件下, 推荐适宜施钙量(CaO)为173 kg hm–2。
13C脉冲标记; 光合碳; 干物质积累; 籽仁发育; 土壤碳积累
花生是重要的油料作物, 提高其产量和品质, 对缓解我国油脂供需矛盾有积极意义[1]。但花生对钙极度敏感, 其钙需求量仅次于氮, 高于磷[2]。土壤缺钙时, 易导致籽仁败育或发育不饱满[3]。由土壤缺钙导致的花生荚果空秕(“空荚”)已成为限制花生产量和品质提升的主要因素之一。
光合产物在作物体内的积累与分配是决定产量的重要因素[4]。钙作为细胞内生化反应的第二信使, 对植物体内干物质运输[5]和物质代谢[6]均有影响。前人研究已证实, 钙对花生光合产物积累有重要影响, 施钙可提高花生叶片叶绿素含量, 增加净光合速率[7], 但土壤缺钙时, 花生叶片衰老加速, 光合生产能力下降[8]; 另外, 钙可影响花生光合产物的转运分配, 土壤供钙不足时, 花生光合产物转运失调, 籽仁正常生理代谢及胚细胞形态发育受影响[9], 可见, 钙调控的光合产物积累和转运对花生籽仁发育有重要影响。当前, 借助13C标记技术, 在玉米[10]、小麦[11]、水稻[12]等作物领域已开展有关光合产物在植物体积累、分配特征的研究, 但光合产物有“就近供应”的特点[13], 而花生是栽培生产中少有的地上开花、地下结果作物, 明确钙调控下光合产物在花生植株的积累与分配特征对解析钙调控花生籽仁发育的机制有积极意义。
植物通过光合作用将大气CO2固定在植物体内, 然后以根际沉积物和植物残体等形式输入土壤[14], 是土壤有机碳的重要来源[15], 因此, 光合碳在植物-土壤系统的分配影响着土壤有机碳周转, 而不同栽培管理措施会改变植株光合碳向土壤的输入量, 如王莹莹等[16]研究表明, 施磷增加了光合碳在水稻地上部的分配, 但降低了光合碳在土壤中的积累; 王婷婷等[17]研究发现, 施氮和干湿交替都可显著增加光合碳在根际土壤中的累积与回收率; 孙海岩等[18]也发现, 长期地膜覆盖和施肥方式可以改变光合碳在玉米-土壤中的分配和转运, 裸地施氮肥提高了光合碳向地下部的分配比例和积累量。前人研究已证实施钙可提升土壤有机质含量[19], 但施钙对花生植株光合碳向土壤分配的影响尚不明确。
因此, 本研究基于盆栽试验, 设置4个施钙量梯度, 在不同花生荚果发育时期进行13C脉冲标记, 以明确不同施钙量对光合产物在花生植株-土壤系统中积累与分配的影响, 以期为探明钙调控光合产物转运影响花生籽仁发育的机制和揭示钙调控下花生光合碳在土壤的积累规律奠定基础, 为优化花生钙肥管理提供科学依据。
1 材料与方法
1.1 供试材料
供试花生品种为‘花育22号’ (不耐低钙)。供试土壤为砂质壤土, 2018年0~20 cm土层土壤化学性质如下: 有机质12.14 g kg–1, 碱解氮77.6 mg kg–1, 有效磷4.13 mg kg–1, 速效钾115.30 mg kg–1, 交换性钙0.71 g kg–1, pH 5.8; 2019年0~20 cm土层土壤化学性质如下: 有机质10.28 g kg–1, 碱解氮70.76 mg kg–1, 有效磷6.33 mg kg–1, 速效钾120.19 mg kg–1, 交换性钙0.89 g kg–1, pH 6.1。供试肥料为复合肥(金正大牌, N-P-K: 15-15-15); 供试钙肥为CaO试剂(国药, 分析纯); 标记材料为13C-Na2CO3(Cambridge Isotope Laboratorics, Inc, 99.0 atom%)。
1.2 试验设计
试验于2018年和2019年的5月至9月在青岛农业大学试验站进行, 设T0 (CaO 0 kg hm–2)、T1 (CaO 75 kg hm–2)、T2 (CaO 150 kg hm–2)和T3 (CaO 300 kg hm–2) 4个施钙量, 以盆栽方式开展。试验采用PVC花盆, 高43 cm, 直径30 cm。田间分层采集的土壤风干后过5 mm筛, 其中20~40 cm土层土壤先装填至花盆20 cm高度处, 0~20 cm土层土壤与钙肥、复合肥充分混匀后装填至花盆40 cm高度处, 保持所有盆装土重量一致(37 kg)。每盆按照750 kg hm–2的施肥量施入复合肥5.3 g, T0、T1、T2和T3处理每盆分别施入CaO为0、1.0、2.0和4.0 g。为减少盆栽环境条件的影响, 花盆埋入土中, 只露出距离盆沿3 cm高度, 每处理36盆。土壤装盆自然沉实1周后播种, 2018年于5月8日播种, 9月17日收获; 2019年于5月6日播种, 9月16日收获。每盆播种3穴, 每穴2粒, 出苗后每穴选留1株健壮苗; 其他管理同常规大田生产。
1.3 13C脉冲标记处理
标记试验于2019年5月至9月开展, 试验设计同非标记处理, 每处理种植16盆, 参考前人研究的花生荚果发育时期[21-21], 共设4次标记, 每次标记每处理用4盆, 标记时间如表1。标记方法参考于鹏等[22], 选择晴好天气, 于09:00—15:00时进行13C标记, 标记箱用水将底部密封, 保证密闭性。标记前, 通过气泵和NaOH溶液吸收掉背景的CO2,13C-CO2通过13C-Na2CO3和H2SO4溶液(1 mol L–1)自动反应获得, 根据标记箱内CO2浓度来确定是否加入硫酸, 并通过控制H2SO4添加量使标记箱中13C-CO2浓度维持在300~350 ppm。标记结束后, 标记箱内剩余的13C-CO2气体通过真空循环泵和NaOH溶液回收(回收0.5 h)。花生继续培养至收获, 标记与未标记植株距离间隔10 m以上。

表1 13C脉冲标记时期
1.4 样品采集与分析
于花生收获期, 从各处理PVC盆中取出完整植株。非标记处理(每处理6盆, 共18株), 按照根、茎(包括下胚轴)、叶、果针、果壳、籽仁分开, 于烘箱105℃杀青30 min, 75℃烘干至恒重, 用于测定植株干物质积累量; 花生荚果自然晒干入库, 平衡30 d后, 用于测产和考种。标记处理按根、茎(包括下胚轴)、叶、果针、果壳、籽仁分开后, 先用自来水冲洗, 再用0.5 mol L–1CaCl2(pH 6.2)浸泡3~5 min, 最后用去离子水冲洗, 以去除吸附在植株表面的土壤及杂质。样品清洗后置于烘箱105℃杀青30 min, 75℃下烘干至恒重, 磨碎过100目筛, 用于13C丰度测定。采用直径3 cm的取土钻于花生株间(避开根周)采集0~20 cm土层土壤样品, 每盆采集3点混合为1份土样, 自然风干后, 研磨, 过100目筛, 用于13C丰度测定。植株及土壤13C丰度委托中国农业科学院农业环境稳定同位素实验室(AESIL, CAAS)测定, 以国际标准的V-PDB为基准进行校正。相关指标计算公式如下:
(1) 花生植株各部位(根、茎、叶、果针、果壳、籽仁)和土壤13C含量的测定由标记样和非标记样中13C的丰度来确定, 样品δ13C (‰)计算方法如下[16]:
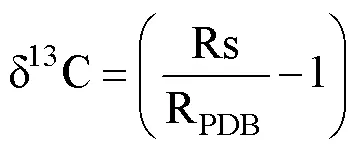
式中, RS表示表示样品的同位素比值, RPDB表示标准物质(pee dee belemnite, PDB)的同位素比值。
(2) 花生植株各部位和土壤13C积累量(mg)计算方法如下[17]:
13CS= [(atom13C%)l–(atom13C%)ul] × TCS× 100
式中,13CS为样品中的13C量, mg; (atom13C%)l和(atom13C%)ul分别表示标记和非标记样品的13C丰度, TCS表示植株和土壤中的总碳量, mg。
(3)13C在各组分中分配比例(%)计算方法如下:
13C=13CS/13Crecovery× 100%
式中, Crecovery为13C总回收量(mg)等于各部分13C量之和, 计算方法如下:13Crecovery=13C根+13C茎+13C叶+13C果壳+13C籽仁+13C果针+13C土壤。
1.5 数据处理和统计分析
采用Microsoft Excel 2013、SPSS 19.0和Origin 2022进行数据处理、统计分析和作图, 各指标测定结果为3次重复的平均值±标准误差(SE)。采用One-way ANOVA单因素方差分析进行差异显著性检验(<0.05)。
2 结果与分析
2.1 不同施钙量对花生植株干物质积累量的影响
2年数据显示, 花生叶、根、果针及植株总干物质积累量在各施钙量间均无明显差异。2年茎干物质积累量均以T0处理最高, 其中, 2018年显著高于其他各处理, 较之提升11.0%~14.2%, 2019年显著高于T2和T3处理, 较之提升8.8%~11.9%。不同施钙量下, 花生荚果干物质积累量有明显差异, 但2年均以T2处理最高, 其中, 2018年较T0、T1和T3分别提升35.3%、23.3%和10.4%, 差异均达显著水平; 2019年显著高于T0和T1处理, 较之分别提升21.8%和12.4% (表2)。

表2 不同施钙量对花生植株各器官干物质积累的影响
花生植株各器官不同小写字母表示干物质积累量在不同施钙量间差异显著(< 0.05)。T0、T1、T2、T3分别表示CaO 0 kg hm–2、CaO 75 kg hm–2、CaO 150 kg hm–2、CaO 300 kg hm–24个施钙梯度。
Different lowercase letters in the organs of peanut plants indicate there is significant difference in dry matter accumulation between different calcium application treatments at< 0.05. T0, T1, T2, and T3 represent CaO 0 kg hm–2, CaO 75 kg hm–2, CaO 150 kg hm–2, and CaO 300 kg hm–2, respectively.
2.2 光合固定13C在花生植株中的积累与分配
在鸡咀幼果期和荚果膨大期标记, 花生整株13C积累量随着施钙量的增加呈增加趋势, 且T2和T3处理均显著高于T0和T1处理。其中, 在鸡咀幼果期, 较T0提升28.1%~28.4%、较T1提升9.3%~9.6%; 在荚果膨大期, 较T0提升17.8%~24.2%、较T1提升16.1%~22.4%。在荚果定型期和籽仁充实期标记, 花生整株13C积累量在不同施钙量下均无明显差异, 平均分别为0.79和1.07 g每株(图1)。
随着荚果发育进程的推进, 各施钙处理下13C在花生籽仁中的分配比例均呈增加趋势, 其中在籽仁发育的关键时期(即籽仁充实期),13C的分配比例可高达38.7% (T3)~40.0% (T2); 同一荚果发育时期, 均以T2处理下13C在花生籽仁中的分配比例最高, 且在鸡咀幼果期和荚果定型期显著高于其他处理, 在荚果膨大期和仔仁充实期显著高于T0和T1处理。整个荚果发育时期13C在花生叶片中的分配比例均较高, 可达27.8%~47.9%, 在荚果膨大期和荚果定型期各施钙处理间无明显差异; 在鸡咀幼果期T0和T1处理下13C在花生叶片中的分配比例均显著低于T2和T3, 且较T2分别降低5.9和10.3个百分点、较T3分别降低7.9和12.2个百分点; 在籽仁充实期以T0处理下13C在花生叶片中的分配比例最低, 较其他处理减少6.6~8.3个百分点, 差异显著。随着荚果发育进程的推进, 各施钙处理下13C在花生茎、果壳和果针中的分配比例总体呈下降趋势, 分别由鸡咀幼果期的平均22.9%、19.7%和8.3%下降到籽仁充实期的平均16.7%、4.6%和2.7%; 就茎部13C分配比例而言, 在各荚果发育时期, T2处理均显著低于T0和T1处理, 较之分别平均降低10.0个百分点和6.7个百分点, T3处理在除鸡咀幼果期外的其他荚果发育时期亦均显著低于T0和T1处理; 就果壳13C分配比例而言, 自荚果膨大期开始, T1、T2和T3处理下花生果壳中的13C分配均显著低于T0, 且分别比T0降低2.0~8.5、3.9~7.9和1.5~5.6个百分点(图2)。
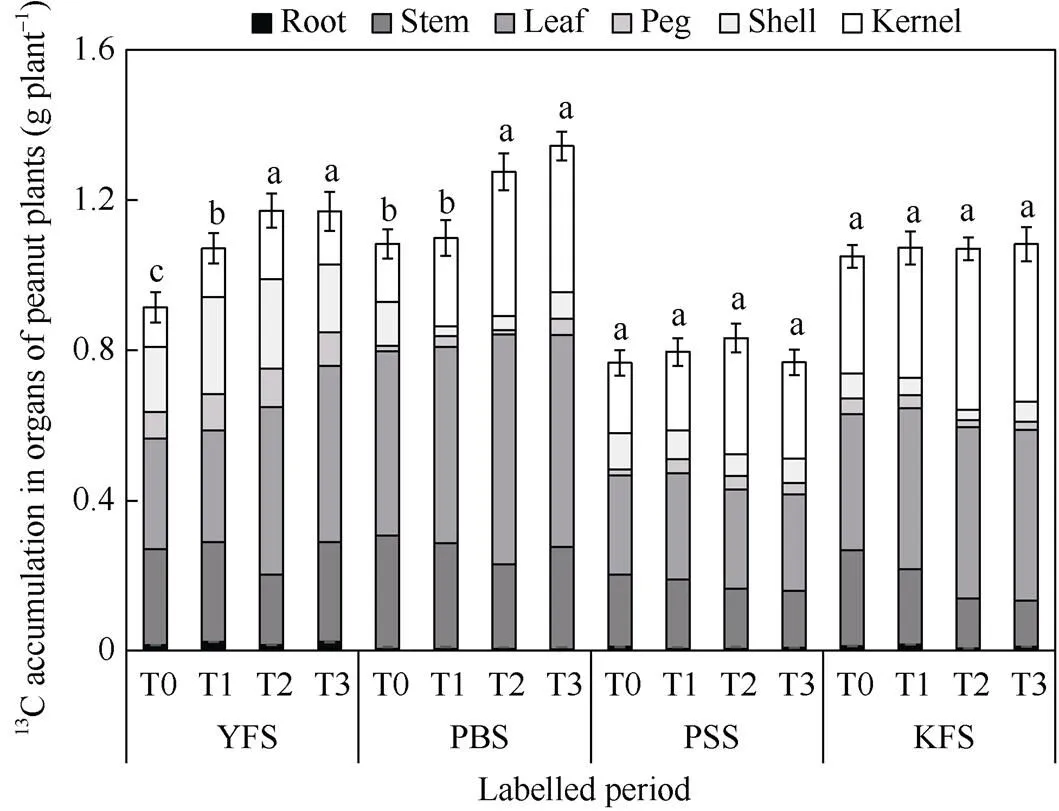
图1 施钙处理对不同荚果发育时期下花生植株各器官13C积累量的影响
不同小写字母表示同一标记时期内花生植株总13C积累量在不同施钙量间差异显著(< 0.05)。YFS: 鸡咀幼果期; PBS: 荚果膨大期; PSS: 荚果定型期; KFS: 籽仁充实期。处理同表2。
Different lowercase letters indicate the total13C accumulation in peanut plants during the same labeled period is significantly different among different calcium application treatments at< 0.05. YFS: young fruit stage; PBS: pod bulking stage; PSS: pod setting stage; KFS: kernel filling stage. Treatments are the same as those given in Table 2.

图2 施钙处理对不同荚果发育时期下花生植株各器官13C分配的影响
不同小写字母表示同一标记时期内花生各器官13C分配比例在不同施钙量间差异显著(< 0.05)。YFS: 鸡咀幼果期; PBS: 荚果膨大期; PSS: 荚果定型期; KFS: 籽仁充实期。处理同表2。
Different lowercase letters indicate the13C distribution percent in organs of peanut in the same labeled period is significantly different among different calcium application treatments at< 0.05. YFS: young fruit stage; PBS: pod bulking stage; PSS: pod setting stage; KFS: kernel filling stage. Treatments are the same as those given in Table 2.
2.3 光合固定13C在土壤中的积累
随着花生荚果发育进程的推进, 植株光合固定13C在土壤中的积累量呈降低趋势(图3)。在鸡咀幼果期和荚果膨大期13C在土壤中的积累量均以T2处理最高, 分别可达1.30和0.85 g 盆–1, 且较T0、T1和T3处理分别可提升39.4%~128.3%、24.9%~37.6%和104.5%~208.4%, 差异均达显著水平。在荚果定型期和籽仁充实期, 各处理光合固定13C在土壤中的积累量迅速降低, 平均仅为86.8 mg 盆–1和83.3 mg 盆–1, 以T2处理为例, 仅占鸡咀幼果期的5.2%~7.5%,占荚果膨大期的7.5%~10.8%。说明, T2处理更有利于促进花生光合碳在土壤中的积累, 且以鸡咀幼果期和荚果膨大期固定的光合碳为主。

图3 施钙处理对不同荚果发育时期下0~20 cm土层土壤13C积累量的影响
不同小写字母表示同一标记时期内土壤13C积累量在不同施钙处理间差异显著(< 0.05)。YFS: 鸡咀幼果期; PBS: 荚果膨大期; PSS: 荚果定型期; KFS: 籽仁充实期。处理同表2。
Different lowercase letters indicate that13C accumulation in the same labeled period is significantly different among different calcium application treatments at< 0.05. YFS: young fruit stage; PBS: pod bulking stage; PSS: pod setting stage; KFS: kernel filling stage. Treatments are the same as those given in Table 2.
2.4 光合固定13C在植物-土壤系统中的分配
随着花生荚果发育进程的推进, 光合固定13C在植物/土壤系统的分配比呈增加趋势, 由鸡咀幼果期的平均1.37增加到籽仁充实期的平均19.03。在鸡咀幼果期和荚果膨大期, 花生光合固定13C均以T3处理在植株中的分配比例最高, 可达65.8%和83.3%, 较T1和T2分别提升14.3~19.1和18.4~23.3个百分点, 差异均达显著水平; 但在上述两荚果发育时期, 花生光合固定13C均以T2处理向土壤中分配比例最高, 可达52.6%和40.0%, 且在鸡咀幼果期显著高于其他各处理。在荚果定型期和籽仁充实期, 光合固定13C向植株中的分配比例在各施钙处理间均无显著差异, 但向土壤中的分配比例均以T0处理最高, 平均为13.8%, 较其他处理平均提升7.1个百分点, 差异达显著水平(图4)。
2.5 施钙量对植物-土壤系统13C积累影响的主成分分析
基于对不同施钙处理下花生各荚果发育时期植物-土壤系统13C积累的主成分分析发现, 第1主成分(PC1)占总变化的43.2%, 第2主成分(PC2)占总变化的27.9%; 不同荚果发育时期对植物-土壤系统13C积累有明显影响, 其中, 鸡咀幼果期对土壤和花生的茎、果针、果壳、根等器官的13C积累量表现出较高影响, 荚果膨大期对花生叶片和植株总13C积累量表现出较高影响, 籽仁充实期则对花生籽仁13C积累量表现出较高影响; 施钙量与花生籽仁(< 0.01)、叶片和全株总13C积累量均呈正相关(< 0.05); 花生各器官之间, 籽仁13C积累量除与叶片13C积累量表现为正相关外(< 0.01), 与根、茎、果针和果壳的13C积累量均表现为负相关(< 0.01) (图5)。

图4 施钙处理对不同荚果发育时期下13C在花生-土壤系统中分配比例的影响
不同小写字母表示同一标记时期内不同处理间13C积累量在花生植株或土壤中的分配比例差异显著(< 0.05)。YFS: 鸡咀幼果期; PBS: 荚果膨大期; PSS: 荚果定型期; KFS: 籽仁充实期。处理同表2。
Different lowercase letters indicate that the distribution ratio of13C in plants or soil in the same labeled period is significantly different among different calcium application treatments at< 0.05. YFS: young fruit stage; PBS: pod bulking stage; PSS: pod setting stage; KFS: kernel filling stage. Treatments are the same as those given in Table 2.
2.6 不同施钙量对花生产量的影响
2年数据显示, 施钙量对花生产量有显著影响, 且均以T2处理产量最高, 较T0和T1分别平均提升21.3%和15.6%, 差异达显著水平(<0.05); T2处理花生千克果数和千克仁数均显著低于T0处理, 较T0分别平均降低13.5%和9.9%, 但与T1和T3处理均无明显差异; 花生出仁率和饱果率亦均以T2处理最高, 且显著高于T0处理, 较T0分别提升5.2~9.5和12.3~12.6个百分点; 施钙量对花生双仁果率无明显影响(表3)。

图5 施钙处理对花生-土壤系统13C积累量影响的主成分分析
缩写同图1。Abbreviations are the same as those given in Fig. 1.

表3 不同施钙量对花生产量及产量性状的影响
花生同一产量性状下不同小写字母表示在不同施钙量间差异显著(< 0.05)。处理同表2。
Different lowercase letters in the same yield factor of peanut indicate there is significant difference at< 0.05. Treatments are the same as those given in Table 2.
基于2年试验数据, 对钙肥施用量与花生荚果产量和籽仁产量分别进行多项式拟合发现(图6), 钙肥施用量()与花生荚果产量()可拟合方程为= –3×10–52+ 0.0098+ 4.6424, 与花生籽仁产量(y)可拟合方程为= –3×10–52+ 0.0104+ 2.9484, 由此推算, 当钙肥的施用量为165 kg hm–2时, 花生荚果产量最高, 可达5.44 t hm–2, 当钙肥的施用量为173 kg hm–2, 花生籽仁产量最高, 可达3.85 t hm–2。
3 讨论
钙作为重要的营养及信号物质, 影响着植物体内的物质运输和代谢[5-6]。前人研究认为, 缺钙花生植株光合效率低下, 光合产物转化运输速率降低, 更多的糖滞留于叶片、果壳中[23-24], 导致籽仁正常生理代谢及胚细胞形态发育受影响, 处于饥饿状态败育或发育不饱满[25]。本研究也发现, 施钙量与花生叶片、籽仁和植株的总13C积累量表现出较高正相关, 与前人研究得出施钙可促进花生光合产物积累[3]的结论一致。另外, 本研究中, 花生籽仁13C积累量与叶片13C积累量呈正相关, 与根、果针和果壳的13C积累量呈负相关, 这可能是由于光合产物“就近供应”的特点[13], 根、果针和果壳等器官的光合产物向籽仁转运更具“距离”优势, 而适宜施钙量可调控根、果针和果壳等器官的光合产物向籽仁转运, 从而促进籽仁发育。Yang等[7]基于RNA-seq基因表达谱分析也证实, 钙充足和不足条件下, 花生果针和荚果的大量基因在转录水平上发生了显著变化, 但具体调控机制还有待于进一步研究。

图6 施钙量与花生荚果产量和籽仁产量的多项式拟合
光合产物是“作物-土壤”系统碳循环的重要环节,植物光合碳主要通过根系分泌、脱落和老根死亡的方式进入到土壤中[26], 这个过程受作物生育时期的影响, 如王群艳等[27]研究表明, 随着水稻生育进程的推进, 光合碳分配到土壤的比例逐渐降低, 由分蘖期的11.4%下降到收获期的4.5%, 本研究也发现, 随着花生荚果发育进程的推进, 光合碳向土壤的分配比例亦呈降低趋势, 由鸡咀幼果期的平均43.4%降低到籽仁充实期的平均7.1%。这可能是由于作物生育前期根系生长旺盛, 光合碳用于形成根系结构化合物的比例高, 加之根际沉积作用强, 从而导致作物生育前期光合碳在土壤中的积累量高于生育后期[21]; 另外, 适宜的施钙量可提高花生根系活力[7], 这可能是导致花生植株光合碳向土壤分配增加的原因, 已有研究亦表明施肥管理可调控植株光合碳在土壤系统的积累与分配, 如李朋发等[28]研究表明腐殖酸能显著促进花生光合碳向地下部的转运。
施钙可减少花生空、秕果数, 提高荚果产量[29], 提升土壤有机质含量[19], 本研究基于2年数据的综合分析也发现, 当施钙量为165 kg hm–2时, 花生荚果产量最高, 施钙量为173 kg hm–2, 花生籽仁产量最高, 且适宜施钙量有利于植株同化光合碳在土壤中的积累。目前, 众多学者开展了花生适宜施钙量研究, 但所推荐的施钙量(CaO)有较大差异, 可从150~750 kg hm–2不等[3,8,29], 而在本研究条件下的适宜施钙量更接近于前人研究的低限, 且发现随着施钙量增加对花生产量表现出一定抑制作用。施肥效果受作物品种、栽培管理、气象条件和土壤地力等影响较大[30-31], 本研究并未测定花生主要生育时期植株的钙含量, 难以确定有利于产量形成的植株适宜含钙量是多少, 此为研究的不足之处; 另外, 本研究2年的施钙处理对花生产量的影响趋势一致, 但2019年产量数据总体低于2018年, 应主要与2019年花生结荚期阴雨日数偏多限制花生生长发育有关, 建议生产过程因地制宜确定钙肥用量。
4 结论
不同施钙量对花生植株总干物质积累无明显影响, 但施钙量(CaO)为150 kg hm–2或300 kg hm–2时可明显提升鸡咀幼果期和荚果膨大期花生植株13C积累量, 降低13C在花生茎和果壳中的分配比例但提高其在花生籽仁中的分配比例, 从而显著降低花生千克果数和千克仁数, 提高花生出仁率、饱果率和产量; 荚果发育时期对13C在花生植株-土壤系统的分配有明显影响,13C向土壤中的分配主要集中在鸡咀幼果期和荚果膨大期, 施钙量(CaO)为150 kg hm–2时可提升13C向土壤中的分配比例; 基于施钙量与籽仁产量的拟合分析, 推荐适宜施钙量为173 kg hm–2。
[1] Luo H, Guo J, Ren X, Chen W, Huang L, Zhou X, Chen Y, Liu N, Xiong F, Lei Y, Liao B, Jiang H. Chromosomes A07 and A05 associated with stable and major QTLs for pod weight and size in cultivated peanut (L.)., 2018, 131: 267–282.
[2] 于天一, 郑亚萍, 邱少芬, 姜大奇, 吴正锋, 郑永美, 孙学武, 沈浦, 王才斌, 张建成. 酸化土壤施钙对不同花生品种(系)钙吸收、利用及产量的影响. 作物杂志, 2021, (4): 80–85.
Yu T Y, Zheng Y P, Qiu S F, Jiang D Q, Wu Z F, Zheng Y M, Sun X W, Shen P, Wang C B, Zhang J C. Effects of calcium (Ca) application in acidified soil on Ca absorption, utilization and yield of different peanut varieties (lines)., 2021, (4): 80–85 (in Chinese with English abstract).
[3] 王建国, 张佳蕾, 郭峰, 唐朝辉, 杨莎, 彭振英, 孟静静, 崔利,李新国, 万书波. 钙与氮肥互作对花生干物质和氮素积累分配及产量的影响. 作物学报, 2021, 47: 1666–1679.
Wang J G, Zhang J L, Guo F, Tang C H, Yang S, Peng Z Y, Meng J J, Cui L, Li X G, Wan S B. Effects of interaction between calcium and nitrogen fertilizers on dry matter, nitrogen accumulation and distribution, and yield in peanut., 2021, 47: 1666–1679 (in Chinese with English abstract).
[4] 蔡倩, 孙占祥, 郑家明, 王文斌, 白伟, 冯良山, 杨宁, 向午燕,张哲, 冯晨. 辽西半干旱区玉米大豆间作模式对作物干物质积累分配、产量及土地生产力的影响. 中国农业科学, 2021, 54: 909–920.
Cai Q, Sun Z X, Zheng J M, Wang W B, Bai W, Feng L S, Yang N, Xiang W Y, Zhang Z, Feng C. Dry matter accumulation, allocation, yield and productivity of maize-soybean intercropping systems in the semi-arid region of western Liaoning province., 2021, 54: 909–920 (in Chinese with English abstract).
[5] Gaiona L, Júniora J, Barretob R, Damião V, Prado R, Carvalho R. Amplification of gibberellins response in tomato modulates calcium metabolism and blossom end rot occurrence., 2019, 26: 498–505.
[6] Arfaoui A, Hadrami A E, Daayf F. Pre-treatment of soybean plants with calcium stimulates ROS responses and mitigates infection by., 2018, 122: 121–128.
[7] Yang S, Li L, Zhang J, Geng Y, Guo F, Wang J, Meng J, Sui N, Wan S, Li X. Transcriptome and differential expression profiling analysis of the mechanism of Ca2+regulation in peanut () pod development., 2017, 8: 1609.
[8] 张彩军, 赵亚飞, 司彤, 王月福, 张晓军, 于晓娜, 王铭伦, 邹晓霞. 钙肥施用对花生荚果不同发育时期衰老特性和产量的
影响. 花生学报, 2021, 50(1): 54–59.
Zhang C J, Zhao Y F, Si T, Wang Y F, Zhang X J, Yu X N, Wang M L, Zou X X. Effect of calcium fertilizer application on senescence characteristics and yield of peanut at different pod development stages., 2021, 50(1): 54–59 (in Chinese with English abstract).
[9] Coskun D, Britto D T, Shi W M, Kronzucker H J. How plant root exudates shape the nitrogen cycle., 2017, 22: 661–673.
[10] Gao J, Zhao B, Dong S T, Liu P, Ren B Z, Zhang J W. Response of summer maize photosynthate accumulation and distribution to shading stress assessed by using13CO2stable isotope tracer in the field., 2017, 8: 1821.
[11] Bicharanloo B, Shirvan M B, Keitel C, Dijkstra F A. Nitrogen and phosphorus availability affect wheat carbon allocation pathways: rhizodeposition and mycorrhizal symbiosis., 2020, 58: 125–136.
[12] Xiao M L, Zang H D, Liu S L, Ye R Z, Zhu Z K, Su Y R, Wu J S, Ge T D. Nitrogen fertilization alters the distribution and fates of photosynthesized carbon in rice-soil systems: a13C-CO2pulse labeling study., 2019, 445: 101–112.
[13] Yoneyama T, Suzuki A. Exploration of nitrate-to-glutamate assimilation in non-photosynthetic roots of higher plants by studies of15N-tracing, enzymes involved, reductant supply, and nitrate signaling: a review and synthesis., 2019, 136: 245–254.
[14] Pausch J, Kuzyakov Y. Carbon input by roots into the soil: quantification of rhizodeposition from root to ecosystem scale., 2018, 24: 13850.
[15] Coskun D, Britto D T, Shi W M, Kronzucker H J. How plant root exudates shape the nitrogen cycle., 2017, 22: 661–673.
[16] 王莹莹, 肖谋良, 张昀, 袁红朝, 祝贞科, 葛体达, 吴金水, 张广才, 高晓丹. 水稻光合碳在植株-土壤系统中分配与稳定对施磷的响应. 环境科学, 2019, 40: 1957–1964.
Wang Y Y, Xiao M L, Zhang Y, Yuan H C, Zhu Z K, Ge T D, Wu J S, Zhang G C, Gao X D. Allocation and stabilization responses of rice photosynthetic carbon in the plant-soil system to phosphorus application., 2019, 40: 1957–1964 (in Chinese with English abstract).
[17] 王婷婷, 祝贞科, 朱捍华, 汤珍珠, 庞静, 李宝珍, 苏以荣, 葛体达, 吴金水. 施氮和水分管理对光合碳在土壤-水稻系统间分配的量化研究. 环境科学, 2017, 38: 1227–1234.
Wang T T, Zhu Z K, Zhu H H, Tang Z Z, Pang J, Li B Z, Su Y R, Ge T D, Wu J S. Input and Distribution of photosynthesized carbon in soil-rice system affected by water management and nitrogen fertilization., 2017, 38: 1227–1234 (in Chinese with English abstract).
[18] 孙海岩, 安婷婷, 谢柠桧, 李双异, 付时丰, 吕欣欣, 程娜, 闫贺明, 汪景宽. 地膜覆盖与施氮肥对光合碳在玉米-土壤系统分配的影响. 土壤通报, 2018, 49(4): 152–160.
Sun H Y, An T T, Xie N H, Li S Y, Fu S F, Lyu X X, Cheng N, Yan H M, Wang J K. Effects of plastic film mulching and nitrogen fertilization on the distribution of photosynthetic fixed carbon in maize-soil system., 2018, 49(4): 152–160 (in Chinese with English abstract).
[19] 张博文, 穆青, 刘登望, 李林, 万书波, 王建国, 郭峰. 施钙对瘠薄红壤旱地花生土壤理化性质的影响. 中国油料作物学报, 2020, 42: 896–902.
Zhang B W, Mu Q, Liu D W, Li L, Wan S B, Wang J G, Guo F. Effects of calcium application on physical and chemical properties of peanut in barren upland red soil., 2020, 42: 896–902 (in Chinese with English abstract).
[20] 罗葆兴, 李煜祥, 温桂芳, 陈朝庆, 叶柏荣, 陈治禧. 花生荚果发育的形态解剖学研究. 作物学报, 1982, 8: 217–228.
Luo B X, Li Y X, Wen G F, Chen C Q, Ye B R. Chen Z X. Studies on the anatomical morphology of pod development in peanut plant., 1982, 8: 217–228 (in Chinese with English abstract).
[21] 李安妮, 叶柏荣, 刘敏敏. 花生荚果发育过程中形态及有机成分的变化. 华南农学院学报, 1983, 4(1): 21–30.
Li A N, Ye B R, Liu M M. Changes in morphology and composition of developing peanut fruit,, 1983, 4(1): 21–30 (in Chinese with English abstract).
[22] 于鹏, 张玉玲, 王春新, 安婷婷, 邹洪涛, 付时丰, 李双异, 汪景宽, 张玉龙. 不同生育期光合碳在水稻-土壤系统中的分配. 土壤学报, 2017, 54: 1218–1229.
Yu P, Zhang Y L, Wang C X, An T T, Zou H T, Fu S F, Li S Y, Wang J K, Zhang Y L. Distribution of photosynthetic carbon in rice-soil system relative to rice growth stage., 2017, 54: 1218–1229 (in Chinese with English abstract).
[23] Charles S A, Halliwell B. Action of calcium ions on spinach () chloroplast fructose bisphosphatase and other enzymes of the Calvin cycle., 1980, 188: 775.
[24] Prado F E, Lázaro J J, Gorgé J L. Regulation by Ca2+of a cytosolic fructose-1, 6-bisphosphatase from spinach leaves., 1991, 96: 1026.
[25] Chen H, Zhang C, Cai T, Deng Y, Zhou S, Zheng Y, Ma S, Tang R, Varshney R K, Zhuang W. Identification of low Ca2+stress-induced embryo apoptosis response genes inby SSH-associated library lift ()., 2016, 14: 682.
[26] Ge T, Yuan H Z, Zhu H H, Wu X H, Nie S A, Liu C, Tong C L, Wu J S, Brookes P. Biological carbon assimilation and dynamics in a flooded rice-soil system., 2012, 48: 39–46.
[27] 王群艳, 祝贞科, 袁红朝, 隋方功, 朱捍华, 葛体达, 吴金水. 不同生育期光合碳在水稻-土壤系统中的分配及输入效率. 环境科学研究, 2016, 29: 1471–1478.
Wang Q Y, Zhu Z K, Yuan H C, Sui F G, Zhu H H, Ge T D, Wu J S. Allocation and input efficiency of assimilated carbon in rice-soil systems at different growth stages.,2016, 29: 1471–1478 (in Chinese with English abstract).
[28] 李朋发, 江春玉, 李忠佩. 不同施肥处理对光合碳在花生-土壤系统中分配的影响. 土壤, 2019, 51: 923–928.
Li P F, Jiang C Y, Li Z P. Effect of different fertilization methods on distribution of photosynthetic carbon in peanut-soil system using13C pulse labeling technique., 2019, 51: 923–928 (in Chinese with English abstract).
[29] 周录英, 李向东, 王丽丽, 汤笑, 林英杰. 钙肥不同用量对花生生理特性及产量和品质的影响. 作物学报, 2008, 34: 879–885.
Zhou L Y, Li X D, Wang L L,Tang X, Lin Y J. Effects of different
Ca applications on physiological characteristics, yield and quality in peanut., 2008, 34: 879–885 (in Chinese with English abstract).
[30] 宇万太, 马强, 周桦. 不同施肥制度对作物产量及土壤磷钾肥力的影响. 干旱地区农业研究, 2022, 28(3): 123–128.
Yu W T, Ma Q, Zhou H. Effects of different fertilization systems on crop yield and soil P and K fertility., 2022, 28(3): 123–128 (in Chinese with English abstract).
[31] 张智, 李小坤, 丛日环, 任涛, 黄铁平, 鲁艳红. 稻田优化施肥效果与氮磷环境效益评价. 中国农业科学, 2016, 49: 906–915.
Zhang Z, Li X K, Cong R H, Ren T, Huang T P, Lu Y H. Optimized fertilization effects and environmental benefits evaluation of nitrogen and phosphorus in the paddy soil., 2016, 49: 906–915 (in Chinese with English abstract).
Effects of calcium application on the distribution of photosynthetic carbon in plant-soil system at different peanut pod development stages
ZOU Xiao-Xia1,*, LIN Yi-Min1, ZHAO Ya-Fei1, LIU Yan1, LIU Juan2, WANG Yue-Fu1, and WANG Wei- Hua1,*
1College of Agronomy, Qingdao Agricultural University / Shandong Provincial Key Laboratory of Dryland Farming Technology, Qingdao 266109, Shandong, China;2Industrial Crops Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China
Investigating the effects of calcium application on the distribution of photosynthetic carbon in the plant-soil system at different stages of the development of peanut pods will help improve the management of calcium fertilizer, and increase the yield of peanut, and the concentration of soil organic carbon. In this study, the common large peanut variety ‘Huayu 22’ was selected, and four gradients of calcium were applied. They included CaO 0 kg hm–2, 75 kg hm–2, 150 kg hm–2, and 300 kg hm–2, and were designated T0, T1, T2, and T3, respectively. These treatments were established to explore the effects of calcium application on peanut yield and the distribution of photosynthetic carbon in the plant-soil system at different stages of peanut pod development. The results showed that the total dry matter accumulation of peanut plants was not affected by the application of different amounts of calcium. The application of a suitable amount of calcium significantly reduced the number of peanut fruit and kernel per kilogram, increased the kernel percent, full pod percent and pod yield, and in 2018 and 2019, the T2 treatment increased the pod yield by 17.5% and 25.1% compared with T0, respectively. A fitting analysis of the calcium applied with the peanut pod and kernel yield revealed that the highest peanut pod and kernel yield could be obtained when the calcium applications were 165 kg hm–2and 173 kg hm–2, respectively. The application of a suitable amount of calcium significantly increased the photosynthetic13C accumu-lation in peanut plants at the young fruit and pod bulking stages, increased the proportion of13C in peanut kernels at different pod development and the pod setting and kernel filling stages. The proportion of13C in the peanut kernels under the T2 and T3 treatments was 33.4%–37.2% and 38.7%–40.0%, respectively. The proportion of13C in the soil also increased when a suitable amount of calcium was applied. The increase was as high as 52.6% (T2), but with the development in peanut pods, the proportion of13C in soil decreased gradually. In conclusion, the application of an appropriate amount of calcium can regulate the distribution of photosynthetic13C in the plant-soil system at different pod development stages of peanut and significantly improved the peanut yield and proportion of photosynthetic13C in peanut kernel and soil. Under the conditions of this study, the recommended amount of calcium to apply was 173 kg hm–2.
13C pulse labeling; photosynthetic carbon; dry matter accumulation; peanut kernel development; soil carbon accumulation
10.3724/SP.J.1006.2023.24009
本研究由国家重点研发计划项目(2020YFD1000905)和山东省自然科学基金青年基金项目(ZR2019QC016)资助。
This study was supported by the National Key Research and Development Program of China (2020YFD1000905) and the Youth Fund Project of National Natural Science Foundation of Shandong Province (ZR2019QC016).
通信作者(Corresponding authors):邹晓霞, E-mail: xxzou@qau.edu.cn; 王维华, E-mail: whwang2000@163.com
2022-01-06;
2022-06-07;
2022-07-08.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220707.1500.016.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
