向日葵DGATs基因家族的鉴定及表达分析
2023-01-12杨佳宝孟晚秋曾令露
张 程 张 展 杨佳宝 孟晚秋 曾令露 孙 黎,*
向日葵DGATs基因家族的鉴定及表达分析
张 程1张 展2杨佳宝1孟晚秋1曾令露1孙 黎1,*
1新疆石河子大学生命科学学院, 新疆石河子 832003;2兵团兴新职业技术学院, 新疆巴州 841007
二酰基甘油酰基转移酶(Diacylglycerol acyltransferase, DGAT)在植物油脂代谢和抗逆过程中发挥重要作用。为探究基因在向日葵(L.)中的进化及在油脂积累和非生物胁迫应答中的功能, 本研究以拟南芥基因为基础序列, 通过同源比对从向日葵基因组中获得18个同源基因序列, 并对其染色体分布、基因结构、蛋白保守结构域、系统进化关系、组织特异性表达以及非生物胁迫下的表达模式进行系统分析。结果表明, 向日葵基因可分为4个亚族(、、和), 且同一亚族成员具有相似的基因结构和蛋白保守基序;基因的启动子区富含逆境和植物激素响应相关元件; 片段复制是导致该基因家族扩张的主要因素; qRT-PCR结果表明,和主要在种子发育的早、中期表达, 与种子油脂快速积累密切相关, 而亚家族基因主要在茎、叶和花中表达。盐、低温、干旱和ABA处理后, 多数基因在向日葵根、茎和叶中呈现诱导表达, 推测其可能在对逆境胁迫的响应中起重要作用。这些结果为进一步研究向日葵基因的功能奠定了基础。
向日葵; DGAT基因家族; 非生物胁迫; 基因表达
向日葵(L)是我国重要的油料作物和经济作物, 主要种植在东北和西北地区, 抗逆性强, 耐旱、耐瘠薄、耐盐碱[1-2]。葵花籽油中含有大量人体所必需的不饱和脂肪酸, 占总脂肪酸含量的90%左右, 主要是油酸(18:1)和亚油酸(18:2), 具有较高的营养价值和保健作用[3]。植物油脂主要以三酰甘油(Triacylglycerol, TAG)的形式储存于种子中。TAG在植物体内主要通过Kennedy途径合成, 二酰甘油酰基转移酶(DGAT, EC2.3.1.20)是催化二酰甘油(Diacylglycerol, DAG)和脂酰-CoA合成TAG的关键酶[4]。在进化过程中, DGAT家族产生了结构上不相关的4个亚家族, 即DGAT1、DGAT2、DGAT3和WSD/DAGT (WSD)[5]。DGAT1、DGAT2是主要亚型, 在大多数真核生物中广泛存在, 已经从蓖麻[6]、玉米[7]、油菜[8]、烟草[9]、油桐[10]和橄榄[11]等植物中鉴定出来并进行了功能研究。相较于和,和基因的研究报道较少[5]。
研究发现,在油料作物发育的胚中高表达,其表达水平与种子发育过程中的油脂积累相关[12]。拟南芥的失活导致突变体的种子油含量降低[13]。玉米的激活(通过插入苯丙氨酸)增加了玉米胚的含油量[7]。通过将拟南芥在烟草叶中的瞬时表达证实了其具有合成TAG的功能[14]。麻疯树和的过量表达分别导致油脂产量增加25.0%和29.6%[15]。DGAT3是一种植物胞质可溶性的金属酶[16], 最早在花生中发现[17]。在烟草中特异表达亚麻荠显著增强了种子中不饱和脂肪酸的积累[18]。WS/DAGT最早在醋酸钙不动杆菌()中发现[19], 是一种双功能酶, 具有TAG和蜡质合成功能, 并且其蜡质合成酶活性远大于TAG合成酶活性。拟南芥AtWSD1具有较高水平的蜡质合成酶活性, 其DGAT酶活性比蜡质合成酶活性低约10倍[20]。同时AtWSD1还参与表皮蜡的合成, 在防止植物脱水和耐盐碱过程中发挥着重要作用[21-22]。
目前为止, DGAT基因家族已在烟草[23]、棉花[24]、花生[25]、玉米[26]、油棕[27]和大豆[28]等植物中进行了研究报道。目前在向日葵中关于DGAT全基因家族的鉴定尚未报道, 本研究从向日葵基因组中鉴定出18个HaDGATs基因, 并对其基因结构、编码蛋白的理化性质和进化关系等进行了分析。采用实时定量PCR技术, 初步探索了表达与种子油脂合成之间的关系, 并且分析了在干旱、低温、盐胁迫和脱落酸(ABA)响应中的表达谱, 研究结果为深入探究基因在向日葵油脂合成及抵御非生物胁迫中的功能奠定基础。
1 材料与方法
1.1 材料
本试验以油用向日葵“T303”品系为试验材料,种植于石河子大学农试场试验田(85°94′N, 44°27′E)。2周后采集根、茎、叶和子叶, 待油葵开花后采集花样品, 并在第0天进行人工自花授粉, 套袋做标记。分别在花后第10、17、24、31和38天采集向日葵发育中的籽粒, 液氮速冻后于–80℃冻存备用。
选取生长3周左右(25℃±1℃, 16 h/8 h)的向日葵幼苗, 进行如下处理: 盐胁迫处理, 将幼苗分别用0、100和300 mmol L–1NaCl处理24 h后取样; 低温胁迫, 将幼苗放入4℃光照培养箱0、12和24 h后取样; 干旱胁迫, 使用15% PEG-6000对幼苗分别处理0、1、3、6、12和24 h后取样; ABA处理, 将幼苗浸泡在100 μmol L–1ABA中, 分别于0、1、3、6、12和24 h后取样, 分别取根、茎、叶样品, 液氮速冻后于–80℃冻存备用。
1.2 HaDGATs家族成员鉴定及理化性质分析
从Ensembl Plants (http://plants.ensembl.org/ index.html)下载向日葵基因组数据, 以拟南芥4个序列, 即()、()、()和()为探针在向日葵基因组中进行比对, 去除重复后以-value≤1e–10作为筛选条件得到候选序列。使用Pfam (http://pfam.xfam.org/)、CDD (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和SMART (http://smart.embl.de/)数据库查看候选序列是否具有完整的二酰甘油酰基转移酶功能结构域,最终确定的序列进行后续分析, 并依据其在染色体上的先后顺序进行命名。使用在线网站ExPASy (https://web.expasy.org/protparam/)预测HaDGATs蛋白理化性质。利用TMHMM (http://www.cbs.dtu.dk/ services/TMHMM/)进行蛋白跨膜区预测。
1.3 HaDGATs系统进化、基因结构和蛋白保守基序分析
使用MEGA 7.0软件采用NJ (Neighbor-Joining tree)法构建系统进化树, EvolView (https://www. evolgenius.info/evolview/)在线网站对进化树进行美化。使用MEME (http://alternate.meme-suite.org/tools/ meme)在线网站分析候选基因的保守基序(Motif)。结合基因组数据库GFF3文件, 提取基因结构信息。使用GSDS (http://gsds.gao-lab.org/)在线绘保守基序和基因结构图。
1.4 HaDGATs染色体定位、顺式作用元件和复制事件分析
MapGene2Chromosome V2 (http://mg2c.iask.in/ mg2c_v2.0/)绘制基因染色体定位图。选取起始密码子上游约2000 bp序列提交至PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站预测基因启动子区的顺式作用元件。
基因复制事件通过多序列比对, 以基因比对相似率大于75%作为筛选标准[29]。使用TBtools软件中Simple Ka/Ks Caculator计算Ka (非同义替换率)和Ks (同义替换率), 通过Ka/Ks比值来探究基因在进化过程中所承受的选择压力[30]。使用T = Ks/2r计算分离时间, r为植物核基因分离速率, 双子叶植物r每个位点每年发生1.5×10–8个同义替换。
1.5 向日葵种仁油脂提取
采集不同发育阶段(花后第10、17、24、31和38天)的油用向日葵“T303”的籽粒, 去壳取种仁, 采用索氏抽提法提取总油脂, 具体步骤及含油量计算参考李培江等[31]的方法。
1.6 荧光定量PCR分析
使用FastPure Plant Total RNA Isolation Kit (南京诺唯赞生物科技股份有限公司)提取总RNA。使用PrimeScriptReverse Transcriptase (大连TaKaRa公司)合成cDNA。使用Primer Premier 5.0软件设计qRT-PCR引物(表1), 以向日葵(AF107577)基因为内参。使用ChamQ Universal SYBR qPCR Master Mix (南京诺唯赞生物科技股份有限公司)进行qRT-PCR反应。反应程序: 95℃预变性30 s, 95℃变性10 s, 60℃退火30 s, 72℃延伸20 s, 40个循环。每个PCR反应重复3次。采用2–∆∆CT法对定量数据进行分析[32], 然后使用ImageGP (http://www.ehbio.com/ImageGP/index.php/Home/Index/PHeatmap.html)在线网站绘制热图。

表1 qRT-PCR引物序列
2 结果与分析
2.1 HaDGATs家族成员鉴定及系统进化分析
通过序列比对, 在向日葵基因组中共获得18个HaDGATs基因(表2)。所编码氨基酸长度在330~666 aa之间; 蛋白相对分子量范围为35.6~74.7 kD, 等电点范围为7.11~9.85。亲疏水性和跨膜区分析发现, HaDGAT1-1、HaDGAT1-2和HaDGAT1-3是疏水性蛋白, 具有8~9个跨膜区; HaDGAT2-1和HaDGAT2- 2也是疏水性蛋白, 均具有2个跨膜区; HaDGAT3是亲水可溶性蛋白, 没有跨膜区; HaWSDs均为疏水性蛋白, 其中HaWSD7~HaWSD9含有1个跨膜区, 其他HaWSDs蛋白不具有跨膜结构。
构建向日葵、拟南芥和红花()等11个植物DGAT蛋白的系统进化树(图1)发现, 植物DGAT家族可分为4个亚家族, 分别为DGAT1、DGAT2、DGAT3和WSD。从进化分枝来看, DGAT1与DGAT2聚为一簇, DAGT3和WSD分别聚为一簇。在同一亚族内, 单双子叶植物形成了不同的分枝。向日葵与同属菊科的红花和黄花蒿()亲缘关系更近, 十字花科的拟南芥与甘蓝型油菜()聚成一簇。拟南芥、玉米和大豆等植物的DGAT在4个亚组中都有分布, 说明DGAT家族基因的分化时间较早。
2.2 HaDGATs基因结构和蛋白保守基序分析
为探究基因在进化上的保守性, 结合基因组注释文件分析了向日葵和拟南芥的基因结构(图2)。在亚家族中,、、和都含有16个外显子和15个内含子;亚家族中,、都具有9个外显子, 8个内含子,具有8个外显子和7个内含子;和均含有2个外显子, 1个内含子;亚家族中,和的外显子数量在5~8之间, 内含子数量在4~7之间。表明, 同一亚族中的和外显子与内含子数量基本一致, 不同亚族之间的外显子与内含子数量差异较大。
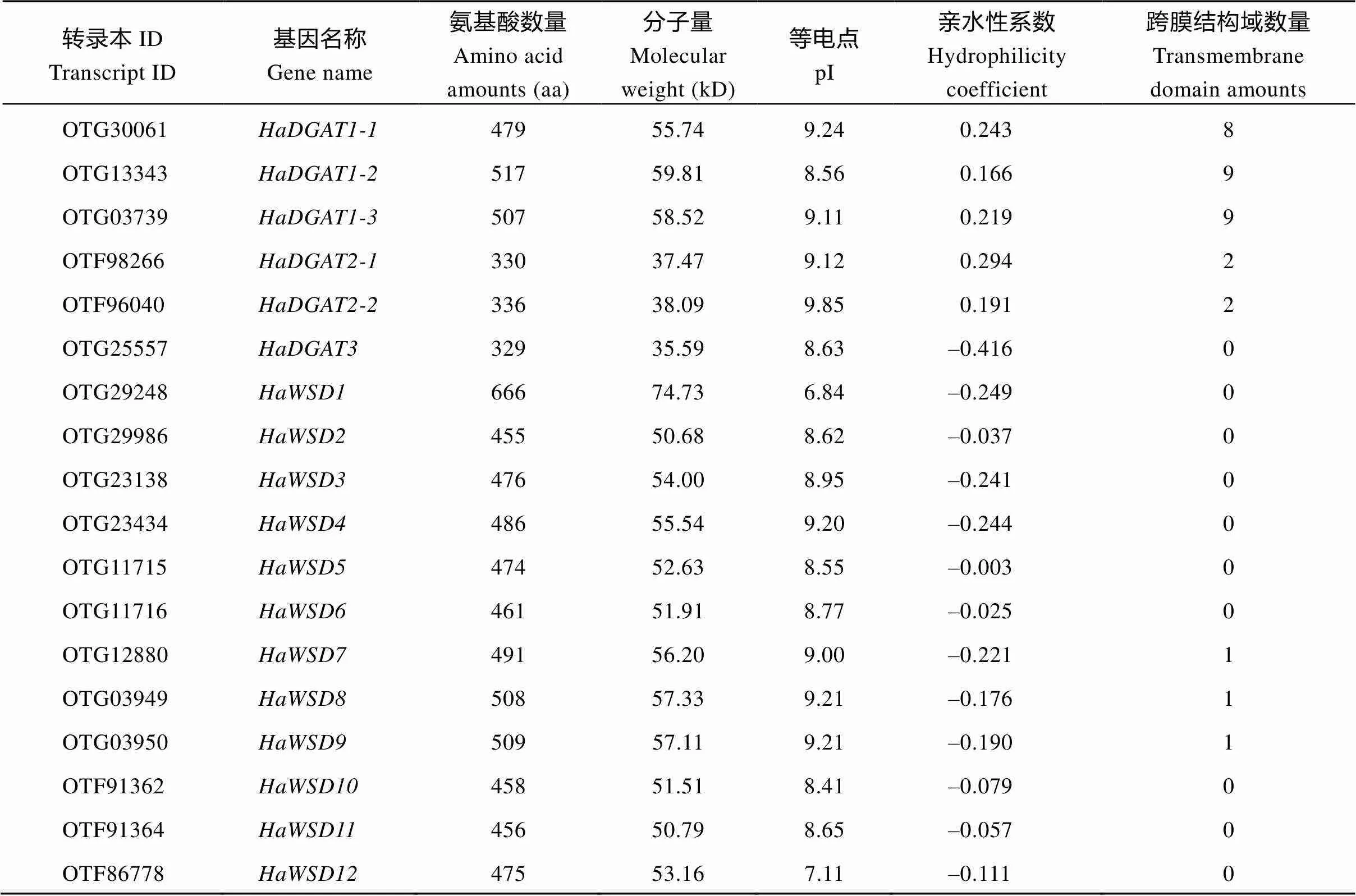
表2 向日葵HaDGATs基因基本信息

图1 向日葵和其他植物DGAT家族蛋白系统发育树
Ha: 向日葵; At: 拟南芥; Gm: 大豆; Ah: 花生; Bn: 甘蓝型油菜; Sb: 高粱; Os: 水稻: Eg: 油棕: Aa: 黄花蒿; Ct: 红花; Zm: 玉米。
Ha:; At:; Gm:; Ah:; Bn:; Sb:; Os:; Eg:; Aa:; Ct:; Zm:.
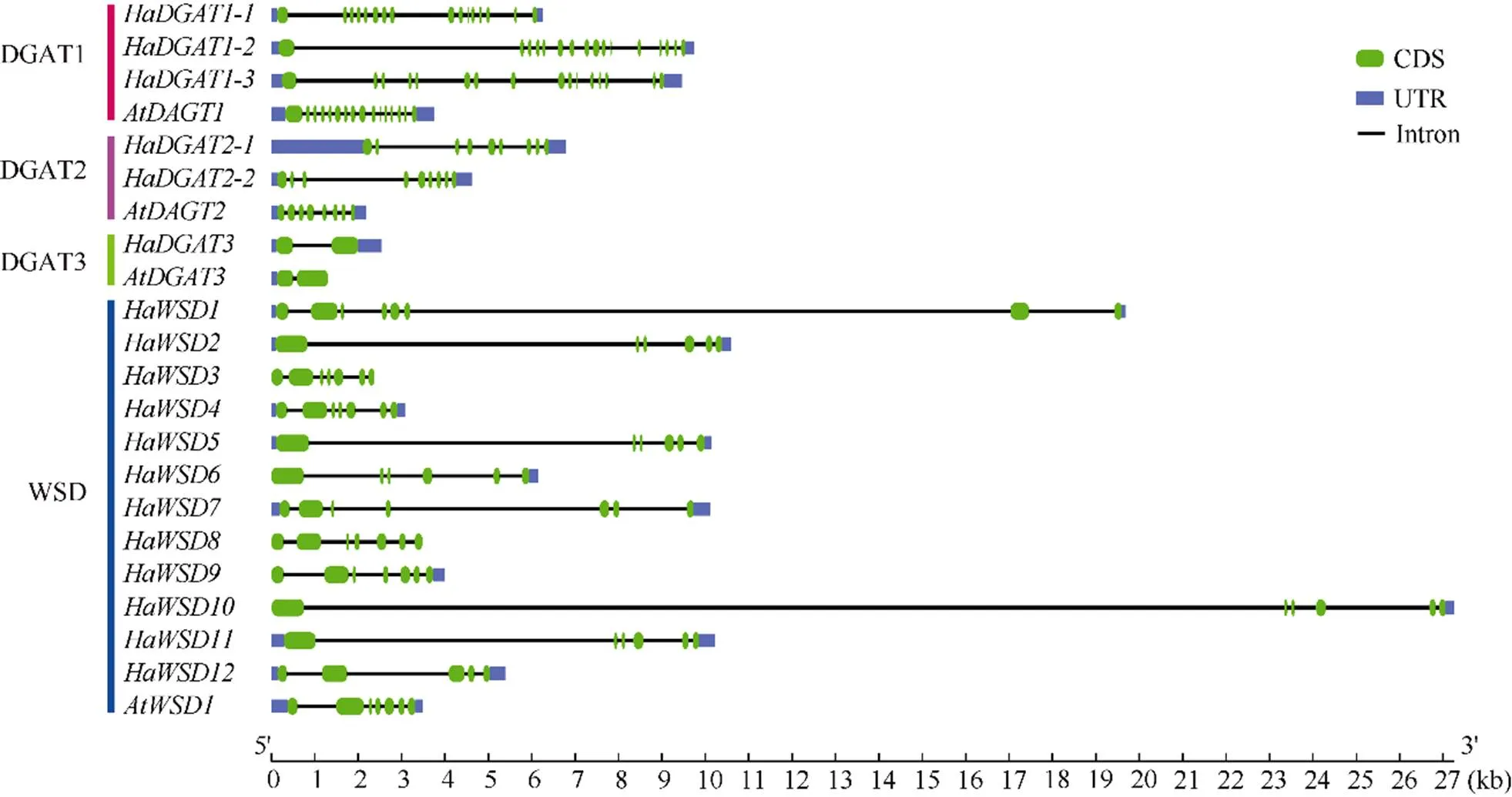
图2 向日葵HaDGATs基因结构
分析比较拟南芥AtDGATs和向日葵HaDGATs蛋白的保守基序发现(图3), DGAT1的Motif 1中包含脂肪酸结合位点(FGXXXXYKWW), Motif 2中含有亮氨酸拉链结构; DGAT2的Motif 1包含脂肪酸结合位点VPVFCFG, Motif 2中含有DGAT2典型的保守序列YFP和EPHS; DGAT3的Motif 1中包含脂肪酸结合蛋白特征序列HVXYYXX, Motif 4中含有脂肪酸结合蛋白特征序列CKKSGXIALLEEFQRAMTG; WSD的Motif 3中存在WS/DGAT蛋白家族特有的保守序列HHXXXDG。

图3 向日葵HaDGATs蛋白的保守基序
2.3 HaDGATs染色体定位与顺式作用元件分析
由图4-A可见, 18个向日葵成员不均匀地分布在10条染色体上, 其中10号染色体上分布最多, 为4个; 12号染色体有3个; 4号、6号和16号染色体各有2个; 3号、5号、14号、15号和17号染色体只有1个基因。
启动子区含有大量激素响应、生长发育和胁迫应答相关的顺式作用元件(图4-B)。、、、、、、和的启动子区含有低温响应元件LTR;、、、、和含有干旱相关元件MBS;、、、和含有防御和胁迫应答元件TC-rich。同时,还拥有大量脱落酸、茉莉酸甲酯和水杨酸响应元件。

图4 向日葵HaDGATs染色体分布(A)及启动子顺式作用元件(B)分析
2.4 HaDGATs复制事件分析
基因复制事件分析发现(表3和图5-A), 向日葵中共存在8个重复基因对, 其中5对为片段重复, 3对串联重复。8个基因对的Ka/Ks比值均小于1, 说明它们经历了纯化选择, 暗示在进化上相对保守, 这有助于维持功能的稳定性。从分化时间来看,基因对的分化时间较早, 分别为37.70 Mya和35.02 Mya (百万年前)。
此外, 将向日葵、拟南芥和红花的进行共线性分析发现(图5-B), 在18个向日葵中, 2个基因与拟南芥存在共线性关系, 11个基因与红花存在共线性关系。进一步分析发现, 3个在红花中分别具有2个直系同源基因, 表明基因家族在菊科多倍化事件中显著扩张。
2.5 HaDGATs在向日葵不同组织中的表达及种子不同发育时期油脂含量分析
组织表达分析结果表明(图6), 18个HaDGATs基因在向日葵不同组织(根、茎、叶、子叶、花和不同发育时期的种子)中的表达存在差异。、、主要在种子发育的第17天和第21天表达, 这与向日葵种子油脂主要在17 d、21 d快速积累高度一致(图7)。则主要在茎、叶、子叶和花中表达。
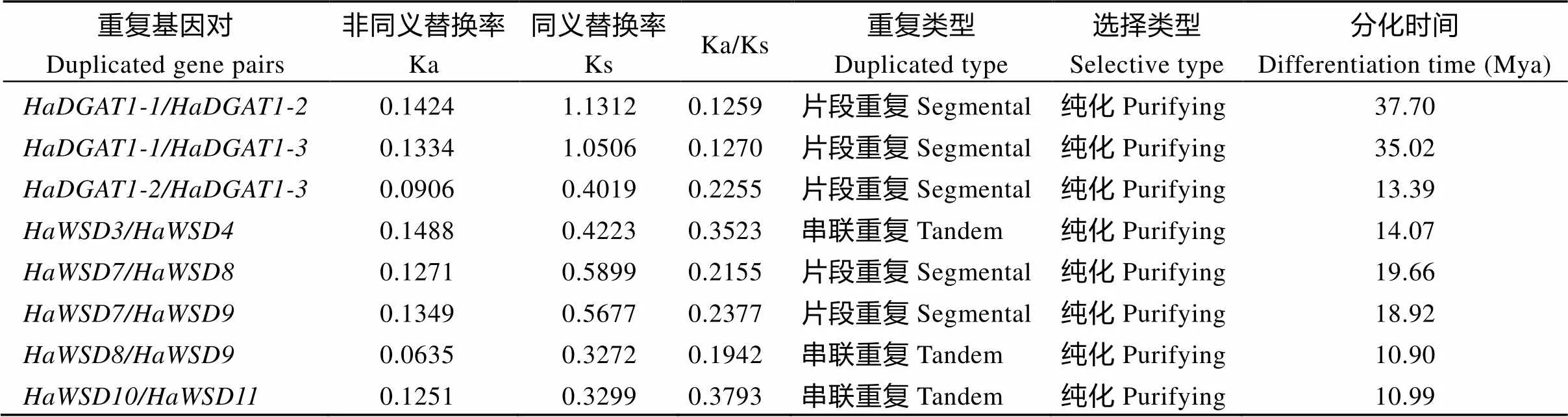
表3 向日葵HaDGATs家族成员基因复制事件和发散时间分析
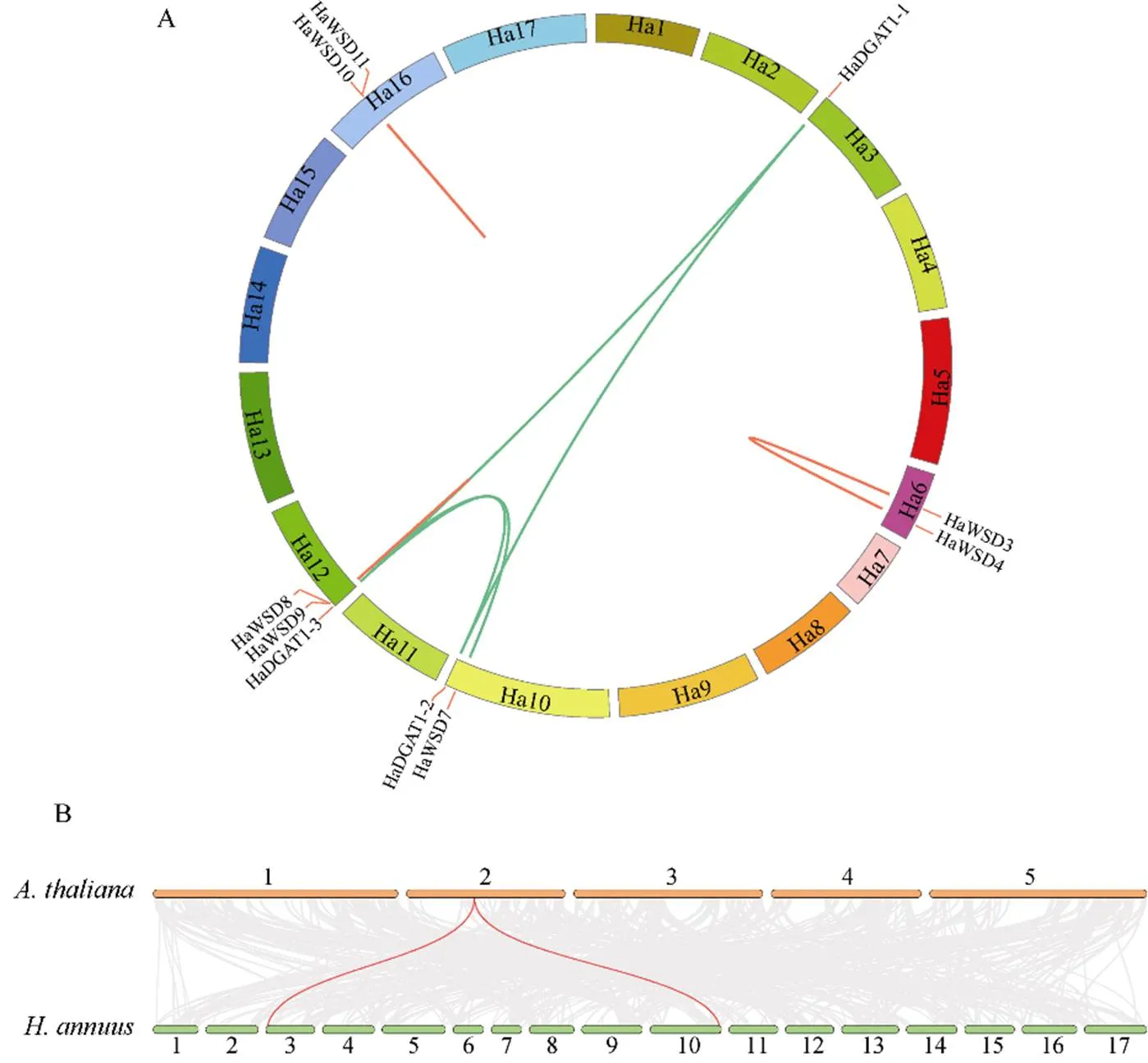
(图5)
A: 向日葵种内共线性分析; B: 向日葵与拟南芥、红花种间基因共线性分析。
A: collinearity analysis ofin sunflower; B: collinearity analysis ofamong sunflower,, and safflower.

图6 HaDGATs在向日葵不同组织的表达模式
DAF: 开花后天数。基因的相对表达量以根的表达量作为对照。
DAF: days after flowering. The relative expression levels ofgenes are compared with the relative expression in roots.
2.5 HaDGATs在向日葵不同组织中的表达及种子不同发育时期油脂含量分析
组织表达分析结果表明(图6), 18个HaDGATs基因在向日葵不同组织(根、茎、叶、子叶、花和不同发育时期的种子)中的表达存在差异。、、主要在种子发育的第17天和第21天表达, 这与向日葵种子油脂主要在17 d、21 d快速积累高度一致(图7)。则主要在茎、叶、子叶和花中表达。
2.6 HaDGATs在非生物胁迫和外源ABA处理下的表达
qRT-PCR分析表明,在盐、低温、干旱胁迫和外源ABA处理下的表达模式不同(图8-A)。不同浓度的NaCl胁迫处理24 h后, 6个基因(、、、、和)在根和茎中的表达量显著下调, 但大部分s在根和茎中的表达上调。100 mmol L-1NaCl胁迫后,和在叶中的表达量与对照相比显著上调。
低温(4℃)胁迫处理下(图8-B),、和在根和茎中的表达受到抑制,~在茎中表达量与对照相比显著上调; 胁迫12 h时,和的根中表达量显著上调; 胁迫24 h时,、、、、、、和在叶中的表达量显著上升。
100 μmol L-1ABA处理下(图9-A),以及大部分在茎中表达上调;、、、和在叶中的表达量显著提高; 此外,和在根中表达显著上调。
15% PEG-6000模拟干旱胁迫下(图9-B),、和的表达量显著下调;在根、茎、叶中呈现不同程度的表达上调。其中,、、、、和在茎中表达上调;、、和主要在根中表达上调;在干旱胁迫1 h时, 在叶中的表达量达到峰值。

图7 向日葵种子发育不同时期的油脂含量分析
不同字母表示数值有显著差异(< 0.05)。
Different lowercase letters indicate there are significantly different at< 0.05.
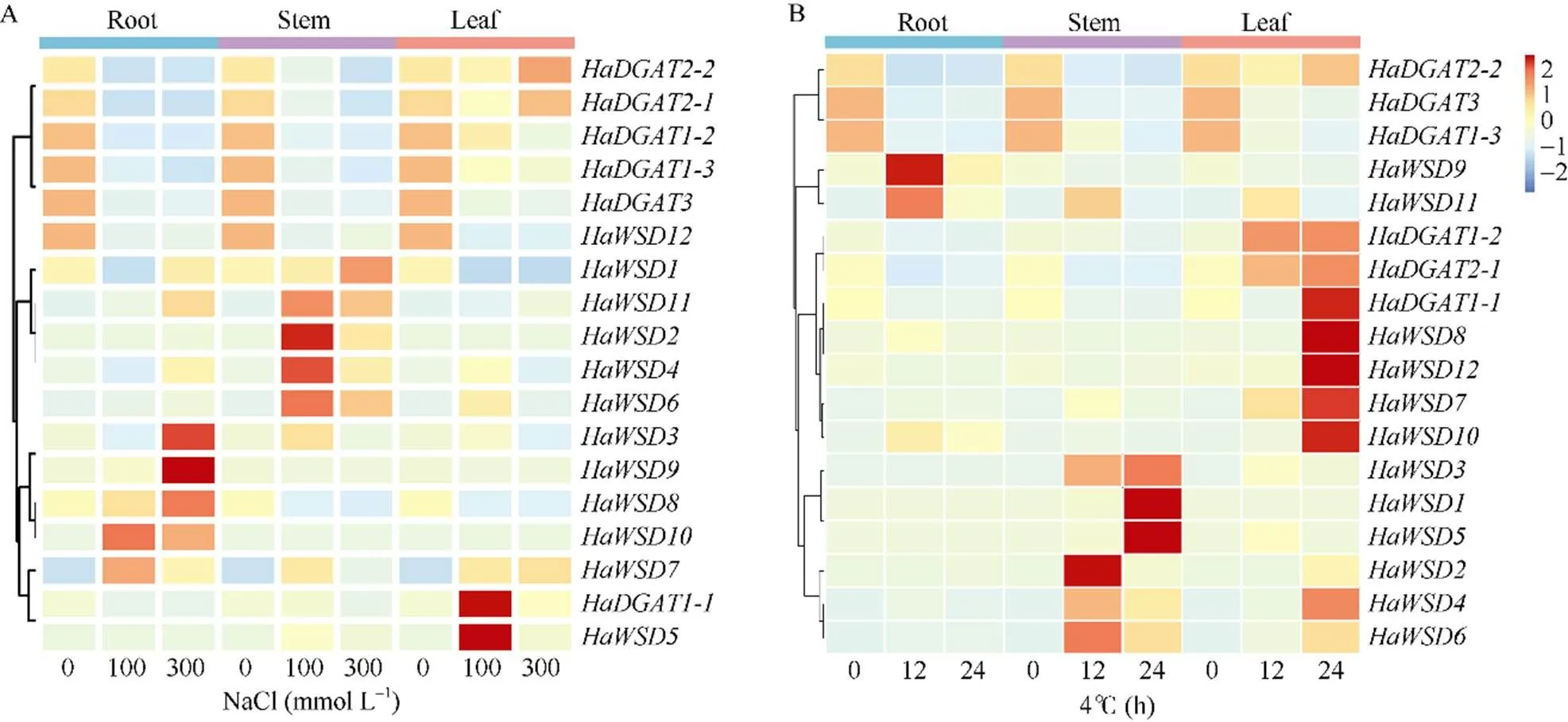
图8 向日葵HaDGATs在盐(A)和低温(B)胁迫下的表达

图9 向日葵HaDGATs在外源ABA (A)和干旱(B)处理下的表达
3 讨论
DGAT是TAG生物合成的“Kennedy途径”中唯一的限速酶[33]。该酶在油脂合成中的作用已在许多植物中被广泛研究[6-11], 可通过超表达基因的遗传操作来实现植物油产量和质量的提升[18]。
本研究通过同源序列比对, 从向日葵基因组数据库中获得了18个HaDGATs基因, 包括4个亚族(3个、2个1个和12个)基因。同一亚族具有相似的外显子-内含子数目和保守的Motif, 但不同亚族成员之间的基因结构和保守Motif差异较大, 推测同一亚族内的基因具有相似的生物学功能。4个DGAT亚家族基因在多个单、双子叶植物中均有分布, 表明DGTA家族成员之间的分化早于物种分化。
在生物进化过程中, 基因复制事件及功能分化是基因组和物种演化的重要驱动力[34]。在向日葵中发现5对片段重复和3对串联重复, 这可能是向日葵家族扩张的主要原因, 也是向日葵适应环境的一种生存策略。同时这些重复基因都受到了纯化选择, 表明在进化上相对保守, 这有助于维持功能的稳定性。此外, 向日葵与红花之间存在多个DGAT直系同源基因, 表明在这些物种分化前就已经在多倍化事件中显著扩张。
早期关于的研究主要集中在[35-36],并证实了其在植物花粉和种子发育过程中发挥着重要作用[37]。拟南芥在发育中的种子中表达量较高, 与种子TAG的积累密切相关[38]。紫苏在种子发育的早期大量表达, 过表达显著提高了拟南芥种子含油率[39]。陆地棉基因的表达量与棉籽油积累量呈正相关[24]。本研究发现,、和在种子发育的早、中期大量表达, 其表达模式与种子油脂快速积累的时期一致, 说明它们在种子油脂合成中起着关键作用。而向日葵亚家族基因主要在茎、叶和花等器官中表达, 推测它们可能参与了这些组织中脂质的积累以及角质层蜡质的形成。植物角质层在防止水分过度散失、抵御紫外辐射和防止病虫害入侵方面具有重要作用[24]。拟南芥已被证明参与茎的表皮蜡合成, 在拟南芥干旱胁迫适应中发挥重要作用[20-21]。()在拟南芥的花中大量表达, 其编码产物可能起到润滑剂的作用, 使花瓣在萼片和花药之间延伸时不受抑制地生长[40]。向日葵的4个亚家族成员呈现不同的组织表达模式, 暗示s基因出现了功能分化, 推测向日葵的脂质积累过程可能受到精细而严格的调控。
据报道,除参与TAG的生物合成, 还参与非生物胁迫的响应[41-42]。与野生型相比, 拟南芥突变体对低温和盐胁迫均表现出显著的敏感性, 其种子发芽率大大降低, 幼苗生长受到显著影响[43]。干旱条件下, 甘蓝型油菜的过表达可以增加种子的含油量[44]。拟南芥多个基因在干旱、盐胁迫和ABA处理后表达量显著升高[21]。本研究发现,的启动子区含有多个与激素响应和逆境胁迫相关的调控元件, 表明其可能参与非生物胁迫与激素响应。对向日葵幼苗进行盐、低温、干旱胁迫和ABA处理后,呈现出差异性表达。s在胁迫和激素处理后均出现不同程度的表达上调, 说明其在向日葵应对逆境响应中发挥着重要作用。
4 结论
本研究利用生物信息学方法, 在向日葵基因组中获得了18个HaDGATs家族基因, 并对其蛋白理化性质、染色体定位、保守序列、基因结构、进化关系和顺式作用元件等进行了分析。组织表达谱与种子油脂积累结果分析表明,、和在向日葵种子油脂合成过程中发挥重要作用。同时基因响应激素与逆境胁迫, 推测其参与向日葵逆境响应的调控。本研究在中筛选出参与油脂合成与逆境响应相关的基因, 为家族基因的功能研究奠定基础, 同时也为其他作物的遗传转化提供有价值的基因资源。
[1] Hryvusevich P, Navaselsky I, Talkachova Y, Straltsova D, Keisham M, Viatoshkin A, Samokhina V, Smolich I, Sokolik A, Huang X, Yu M, Bhatla S, Demidchik V. Sodium influx and potassium efflux currents in sunflower root cells under high salinity., 2020, 11: 613936.
[2] 吕品, 于海峰, 侯建华. 利用抗旱选择导入系定位向日葵产量性状QTL. 作物学报, 2018, 44: 385–396.
Lyu P, Yu H F, Hou J H. QTL mapping of yield traits in sunflower using drought resistant selection introgression lines., 2018, 44: 385–396 (in Chinese with English abstract).
[3] Nelson G J. Dietary fat, trans fatty acids, and risk of coronary heart disease., 1998, 56: 250–252.
[4] Cases S, Smith S J, Zheng Y W, Myers H M, Lear S R, Sande E, Novak S, Collins C, Welch C B, Lusis A J, Erickson S K, Farese R V. Identification of a gene encoding an acyl CoA: diacylglycerol acyltransferase, a key enzyme in triacylglycerol synthesis., 1998, 95: 13018–13023.
[5] 唐桂英, 柳展基, 单雷. 二酰基甘油酰基转移酶(DGAT)研究进展. 中国油料作物学报, 2010, 32: 320–328.
Tang G Y, Liu Z J, Shan L. Progress of diacylglycerol acyltransferase (DGAT) study., 2010, 32: 320–328 (in Chinese with English abstract).
[6] He X H, Grace Q C, Lin J T, McKeon T A. Regulation of diacylglycerol transferase in developing seeds of castor., 2004, 39: 865–871.
[7] Zheng P, Allen W B, Roesler K, Williams M E, Zhang S, Li J, Glassman K, Ranch J, Nubel D, Solawetz W, Bhattramakki D, Llaca V, Deschamps S, Zhong G Y, Tarczynski M C, Shen B. A phenylalanine in DGAT is a key determinant of oil content and composition in maize., 2008, 40: 367–372.
[8] Nykiforuk C L, Laroche A, Weselake R J. Isolation and characterization of a cDNA encoding a second putative diacylglycerol transferase from a microspore-derived cell suspension culture ofL. cv Jet Neuf., 1999, 121: 1957–1959.
[9] Bouvier-Navé P, Benveniste P, Oelkers P, Sturley S L, Schaller H. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA: diacylglycerol acyltransferase., 2000, 267: 85–96.
[10] Shockey J M, Gidda S K, Chapital D C, Kuan JC, Dhanoa P K, Bland J M, Rothstein S J, Mullen R T, Dyer J M. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum., 2006, 18: 2294–2313.
[11] Banilas G, Karampelias M, Makariti I, Kourti A, Hatzopoulos P. The olivegene is developmentally regulated and shares overlapping but distinct expression patterns with., 2011, 62: 521–532.
[12] Li R, Yu K, Hildebrand D F.,andexpression in seeds and other tissues of epoxy and hydroxy fatty acid accumulating plants., 2010, 45: 145–157.
[13] Zou J, Wei Y, Jako C, Kumar A, Selvaraj G, Taylor D C. TheTAG1 mutant has a mutation in a diacylglycerol acyltransferase gene., 1999, 19: 645–653.
[14] Zhou X R, Shrestha P, Yin F, Petrie J R, Singh S P. AtDGAT2 is a functional acyl-CoA: diacylglycerol acyltransferase and displays different acyl-CoA substrate preferences than AtDGAT1., 2013, 587: 2371–2376.
[15] Zhang T T, He H, Xu C J, Fu Q, Tao Y B, Xu R, Xu Z F. Overexpression of type 1 and 2 diacylglycerol acyltransferase genes (and) enhances oil production in the woody perennial biofuel plant.(Basel), 2021, 10: 699.
[16] Aymé L, Arragain S, Canonge M, Baud S, Touati N, Bimai O, Jagic F, Louis-Mondésir C, Briozzo P, Fontecave M, Chardot T.DGAT3 is a [2Fe-2S] protein involved in TAG biosynthesis., 2018, 8: 17254.
[17] Saha S, Enugutti B, Rajakumari S, Rajasekharan R. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase., 2006, 141: 1533–1543.
[18] Gao H, Gao Y, Zhang F, Liu B, Ji C, Xue J, Yuan L, Li R. Functional characterization of an novel acyl-CoA: diacylglycerol acyltransferase 3-3 () gene from., 2021, 303: 110752.
[19] Kalscheuer R, Steinbüchel A. A novel bifunctional wax ester synthase/acyl-CoA: diacylglycerol acyltransferase mediates wax ester and triacylglycerol biosynthesis in., 2003, 278: 8075–8082.
[20] Li F, Wu X, Lam P, Bird D, Zheng H, Samuels L, Jetter R, Kunst L. Identification of the wax ester synthase/acyl-coenzyme A: diacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in., 2008, 148: 97–107.
[21] Patwari P, Salewski V, Gutbrod K, Kreszies T, Dresen-Scholz B, Peisker H, Steiner U, Meyer A J, Schreiber L, Dörmann P. Surface wax esters contribute to drought tolerance in., 2019, 98: 727–744.
[22] Abdullah H M, Rodriguez J, Salacup J M, Castañeda I S, Schnell D J, Pareek A, Dhankher O P. Increased cuticle waxes by overexpression of WSD1 improves osmotic stress tolerance inand., 2021, 22: 5173.
[23] 牛永志, 王国平, 郑昀晔, 马文广. 烟草DGAT基因家族全基因组鉴定与分析. 中国烟草科学, 2020, 41(1): 1–8.
Niu Y Z, Wang G P, Zheng Y Y, Ma W G. Genome-wide identification and analysis of DGAT family genes in tobacco., 2020, 41(1): 1–8 (in Chinese with English abstract).
[24] Zhao Y, Wu N, Li W, Shen J, Chen C, Li F, Hou Y.evolution and characterization of acetyl coenzyme A: diacylglycerol acyltransferase genes in cotton identify the roles of in oil biosynthesis and fatty acid composition.(Basel), 2021, 12: 1045.
[25] 郑玲, 单雷, 李新国, 郭峰, 孟静静, 万书波, 彭振英. 花生基因家族的生物信息学分析. 山东农业科学, 2018, 50(6): 10–18.
Zheng L, Shan L, Li X G, Guo F, Meng J J, Wan S B, Peng Z Y. Bioinformatics analysis of peanutgene family., 2018, 50(6): 10–18 (in Chinese with English abstract).
[26] Yan B, Xu X, Gu Y, Zhao Y, Zhao X, He L, Zhao C, Li Z, Xu J. Genome-wide characterization and expression profiling of diacylglycerol acyltransferase genes from maize., 2018, 61: 735–743.
[27] Rosli R, Chan P, Chan K, Amiruddin N, Low E, Singh R, Harwood J, Murphy D. In silico characterization and expression profiling of the diacylglycerol acyltransferase gene family (DGAT1, DGAT2, DGAT3 and WS/DGAT) from oil palm,., 2018, 275: 84–96.
[28] Zhao J, Bi R, Li S, Zhou D, Bai Y, Jing G, Zhang K, Zhang W. Genome-wide analysis and functional characterization of Acyl-CoA: diacylglycerol acyltransferase from soybean identifiesandroles in oil synthesis inseeds., 2019, 242: 153019.
[29] Freeling M. Bias in plant gene content following different sorts of duplication: tandem, whole-genome, segmental, or by transposition., 2009, 60: 433–453.
[30] Chen C, Chen H, Zhang Y, Thomas H R, Frank M H, He Y, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data., 2020, 13: 1194–1202.
[31] 李培江, 米瑶, 余竟, 李碧娟, 廖芳, 李关荣. 美国引进向日葵种子含油量和脂肪酸组成比较分析. 中国油脂, 2015, 40(11): 104–106.
Li P J, Mi Y, Yu J, Li B J, Liao F, Li G R. Comparative analysis of oil content and fatty acid composition of sunflower seeds introduced from the United States., 2015, 40(11): 104–106 (in Chinese with English abstract).
[32] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(−delta delta C(T)) method., 2001, 25: 402–408.
[33] Xu C, Shanklin J. Triacylglycerol metabolism, function, and accumulation in plant vegetative tissues., 2016, 67: 179–206.
[34] Panchy N, Lehti-Shiu M, Shiu S H. Evolution of gene duplication in plants., 2016, 171: 2294–2316.
[35] Misra A, Khan K, Niranjan A, Nath P, Sane V A. Over-expression offromincreases seed oil levels and alters oil quality in transgenic., 2013, 96: 37–45.
[36] Xu J, Francis T, Mietkiewska E, Giblin E M, Barton D L, Zhang Y, Zhang M, Taylor D C. Cloning and characterization of an acyl-CoA-dependent() gene from, and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content., 2008, 6: 799–818.
[37] Zhang M, Fan J L, Taylor D C, Ohlrogge J B.andacyltransferases have overlapping functions intriacylglycerol biosynthesis and are essential for normal pollen and seed development., 2009, 21: 3885–3901.
[38] Lu C L, de Noyer S B, Hobbs D H, Kang J, Wen Y, Krachtus D, Hills M J. Expression pattern of diacylglycerol acyltransferase-1, an enzyme involved in triacylglycerol biosynthesis, in., 2003, 52: 31–41.
[39] 鲁庚, 唐鑫, 陆俊杏, 李丹, 胡秋芸, 胡田, 张涛. 紫苏二酰基甘油酰基转移酶2基因克隆与功能研究. 作物学报, 2020, 46: 1283–1290.
Lu G, Tang X, Lu J X, Li D, Hu Q Y, Hu T, Zhang T. Cloning and function analysis of a type 2 diacylglycerol acyltransferase (DGAT2) from., 2020, 46: 1283–1290 (in Chinese with English abstract).
[40] Takeda S, Iwasaki A, Matsumoto N, Uemura T, Tatematsu K, Okada K. Physical interaction of floral organs controls petal morphogenesis in., 2013, 161: 1242–1250.
[41] Chi X, Hu R, Zhang X, Chen M, Chen N, Pan L, Wang T, Wang M, Yang Z, Wang Q. Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut (L.)., 2014, 9: e105834.
[42] Tan W J, Yang Y C, Zhou Y, Huang L P, Xu L, Chen Q F, Yu L J, Xiao S. Diacylglycerol acyltransferase and diacylglycerol kinase modulate triacylglycerol and phosphatidic acid production in the plant response to freezing stress., 2018, 177: 1303–1318.
[43] Lu C, Hills M J.mutants deficient in diacylglycerol acyltransferase display increased sensitivity to abscisic acid, sugars, and osmotic stress during germination and seedling development., 2002, 129: 1352–1358.
[44] Weselake R J, Shah S, Tang M, Quant P A, Snyder C L, Furukawa-Stoffer T L, Zhu W, Taylor D C, Zou J, Kumar A, Hall L, Laroche A, Rakow G, Raney P, Moloney M M, Harwood J L. Metabolic control analysis is helpful for informed genetic manipulation of oilseed rape () to increase seed oil content., 2008, 59: 3543–3549.
Genome-wide identification and relative expression analysis of DGATs gene family in sunflower
ZHANG Cheng1, ZHANG Zhan2, YANG Jia-Bao1, MENG Wan-Qiu1, ZENG Ling-Lu1, and SUN Li1,*
1College of Life Science, Shihezi University, Shihezi 832003, Xinjiang, China;2Bingtuan Xingxin Vocational and Technical College, Bazhou 841007, Xinjiang, China
Diacylglycerol acyltransferase (DGAT) plays an important role in plant oil metabolism and stress resistance. To explore the evolution ofgene insunflower (L.) and its function in oil biosynthesis and response to abiotic stresses, 18 homologous gene sequences ofwere obtained from the sunflower genome database by alignment withgenes. Then, chromosome distribution, gene structure, conserved protein motifs, phylogenetic relationship, tissue-specific expression of, and their expressing patterns under abiotic stresses were systematically investigated. The results showed that sunflowergenes were divided into four subfamilies (,,, and), and the members of the same subfamily shared similar gene structures and conserved motifs. The promoter regions ofharbored multiple-elements related to environmental stresses and plant hormone response. The main factor foramplification was fragment duplication. The qRT-PCR indicated that,, andwere mainly expressed in the early and middle stages of sunflower seed development, which coincided with the rapid accumulation period of oil in seeds, whilesubfamily genes were mainly expressed in stems, leaves, and petals. Most ofgenes could be induced by NaCl, low temperature, drought, and ABA treatments in sunflower roots, stems, and leaves, indicating that they might play essential roles in dealing with various abiotic stresses. The results revealed thathad functional differentiation in regulating lipid biosynthesis and abiotic stresses. This study provides an important foundation for further understanding the function of sunflowergenes.
sunflower; DGAT gene family; abiotic stresses; gene expression
10.3724/SP.J.1006.2023.14217
本研究由国家自然科学基金项目(31760064, 31360052)资助。
This study was supported by the National Natural Science Foundation of China (31760064, 31360052).
通信作者(Corresponding author):孙黎, E-mail: sunlishz@126.com
E-mail: 2020002371@qq.com
2021-11-23;
2022-05-05;
2022-05-24.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220523.1818.018.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
