海南文心兰切花品种病毒病的分子鉴定
2023-01-12闫钟荣谢承智宋希强王洪星
闫钟荣,谢承智,宋希强,王洪星
(海南大学 a.海南省热带特色花木资源生物学重点实验室;b.林学院,海南 海口 570228)
兰科植物是多年生草本植物,全世界范围内约有750 属25 000 种,其野生种群主要分布于美国、智利、阿根廷等国家的热带和亚热带地区[1]。兰花具有花型独特、花色艳丽、花香浓郁等特点,是一种重要的观赏花卉,具有重要的经济价值和观赏价值。兰花中一些内生菌可促进兰花生长发育,增强植株抗逆性[2-3],对兰花炭疽病具有生物防治潜力[4]。兰花花瓣中含有挥发性物质而具有独特的香味,其中挥发性物质主要由萜类化合物、苯丙酸类和脂肪酸衍生物组成,具有防治病原菌侵害、吸引昆虫授粉繁殖等功能[5-6]。与此同时,兰花的生长发育受到温度、湿度、病原菌等因素的影响,严重影响其形态特征、观赏价值和经济价值[7-8]。
兰花生长过程中易受到病原菌的侵染,已从感病的兰花植株中分离并鉴定了57 种病毒[9],其中以建兰花叶病毒(Cymbidium mosaic virus,CymMV)和齿兰环斑病毒(Odontoglossum ringspot virus,ORSV)危害最显著[10-11]。CymMV 属甲型线形病毒科(Alphaflexiviridae)马铃薯X 病毒属(Potexvirus),基因组为ssRNA(约6 200 bp),编码RNA 指导的RNA 聚合酶、运动蛋白、外壳蛋白等蛋白质,介导病毒的快速复制和长距离转移[12]。CymMV 外壳蛋白(Coat Protein,CP)基因的开放阅读框长度为672 bp,编码223 个氨基酸,在病毒细胞间和长距离转运过程中发挥着重要作用[12]。CymMV 可通过水源灌溉、机械损伤、交叉接触、外源输入等方式进行传播,广泛分布于美国、新加坡、韩国、中国、中国台湾等国家和地区[13-14]。兰花感染CymMV 后,导致叶和花器官变形与褪色,最终形成坏死的凹斑,严重影响兰花的观赏价值和经济价值[15]。ORSV 属帚状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus),基因组为ssRNA(约6 618 bp),具有4 个开放阅读框,且病毒衣壳无包膜[16]。ORSV 诱导兰花叶片上形成菱形斑驳或环斑,同时诱导花器官变色或形成环斑[15]。此外,兰花植株同时感染上述两种病毒,可诱发花棕色坏死条纹出现[10-11]。在新加坡,兰花CymMV 的感染率高达54.6%,ORSV 的感染率为4.0%,两种病毒的复合侵染率为14.2%[17]。刘福秀等[18]利用ELISA 法调查了海南岛文心兰感染病毒病情况,研究结果显示CymMV 的感染率为77.58%,ORSV 的感染率为16.04%,两种病毒的复合侵染率为10.19%。泰国[19]、中国台湾[20]以及世界其他的一些地区也报道了类似的结果[21-23]。兰花病毒分子常用的检测方法与技术有酶联免疫吸附法(Enzyme-linked Immuno Sorbent Assay,ELISA)、免疫胶体金技术、免疫毛细区带电泳法(Immuno-Capillary Zone Electrophoresis,I-CZE)、反转录-聚合酶链锁反应(Revers Transcription Polymerase Chain Reaction,RT-PCR)、免疫捕捉PCR 技术(Immuno-Capture PCR,IC-PCR)、TaqMan 实时荧光定量RT-PCR(TaqMan realtime quantity RT-PCR)技术、石英晶体微天平生物传感器检测技术(Quartz Crystal Microbalance Biosensor,QCM biosensor)、液相色谱-质谱分析法(Liquid Chromatography Mass Spectrometry,LCMS)等,但未见小RNA 深度测序技术在海南兰花病毒病分子鉴定中的应用[24-26]。
文心兰Oncidium hybridum属兰科Orchidaceae文心兰属Oncidium多年生常绿草本植物,具有花期长、花形优美、花色艳丽多样、观赏价值高等优点,素有“吉祥兰”的称号,是世界重要的盆花和切花种类之一,也是极具竞争力和发展潜力的一种高经济价值花卉[27-28]。文心兰生长过程中易受到病毒病的侵害,病毒病则显著影响文心兰植株的生长活力、成花时间、成花品质和经济价值,进而影响文心兰全产业链的发展[29-30]。海南省是文心兰重要的种植与繁育之地,目前关于海南省文心兰主产区感染病毒的种类和数量尚不清楚,且文心兰病毒分子水平的系统鉴定尚不完善。因此,本研究以海南省不同区域种植的文心兰为试验材料,分析疑似病样叶片,利用RT-PCR 以及sRNA 深度测序技术对文心兰病毒进行鉴定,明确海南文心兰病毒病的种类和CP 基因的序列特征,建立系统、准确的海南文心兰病毒检测方法,为海南文心兰病毒病的鉴定与防治奠定了理论基础和技术保障。
1 材料与方法
1.1 文心兰叶片采集
根据海南省文心兰叶片系统性斑驳、坏死斑、环斑等病症,于2020 年12 月和2021 年5 月分别在海南博大兰花科技有限公司、海南出入境检验检疫局热带植物隔离检疫中心、海口海关热带植物隔离检疫中心、乐东生态农业开发有限公司、南龙寿洋休闲观光农业有限公司、海南省林业总公司、五指山红山缤纷花场、五指山万泉园艺有限公司、海南省保亭县天乐花卉有限责任公司、三亚市林业科学研究院等企业单位或文心兰种植基地以S 形路线采样,共计采集178 份样品(第1次采样46 份,第2 次采样132 份)。样品包括‘黄金三号’‘黄金二号’‘柠檬绿8061’‘柠檬绿8060’‘柠檬绿8058’‘NO0008’‘博大一号’‘剑叶文心’‘散干平白’‘香水文心’‘新奇士文心’‘月光文心’等12 个品种,每份样品(叶片)采集重量为100~200 g,除去样品表面污染物,保鲜袋封装后于实验室-80℃保存备用。
1.2 总RNA 提取与反转录
文心兰样品总RNA 提取采用北京华越洋生物公司的“快速通用植物RNA 提取试剂盒3.0”(货号0416-50)进行,反转录采用TaKaRa 公司的“PrimeScript ™ 1st Strand cDNA Synthesis Kit 试剂盒”(货号6110A)进行,具体实验操作方法与步骤详见试剂盒说明书。
1.3 病毒的PCR 检测
利用GenBank 中已有病毒的基因组序列和已发表的文献,设计CymMV、ORSV、菜豆黄花叶病毒(Bean yellow mosaic virus,BYMV)、辣椒褪绿病毒(Capsicum chlorosis virus,CaCV)、兰花斑点病毒(Orchid fleck virus,ORF)、凤仙花坏死斑病毒(Impatiens necrotic spot virus,INSV)、黄瓜花叶病毒(Cucumber mosaic virus,CMV)和落葵皱纹花叶病毒(Basella rugose mosaic virus,BaRMV)8 种病毒的Coat Protein(CP)基因引物序列,由生工生物工程(上海)股份有限公司合成,引物信息如表1 所示。PCR 反应体系为25 μL:2×Taq Plus Master Mix Ⅱ(Vazyme,P213-01)12.5 μL,cDNA模板1 μL,引物各1 μL,ddH2O 9.5 μL。PCR 扩增条件:95℃预变性3 min;95℃变性30 s,引物对应退火温度退火30 s,72℃延伸1 min,35 个循环;72℃延伸10 min,4℃保温。PCR 扩增产物用1%的琼脂糖凝胶电泳检测,其中电压为80 V,时间为30 min。实验进行3 次生物学重复。
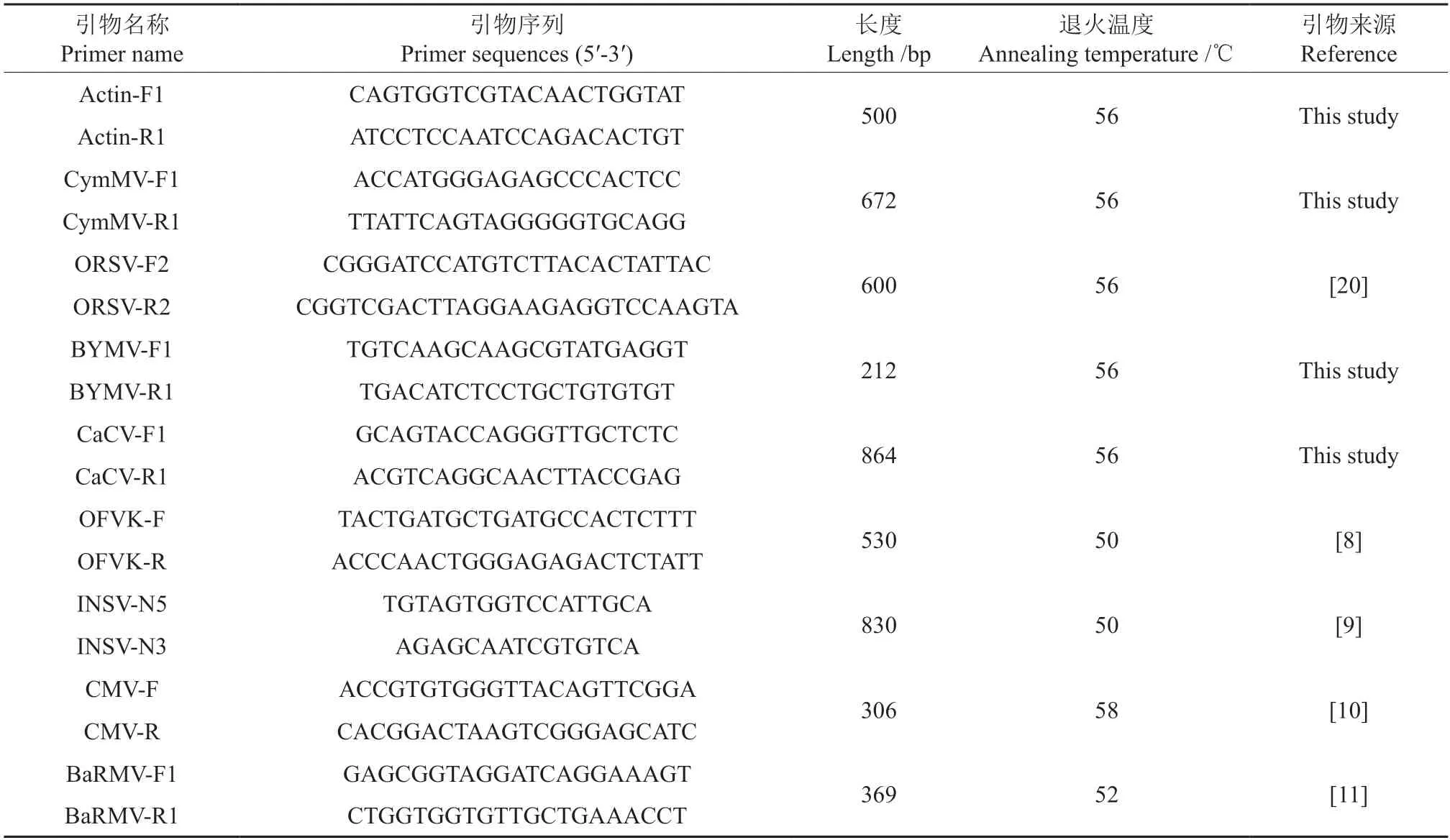
表1 海南文心兰病毒PCR 扩增引物名称与序列Table 1 Primers for virus PCR amplification in leaves of Hainan Oncidium hybridum
1.4 CymMV 和ORSV CP 基因的克隆与序列分析
根据上述设计的CymMV 和ORSV CP 基因引物进行PCR 扩增,回收产物与pMD-19T vector 进行连接(T4 连接酶),然后利用热激法转化大肠杆菌TOP10 感受态细胞,涂平板并过夜培养。挑取平板上阳性单克隆至灭菌的eppendorf 管中,然后送至生工生物工程(上海)股份有限公司进行测序。利用DNAStar 软件进行CymMV 和ORSV CP 基因序列拼接,同时利用NCBI(http://www.ncbi.nlm.nih.gov/)中的BLAST 软件进行序列同源性比对和分析;利用MEGA-X 软件,采用最大似然法(Maximum Likelihood)构建基于CP 基因序列的系统进化树。
1.5 sRNA 深度测序
将具有明显褐色斑、坏死斑等病症且未检测到病毒的9 份海南文心兰叶片样品混合,利用TRIzol 试剂提取总上述样品的总RNA(体积为50 μL),同时对提取的总RNA 进行如下分析与评估:1)琼脂糖凝胶电泳分析总RNA 的降解程度并评估其污染程度;2)利用Nanodrop 法检测总RNA 的纯度(OD260/280比值);3)利用Qubit法对总RNA 溶液的浓度进行精确定量分析;4)利用Agilent 2100 仪器精确检测RNA 的完整性。样品检测合格后,依据Small RNA 的3′及5′端特殊结构(5′端有完整的磷酸基团,3′端有羟基),以提取的总 RNA 为起始样品,利用Small RNA Sample Pre Kit 直接将Small RNA 两端加上接头,然后反转录合成cDNA。随后经过PCR 扩增,利用PAGE 胶分离目标DNA 片段,切胶回收得到cDNA 文库。文库构建完成后,先使用Qubit2.0 软件进行初步定量,稀释文库至1 ng/μL,然后使用Agilent 2100 仪器对文库的插入片段长度(insert size)进行检测,insert size 符合预期后,使用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nM),以保证文库质量。库检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling 后进行HiSeq/MiSeq 测序。为了确定引起症状的潜在病毒,我们使用NovaseQ6000 系统对sRNAs 进行深度测序,以FASTQ 格式接收高质量的原始读数(raw reads)。测序由北京诺禾致源科技股份有限公司进行,实验进行3 次生物学重复。
2 结果与分析
2.1 叶片表型
由图1 可知,感染不同病毒后,海南文心兰‘黄金三号’‘黄金二号’‘柠檬绿8061’‘柠檬绿8060’‘柠檬绿8058’和‘NO0008’品种叶片整体或局部出现大小不一的褪绿块状斑(图1A—C)或褪绿条纹斑(图1D—F),‘博大一号’‘剑叶文心’和‘散干平白’品种的叶片局部呈现黄化的雾状斑(图1G—I),‘香水文心’‘新奇士文心’和‘月光文心’品种的叶片表现出明显的皱缩或畸形和黑色坏色斑症状(图1J—L),表明不同病毒对海南文心兰叶片的表面形态具有重要的影响,且不同品种之间存在明显差异。
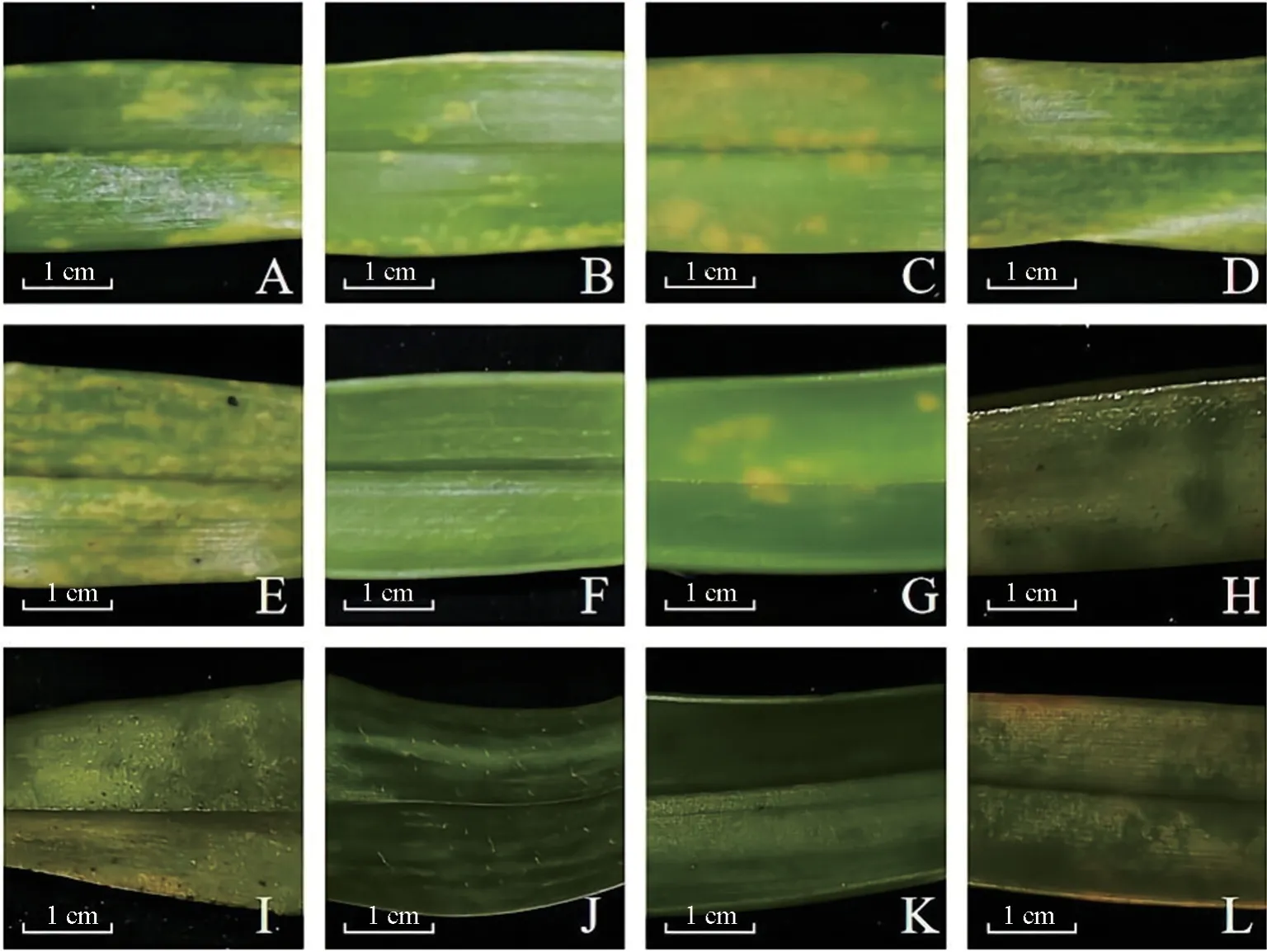
图1 海南文心兰叶片感染病毒的表型Fig.1 Symptoms of leaves from Hainan Oncidium hybridum infected with virus
2.2 病毒的分子鉴定
由图2 可知,在‘黄金三号’‘柠檬绿8058’‘NO0008’ ‘散干平白’‘香水文心’‘月光文心’‘黄金二号’和‘柠檬绿8060’叶片中检测到CymMV 病毒的CP 基因,约为700 bp;在‘黄金三号’‘散干平白’‘香水文心’‘新奇士文心’和‘柠檬绿8060’叶片中检测到ORSV病毒的CP 基因,约为500 bp,表明不同类型的海南文心兰叶片表型主要由CymMV 和ORSV 病毒的侵染而导致。
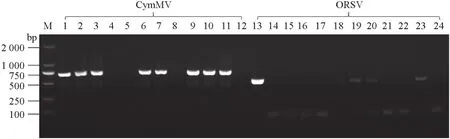
图2 海南文心兰叶片病毒的分子鉴定Fig.2 Molecular identification of viruses in leaves of Hainan Oncidium hybridum
2.3 CP 基因的克隆与序列分析
基因测序结果显示,建兰花叶病毒海南分离物CymMV-HN 的CP 基因全长为672 bp,编码223个氨基酸,其GeneBank登录号为MZ662114(图3A)。CymMV-HN 的CP 基因编码的氨基酸序列分析结果显示,氨基酸的F87S 和N29D 位点发生突变,剩余氨基酸则完全相同,表明海南文心兰CymMV-HN 的CP 基因在进化中相对比较保守(图4A)。与已报道CymMV 的CP 基因序列进行比较,海南分离物CymMV-HN 的CP 基因序列与巴西分离物CymMV-PHALAEN-ATIBAIA 的CP 基因序列(KX960734.1)同源性为97.47%,与中国广东分离物CymMV-LZ14的CP基因序列(KP137370.1)和中国河南分离物CymMV-CHN-HNZZ01 的CP基因序列(KU873000.1)同源性分别为97.32%和97.17%,表明海南文心兰CymMV 的CP 基因在进化过程中十分保守(图5A)。
齿兰环斑病毒海南分离物ORSV-HN 的CP 基因全长为477 bp,编码158 个氨基酸,其GeneBank 登录号为MZ662115(图3B)。ORSV-HN 的CP 基因编码的氨基酸序列与已报道的新加坡分离物ORSV-Singapore 的CP 基因序列(AF404777.1)、韩国分离物ORSV-ONK1的CP 基 因 序 列(AB541505.1 和AB541487.1)的序列完全相同(图4B)。与此同时,海南文心兰ORSV-HN 的CP 基因序列与新加坡分离物ORSV-Singapore 的CP 基因序列(AF406777.1)的同源性为99.37%,与韩国分离物ORSV-ONK1和ORSV-CYK1 的CP 基因序列(AB541505.1 和AB541487.1)的同源性均为99.16%,表明海南文心兰ORSV 的CP 基因在进化过程中同样十分保守(图5B)。

图3 CymMV-HN(A)和ORSV-HN(B)CP 基因核酸与氨基酸序列分析Fig.3 Analysis of nucleotides and amino acid sequences of CP genes of CymMV-HN (A) and ORSV-HN (B)

图4 CymMV-HN (A)和ORSV-HN (B) CP 氨基酸序列比对Fig.4 Alignment of CP protein amino acid sequences of CymMV-HN (A) and ORSV-HN (B)

图5 基于CymMV-HN (A)和ORSV-HN (B) CP 氨基酸序列的系统进化树Fig.5 Phylogenetic tree based on CP gene sequences of CymMV-HN (A) and ORSV-HN (B)
2.4 sRNA 深度测序分析
海南文心兰叶片样品进行sRNA 深度测序共获得26 976 941 条raw reads,质控后得到26 039 391条clean reads。植物感染病毒后富集的病毒siRNAs 长度主要为21-nt,22-nt 和24-nt 三种类型。在海南文心兰叶片sRNA 深度测序后质控的clean reads 分析结果显示,24-nt 长度的sRNA 序列数量最多,占比为35.42%,其次是21-nt 和22-nt,分别占比为25.01%和15.06%(图6A)。利用bowtie 软件将sRNA 数据进行过滤,在GenBank Virus RefSeq 核酸数据库中注释到94 780 条reads,其中21-nt 长度的sRNA 序列数量最多,占比为23.08%,其次是18-nt 长度的序列,占比为15.73%(图6B)。通过velvet 软件,筛选18~26 nt的序列进行拼接组装,获得1 256 个contigs,其中长度为50~100 bp 的contigs 最多,为1 078 个,500~1 000 bp 最少,仅有1 个(图6C)。利用Blast 算法,采用参数限制e-value(1e-6 for BLASTN,1e-4 for BLASTX),对1256个contigs 进行分类注释,在NCBI Nr(NCBI nonredundant protein sequences)、NCBI Nt(NCBI non-redundant nucleotide sequences)、GenBank Virus RefSeq Nucletide、GenBank Virus RefSeq Protein 数据库中分别注释到211、518、111 和112个contigs,共同注释到66 个contigs(图6D)。从分类注释结果中,分离病毒相关的contigs 注释信息,在CymMV 和ORSV 基因组数据库中分别注释到56 和39 个contigs,表明海南文心兰叶片感病表型是由上述两种病毒侵染而导致,此结果与PCR 鉴定结果相一致(表2)。
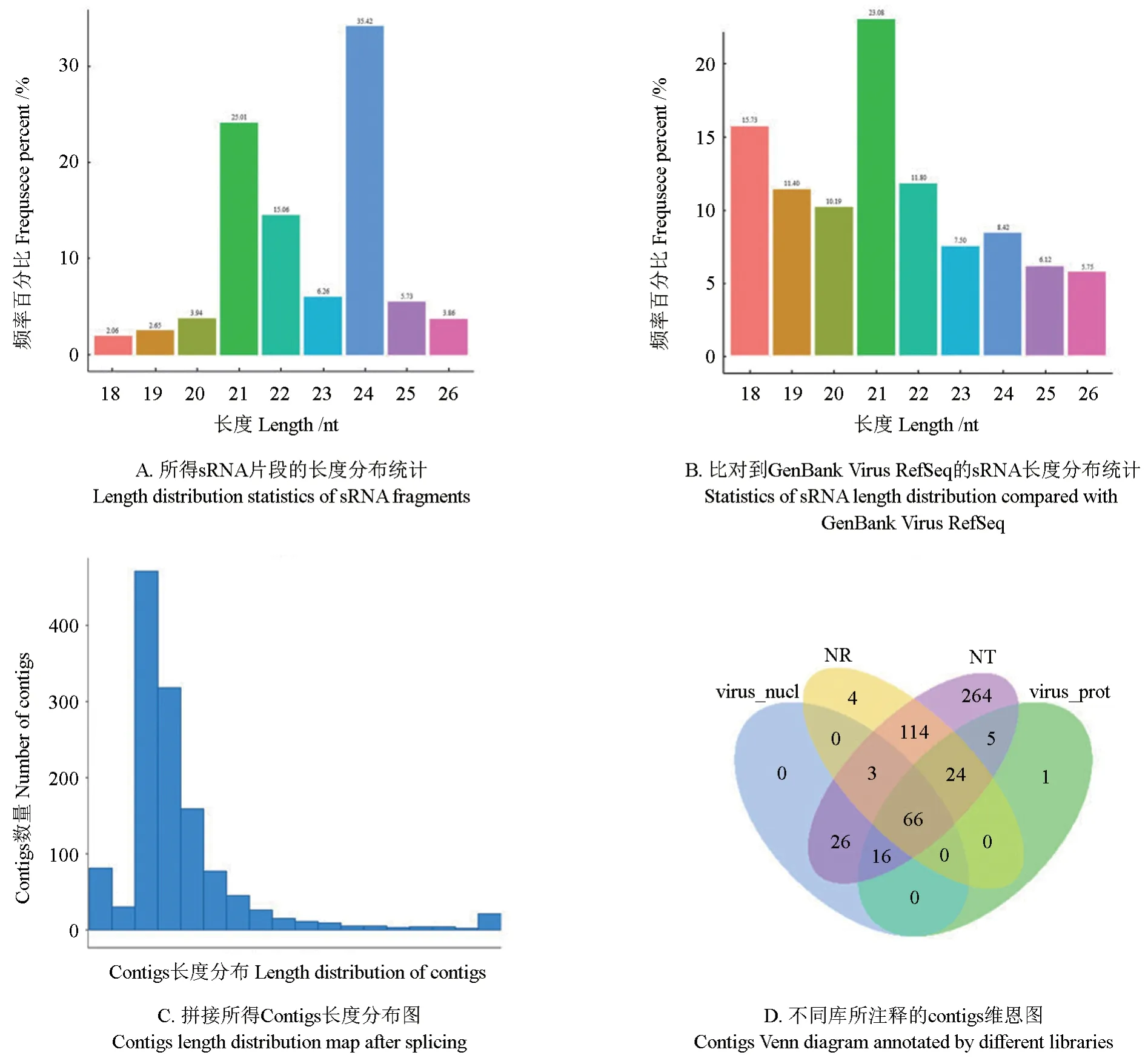
图6 海南文心兰叶片样品sRNA 深度测序结果分析Fig.6 Analysis of small RNA deep sequencing results in leaf samples of Hainan Oncidium hybridum

表2 利用sRNA 深度测序分析海南文心兰CyMV 和ORSV 病毒的种、科、属Table 2 Analysis of virus species, families and genus of CymMV and ORSV by small RNA deep sequencing in leaf samples of Hainan Oncidium hybridum
3 讨 论
文心兰是一种常绿观赏草本植物,其生长过程中易受到病毒的侵染,严重影响其观赏价值和经济价值。兰花感染CymMV 或ORSV 后,表现为环斑、坏死斑、褪绿条纹、灰白斑等症状[1],导致植株生长矮小、花小不艳、花期缩短[14],已在蝴蝶兰(Phalaenopsis aphrodite)、南茜文心兰(OncidiumGower Ramsey)、建 兰(Cymbidium ensifolium)等品种进行了分离和鉴定[25,31]。本文研究结果显示,不同产地和品种的海南文心兰感染病毒后,叶片呈现褪绿状斑或条纹、黄化雾状斑、皱缩、黑色坏色斑等症状,表明海南文心兰受到不同类型的病毒侵染(图1)。与此同时,利用RT-PCR 技术在采集的海南文心兰病样中仅检测到CymMV 或ORSV,且同时在‘黄金三号’‘散干平白’‘香水文心’‘新奇士文心’和‘柠檬绿8060’样品中检测到了CymMV 和ORSV,表明CymMV 和ORSV 是导致海南文心兰感病的主要病毒类型,这与吴伟文等的研究结果相一致(图2)[25]。已有的研究结果显示,在福建[27]、广东[28]、台湾[17]、云南[18-19]等地栽培的文心兰病样组织中分别检测到CymMV、ORSV、BYMV、CaCV、CMV 和INSV,而在海南文心兰叶片病样中未检测到CymMV 和ORSV 以外的其他病毒,说明CymMV 和ORSV 是海南文心兰感病的主要病毒因子。
CP 蛋白是文心兰病毒的一种重要蛋白质,其核酸序列和氨基酸序列具有高度的保守性,在病毒细胞间和长距离转移过程中发挥着重要作用[12]。已从卡特兰Cattleya hybida[13]和建兰[32]病样组织中分离并鉴定了CymMV 和ORSV 的CP 基因,其核酸序列长度分别为672 和477 bp,编码223 和158 个氨基酸。本文实验结果显示,CymMV-HN和ORSV-HN CP 基因的核酸序列长度分别为672和477 bp,分别编码223 和158 个氨基酸,这与罗金水的研究结果相一致[32]。海南文心兰CymMV-HN 和ORSV-HN CP 基因序列比对结果显示,它们与巴西和新加坡分离到的CymMV 和ORSV 的CP 基因核酸序列具有较高的同源性,且没有明显的差异,表明海南文心兰CymMV 和ORSV 的CP基因序列具有较高的保守性(图2~5)。
植物细胞内sRNA 序列经过Dicer 酶的催化形成微 RNA(miRNA)和小干扰 RNA(siRNA),然后被装载到Argonaute(AGO)蛋白家族上,引导产生RNAi 沉默复合体到互补的靶RNA 或DNA 链上,在生长发育、基因表达、DAN 修复、病毒防御、生物和非生物胁迫应答过程中发挥着重要调节作用[33-34]。病原菌的基因组(ssRNA 和dsRNA)在感染植物后可以整合到植物基因组中,经过剪切作用产生miRNA 和siRNA,在病原菌复制、转移、毒害等方面发挥着重要作用[35-36]。因此,对植物中sRNA 群体进行深度高通量测序和生物信息学分析,可以将给定样本进行通用病毒检测和完整的病毒基因组重建[35]。利用sRNA深度测序技术对海南文心兰叶片病样进行分析,海南文心兰叶片病样质控后得到26 039 391 条clean reads,其中24-nt 的sRNAs 含量最丰富,其次是21-nt 和22-nt 长度的sRNA。海南文心兰叶片clean reads 拼接后获得1 256 个Contigs,在Nr 等4 个数据库中共同注释到66 个Contigs,在CymMV 和ORSV 基因组数据库中分别注释到56和39 个Contigs,表明海南文心兰叶片病症主要由CymMV 和ORSV 侵染而导致,这与上述的分子鉴定结果相一致(图2 和图6)。本文建立了海南文心兰病毒病系统、科学的鉴定体系,但CymMV和ORSV 侵染海南文心兰的分子机制及致病机理尚不清楚,需利用转录组学和RNA 组学等技术开展研究。
4 结 论
本研究对海南海口、文昌、乐东、三亚等地区的文心兰进行检查,感病叶片呈现褪绿块状斑、褪绿条纹斑、黄化雾状斑、黑色坏色斑、皱缩或畸形症状,表明病毒侵染影响海南文心兰的生长发育;利用RT-PCR 技术在海南文心兰叶片病样组织中检测到CymMV 和ORSV,且CP 基因序列具有较高的保守性,表明CymMV 和ORSV 是导致其感病的主要病毒类型;利用sRNA 深度测序技术分析海南文心兰叶片组织中sRNA 的类型与丰度,质控后拼接获得1 256 个contigs,在Nr等数据库中共注释到66 个contigs,在CymMV和ORSV 基因组数据库中分别注释到56 和39 个Contigs,表明CymMV 和ORSV 是海南文心兰染病的主要因素。与此同时,本研究建立了系统、快速鉴定海南文心兰CymMV 和ORSV 病毒的检测方法,为海南文心兰病毒病的诊断与防治提供了技术体系与理论依据。
