保康红豆杉性别分化过程中大小孢子叶球和内源激素的变化分析
2023-01-12贺心茹何舒怀龙凤英李英杰费永俊
贺心茹,何舒怀,龙凤英,李英杰,胡 蝶,费永俊
(1.长江大学 园艺园林学院,湖北 荆州 434025;2.浙江五洲工程项目管理有限公司,浙江 杭州 310000)
南方红豆杉Taxus chinensis var.mairei为红豆杉科Taxaceae 红豆杉属Taxus的常绿乔木,是中国特有的白垩纪孑遗植物,在我国长江流域及台湾等山地或溪谷地带间断分布[1]。其树形优美、材质坚硬、含高效抗癌物质紫杉醇,是集观赏、材用和药用的综合植物资源[2]。南方红豆杉花单性,雌雄异株,天然群落中雌雄树比例悬殊(大致为1︰9),花期不遇,自然更新困难[3];且由于气候变化、生境破坏及人为干扰等原因,野生资源已处于濒危状态,被列为我国Ⅰ级保护植物,并被《濒危野生动植物种国际贸易公约》(CITES)收录。现阶段,以南方红豆杉为研究对象进行的相关试验主要集中在种子萌发、苗木繁育、紫杉醇含量及合成途径、群落特征与种群结构、种群遗传多样性、濒危机制等方面[4-8]。费永俊等发表的保康红豆杉Taxus chinensisf.baokangsis与原变种南方红豆杉主要区别在于其雄株上有部分枝条发育成雌性枝条或雌雄球花在同一果枝上,呈现雌雄同株现象[9],这种由雌雄异株到雌雄同株的进化方式较为特殊[10-11]。
植物性别分化是有性繁殖中一个较为普遍的现象,因受到遗传因子与环境的影响,具复杂性和不稳定性,目前的研究主要集中在白麦瓶草Silene latifolia、玉米Zea mays和黄瓜Cucumis sativus等模式植物,裸子植物涉及较少。本研究以保康红豆杉和南方红豆杉为研究对象,通过研究不同发育时期大小孢子叶球形态学、细胞学及内源激素的变化,旨在探明保康红豆杉性别分化的关键时期和激素对花性别分化的影响,为保康红豆杉性别分化调控机制的深入研究提供新的理论知识。
1 材料与方法
1.1 试验地概况
试验材料采自于长江大学实习基地—湖北省监利县润景园林绿化股份有限公司苗圃基地,位于29°49′N,112°54′E,属于亚热带季风气候。年辐射总量为104~110 kcal/cm2,年日照时数1 800~2 000 h,年平均气温15.9~16.6℃,年无霜期242~263 d,年降水量1 100~1 300 mm。四季分明、光能充足、热量丰富、雨水充足、无霜期长,水热同步为植物生长提供了优良的条件。
1.2 试验材料
保康红豆杉和南方红豆杉于2012 年引自湖南长沙跳马红豆杉基地,2015 年开始开花结实。采集时为9 年生母树,胸径达6~8 cm,树高约2 m,冠幅为W 0.8 m×E 1.2 m,长势优良。保康红豆杉大、小孢子叶球分别用Taxus-TD 和Taxus-TX 表示;南方红豆杉大、小孢子叶球分别用Taxus-D 和Taxus-X 和表示。
1.3 试材取样及处理
以保康红豆杉和南方红豆杉的大、小孢子叶球为试材,从2016 年12 月4 日开始,每隔10 d到湖北省荆州市监利县采集试材,共采集5 次。材料分为两种采集方式:1)采集带有一定数量试材的枝条(为石蜡切片试验材料),分类标记并插至花泥中,带回实验室进行后续处理;2)户外采好样品,用蒸馏水冲洗杂物,迅速置于液氮中固定,带回实验室后放入超低温冰箱储存备用。在试验地均选取至少10 株母树进行试材采样,并在树的各个方向采集且混合。
1.4 试验方法
1.4.1 形态指标的测定
将采集的大、小孢子叶球置于体视显微镜(Leica M165C)观察,描述其形态特征。
1.4.2 石蜡制片法
将采集的大、小孢子叶球剥去苞片后分别置于70%FAA 固定液中(固定液体积高于材料总体积的20 倍),各个时期的孢子叶球经过梯度脱水后用常规的石蜡切片技术包埋,Leica RM2235 连续切片,切片厚度为8 μm,采用番红—固绿对染法进行染色[12],中性树脂封片镜检[13-14]。
1.4.3 内源激素的测定
选择母细胞发育时期的大、小孢子叶球进行内源激素测定,小孢子叶球的采样时间为2016 年12 月4 日,大孢子叶球的采样时间为2017 年1 月13 日。采集的样品采用酶联免疫法(ELISA)[15]分别单独测定保康红豆杉和南方红豆杉大、小孢子叶球脱落酸(ABA)、细胞分裂素(CTK)、吲哚乙酸(IAA)、茉莉酸甲酯(MeJA)、赤霉素(GA4、GA3)和油菜素内酯(BR)7 种内源激素的含量。
2 结果与分析
2.1 大、小孢子叶球发育的形态学特征
通过体视显微镜观察了5 个不同分化时期的大、小孢子叶球的发育形态特征(图1)。开始采集时(12 月初),大孢子叶球由多层芽鳞包裹、呈椭球形,与营养芽很难区分,唯一的区别在于营养芽顶端呈圆锥形;随着大孢子叶球的发育,其珠心、珠被以及珠鳞的发育,其大孢子叶球的横径逐渐增大,与营养芽的区别也逐渐明显。小孢子叶球在采集时体积就较生殖芽、营养芽大很多,很容易区分;小孢子叶球外披苞片,内由13~20 个小孢子叶组成,每个小孢子叶包含数个盾形小孢子囊;随着小孢子叶球的发育,其横径逐渐增大,于1 月份开始大于纵径,小孢子叶球也逐渐伸出苞片,裸露在空气中,其颜色逐渐从嫩绿色转变为黄褐色。在12 月份至次年的1 月份,通过比较同一时期的大、小孢子叶球,发现小孢子叶球的形态发育较大孢子叶球快。
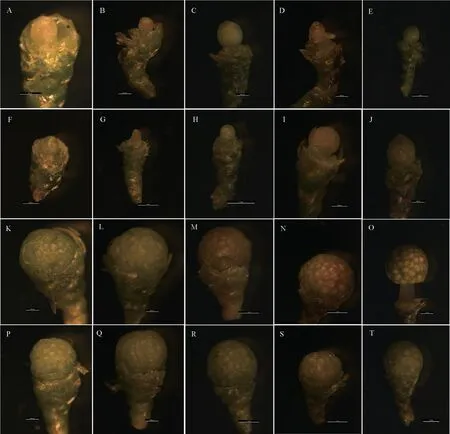
图1 不同分化时期大、小孢子叶球的形态变化Fig.1 The morphology structure changes of ovulate strobilus and microstrobilus in different differentiation phases
2.2 大、小孢子叶球发育的细胞学特征
12 月初,Taxus-D 的胚珠原基分化完成形成珠心(图2A—B),Taxus-TD 的胚珠原基正在分化中(图2F—G);12 月末,大孢子叶球的珠心中下部出现与周围明显不同的造孢细胞(图2-C,2-H),其较周围细胞的细胞质更为浓密、细胞核更大;次年1 月,造孢组织中分化出大孢子母细胞(图2D—E,I—J)。比较同一时期的Taxus-D和Taxus-TD 可知,Taxus-TD 的发育相对落后于Taxus-D,但差异不明显。
12 月初,Taxus-X 中小孢子母细胞内含物丰富且凌乱、染色较深,正处于减数分裂前期(图2K);Taxus-TX 发育稍滞后,处于小孢子母细胞成熟期(图2P)。随后进行减数分裂(图2L,2Q—R),形成四分体(含左右对称形、四面体形和线形排列方式);之后进入小孢子游离期(图2M—N,2S);次年的1 月中旬,游离小孢子开始生长,表现为细胞核增大、迁往细胞中心,随着细胞壁的逐渐增厚,花粉粒逐渐成熟(图2O,2T)。比较同一时期的Taxus-X 和Taxus-TX 可知,Taxus-TX 的发育相对落后于Taxus-X,但差异不大。
2.3 大、小孢子叶球内源激素的含量分析
如图3 所示,保康红豆杉和南方红豆杉大、小孢子叶球的ABA 含量明显高于其他六种激素含量。比较保康红豆杉大小孢子叶球和南方红豆杉大小孢子叶球中的内源激素含量可知:在保康红豆杉大孢子叶球中CTK、IAA、ABA、GA3、MeJA 和BR 的含量均高于小孢子叶球中的含量,GA4的含量低于小孢子叶球中的含量;在南方红豆杉大孢子叶球中ABA 和BR 含量高于小孢子叶球中的含量,CTK、IAA、GA3、GA4、MeJA 的含量均低于小孢子叶球中的含量。

图3 大、小孢子叶球内源激素的含量分析Fig.3 Analysis of endogenous hormones in ovulate strobilus and microstrobilus
通过比较保康红豆杉和南方红豆杉大孢子叶球间、小孢子叶球间的内源激素含量发现:
保康红豆杉大孢子叶球中CTK、IAA 和MeJA 的含量均高于南方红豆杉大孢子叶球中的含量,ABA、GA3、GA4和BR 的含量均低于南方红豆杉大孢子叶球中的含量;保康红豆杉小孢子叶球中CTK、ABA、MeJA 和BR 的含量均高于南方红豆杉小孢子叶球中的含量,IAA、GA3和GA4的含量均低于南方红豆杉小孢子叶球中的含量。
综上分析可知,保康红豆杉和南方红豆杉大孢子叶球中的ABA 和BR 含量均显著高于小孢子叶球,GA4 含量显著低于小孢子叶球中的含量,CTK、IAA、GA3和MeJA 在保康红豆杉大孢子叶球中的含量均高于小孢子叶球,而在南方红豆杉大孢子叶球中的含量均低于小孢子叶球的含量。CTK 和MeJA 在保康红豆杉大、小孢子叶球中的含量均高于南方红豆杉大、小孢子叶球,GA3和GA4的含量均低于南方红豆杉大、小孢子叶球。IAA 在保康红豆杉大孢子叶球中的含量高于南方红豆杉大孢子叶球,而在保康红豆杉小孢子叶球中的含量低于南方红豆杉小孢子叶球。
2.4 大、小孢子叶球内源激素的相关性分析
由表1 可知,CTK 与IAA 之间为显著正相关(R=0.590*),与MeJA 之间呈极显著正相关(R=0.912**),与GA4呈极显著负相关,相关系数为0.936;IAA 与ABA 之间存在显著负相关(R=-0.655*);ABA 与GA3之间存在显著负相关(R=-0.629*);GA3与GA4之间显著正相关,相关系数为0.705,与MeJA 之间呈显著负相关(R=-0.635*);GA4与MeJA 之间呈极显著负相关,相关系数为0.932。

表1 大、小孢子叶球内源激素的相关性分析†Table 1 Correlation analysis of endogenous hormones in ovulate strobilus and microstrobilus
3 结论与讨论
3.1 保康红豆杉形态学和细胞学研究
保康红豆杉、南方红豆杉的胚珠单生顶端,与红豆杉属其他植物一样,而区别于松柏类植物的胚珠侧生,这个结论与徐刚标等的结论相一致[16]。根据松杉类的胚珠进化趋势,一般认为胚珠直立较其他类植物原始。保康红豆杉和南方红豆杉的大孢子母细胞减数分裂形成四分体的方式与太白红杉Larix chinensis[17]、云南松Pinus yunnanensis和樟子松Pinus sylvestris[18]相同,都是大孢子母细胞通过两次减数分裂形成4 个大孢子,远离珠孔的1 个大孢子发育成功能性大孢子。与欧洲红豆杉不同,保康红豆杉和南方红豆杉都可能形成多个大孢子母细胞,这也验证了费永俊等认为南方红豆杉具孤雌生殖的能力[19],但保康红豆杉的孤雌生殖暂时还未发现。保康红豆杉、南方红豆杉的每个小孢子叶中小孢子囊数目基本一致,约4~9 个,与肖玉菲等的结果相同[25];两者的小孢子母细胞进行减数分裂形成四分体(包括左右对称、四面体、线形),在越冬前进入小孢子游离期,次年春季发育成成熟花粉粒。
保康红豆杉和南方红豆杉的大、小孢子叶球发育正常,同红豆杉属其他植物一样,大孢子叶球的生长发育比小孢子叶球的慢;大孢子母细胞和小孢子母细胞蕴含大量的遗传信息,是性别分化的重要步骤,该时期对研究保康红豆杉雌雄同株变异性状的机理探究具有重要意义。
3.2 内源激素对保康红豆杉性别决定的影响
大量研究证明植物激素参与了植物性别决定过程[20],前人研究表明控制性别表达的基因受IAA、ABA、CTK、GA 和MeJA 等植物激素的影响,现有研究主要集中于雌雄异株植物上[21-22]。ABA参与调控植物花发育的不同时期,王英等[23]研究发现不同发育时期棕榈雌花的ABA 含量一直高于雄花,高水平的ABA 含量更有利于雌花的发育;盛云燕等[24]在研究与甜瓜的性别分化相关的植物激素中发现BR 对黄瓜性别分化具有间接作用;赤霉素在性别分化中被认为是一种雄性激素,可促进部分植物的雄性发育[25],也有研究结果表明,GA 具有促进植物雌花性别分化的作用[26]。本研究中,保康红豆杉和南方红豆杉的大孢子叶球中的ABA 和BR 含量均高于小孢子叶球中的含量,GA4含量显著低于小孢子叶球中的含量,与上述研究结果一致,说明高水平ABA 和BR 含量促进保康红豆杉和南方红豆杉的大孢子叶球的发育,低水平GA4含量促进小孢子叶球发育。
CTK 在植物的性别表达过程中具有促雌的作用,研究发现,对大麻喷施一定浓度的细胞分裂素会出现明显的促雌作用[27];IAA具有雌性效应,如IAA 对仙人掌[28]促雌的影响,莫长明等[29]在测定罗汉果花芽分化过程中IAA 含量时发现在雌花分化过程中IAA 含量出现下降趋势,在雄花芽、两性花芽分化过程中IAA 含量保持稳定,表明IAA可能对罗汉果花性别分化具有重要作用。MeJA 参与植物各种各样的发育过程,可以诱导小麦等作物的颖花开放,有研究表明柿雌花中JA 浓度显著高于雄花,预示着JA 有助于柿雌蕊的发育[30]。在本研究中,CTK、IAA、GA3和MeJA 在保康红豆杉大孢子叶球中的含量均高于小孢子叶球,与上述研究结果一致,说明CTK、IAA、GA3和MeJA 有助于促进保康红豆杉大孢子叶球的发育,而在南方红豆杉中研究结果相反,这可能与物种的差异性有关,后期可以进一步深入研究CTK、IAA、GA3和MeJA 四种激素对保康红豆杉和南方红豆杉性别决定的影响。本实验结果中,CTK 和MeJA 在保康红豆杉大、小孢子叶球中的含量均高于南方红豆杉大、小孢子叶球,GA3和GA4的含量均低于南方红豆杉大、小孢子叶球,IAA 在保康红豆杉大孢子叶球中的含量高于南方红豆杉大孢子叶球,而在保康红豆杉小孢子叶球中的含量低于南方红豆杉小孢子叶球,激素在保康红豆杉和南方红豆杉大、小孢子叶球中的表达差异可能是由于激素转导信号的差异所引起的,具体的调控网络需要进一步深入研究。
本研究从形态学、细胞学和内源激素的角度为保康红豆杉性别分化调控机制提供了新的理论知识,但是这只是单纯从生化的角度来分析保康红豆杉性别分化过程中大小孢子叶球发育的情况,仍然还需要从分子水平深入研究才能够进一步揭示保康红豆杉性别分化的机制。
