Ghrelin对围术期神经认知障碍小鼠术后海马氧化应激及炎性反应的影响
2023-01-11展巧稚阎文军
展巧稚, 阎文军
作者单位:750004 银川,宁夏医科大学临床医学院(展巧稚);730000 兰州,甘肃省人民医院麻醉科(阎文军)
目前,随着人口老龄化的进展,接受麻醉和手术的老年人数大幅增加。围手术期神经认知障碍(perioperative neurocognitive disorder,PND)是手术和麻醉过程中常发生的中枢神经系统并发症,包括术前已经存在的认知功能障碍、术后1周内出现的术后谵妄以及术后30 d内存在的认知功能减退[1],可表现为认知能力、记忆力、语言及社交能力的损伤。PND的发生率随着年龄的增长而显著增加,尤其是在>65岁的患者中,非心脏手术后3个月的PND发生率达12%~21%,是年轻患者的2~10倍[2]。而>75岁患者的PND发病率更是65~75岁患者的3倍[3]。PND可导致患者生活质量下降,并会造成其他生理和心理疾病,给社会和家庭带来负担。Ghrelin是由28个氨基酸组成的多肽,主要由胃黏膜分泌,是调节垂体生长激素分泌的内源性激素,具有增进食欲和促进胃酸分泌、胃蠕动等功能。Ghrelin广泛分布于中枢神经系统,与海马空间学习记忆能力密切相关[4]。有研究显示,Ghrelin可以抑制神经炎症反应,减少氧化应激的损害,从而发挥器官保护作用[4-5]。但Ghrelin对手术造成的学习记忆障碍是否有保护作用尚鲜见相关研究报道。鉴此,本研究通过观察Ghrelin预处理对PND的保护作用,探讨其对PND老龄小鼠氧化应激、神经炎症反应的影响,为PND发病机制的研究提供参考。
1 材料与方法
1.1实验动物 SPF级健康雄性C57BL/6J小鼠,购自斯贝福北京生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010。体质量35~45 g,14月龄,分笼饲养,每笼4只。在甘肃中医药大学实验动物中心饲养至16月龄后开始进行实验。饲养环境:湿度40%~60%,恒温20 ℃。
1.2实验试剂 Ghrelin购自美国Sigma公司;丙二醛(malondialdehyde,MDA)、总超氧化物气化酶(total superoxide dismutase,T-SOD)检测试剂盒购自南京建成公司;环氧合酶-2(cyclooxygenase-2,COX-2)、高迁移族率蛋白B1(high-mobility group box-1,HMGB1)检测试剂盒购自武汉云克隆公司。
1.3实验方法 实验前连续5 d对小鼠进行水迷宫定位航行训练,检测小鼠学习能力。这一方面可以训练小鼠对隐藏在水下平台的位置形成记忆,另一方面可据此剔除在规定时间内找不到隐藏在水下平台的小鼠。Ghrelin溶于双蒸水(1 mg/ml),使用之前用0.9%生理盐水再次稀释至0.05 mg/ml。将经挑选合格的小鼠随机分为Sham组、PND组、PND+Vehicle组和PND+Ghrelin组,每组12只。干预方法:(1)Sham组小鼠予腹腔注射5%水合氯醛麻醉,充分消毒,切开小腿胫骨侧皮肤后缝合,不做任何手术和治疗措施,术毕,创面应用利多卡因胶浆镇痛。(2)PND组小鼠予腹腔注射5%水合氯醛麻醉,充分消毒,行胫骨骨折髓内固定术,术毕予利多卡因胶浆进行术后镇痛,不行任何治疗。(3)PND+Ghrelin组小鼠行胫骨骨折髓内固定术,操作方式同PND组。麻醉前2 h和苏醒后予腹腔注射Ghrelin 80 μg/kg,1次/d,连续7 d。(4)PND+Vehicle组小鼠在麻醉前2 h和苏醒后予腹腔注射0.9%生理盐水(1.6 ml/kg)作为安慰剂进行对照,1次/d,连续7 d,其余干预措施同PND+Ghrelin组。若实验过程中有动物死亡,随即增补相应的只数到各组,直至满足各组小鼠数达12只。
1.4PND模型制备 参照相关文献[6]对小鼠进行胫骨骨折髓内固定术。具体操作为:小鼠术前8 h禁食禁水,予5%水合氯醛(0.5 ml/100 g)进行麻醉,待小鼠翻正反射消失后进行手术。小鼠取仰卧位,备皮,使用碘伏棉签对手术部位以及周围1 cm处的皮肤进行消毒。于右侧后肢膝下胫骨侧切开皮肤约0.5 cm,逐层分离皮下组织暴露胫骨,取0.3 mm的钢针插入胫骨髓腔中,待充分固定后用眼科剪于胫骨中下1/3处横形部分断裂(不完全骨折),清创后缝合伤口,手术切口周围予0.2%利多卡因胶浆局部浸润镇痛。术中室温维持在24~26 ℃,维持直肠温度36.5~37.5 ℃。待小鼠苏醒后继续放回笼内饲养。
1.5水迷宫实验 水迷宫是测试依赖于海马的空间学习和记忆能力的常用方法,主要由定位航行实验和空间探索实验两部分组成。定位航行实验需连续训练5 d,小鼠在第1次游泳时,因没有探索的记忆,一般不会找到水下隐藏的平台,但随着训练次数的增加会形成固定的记忆,小鼠可在很短的时间内到达平台的位置。开始实验时,事先将小鼠放置在平台上停留30 s,让其熟悉周围环境后,将小鼠头朝池壁放入水中,记录小鼠找到水下隐藏平台的时间,如果超过60 s,则引导动物至平台并停留30 s,四个象限依次重复,每天训练4次,连续训练6 d,剔除在规定时间内找不到水下隐藏平台的小鼠。在行胫骨骨折髓内固定术后第7天进行空间探索实验,撤除水下的平台,在经过连续5 d的训练后,小鼠已形成固定的记忆,当撤除水下隐藏的平台,小鼠会凭已经形成的记忆探索原来的平台,在平台所在位置的停留时间会比其他任何位置久。将小鼠由原始平台所在位置的对侧象限头朝下放入水中,开始实验,记录、分析小鼠逃避潜伏期(入水后第1次成功找到平台所需要的时间)、逃逸平台进入次数、目标象限停留时间百分比,作为空间记忆的检测指标。
1.6氧化应激及炎症指标检测方法 术后第7天空间探索实验结束,采用5%水合氯醛麻醉小鼠,经心脏采血后翻正小鼠立即断头取脑,在冰上迅速分离左右两侧海马组织,分别置于两个2 ml冻存管中,-80 ℃保存。一侧海马组织用于COX-2、HMGB1蛋白检测,另一侧用于MDA、SOD蛋白检测。将经心脏采得血液置于1.5 ml离心管中,静置后离心(3 000 r/min,10 min),留取上清液,-80 ℃保存,用于COX-2、HMGB1的检测。
1.6.1 血清COX-2、HMGB1水平检测 采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清中COX-2、HMGB1浓度,具体步骤方法严格按照试剂盒说明书进行。
1.6.2 海马组织中MDA、T-SOD、COX-2、HMGB1水平检测 从-80 ℃冰箱中取所需的海马组织,按质量体积比1∶10加入预冷的裂解液,通过匀浆器充分研磨海马组织,离心后提取上清液,采用BCA法检测蛋白浓度。通过ELISA检测海马组织中MDA、T-SOD表达水平。通过Western blot实验检测海马组织中COX-2、HMGB1的表达水平。加入相应体积的蛋白上样缓冲液,100 ℃水浴5 min。通过凝胶电泳后采用湿转膜法转膜,以5%脱脂奶粉封闭处理2 h,4 ℃条件下予一抗[anti-HMGB1(1∶4 000)、anti-COX-2(1∶2 000)、anti-GAPDH(1∶4 000)]孵育过夜。次日,将膜置于TBST液中清洗3次,8 min/次,以辣根过氧化物酶标记的二抗(1∶2 000)在室温下孵育1 h,TBST液清洗3次,8 min/次,超敏ECL化学发光液(BeyoECL Plus)显影;采用Bio Rad化学发光凝胶成像仪(C500 Western blot,美国Azure)进行扫描,应用Image J软件对蛋白条带进行定量分析。

2 结果
2.1四组小鼠空间探索实验结果比较 与Sham组比较,PND组、PND+Vehicle组和PND+Ghrelin组的逃避潜伏期更长,60 s内逃逸平台进入次数、目标象限停留时间占比降低,差异有统计学意义(P<0.05)。与PND组比较,PND+Ghrelin组的逃避潜伏期显著缩短,60 s内逃逸平台进入次数、目标象限停留时间占比升高,差异有统计学意义(P<0.05)。见表1。
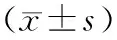
表1 四组小鼠空间探索实验结果比较
2.2四组小鼠血清COX-2和HMGB1水平比较 与Sham组比较,PND组、PND+Vehicle组、PND+Ghrelin组血清COX-2、HMGB1水平升高,差异有统计学意义(P<0.05)。与PND组相比,PND+Ghrelin组血清COX-2、HMGB1水平降低,差异有统计学意义(P<0.05)。见表2。
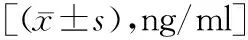
表2 四组小鼠血清COX-2、HMGB1水平比较
2.3四组小鼠海马组织的MDA、T-SOD水平比较 与Sham组比较,PND组、PND+Vehicle组、PND+Ghrelin组海马组织的MDA水平升高、T-SOD水平降低,差异有统计学意义(P<0.05)。与PND组比较,PND+Ghrelin组海马组织的MDA水平降低、T-SOD水平升高,差异有统计学意义(P<0.05)。见表3。
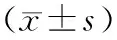
表3 四组小鼠海马组织的MDA、T-SOD水平比较
2.4四组小鼠海马组织的HMGB1、COX-2表达水平比较 与Sham组比较,PND组、PND+Vehicle组、PND+Ghrelin组海马组织的HMGB1、COX-2表达水平均升高,差异有统计学意义(P<0.05)。与PND组比较,PND+Ghrelin组海马组织的HMGB1、COX-2表达水平降低,差异有统计学意义(P<0.05)。见图1~2。
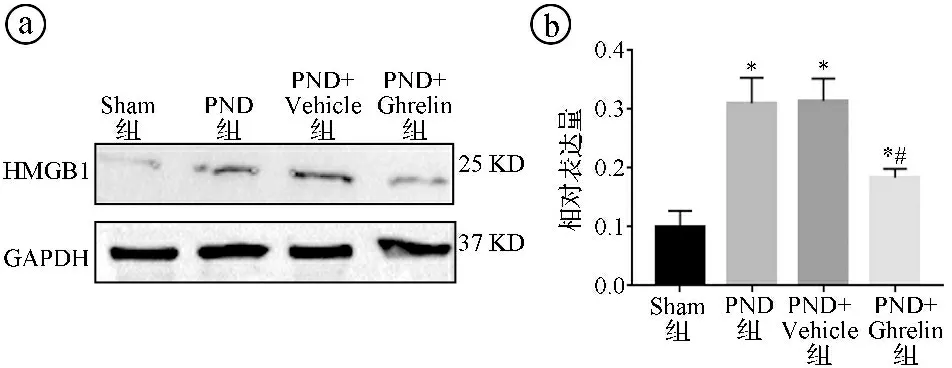
ⓐWestern blot实验结果图;ⓑ四组海马组织HMGB1相对表达量柱形图,与Sham组比较,*P<0.05;与PND组比较,#P<0.05图1 四组小鼠海马组织HMGB1表达水平比较图
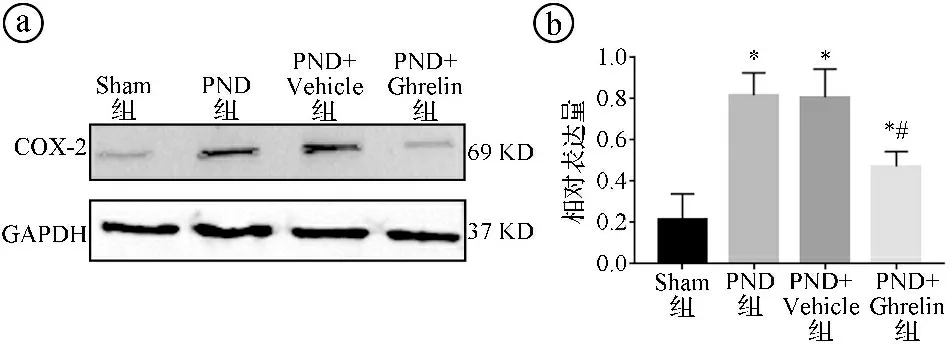
ⓐWestern blot实验结果图;ⓑ四组海马组织COX-2相对表达量柱形图,与Sham组比较,*P<0.05;与PND组比较,#P<0.05图2 四组小鼠海马组织COX-2表达水平比较图
3 讨论
3.1本研究探讨了Ghrelin在改善手术麻醉引起的老龄小鼠认知功能障碍、海马组织氧化应激反应以及中枢系统神经炎症和全身外周炎症反应中的神经保护作用和潜在机制,通过水迷宫行为学实验来检测老龄小鼠的学习和记忆能力。结果表明,PND组老龄小鼠逃避潜伏期显著延长,目标象限停留时间占比、逃逸平台进入次数显著减少,说明胫骨骨折髓内固定术可诱导PND。本课题组的前期研究也证实了胫骨骨折髓内固定术模型能稳定诱导PND发生[7]。与PND组相比,PND+Ghrelin组老龄小鼠逃避潜伏期显著缩短,目标象限停留时间占比、逃逸平台进入次数显著升高,说明给予Ghrelin处理可使PND老龄小鼠学习记忆能力得到改善。
3.2为进一步分析Ghrelin保护PND老龄小鼠学习、记忆的可能机制,本课题组分析了Ghrelin处理对海马组织的影响。有研究表明,手术及其愈合过程中机体会发生氧化应激[8],氧自由基通过对细胞中脂质的过度氧化引起细胞内酶活性改变、蛋白质变性、细胞膜结构、功能破坏等,最终导致细胞变性或坏死,这是神经系统变性疾病的主要发病机制[9]。本实验中,PND组小鼠术后海马组织的MDA水平升高,T-SOD水平降低,而经Ghrelin处理后,小鼠海马组织的MDA和T-SOD的水平变化得到恢复和改善,提示Ghrelin处理可抑制PND老龄小鼠术后海马组织的氧化应激反应。
3.3目前的研究认为,手术应激导致的高浓度炎症因子可能会干扰海马的正常功能,导致海马神经元的神经毒性,最终受损的海马神经元导致认知功能障碍[10]。HMGB1是一种核蛋白,在稳定核小体结构和调节基因转录方面起着重要的作用。当机体遭受创伤时HMGB1赖氨酸残基乙酰化改变,损伤或坏死的细胞释放大量乙酰化HMGB1到细胞外,能够通过活化和转运骨髓来源的巨噬细胞,与细胞表面晚期糖基化终末产物受体(receptor of advanced glycation end products,RAGE)高亲和力结合,介导外周和中枢的炎症反应[11]。细胞外HMGB1被认为是手术应激反应的关键炎症介质[12],炎症因子可以破坏血脑屏障的完整性,通过调节趋化因子单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)在海马体中的表达,使骨髓产生的单核细胞转移到海马体中,发生中枢神经系统炎症反应,破坏神经元,最终导致脑损伤并出现认知障碍[13-14]。
3.4环氧合酶包含三个亚型,即COX-1、COX-2和COX-3。在正常生理条件下,COX-2很少在中枢神经系统中表达。然而,外部刺激可诱导海马组织中COX-2表达上调。有研究显示,COX-2过表达发生在与中枢炎症反应相关的神经退行性疾病中[15-16]。在哺乳动物脑组织中,COX-2主要分布在海马神经元中,参与基本的脑功能,包括神经递质释放,以及学习和记忆能力调节。COX-2是炎症相关疾病的重要调节因子之一,在创伤后触发炎症级联反应[17-19]。因此,HMGB1、COX-2是常见的促炎因子,在PND的发病中起着重要作用。本研究结果显示,PND组小鼠海马和血清中COX-2和HMGB1的表达升高,而Ghrelin处理可下调PND小鼠海马组织和外周血清中COX-2和HMGB1的蛋白表达,提示Ghrelin可通过调节炎症因子COX-2和HMGB1的表达从而发挥神经保护作用。
综上所述,Ghrelin可以改善胫骨骨折手术引起的PND小鼠的学习记忆能力,其作用可能与Ghrelin抑制中枢神经炎症、氧化产物过度生成有关。本研究结果提示Ghrelin可能会成为治疗PND老龄小鼠学习记忆障碍的一种有效药物,但结论仍需进一步验证。
