着丝粒蛋白L表达与肝移植术后肝细胞癌复发的关联性研究
2023-01-11陈丰穗张志强赖彦华吴志贤周丽丽
方 坚, 阮 梅, 夏 磊, 黄 倩, 陈丰穗, 张志强, 张 霞, 赖彦华, 李 懿, 吴志贤, 周丽丽
肝移植术是部分肝癌患者及终末期肝病患者最佳治疗选择之一,我国每年肝移植数量达5 000余例[1]。得益于免疫抑制治疗药物的进步等原因,患者肝移植术后的生存期显著提升[2]。2015—2020年我国大陆公民逝世后器官捐献肝移植受者术后1年、3年的累计生存率分别为83.6%、74.9%[3]。移植术后肝癌复发是影响患者生存的主要原因之一[4]。我国大陆移植患者中,肝癌受者比例为36.8%[5],而20%~57%的患者在术后出现复发[5-6],中位生存期通常不足1年[2,7]。因此,寻找可靠的指标评估肝癌患者移植术后复发的风险因素具有重要的价值。着丝粒蛋白L(centromere protein L,CENPL)是着丝粒蛋白家族的成员。着丝粒蛋白可结合纺锤体微管,细胞分裂时调控染色体分离[8]。CENPL的突变会影响着丝粒相关网络蛋白的相互作用,从而阻碍着丝粒组装和染色体排列[9]。本研究团队的前期研究发现,CENPL可能在肝癌的发生、发展中发挥重要作用[10]。然而,目前鲜有文献报道CENPL在移植术后肝癌复发中的作用。鉴此,本研究旨在探讨肝移植术后肝癌复发患者CENPL表达情况及其与临床病理参数和复发的关联性。
1 对象与方法
1.1研究对象 选择2014年1月至2020年6月在福建中医药大学附属第三人民医院、联勤保障部队第九〇〇医院和广西壮族自治区人民医院行肝移植术并在术后发生肝细胞癌复发的患者93例(复发组)。经性别与年龄匹配,选择同期行肝移植手术但术后未复发的肝细胞癌患者46例(未复发组)。
1.2纳入与排除标准 纳入标准:(1)肝移植术前经病理检查明确诊断为肝细胞癌;(2)年龄>18岁;(3)病历资料及随访资料完整。排除标准:(1)有其他器官移植史者;(2)合并胆管细胞癌,或其他恶性肿瘤者;(3)随访依从性不佳者。
1.3肝移植方法 供体符合我国脑死亡捐赠规范[11],手术方法均为原位肝移植。所有患者签署知情同意书。肝癌肝移植的米兰标准[12]:单个肿瘤直径≤5 cm,或肿瘤数目≤3个,每个直径≤3 cm,并且无大血管侵犯和远处转移。肝癌肝移植的杭州标准[11]:(1)无大血管侵犯和肝外转移;(2)肿瘤直径之和小于或等于8 cm,或肿瘤直径之和大于8 cm,但满足术前甲胎蛋白(alpha-fetoprotein,AFP)≤400 μg/L,且组织学分级为高、中分化。
1.4资料收集 通过医院电子病历系统收集患者肝移植前的临床资料,包括年龄、性别、乙型肝炎病毒(hepatitis B virus,HBV)感染、丙型肝炎病毒(hepatitis C virus,HCV)感染、肝硬化、Child-Pugh分级、白细胞(white blood cell,WBC)、血小板(platelet,PLT)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBil)、血细胞计数、肿瘤大小、肿瘤包膜、中国肝癌分期(China Liver Cancer Staging,CNLC)、AFP、免疫抑制剂方案、肿瘤复发时间、随访时间等。
1.5随访方法 随访间隔为1~3个月:对于术后早期指标不稳定的患者随访间隔为1个月;对于半年后状态稳定患者,随访间隔可延长至3个月。随访内容包括生化检查和影像学检查。化验检查内容包括肝肾功能、电解质、血脂、AFP水平及常见肿瘤指标、血细胞分析、凝血功能、乙肝病毒DNA和乙肝五项,以及他克莫司、西罗莫司血药浓度。影像学检查包括腹部彩超、腹部或胸部CT或腹部MR。观察患者肝癌复发情况,原发性肝癌复发诊断主要依据增强腹部和胸部CT或MR,并结合AFP水平,影像学报告均由有经验的高年资影像学专科医师出具。
1.6免疫组织化学染色 标本来源于患者移植术前自身的病肝组织。常规二甲苯、酒精脱水。抗原修复:煮沸(95 ℃,15~20 min),自然冷却20 min以上,再用冷水冲洗罐子,加快冷却至室温,磷酸盐缓冲溶液(phosphate buffered solution,PBS)(pH 7.2)冲洗5 min,重复冲洗3次。阻断灭活内源性过氧化物酶:3% H2O2室温下孵育10 min,PBS(pH 7.2)冲洗5 min,重复冲洗3次。稀释一抗,滴加50 μl稀释好的一抗(用PBS缓冲液代替一抗作阴性对照),37 ℃孵育60 min,PBS冲洗5 min,重复冲洗3次。擦干后滴加30 μl聚合物增强剂(二抗试剂A)室温25 ℃孵育20 min,PBS冲洗5 min,重复冲洗3次。加生物素化抗兔二抗室温下孵育30 min,PBS冲洗5 min,重复冲洗3次。滴加100 μl新鲜配制的二氨基联苯胺(diaminobenzidine,DAB)显色液,显微镜下观察5~20 min。自来水冲洗后,苏木素复染,PBS液返蓝。常规95%酒精脱水,干燥,封片。对染色程度进行半定量评分。评分标准[13]:切片在400倍显微镜下,随机选取5个视野,每个视野计数200个细胞,根据染色细胞所占百分率评分。无明显细胞着色为0分,1%~10%着色为1分,10%<着色≤30%为2分,>30%着色为3分。再根据染色强度评分:未显色或显色不清为0分,浅黄色为1分,棕黄色为2分,深褐色为3分。每张切片最终得分为染色百分率和染色强度平均分数的乘积,得分≥3分者为高表达,得分<3分者为低表达[13]。免疫组化的一抗购自福州中杉金桥,二抗购自Abcam公司。

2 结果
2.1肝癌组织和癌旁组织免疫组织化学染色结果 光镜下可见癌组织CENPL染色呈阳性,主要表达在细胞核部位,少量在细胞质表达。癌旁组织未见CENPL染色。见图1。
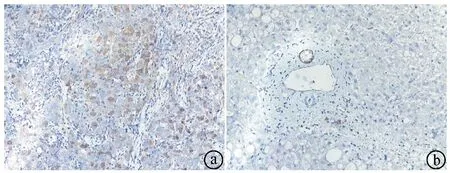
ⓐ肝癌组织CENPL高表达;ⓑ癌旁组织CENPL表达不明显图1 肝癌组织和癌旁组织免疫组织化学染色所见(×200)
2.2两组临床资料比较 复发组CNLC为Ⅱ期、CENPL高表达的人数比例大于未复发组,差异有统计学意义(P<0.05)。其余指标比较差异无统计学意义(P>0.05)。见表1。
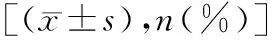
表1 两组临床资料比较
2.3肝移植后肝癌复发的影响因素分析结果 以复发情况为因变量,将表1中有统计学意义的指标(CNLC、CENPL表达情况)作为自变量纳入多因素Cox回归模型。结果显示,以CNLC Ⅱ期为参照,CNLC Ⅰ期是肝移植后肝癌复发的抑制因素[HR(95%CI)=0.46(0.13~0.91),P=0.013];以CENPL低表达为参照,CENPL高表达是肝移植后肝癌复发的促进因素[HR(95%CI)=1.68(1.41~2.99),P=0.003]。
2.4肝癌复发患者CENPL高表达组与低表达组的生存预后比较 CENPL高表达组的中位无复发生存期(recurrence-free survival,RFS)为5(3~22)个月,低表达组中位RFS为8(5~26)个月,两组差异有统计学意义(log-rank检验:χ2=9.269,P=0.002)。CENPL高表达组中位总生存期(overall survival,OS)为14(8~40)个月,低表达组中位OS为22(9~37)个月,两组差异有统计学意义(log-rank检验:χ2=4.406,P=0.031)。见图2。
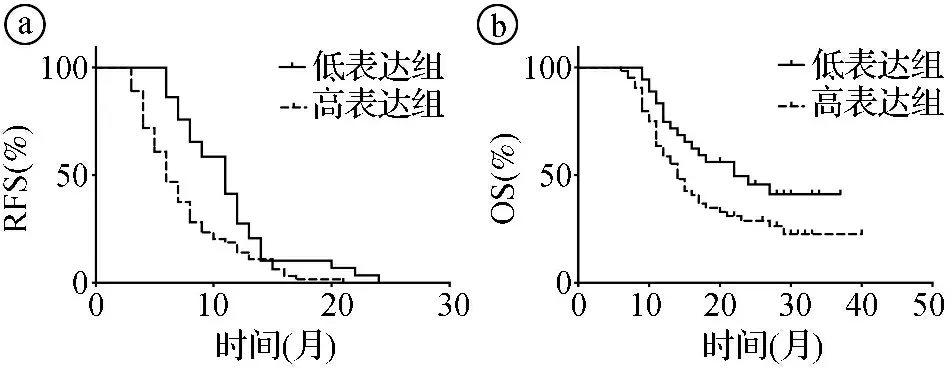
ⓐ两组RFS比较;ⓑ两组OS比较图2 肝癌复发患者CENPL高表达组与低表达组生存预后情况的Kaplan-Meier生存曲线比较图
2.5肝癌复发患者CENPL高表达组与低表达组临床资料比较 两组年龄、性别、HBV感染、HCV感染、肝功能、肝硬化、肿瘤包膜、大血管侵犯、远处转移等情况比较差异无统计学意义(P>0.05)。见表2。
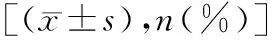
表2 肝癌复发患者CENPL高表达组与低表达组临床资料比较
3 讨论
3.1肝细胞癌复发导致患者在肝移植后的生存率下降。研究表明,肝移植后肝细胞癌复发的原因可能包括[14-17]:(1)移植前癌细胞已发生微转移;(2)手术操作导致肿瘤破裂,从而引起肿瘤转移;(3)免疫抑制剂的使用促进了肿瘤细胞的增殖和侵袭。也有研究表明,肿瘤细胞及肿瘤微环境表达的多种生物分子在肿瘤的复发中发挥了重要作用[18]。术前检测这些分子标志物,术后定量检测分泌性标志物的相应抗体,可预测肝移植后肿瘤复发。但目前尚未有公认和广泛应用的标志物,因此进一步寻找具有应用价值的标志物具有重要的临床意义。
3.2CENPL是着丝粒蛋白H-着丝粒蛋白I(centromere protein H-centromere protein I,CENPH-CENPI)相关的着丝粒复合体的一个亚基,是正常着丝粒功能和有丝分裂过程不可缺少的蛋白[19]。已经发现与CENPL相关的疾病包括染色体22Q11.2缺失综合征、染色体17p13.3重复综合征。目前关于CENPL在肿瘤中的研究报道较少。有文献报道CENPL mRNA在肝细胞癌中过表达,其水平与患者的临床病理参数密切相关[10]。CENPL mRNA高表达者的生存预后情况较差。在没有肝炎病毒感染的白种人和黄种人男性肝癌患者中,更高水平的CENPL mRNA与较差的OS相关。通过整合多个数据库,Zeng等[20]研究发现,CENPL在多种癌症类型中都呈高表达,且与不良临床病理学特征显著相关;基因集富集分析(gene set enrichment analysis,GSEA)结果发现CENPL可能通过细胞周期、DNA复制、p53信号通路和卵母细胞减数分裂等途径参与肝细胞癌的发生和进展。此外,有研究发现CENPL的表达与多种免疫细胞标志物呈正相关,其中与M1巨噬细胞标志物干扰素调节因子5(interferon regulatory factors,IRF5)、Treg细胞标志物趋化因子受体8(chemokine receptor 8,CCR8)以及信号转导和转录激活因子5B(signal transduction and activator of transcription 5B,STAT5B)的相关性最高。CENPL与T细胞衰竭标志物也存在正相关,包括程序性死亡受体1(programmed death 1,PD-1)、细胞毒T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA4)、淋巴细胞活化基因-3(lymphocyte activation gene-3,LAG3)、胸腺细胞选择相关高迁移率群盒蛋白(thymocyte selection-related high mobility group box protein,TOX)、T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoglobulin and ITIM domain protein,TIGIT)、重组人颗粒酶-B(recombinant human granzyme-B,GZMB)和T细胞免疫球蛋白黏蛋白-3(T cell immunoglobulin and mucin domain-containing protein-3,Tim-3),特别是与Tim-3的相关性最高[21]。本研究免疫组化结果也显示CENPL在肝细胞癌组织中呈高表达,这与Feng等[22]的研究结果相似。也有研究发现在肝细胞癌患者中,CENPL的表达水平与B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞等免疫指标呈正相关[23-24]。这解释了CENPL高表达预测不良预后的结果,也为新的免疫治疗方法提供了参考。
3.3目前关于CENPL在肝移植术后肝癌复发中的机制尚不明确。本研究结果显示,复发组的CENPL表达水平显著高于未复发组。进一步分析发现,在肝癌复发患者中,CENPL高表达组的RFS、OS较低表达组更差,提示CENPL与肝移植术后肝细胞癌复发有关联。另外,高表达CENPL组发生血管侵犯和远处转移的人数比例较低表达组更高,但结果未显示出统计学意义,这可能与本研究病例数不足有关。近年来有一些研究者尝试研究肝移植术后肝细胞癌复发的预测标志物。王超[25]研究了供肝移植物单碳代谢基因多态性与肝移植后肝细胞癌复发风险之间的关系,结果发现单碳代谢基因多态性在肝移植后肝细胞癌复发中具有重要作用,供体的rs1801394和rs1127717多态性可作为肝移植受者肝细胞癌复发的生物标志物。有学者认为肿瘤内肥大细胞(mast cells within the tumor,iMC)可能参与肝癌的抗肿瘤免疫作用[26],其可预测移植后肿瘤复发。值得注意的是,对于超出了米兰标准的患者,iMC可以识别低风险患者;而在低AFP患者中,iMC可以识别高危患者。
综上所述,CENPL表达与肝移植术后肝细胞癌复发具有关联性,高水平CENPL与患者不良预后有关。但本研究为回顾性研究,且样本量较小,所得结论有待进一步验证。另外,CENPL为非分泌性蛋白,难以在血清中便捷检测,故其在临床中的应用价值也有待开发,相关具体机制值得深入探索。
