miR-27a下调表达对大鼠心肌缺血再灌注后急性肺损伤的保护作用及机制研究
2023-01-11古文玉徐桂萍王晓丽
古文玉, 徐桂萍, 陈 哲, 王晓丽
心肌缺血再灌注(myocardial ischemia-reperfusion,MI/R)损伤是一种常见的临床病理生理现象,是由于患者心肌长期缺血再恢复血液灌注后出现的严重心肌组织损伤和功能障碍[1]。虽然缺血再灌注发生在心脏,但除心脏外,对远隔器官也可产生结构和功能的损伤,其中肺最易受累,早期即可表现出临床症状[2]。MicroRNA(miRNA)是一种长度约为18~23个核苷酸的内源性非编码微小RNA,在基因转录后调控中起关键作用[3]。既往研究表明miR-27a在肺损伤中起保护作用,例如,miR-27a通过调节Toll样受体4/髓样分化因子88/核因子-κB通路减少炎症反应和细胞凋亡,实现对脂多糖诱导急性肺损伤(acute lung injury,ALI)的保护作用[4]。研究表明七氟醚可能通过上调miR-27a的表达,抑制促炎因子释放从而改善脂多糖诱导的ALI[5]。然而,对于MI/R所致ALI,目前还没有特异性的治疗方法,尚少有miR-27a对大鼠MI/R所致ALI的研究,miR-27a是否能通过抑制炎症反应来保护MI/R所致ALI尚不清楚。本研究在MI/R肺损伤造模前对大鼠予尾静脉注射抑制剂以下调miR-27a的表达,观察大鼠肺损伤程度,明确下调miR-27a表达是否有肺保护作用,测量氧化应激指标和炎症因子,以探讨其相关作用机制。现报道如下。
1 材料与方法
1.1实验动物及分组 选择清洁级8~12周龄成年雄性SD大鼠40只,体重250~300 g。饲养环境昼夜节律正常(12 h光/暗循环),相对湿度(55±15)%,温度(25±2)℃。将40只大鼠随机分为假手术组(SP组)、模型组(I/R组)、miR-27a抑制剂组(anta-27a+I/R组)、miR-27a抑制剂空白对照组(NC+I/R组),每组10只。本研究获新疆医科大学动物实验伦理委员会批准(IA-CUC20170420-02)。
1.2试剂与仪器 监护仪(美国迈瑞公司);手术显微镜(德国Zeiss公司);antagomir-27a、antagomir-NC(上海吉玛制药技术有限公司);苏木素(美国Sigma公司);伊红Y(中国医药集团有限公司)。白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自武汉Elabscience公司。
1.3大鼠MI/R所致ALI模型构建[6]大鼠禁食12 h后称体重并进行标记。腹腔注射1%戊巴比妥钠(50 mg/kg)进行麻醉,固定大鼠,连接监护仪。行T字形气管切开,置入导管,连接呼吸机行辅助呼吸,调整呼吸机参数:潮气量为4~5 ml/100 g,频率为60次/min,呼吸比为2∶1。在左侧第3~4肋间纵行切开,暴露心脏,显微镜观察下寻找左冠状静脉主干,可见冠状动脉的左前降支(left anterior descending,LAD)与之伴行,用6.0血管线于LAD起始部约4 mm处结扎,阻断血流30 min,结扎时放置1根中间剪有一缺口的塑料软管。结扎成功标准:肉眼可见心脏室壁运动减弱,左室前壁颜色变苍白,心电图表现为ST段抬高幅度>0.25 mV。阻断血流30 min后,于塑料软管缺口处,用眼科剪剪断血管线开放血流,开放后缝合胸腔再灌注120 min。再灌注成功标准:缺血区颜色逐渐苍白转红润,ST段抬高幅度逐渐下降至约50%则提示再灌注成功。SP组同样处理,但不进行血管结扎。anta-27a+I/R组与NC+I/R组手术前连续3 d分别予尾静脉注射antagomir-27a、antagomir-NC 10 mg/kg,第4天行模型构建。NC组尾静脉注射等容量生理盐水。
1.4大鼠血清IL-6和TNF-α检测 在再灌注120 min时,每组随机取大鼠5只,采腹主动脉血3 ml,4 ℃下3 500 r/min离心15 min,取上清液,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法严格按照试剂盒说明书步骤检测血清IL-6和TNF-α水平。
1.5大鼠肺组织湿干重比(wet/dry weight ratio,W/D)测定 在再灌注120 min时,取上述大鼠(方法1.4)右肺组织,生理盐水冲洗,滤纸吸干水分,称湿重。将右肺置于60 ℃烘箱中恒温干燥48 h,称干重,W/D=湿重/干重。
1.6大鼠肺组织MDA、SOD水平检测 在再灌注120 min时,每组取另5只大鼠,麻醉后取新鲜右肺部分组织块,用2~8 ℃的磷酸缓冲盐溶液(phosphate buffered saline,PBS)(0.01 M,pH 7.4)漂洗,滤纸吸干,称重,放于匀浆容器中进行匀浆,取上清置于冰上待测。采用比色法严格按照试剂盒的操作步骤检测肺组织MDA、SOD水平。
1.7HE染色 在再灌注120 min时,取上述(方法1.6)大鼠的左肺上叶组织,置于中性甲醛中固定,脱水,石蜡包埋切片后行HE染色,光镜下观察肺组织病理改变。
1.8大鼠肺组织IL-6和TNF-α水平检测 在再灌注120 min时,取上述(方法1.6)大鼠左肺下叶组织,匀浆后离心,取上清液。采用ELISA法严格按照试剂盒说明书步骤检测肺组织中IL-6和TNF-α水平。

2 结果
2.1四组大鼠肺组织病理学情况 光镜下,SP组结构清晰完整,无充血、出血、炎性细胞浸润及肺泡间隔增厚。I/R组与NC+I/R组结构破坏严重,细胞排列紊乱,肺泡腔内大量炎性细胞浸润,有明显的肺泡充血、出血、肺泡间隔增厚,间质渗出严重,可见大量中性粒细胞等炎性细胞浸润。与I/R组和NC+I/R组比较,anta-27a+I/R组肺组织病理损伤程度明显减轻,肺泡及肺间质仅少量炎性细胞浸润。见图1。
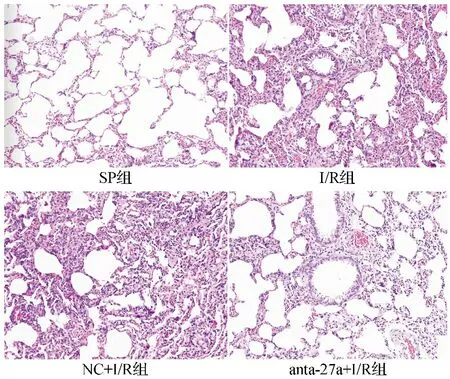
图1 四组大鼠肺组织光镜下所见(HE染色,×200)
2.2四组肺组织W/D值比较 四组肺组织W/D值比较差异有统计学意义(F=346.089,P<0.001)。与SP组比较,I/R组、anta-27a+I/R组、NC+I/R组肺组织W/D值显著增加(P<0.05)。与I/R组和NC+I/R组比较,anta-27a+I/R组W/D值降低,差异有统计学意义(P<0.05)。NC+I/R组W/D值与I/R组比较差异无统计学意义(P>0.05)。见图2。
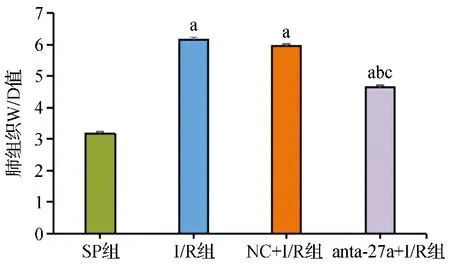
W/D值:SP组(3.18±0.11),I/R组(6.16±0.21),NC+I/R组(5.96±0.18),anta-27a+I/R组(4.65±0.14)。与SP组比较,aP<0.05;与I/R组比较,bP<0.05;与NC+I/R组比较,cP<0.05图2 四组大鼠肺组织W/D值比较图
2.3四组大鼠肺组织氧化应激指标比较 与SP组比较,I/R组、anta-27a+I/R组、NC+I/R组肺组织中MDA水平更高,而SOD水平更低,差异有统计学意义(P<0.05)。与I/R组和NC+I/R组比较,anta-27a+I/R组肺组织MDA水平下降,SOD水平上升,差异有统计学意义(P<0.05)。NC+I/R组与I/R组MDA、SOD水平比较差异无统计学意义(P>0.05)。见表1。
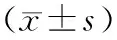
表1 四组大鼠肺组织MDA、SOD水平比较
2.4四组大鼠炎症指标水平比较 与SP组比较,I/R组、anta-27a+I/R组、NC+I/R组肺组织和血清的TNF-α和IL-6更高,差异有统计学意义(P<0.05)。与I/R组和NC+I/R组比较,anta-27a+I/R组肺组织和血清的TNF-α和IL-6水平显著下降(P<0.05)。NC+I/R组与I/R组各指标比较差异均无统计学意义(P>0.05)。见表2。
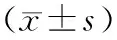
表2 四组大鼠肺组织与血清TNF-α、IL-6水平比较
3 讨论
3.1MI/R损伤是临床上常见的病理现象,主要发生在心脏手术和心肌梗死后再灌注治疗期间,再灌注造成心肌损伤的同时激活机体发生炎性反应并释放大量炎症介质和细胞因子,炎症介质经循环系统作用于远隔脏器,导致多种远隔器官的损伤,其中肺脏最易受累[7-9]。炎症反应和氧化应激是ALI的主要发病机制。SOD和炎症因子的异常产生作用于肺毛细血管内皮细胞,破坏其完整性,增加血管通透性,最终导致ALI的发生[10-11]。ALI主要表现为广泛的炎症、弥漫性肺泡损伤、肺水肿[12]。本研究中,与SP组相比,I/R组大鼠再灌注后肺W/D值增高,表明肺血管通透性增加,肺水增加。肺组织病理学结果显示肺泡结构破坏严重,肺泡腔内大量炎性细胞浸润,有明显的肺泡充血、出血、肺泡间隔增厚,间质渗出严重,提示大鼠在MI/R后发生了ALI,造模成功。与SP组比较,I/R组和NC+I/R组血清及肺组织的IL-6和TNF-α水平显著升高,肺组织中MDA水平明显增加,而SOD水平下降,表明大鼠MI/R激活了机体的炎症反应并且导致了肺组织氧化损伤。
3.2miR-27a是一种位于19号染色体的多功能因子,成熟的miR-27a有两种异构体:miR-27a-3p和miR-27a-5p。研究表明miR-27a在炎症因子表达和氧化应激反应的调控方面发挥重要作用[13]。氧化应激和脂质过氧化在心肌再灌注后远隔器官损伤中起重要作用[14]。MDA是脂质过氧化的终产物之一,可以反映脂质过氧化程度;SOD是一种内源性氧自由基清除剂,其水平可以反映机体的抗氧化能力。有研究报道,在小鼠肾脏的MI/R模型中,过表达miR-27a-3p靶向生长因子受体结合蛋白2(growth factor receptor-bound protein 2,Grb2)促进氧化应激,增加MDA水平,降低SOD水平,加重了肾损伤[15]。在暴露于七氟醚的新生小鼠中,下调miR-27a-3p表达可以通过上调过氧化物酶体增殖物激活受体-γ减少炎症反应,并可通过降低氧化应激相关蛋白的表达来减弱七氟醚诱导的海马神经元凋亡[16]。然而,目前尚无研究报道miR-27a对MI/R后肺组织氧化应激反应的影响。本研究结果示,与I/R组和NC+I/R组比较,anta-27a+I/R组大鼠肺组织MDA水平降低,SOD水平增加,W/D值下降,病理结构得到改善;而NC+I/R组与I/R组的氧化应激指标、W/D值及病理学表现并无显著差异。以上结果表明下调miR-27a表达可以减少MI/R后肺组织损伤的脂质过氧化,增强机体抗氧化能力,从而产生肺保护作用。
3.3有研究发现,MI/R后产生的大量炎症介质与细胞因子随血流输送至肺,导致肺损伤,包括TNF-α、IL-6、IL-1和IL-8等[17]。TNF-α是炎症反应中的关键因子,是导致ALI的重要细胞因子之一。IL-6是应激反应中重要的介导物,参与全身免疫反应和炎症级联反应,可激活中性粒细胞,增加创伤后炎症介质的产生,加重组织损伤[18]。既往研究中miR-27a的表达对不同模型炎症反应的影响有着不同的结论。有研究发现下调miR-27a的表达可以降低核因子-κB的磷酸化并抑制其DNA结合活性,下调TNF-α和IL-6的表达水平,最终减轻脓毒症小鼠的肺部炎症[19]。然而,在小鼠肝损伤模型中,antagomir-27a下调miR-27a表达后促进了炎症反应,抑制紫杉醇对肝损伤的保护作用[20]。也有研究发现,在脂多糖诱导的小鼠ALI模型中,miR-27a表达显著下调,agomir-27a上调miR-27a表达可以减少支气管肺泡灌注液中TNF-α、IL-6和IL-1β等炎症细胞因子的产生,降低肺W/D值,改善肺组织病理损伤,减轻脂多糖诱导的小鼠ALI[21]。尽管以往研究证明miR-27a可以减轻脂多糖诱导的ALI,但是关于miR-27a在MI/R导致的ALI中的作用尚未见报道。本研究中,与I/R组和NC+I/R组比较,anta-27a+I/R组血清和肺组织的TNF-α、IL-6水平下降,降低了肺组织W/D值,减轻了肺组织损伤,提示下调miR-27a表达具有抗炎作用,并能够抑制MI/R导致的肺组织炎症反应,实现对肺组织的保护效应。
综上所述,下调miR-27a表达可以通过减轻氧化应激与炎症反应,缓解MI/R后所引起的ALI。
