磷霉素对万古霉素致肾损伤模型大鼠Keap1-Nrf2/ARE通路的影响*
2023-01-10黄晓青黄丽蓓杨斌林子杰梁雪何庆林丘岳
黄晓青,黄丽蓓,杨斌,林子杰,梁雪,何庆林,丘岳
(1.广西医科大学第一附属医院药学部,南宁 530021;2.广西医科大学药学院,南宁 530021;3.广西医科大学第一临床医学院,南宁 530021)
万古霉素是治疗耐药革兰阳性菌,特别是金黄色葡萄球菌感染的一线药物。万古霉素主要经肾消除,给药剂量90%在给药24 h内从尿排出。万古霉素肾损伤(vancomycin-induced kidney injury,VIKI)是限制其临床应用的原因之一,万古霉素的肾毒性在给药后4~8 d即可出现,表现为血清肌酐水平升高、肾小球滤过率降低等,其机制尚未完全清楚[1]。磷霉素作用于细菌细胞壁合成的早期,可破坏细菌外层结构或改变联用药物进入菌体途径,使药物在菌体内易于富集而出现良好的协同作用,可与多种抗菌药物联合使用[2]。万古霉素联合磷霉素对耐甲氧西林金黄色葡萄球菌(MRSA)及其引起的慢性生物被膜感染有协同杀菌作用。磷霉素联合万古霉素为临床治疗MRSA感染特别是万古霉素血药浓度较低部位如颅内感染以及感染性心内膜炎等常用联合方案之一[3-4]。研究报道,磷霉素对万古霉素、氨基糖苷类、顺铂等药物引起的肾功能损伤有保护作用,机制尚未明确[4]。本课题组前期研究发现,磷霉素能有效改善万古霉素所致大鼠肾损伤,其机制可能与抑制大鼠体内的氧化应激反应有关[5]。Kelch样环氧氯丙烷相关蛋白-1(Kelch like epichlorohydrin related protein-1,Keap1)-核因子E2相关因子(nuclear factor E2 related factor,Nrf2)/抗氧化反应元件(antioxidant responsive element,ARE)(Keap1-Nrf2/ARE) 信号通路是机体内最重要的内源性抗氧化信号通路[6],故本研究从Keap1-Nrf2/ARE氧化应激信号通路及下游靶蛋白谷胱甘肽过氧化物酶-1(glutathione peroxidase-1,GPX-1)探讨VIKI及磷霉素保护机制。
1 材料与方法
1.1药品与试剂 注射用盐酸万古霉素(浙江医药新昌制药厂,批号:1161191108);注射用磷霉素钠(东北制药集团沈阳第一制药厂,批号:H2018-3433);总蛋白测定试剂盒(南京建成生物工程研究所,批号:20191022);尿N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)试剂盒(江苏晶美生物科技有限公司,批号:201912);肾损伤因子1(kidney injury molecule 1,KIM-1)试剂盒(Elabscience,批号XQG7W9KIS);RNA提取试剂盒(美国Axygen公司,批号03712KD6);逆转录试剂(Takara公司,批号 RR028A-1);荧光染料SYBR Green (Throme公司,批号 00751233);Nrf2、Keap1、GPX-1及β-Action 引物由上海生工生物工程有限公司合成。
1.2实验动物 成年健康清洁级雄性SD大鼠,60只,体质量180~220 g,由广西医科大学实验动物中心提供,实验动物生产许可证号:SCXK(桂)2019-0035。大鼠饲养于温度为(26±1)℃、相对湿度为85%、清洁级动物实验室内,自由饮水进食,实验前适应性喂养3 d。
1.3仪器 ABI 7500实时荧光定量聚合酶链反应(PCR)仪(美国伯乐生命医学产品有限公司,Bio-Rad CFX Touch);台式高速冷冻离心机(艾本德中国有限公司,5810R);连续光谱扫描式酶标仪(美国Molecular Devices公司,SpectraMaxPlus384);倒置显微镜(日本奥林巴斯公司,CKX-41)。
1.4动物分组与给药 雄性SD大鼠60只,按照随机数字表法分为正常对照组、磷霉素组、模型对照组(万古霉素组)和联合用药小、中、大剂量组(记为联合-L组、联合-M组、联合-H组 ),每组各10只。正常对照组大鼠给予等剂量 0.9%氯化钠注射液,模型对照组大鼠给予万古霉素0.2 g·kg-1,磷霉素组给予磷霉素0.25 g·kg-1,联合-L组、联合-M组、联合-H 组分别给予磷霉素0.125,0.25,0.5 g·kg-1,30 min后给予万古霉素0.2 g·kg-1,均腹腔注射,每天 1次,连续21 d。给药剂量依据:万古霉素肾功能正常成人剂量一般2~4 g·d-1,儿童为0.06 g·kg-1·d-1。根据课题组前期研究,万古霉素0.2 g·kg-1可成功造模[5]。磷霉素成人用量为4~12 g·d-1,严重感染可增加至12 g·d-1,儿童剂量为0.1~0.3 g·kg·d-1,因此联合给药组磷霉素设置了3个浓度。
1.5尿液KIM-1、24 h尿蛋白、NAG含量测定 给药最后一天收集大鼠24 h尿液,常温下3 000 r·min-1(r=10.9 cm)离心尿液10 min,上清液置于-80 ℃冰箱保存,测定尿中KIM-1、24 h尿蛋白、尿NAG。其中,KIM-1、NAG均采用酶联免疫吸附实验(ELISA)法测定;24 h尿蛋白采用考马斯亮蓝法测定;实验操作按照相关试剂盒说明书进行。
1.6实时荧光定量PCR 检测肾组织Nrf2、Keap1、GPX-1 mRNA 表达 根据试剂盒步骤,提取肾组织RNA,再逆转录为cDNA,采用ABI 7500实时荧光定量PCR仪进行扩增。以β-Action作为内参。β-Action的引物序列上游:5′-GAGACCTTCAACACCCCAGC-3′,下游5′-CCACAGGATTCCATACCCAA-3′。Nrf2的引物序列上游:5′-TGCCCCTGTGGTCAAAGTG-3′,下游5′-GGTTCGGTTACCGTCCTGC-3′。KEAP1的引物序列上游:5′-GAGATATGAGCCAGATCGAGACG-3′,下游5′-GGTGTAATCATCCGCCACTCAT-3′。GPX-1的引物序列上游:5′-GTCCACCGTGTATGCCTTCTC-3′,下游:5′-CAGCAGGGCTTCTATATCGGG-3′。用Relative Quanti-fication Study分析方法进行分析,用2-△△Ct法对PCR结果数据进行计算。

2 结果
2.1各组大鼠尿液KIM-1、24 h尿蛋白、NAG测定结果 与正常对照组大鼠比较,模型对照组24 h尿蛋白、NAG、KIM-1水平显著升高(P<0.05);与模型对照组比较,联合-M、联合-H组24 h尿蛋白、NAG、KIM-1含量下降明显(P<0.01),且与磷霉素呈剂量依赖性,见表1。

表1 6组大鼠尿液KIM-1、24 h尿蛋白、NAG测定结果
2.2各组大鼠肾组织Nrf2、Keap1、GPX-1 mRNA表达情况 与正常对照组大鼠比较,模型对照组肾脏组织Nrf2 mRNA表达升高(P<0.01),GPX-1 mRNA表达下降,keap1几乎无变化,提示模型对照组已经在万古霉素诱导下发生了氧化应激反应。联合-L及联合-M 组Nrf2、Keap1 mRNA表达明显升高(P<0.01),联合给药3个剂量组GPX-1 mRNA 表达均显著升高(P<0.01),提示磷霉素能激活GPX-1 mRNA表达。见表2。
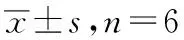
表2 6组大鼠Nrf2、Keap1和GPX-1 mRNA表达情况
3 讨论
VIKI的产生机制尚不完全清楚,可能包括[7]①免疫反应:VIKI是由包括酸性粒细胞、肥大细胞、浆细胞、淋巴细胞和巨噬细胞在内的间质浸润对万古霉素的免疫应答。②急性肾小管坏死:a.氧化应激,近曲小管细胞的氧化应激是引起急性肾小管坏死最常见的机制。万古霉素通过增加耗氧及三磷酸腺苷(ATP)浓度来刺激氧化磷酸化,形成铁络合物产生自由基。自由基诱导脂质过氧化,导致线粒体膜去极化,释放细胞色素C,激活半胱天冬酶,导致细胞凋亡[8]。血红素加氧酶1(heme oxygenase 1,HMOX1)是一种氧化应激蛋白,可催化血红素生成胆绿素、一氧化碳(carbon monoxide,CO)和铁离子,在氧化性肾损伤中发挥重大的保护作用。HMOX1可降低组织对氧化应激的敏感程度,Nrf2是其主要的上游调控基因之一。b.管型形成[9],多种因素可导致万古霉素在肾小管内过饱和和沉淀,包括药物浓度过高和低尿pH值。万古霉素能诱导肾小管上皮细胞耗氧量升高,介导氧化应激的产生,生成大量活性氧,导致氧化还原平衡失调,造成肾小管损伤[6,10-11]。
实验选用雄性 SD 大鼠,原因在于雌鼠的雌激素含量相对较高,而雌激素具有显著的抗炎作用,可能会影响实验结果[12]。尿NAG是一种溶酶体水解酶,在肾小管上皮细胞中的含量相对较高,其含量水平能迅速反映肾小管实质细胞的损伤情况,也可反映肾功能早期损伤情况。KIM-1是一种跨膜糖蛋白,主要由肾近曲小管上皮细胞产生,正常情况下表达较少或基本不表达(健康人群尿液中检测不到),当缺氧或损伤时可刺激近端肾小管大量表达,尿KIM-1明显增加[13-14]。血清尿素氮、肌酐为肾损伤的传统指标,而尿 KIM-1及NAG的灵敏度、特异性高,可作为一种快速反映早期肾损伤的生物标志物[15]。与正常对照组大鼠比较,模型对照组尿液24 h尿蛋白、NAG、KIM-1含量显著升高,联合-M、联合-H组24 h尿蛋白、NAG、 KIM-1含量下降。从联合-M、联合-H组的总体趋势看,磷霉素对万古霉素肾损伤的保护作用表现出剂量依赖性。
Keap1-Nrf2/ARE是近年来新发现的机体抵抗外界氧化刺激的防御性转导通路[16]。Nrf2是一种重要内源性保护因子,可控制外周淋巴系统,维护及稳定内环境,间接发挥抗氧化作用,调节有关促炎症反应的刺激因素,保护相关细胞与组织,并且在病理性炎症反应中起到保护作用。通常情况下,Nrf2 在细胞质中并不单独存在,而是与细胞骨架相关蛋白 Keap1 以二聚体形式结合存在。外界氧化应激因子刺激后,Nrf2与Keap1解离,转位进入细胞核,通过 Keap1-Nrf2/ARE 信号通路调节抗氧化酶基因,并诱导下游靶蛋白 GPX-1表达,激活氧化应激系统,启动抗氧化作用,从而保护组织和细胞[17-18]。故本研究以Keap1-Nrf2/ARE信号通路为主,探讨Nrf2、Keap1及下游蛋白 GPX-1 mRNA表达情况。
与正常对照组比较,模型对照组大鼠肾脏组织Nrf2 mRNA表达升高,Keap1几乎无变化,GPX-1 mRNA表达下降,提示模型对照组在万古霉素诱导下发生了氧化应激反应,但并未激活Keap1-Nrf2/ARE信号通路。采用磷霉素干预后联合用药组Nrf2、Keap1及GPX-1 mRNA表达均显著升高,明显高于正常对照组及模型对照组,提示磷霉素通过促进 Nrf2与 Keap1 解离,使其进入细胞核内,结合ARE,诱导下游靶蛋白 GPX-1 表达,进而增强机体抗氧化反应能力。
综上所述,磷霉素通过刺激GPX-1 mRNA的表达改善万古霉素引起的肾损伤,其机制可能是激活机体抵抗外界氧化刺激的防御性转导Keap1-Nrf2/ARE信号通路。
本研究不足之处是技术手段较单一,研究内容不够丰富,拟在下一步研究中采用蛋白质免疫印迹实验加以验证,并进一步研究VIKI的产生机制及磷霉素的保护作用。
