复方丹参滴丸调控LOX-NF-κB炎症途径治疗心肌缺血的机制研究
2023-01-10曹博雅陈家黎石晓溪李东岳卢令慧曹俊岭
曹博雅,陈家黎,石晓溪,李东岳,卢令慧,高 阔,王 伟,曹俊岭, 5,张 建
复方丹参滴丸调控LOX-NF-κB炎症途径治疗心肌缺血的机制研究
曹博雅1,陈家黎2,石晓溪3,李东岳2,卢令慧2,高 阔2,王 伟4,曹俊岭1, 5*,张 建6*
1. 北京中医药大学中药学院,北京 100029 2. 北京中医药大学中医学院,北京 100029 3. 北京中医药大学第三附属医院,北京 100029 4. 广州中医药大学基础医学院,广东 广州 510700 5. 北京中医药大学东方医院,北京 100029 6. 北京中医药大学生命科学学院,北京 100029
基于动物心肌缺血模型及体外心肌细胞损伤模型探究复方丹参滴丸调控脂氧合酶(lipoxygenase,LOX)-核因子-κB(nuclear factor-κB,NF-κB)途径抑制炎症反应治疗心肌缺血的作用机制。采用冠状动脉左前降支结扎术制备大鼠心肌缺血模型,心电图检测心肌缺血情况;Western blotting检测心肌组织LOX途径关键酶LOX5、LOX12、LOX15及下游分子p-NF-κB p65和白细胞介素-1β(interleukin-1β,IL-1β)的蛋白表达。体外培养H9c2心肌细胞,采用缺氧缺糖6 h诱导心肌细胞损伤模型,荧光倒置显微镜下观察心肌细胞形态;MTT法检测细胞活力;Western blotting检测LOX-NF-κB途径相关蛋白表达。复方丹参滴丸显著抑制心肌缺血大鼠心肌组织中LOX5、LOX12、LOX15和IL-1β的蛋白表达及NF-κB p65的磷酸化水平(<0.01、0.001)。体外细胞实验结果显示复方丹参滴丸明显改善H9c2心肌细胞缺氧缺糖损伤,显著提高心肌细胞存活率(<0.01、0.001),降低LOX5、LOX12、LOX15和IL-1β的蛋白表达及NF-κB p65的磷酸化水平(<0.05、0.01、0.001)。复方丹参滴丸可通过抑制LOX-NF-κB炎症途径减轻心肌缺血损伤。
复方丹参滴丸;心肌缺血;炎症;脂氧合酶;核因子-κB
心肌缺血性损伤是全球心血管疾病死亡的十大主要原因之一,是危害人类健康的最常见、最严重的疾病之一[1]。心肌缺血是指心脏血液灌注减少,心脏供氧量降低,心肌能量代谢异常,从而不能维持心脏正常功能的病理状态[1-2]。心肌缺血会引发心脏病理性炎症,持续失调的炎症反应会加重心肌组织损伤,导致心肌缺血最终发展为心衰[3-4]。研究表明,脂氧合酶(lipoxygenase,LOX)途径介导的花生四烯酸代谢及其代谢产物引发的炎症反应与心肌缺血密切相关[5-8]。LOX是参与花生四烯酸代谢的关键酶之一,在刺激炎症反应中起重要作用[9]。经LOX代谢途径产生的代谢产物白三烯(leukotrienes,LTs)是炎症反应中的炎性介质之一,具有增加血管通透性、引起血浆渗出和白细胞趋化等功能[10],这些产物还会触发炎症信号级联反应如核因子-κB(nuclear factor-κB,NF-κB)的激活[11-12],NF-κB在机体的免疫反应、炎症过程中参与调节细胞凋亡、增殖及应激反应,是细胞内的关键信号通路之一[13-16],且NF-κB信号通路对于诱导各种炎症相关细胞因子和介质至关重要,包括白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等[17-18]。研究表明,抑制炎症反应及减少炎症因子释放可治疗心肌缺血[19-22]。因此,抑制炎症反应可以是减轻心肌缺血损伤的有效策略之一。
复方丹参滴丸由丹参、三七和冰片3味中药组成,具有活血化瘀、理气止痛的功效,主治气滞血瘀所致的胸痛,是中医治疗冠心病、心绞痛等心脏疾病的常用药。大量研究表明,复方丹参滴丸具有抗炎[23]、促进冠脉微循环[24]、抑制血小板活化和聚集[25-26]、改善心肌能量代谢[27-28]等多种药理活性,但其通过抗炎而抑制心肌缺血损伤的机制尚不完全清楚。基于LOX-NF-κB炎症途径在介导心肌缺血损伤中的重要作用,本研究探究了复方丹参滴丸通过抗炎而治疗心肌缺血的作用机制。
1 材料
1.1 动物与细胞
48只SPF级雄性SD大鼠,体质量220~240 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)-2016-0006。动物饲养于北京中医药大学动物房,温度(23±2)℃,湿度(40±5)%,12 h光照和黑暗循环,自由进食饮水。动物实验经北京中医药大学实验动物伦理委员会批准(批准号BUCM-4-2021100904-4166)。
H9c2大鼠心肌细胞购自北京协和细胞库。
1.2 药品与试剂
复方丹参滴丸(批号Z10950111)购自天津天士力医药集团股份有限公司;卡维地洛(批号0K0254D26)购自齐鲁制药有限公司;戊巴比妥钠购自德国Merck公司;Zileuton(批号15663)购自美国MCE公司;PD146176(批号4079269)、黄芩素(批号MKCL8512)购自美国Sigma公司;胎牛血清(批号2059461RP)、DMEM培养基(批号8121011)、青霉素/链霉素双抗(批号2240831)、0.25%胰酶(批号2188970)购自美国Invitrogen公司;Earle’s平衡盐溶液(批号H23N11B131963)购自上海源叶生物科技有限公司;MTT(批号20200606)购自北京百瑞极生物科技有限公司;2.5 L厌氧产气袋(批号0176LJ-4)和2.5 L密封厌氧罐(批号C-31)购自日本三菱公司;BCA蛋白定量试剂盒(批号2021J1DP1511)、蛋白质相对分子质量标准(批号02511800)、ECL超敏发光液(批号2021F0CP1050)购自北京普利莱基因技术有限公司;LOX5抗体(批号ab169755)、LOX15抗体(批号ab244205)、磷酸化NF-κB p65(S536)抗体(批号ab76302)、IL-1β抗体(批号ab254360)购自英国Abcam公司;NF-κB p65抗体(批号80979-1-RR)购自美国Proteintech公司;LOX12抗体(批号PA578760)购自美国Invitrogen公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号AB0037)购自上海泊湾生物科技有限公司;HRP标记的羊抗兔IgG多克隆抗体(批号C1309)购自北京普利莱基因技术有限公司。
1.3 仪器
MCO-18AIC型CO2培养箱(日本SANYO公司);Epoch酶标仪(美国伯腾仪器有限公司);ECLIPSE TE2000-S型倒置荧光显微镜(日本Nikon公司);Mini-PROTEAN Tetra电泳及电转设备、ChemiDocTMMP凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 体内实验
2.1.1 分组、造模与给药 48只SD大鼠适应性喂养7 d后,随机分为假手术组、模型组、复方丹参滴丸(170 mg/kg,临床等效剂量)组和卡维地洛(25 mg/kg,临床等效剂量)组,每组12只。大鼠ip 1%戊巴比妥钠(50 mg/kg)麻醉后,仰卧位固定,手术区备皮,用碘伏消毒,进行气管插管,连接呼吸机,呼吸机参数:潮气量6 mL,呼吸频率80次/min,呼吸比1∶2。于3、4肋间逐层开胸暴露心脏,破心包膜,取5/0手术缝合线于左心耳下2 mm处结扎冠状动脉左前降支,在心脏表面滴1滴利多卡因,清除胸腔血污,用2/0缝合线逐层关胸,脱离呼吸机。大鼠ip利多卡因0.2 mL、呋塞米0.2 mL、青霉素钠(4×105U/kg)。待手术后的大鼠恢复自主呼吸后置于电热毯上至苏醒。假手术组对冠状动脉左前降支只穿线不结扎,其他步骤相同。
术后对大鼠行心电图检测,将麻醉后的大鼠仰卧位固定,参照人十二导联心电图连接电极,设定走纸速度25 min/s,出现6~8个导联病理性Q波为造模成功,剔除未成模的动物。术后24 h各给药组开始ig药物,假手术和模型组ig等体积生理盐水,1次/d,连续14 d,保持每天给药时间一致。
2.1.2 大鼠心电监测、心脏取材及心脏损伤观察 在给药的第5天对大鼠行心电图检测,观察药物是否在缺血的急性期就已发挥心肌保护作用。在缺血恢复期给药后的第14天进行心脏组织取材,手术剪开胸,取出全心,置于预冷生理盐水中泵净心脏中残留的血液,冰上剔净心耳和其他残余组织,各组典型心脏形态拍照记录。切取梗死边缘区组织,液氮速冻保存,留作Western blotting检测。假手术组心脏在与模型组相同位置做相同处理。
2.1.3 Western blotting检测大鼠心肌组织相关蛋白表达 使用RIPA裂解液(100 g/L)和手持匀浆器将心肌组织破碎成组织匀浆液,于4 ℃、12 000×离心10 min,取上清。使用BCA蛋白定量试剂盒测定蛋白浓度,完成定量后100 ℃煮沸变性10 min,冷却后储存于−20 ℃冰箱。样品经SDS-PAGE分离,转膜,封闭后,分别孵育相应的一抗和二抗后曝光并显影,采用Image J软件进行灰度值分析。
2.2 体外实验
2.2.1 细胞培养 H9c2细胞用含10%胎牛血清和1%青霉素/链霉素双抗的DMEM培养基,置于37 ℃、5% CO2的培养箱中培养,在细胞融合度为90%时传代。
2.2.2 氧糖剥夺(oxygen-glucose deprivation,OGD)模型的建立 H9c2细胞培养到实验所需的密度,弃去原有培养液,PBS清洗2次,加入Earle’s无糖平衡盐溶液,放入缺氧小室内,并放入厌氧产气袋,盖紧缺氧小室的盒盖,放入培养箱进行缺氧缺糖造模,时间分别为0、4、6、8 h,然后从缺氧小室中取出,选取当细胞活力为50%左右的造模时间进行后续实验。
2.2.3 细胞分组与给药
(1)复方丹参滴丸的无细胞毒性浓度和保护作用浓度测定:复方丹参滴丸无细胞毒性浓度测定实验设置对照组和不同质量浓度(2000、1000、500、250、125 µg/mL)的复方丹参滴丸组。复方丹参滴丸保护作用浓度筛选实验设置对照组、模型组(按“2.2.2”项下方法处理)和不同质量浓度(500、250、125 µg/mL)的复方丹参滴丸组(在缺氧缺糖时分别加入含不同浓度复方丹参滴丸的Earle’s平衡盐溶液)。
(2)复方丹参滴丸调控LOX-NF-κB炎症途径的机制研究:设置对照组、模型组、复方丹参滴丸(500 µg/mL)组、LOX5抑制剂Zileuton(50 µmol/L)组、LOX12抑制剂黄芩素(1 µmol/L)组和LOX15抑制剂PD146176(1 µmol/L)组。各给药组均在造模的同时给药。
2.2.4 MTT测定细胞活力 取生长状态良好的H9c2细胞,经计数后稀释为1×105个/mL,每孔100 µL接种到96孔板上,培养24 h,细胞生长至约80%时按“2.2.3(1)”项下进行分组给药,处理24 h,倒扣法倒出原有培养基,每孔加100 µL PBS洗涤2遍后,每孔加入100 µL以PBS配制的0.5 g/mL的MTT,放于培养箱中继续孵育4 h,弃去MTT溶液,每孔加150 µL DMSO溶解结晶,置于微量振荡器待结晶完全溶解后,于酶标仪570 nm处检测吸光度()值,计算细胞存活率。
细胞存活率=实验/对照
2.2.5 荧光倒置显微镜观察细胞形态 取生长状态良好的H9c2细胞,经计数后稀释至2.5×105个/mL,接种于6孔板中,每孔1 mL,培养24 h后按“2.2.3(2)”项下进行分组给药,分别于给药前、缺氧缺糖6 h时,于荧光倒置显微镜下观察细胞形态,并拍照记录。
2.2.6 Western blotting检测H9c2细胞相关蛋白表达 取生长状态良好的H9c2细胞,经计数后稀释至2.5×105个/mL,接种于6孔板中,每孔1 mL,培养24 h后按“2.2.3(2)”项下进行分组给药,缺氧缺糖6 h后,弃上清,用预冷的PBS清洗2遍后,每孔加入100 µL预冷的RIPA裂解液裂解30 min,期间反复吹打细胞使其充分裂解,全程冰上操作。收集裂解液,4 ℃、20 000×离心20 min后收集上清。按“2.1.3”项下方法进行蛋白定量、样品制备、Western blotting检测以及灰度分析。
2.3 统计学分析
3 结果
3.1 各组大鼠心电图及心脏形态比较
术后5 d心电图(图1)结果显示,假手术组P波规律出现,P-R间期及R-R间期大致相同,QRS波波形规律,无宽大畸形,S-T段未见明显压低及抬高。模型组ST段明显抬高,呈“弓背向上”型,为心肌梗死特异性指标,且QRS波抬高、增宽。复方丹参滴丸组提示窦性心率,P波规律出现,P-R间期及R-R间期大致相同,QRS波波形规律,无宽大畸形,与模型组比较,S-T段抬高缓解。卡维地洛组心电图提示窦性心率,P波规律出现,P-R间期及R-R间期大致相同,QRS波波形规律,无宽大畸形,与模型组比较,S-T段抬高缓解。提示复方丹参滴丸在缺血的急性期已开始具有很好的心肌保护作用。术后14 d恢复期各组大鼠心脏取材后通过对损伤情况进行比较,发现复方丹参滴丸组和卡维地洛组大鼠心肌缺血损伤区域小于模型组,提示给药组可在一定程度上减轻心肌缺血损伤。
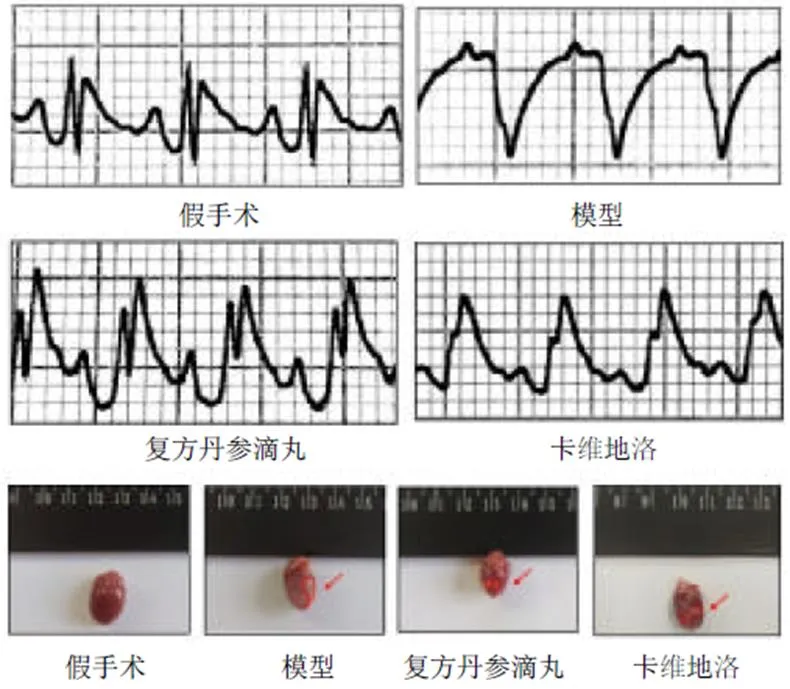
图1 各组大鼠心电图及心脏形态
3.2 复方丹参滴丸对心肌缺血大鼠心肌组织相关蛋白表达的影响
如图2所示,与假手术组比较,模型组大鼠心肌组织中LOX途径关键酶LOX5、LOX12和LOX15的蛋白表达水平均显著升高(<0.01、0.001),提示LOX途径激活,炎症反应增强;与模型组比较,复方丹参滴丸显著降低LOX5、LOX12、LOX15和IL-1β的蛋白表达及NF-κB p65的磷酸化水平(<0.01、0.001),表明复方丹参滴丸通过抑制LOX途径关键酶的蛋白表达继而降低NF-κB p65的磷酸化水平和IL-1β的表达,从而抑制心肌组织炎症反应,进而发挥抗心肌缺血作用。
3.3 H9c2细胞OGD模型的建立
为建立适宜的模型进行机制验证实验,对细胞的缺氧缺糖时间进行考察。将H9c2细胞置于37 ℃、5% CO2的培养箱中,分别缺氧缺糖培养4、6、8 h,观察造模效果,如图3所示,当缺氧缺糖6 h时,细胞活力在50%左右,此时观察药物的保护作用较为合适,故将其作为模型的缺氧缺糖时间。
3.4 复方丹参滴丸对正常H9c2细胞活力的影响
当药物浓度过高时,会具有细胞毒性。为了探讨复方丹参滴丸的药理作用,首先筛选了复方丹参滴丸的无细胞毒性浓度。如图4所示,与对照组比较,复方丹参滴丸质量浓度为2000 µg/mL时对H9c2细胞活力表现出明显抑制作用(<0.05),因此选择125、250、500、1000 µg/mL 4个质量浓度考察复方丹参滴丸对H9c2细胞OGD模型的保护作用。

与假手术组比较:##P<0.01 ###P<0.001;与模型组比较:**P<0.01 ***P<0.001

与缺氧缺糖0 h比较:***P<0.001

与对照组比较:*P<0.05
3.5 复方丹参滴丸对OGD诱导的H9c2细胞活力的影响
如图5所示,与对照组比较,模型组细胞活力显著降低(<0.001);与模型组比较,复方丹参滴丸在500、1000 µg/mL时均对心肌细胞活力表现显著保护作用(<0.01、0.001),其中复方丹参滴丸在500 µg/mL时对细胞活力的影响最大,因此选择500 µg/mL的复方丹参滴丸作为后续探究其机制的质量浓度。

与对照组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,图7同
3.6 复方丹参滴丸保护OGD模型各时段H9c2细胞形态
在荧光倒置显微镜下观察OGD模型各时段H9c2细胞形态,如图6所示,给药前,各组细胞贴壁状态良好,大部分呈长梭形,细胞边缘结构清晰,胞质透亮。对照组细胞在各时段细胞形态规则,增长速度正常。模型组细胞在缺氧缺糖6 h后贴壁不牢,细胞皱缩,形态变得不规则,漂浮细胞增多,细胞数量显著减少。复方丹参滴丸组细胞贴壁数量增加,细胞皱缩变形的现象得到改善。

图6 复方丹参滴丸对H9c2心肌细胞形态的保护作用 (×100)
3.7 复方丹参滴丸对OGD诱导的H9c2细胞相关蛋白表达的影响
如图7所示,与对照组比较,模型组LOX途径关键酶LOX5、LOX12和LOX15的蛋白表达水平均显著升高(<0.001),提示LOX途径激活,炎症反应增强;与模型组比较,复方丹参滴丸组LOX5、LOX12、LOX15和IL-1β蛋白表达及NF-κB p65的磷酸化水平均显著降低(<0.05、0.01、0.001),与LOX5抑制剂Zileuton、LOX12抑制剂黄芩素、LOX15抑制剂PD146176作用相似(<0.01、0.001)。表明复方丹参滴丸通过抑制LOX途径的激活继而降低NF-κB p65磷酸化水平和IL-1β表达,从而抑制心肌细胞炎症反应,减少细胞丢失,发挥对OGD心肌细胞损伤模型的保护作用

图7 复方丹参滴丸对OGD诱导的H9c2细胞LOX-NF-κB途径相关蛋白表达的影响(, n = 3)
4 讨论
心肌缺血损伤会引起心肌细胞强烈的炎症风暴、凋亡、氧化应激等病理过程,最终导致心力衰竭。LOX途径关键酶对心肌缺血时炎症反应的调控具有重要作用[29-30]。研究表明,LOX15在冠心病患者心肌组织中的表达显著增加[31]。另有研究发现,在小鼠心肌缺血再灌注模型中LOX5蛋白表达量显著上调,该信号通路被显著激活[32],且LOX5抑制剂可通过减少NF-κB表达、抑制心肌细胞炎症和凋亡从而减轻大鼠心肌缺血再灌注损伤[33]。心肌缺血导致细胞中的LOX途径被激活,该途径产生的代谢产物如羟基二十碳四烯酸、白三烯等表现出多种生物活性,如增加血管通透性、促进血浆渗出以及使白细胞迁移到炎症区域等[33-34],这些代谢产物促进了炎症的发生发展[35],如白三烯可促进NF-κB的激活,而NF-κB是诱导炎性细胞因子表达的关键转录因子,激活的NF-κB会诱导炎症反应增强并促进炎症因子释放,因此,抑制LOX-NF-κB炎症途径的激活,对于减轻心肌细胞的炎症反应、改善心肌缺血损伤具有重要意义。
本研究首先采用冠状动脉左前降支结扎术构建了大鼠心肌缺血模型,在给药的第5天对大鼠行心电图检测,发现复方丹参滴丸在缺血的急性期已开始具有很好的心肌保护作用。在缺血恢复期给药后的第14天进行心脏取材,通过心脏组织损伤情况比较,发现复方丹参滴丸可在一定程度上减轻心肌缺血损伤。继而,对心肌组织LOX5、LOX12、LOX15和IL-1β的蛋白表达及NF-κB p65的磷酸化水平进行定量检测,结果显示模型组大鼠心肌组织中上述蛋白表达水平均显著升高,表明LOX-NF-κB介导的炎症途径在大鼠心肌缺血模型中被高度激活。复方丹参滴丸干预后可显著降低上述蛋白的表达水平,减小大鼠心肌组织梗死面积,减轻心脏炎症反应,改善心肌缺血现象。随后构建H9c2心肌细胞氧糖剥夺模型,体外模拟心肌缺血的病理状态,从LOX-NF-κB炎症途径探究复方丹参滴丸抗心肌缺血损伤的具体分子机制,结果同样显示,复方丹参滴丸给药后LOX途径关键酶LOX5、LOX12、LOX15表达水平显著降低,其下游蛋白NF-κB p65的磷酸化水平和IL-1β的表达水平也显著降低。由此表明复方丹参滴丸可通过抑制LOX途径3个关键酶的表达水平,继而降低了NF-κB p65的磷酸化水平,抑制炎症因子IL-1β的释放(图8),从而减轻炎症反应和心肌细胞损伤,明显改善OGD损伤后心肌细胞的形态,显著缓解心肌细胞OGD损伤。
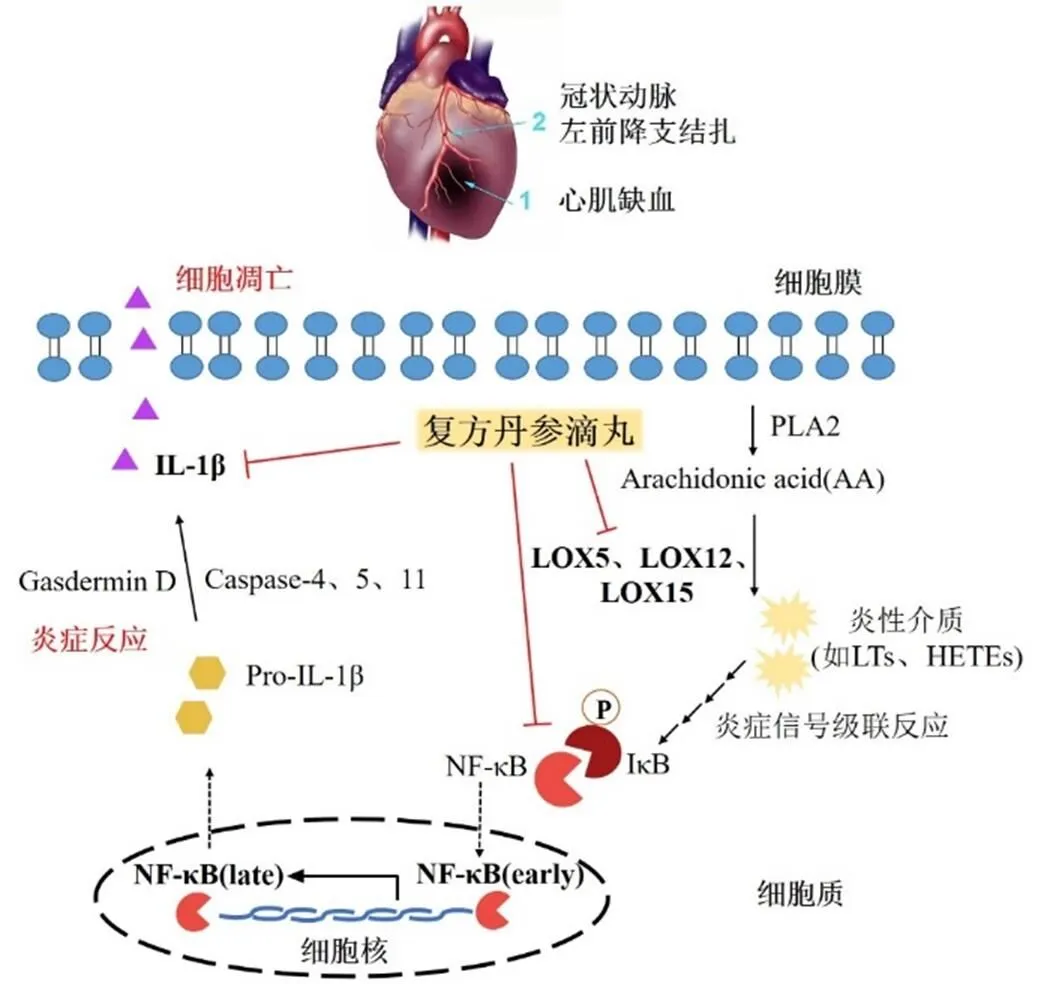
图8 复方丹参滴丸对心肌缺血时LOX-NF-κB炎症途径及其下游分子的抑制作用
复方丹参滴丸是利用现代制剂工艺研制的一种中药滴丸复方制剂,具有多效应成分溶解快、易吸收、纯度高且便于服用等优点,在心肌缺血等心血管疾病的治疗中也发挥了重要作用[36-38]。丹参酮IIA作为丹参的有效成分,可减少脂多糖刺激的RAW264.7巨噬细胞中促炎介质的产生,其机制可能为通过抑制RAW264.7细胞中的NF-κB活化以发挥抗炎活性[39];另有研究表明,三七的主要化学成分人参皂苷Rg1能下调脂多糖诱导的炎症细胞因子的表达,减少Toll样受体4和NF-κB的表达,减轻脂多糖诱导的心肌细胞炎症反应和凋亡[40]。更多复方丹参滴丸抑制炎症反应减轻心肌缺血的效应成分需要被进一步揭示,在动物整体水平以及细胞分子水平上进行确切验证。
本研究基于体内外实验证实了复方丹参滴丸具有类似LOX抑制剂的作用,通过抑制LOX途径关键酶的激活,从而调节LOX-NF-κB炎症途径缓解心肌缺血损伤。为复方丹参滴丸靶向调控心肌缺血的分子机制阐明提供了科学依据,提示抑制炎症因子释放可能是预防和治疗心血管疾病的潜在策略,同时为心肌缺血引发的心血管疾病的防治提供干预机制和治疗思路。
利益冲突 所有作者均声明不存在利益冲突
[1] Wang W L, Ge T Y, Chen X,. Advances in the protective mechanism of NO, H2S, and H2 in myocardial ischemic injury [J]., 2020, 7: 588206.
[2] Fan S, Sun J B, Li R,. Lycopene protects myocardial ischemia injury through anti-apoptosis and anti-oxidative stress [J]., 2019, 23(7): 3096-3104.
[3] Hanna A, Frangogiannis N G. Inflammatory cytokines and chemokines as therapeutic targets in heart failure [J]., 2020, 34(6): 849-863.
[4] Severino P, D'Amato A, Pucci M,. Ischemic heart disease and heart failure: Role of coronary ion channels [J]., 2020, 21(9): 3167.
[5] Halade G V, Kain V, Tourki B,. Lipoxygenase drives lipidomic and metabolic reprogramming in ischemic heart failure [J]., 2019, 96: 22-32.
[6] Kain V, Ingle K A, Rajasekaran N S,. Activation of EP4 receptor limits transition of acute to chronic heart failure in lipoxygenase deficient mice [J]., 2021, 11(6): 2742-2754.
[7] Mashima R, Okuyama T. The role of lipoxygenases in pathophysiology; new insights and future perspectives [J]., 2015, 6: 297-310.
[8] Sexton A, McDonald M, Cayla C,. 12-Lipoxygenase-derived eicosanoids protect against myocardial ischemia/reperfusion injury via activation of neuronal TRPV1[J]., 2007, 21(11): 2695-2703.
[9] Lončarić M, Strelec I, Moslavac T,. Lipoxygenase inhibition by plant extracts [J]., 2021, 11(2): 152.
[10] Colazzo F, Gelosa P, Tremoli E,. Role of the cysteinyl leukotrienes in the pathogenesis and progression of cardiovascular diseases [J]., 2017, 2017: 2432958.
[11] Hu T Y, Zhang H, Chen Y Y,. Dysiarenone from marine spongeattenuates ROS and inflammation via inhibition of 5-LOX/NF-κB/MAPKs and upregulation of Nrf2/HO-1 in RAW264.7 macrophages [J]., 2021, 14: 587-597.
[12] Wang D Z, Dubois R N. Eicosanoids and cancer [J]., 2010, 10(3): 181-193.
[13] Pena E, Brito J, El Alam S,. Oxidative stress, kinase activity and inflammatory implications in right ventricular hypertrophy and heart failure under hypobaric hypoxia [J]., 2020, 21(17): E6421.
[14] Szabo T M, Frigy A, Nagy E E. Targeting mediators of inflammation in heart failure: A short synthesis of experimental and clinical results [J]., 2021, 22(23): 13053.
[15] Bezhaeva T, Karper J, Quax P H A,. The intriguing role of TLR accessory molecules in cardiovascular health and disease [J]., 2022, 9: 820962.
[16] Rasmi R R, Sakthivel K M, Guruvayoorappan C. NF-κB inhibitors in treatment and prevention of lung cancer [J]., 2020, 130: 110569.
[17] Wu J, Zhao Y M, Deng Z K. Tangeretin ameliorates renal failure via regulating oxidative stress, NF-κB-TNF-α/iNOS signalling and improves memory and cognitive deficits in 5/6 nephrectomized rats [J]., 2018, 26(1): 119-132.
[18] Lu J S, Zhang H B, Pan J Y,. Fargesin ameliorates osteoarthritis via macrophage reprogramming by downregulating MAPK and NF-κB pathways [J]., 2021, 23(1): 142.
[19] Wolf D, Ley K. Immunity and inflammation in atherosclerosis [J]., 2019, 124(2): 315-327.
[20] Soehnlein O, Libby P. Targeting inflammation in atherosclerosis-from experimental insights to the clinic [J]., 2021, 20(8): 589-610.
[21] Murphy S P, Kakkar R, McCarthy C P,. Inflammation in heart failure: JACC state-of-the-art review [J]., 2020, 75(11): 1324-1340.
[22] Ong S B, Hernández-Reséndiz S, Crespo-Avilan G E,. Inflammation following acute myocardial infarction: Multiple players, dynamic roles, and novel therapeutic opportunities [J]., 2018, 186: 73-87.
[23] Yi J, Yuan C J, Ai Q,. The effects of Compound Danshen Dripping Pills and human umbilical cord blood mononuclear cell transplant after acute myocardial infarction [J]., 2014, 12(2): 123-128.
[24] Han J Y, Li Q, Ma Z Z,. Effects and mechanisms of compound Chinese medicine and major ingredients on microcirculatory dysfunction and organ injury induced by ischemia/reperfusion [J]., 2017, 177: 146-173.
[25] Wang F, Liu Y Y, Liu L Y,. Inhibition effect of cardiotonic pills on venous thrombosis induced in rat mesentery by photochemical reaction [J]., 2006, 34(1/2): 131-138.
[26] Yu C, Qi D, Lian W,. Effects of danshensu on platelet aggregation and thrombosis:arteriovenous shunt and venous thrombosis models in rats [J]., 2014, 9(11): e110124.
[27] Zou H M, Zhang B, Xu X C,. Urinary metabolomic strategy to evaluate Compound Danshen Dripping Pills for myocardial ischaemia in rats [J]., 2015, 112: 98-105.
[28] Guo J H, Yong Y H, Aa J Y,. Compound Danshen Dripping Pills modulate the perturbed energy metabolism in a rat model of acute myocardial ischemia [J]., 2016, 6: 37919.
[29] Kayama Y, Minamino T, Toko H,. Cardiac 12/15 lipoxygenase-induced inflammation is involved in heart failure [J]., 2009, 206(7): 1565-1574.
[30] Lin B, Zhao H, Li L,. Sirt1 improves heart failure through modulating the NF-κB p65/microRNA-155/BNDF signaling cascade [J]., 2020, 13(10): 14482-14498.
[31] Magnusson L U, Lundqvist A, Asp J,. High expression of arachidonate 15-lipoxygenase and proinflammatory markers in human ischemic heart tissue [J]., 2012, 424(2): 327-330.
[32] Li C, Wang J, Wang Q Y,. Qishen granules inhibit myocardial inflammation injury through regulating arachidonic acid metabolism [J]., 2016, 6: 36949.
[33] Abueid L, Uslu Ü, Cumbul A,. Inhibition of 5-lipoxygenase by zileuton in a rat model of myocardial infarction [J]., 2017, 17(4): 269-275.
[34] Wang B, Wu L J, Chen J,. Metabolism pathways of arachidonic acids: Mechanisms and potential therapeutic targets [J]., 2021, 6(1): 94.
[35] He Z L, Tao D, Xiong J M,. Phosphorylation of 5-LOX: The potential set-point of inflammation [J]., 2020, 45(10): 2245-2257.
[36] 郝晨伟, 李正翔, 张铭慧, 等. 丹参及其配伍制剂治疗冠心病的研究进展 [J]. 中草药, 2021, 52(13): 4096-4106.
[37] 刘永成, 田颖, 郭栋, 等. 复方丹参滴丸治疗原发性高血压的系统评价和Meta分析 [J]. 中草药, 2022, 53(10): 3111-3124.
[38] 陈凯, 陈敏娜, 王琼, 等. 基于网络药理学及分子对接技术的复方丹参滴丸治疗心绞痛潜在分子机制探讨[J]. 药物评价研究, 2022, 45(7): 1282-1293.
[39] Jang S I, Kim H J, Kim Y J,. Tanshinone IIAinhibits LPS-induced NF-kappaB activation in RAW264.7 cells: Possible involvement of the NIK-IKK, ERK1/2, p38 and JNK pathways [J]., 2006, 542(1/2/3): 1-7.
[40] Luo M, Yan D, Sun Q,. Ginsenoside Rg1attenuates cardiomyocyte apoptosis and inflammation via the TLR4/NF-kB/NLRP3 pathway [J]., 2020, 121(4): 2994-3004.
Mechanism of Compound Danshen Dripping Pills against myocardial ischemia based on LOX-NF-κB pathway
CAO Bo-ya1, CHEN Jia-li2, SHI Xiao-xi3, LI Dong-yue2, LU Ling-hui2, GAO Kuo2, WANG Wei4, CAO Jun-ling1, 5, ZHANG Jian6
1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China 2. School of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China 3. Third Affiliated Hospital, Beijing University of Chinese Medicine, Beijing 100029, China 4. School of Basic Medicine, Guangzhou University of Chinese Medicine, Guangzhou 510700, China 5. Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100029, China 6. School of Life Sciences, Beijing University of Chinese Medicine, Beijing 100029, China
To explore the mechanism of Compound Danshen Dripping Pills (复方丹参滴丸) on treatment of myocardial ischemia by regulating lipoxygenase (LOX)-nuclear factor-κB (NF-κB) pathway to inhibit inflammatory response based on animal models of myocardial ischemia andmyocardial cell injury model.The rat model of myocardial ischemia was established by ligation of left anterior descending coronary artery, with myocardial ischemia detected by ECG; Protein expressions of LOX5, LOX12, LOX15, p-NF-κB p65 and interleukin-1β (IL-1β) were detected by Western blotting. H9c2 cardiomyocytes were cultured, and the model of myocardial cell injury was induced by deprivation of oxygen-glucose (OGD) for 6 h, morphology of myocardial cells was observed under fluorescence inverted microscope; Cell viability was detected by MTT; Western blotting was used to detect LOX-NF-κB pathway related protein expressions.Compound Danshen Dripping Pills significantly inhibited the protein expression levels of LOX5, LOX12, LOX15, p-NF-κB p65 and IL-1β in myocardial tissues of rats with ischemia (< 0.01, 0.001). Thecell experiments indicated that Compound Danshen Dripping Pills could dramatically improve the OGD injury of H9c2 myocardial cells, significantly increase the survival rate of myocardial cells (< 0.01, 0.001), and reduce LOX5, LOX12, LOX15 and IL-1β protein expressions and NF-κB p65 phosphorylation level (< 0.05, 0.01, 0.001).Compound Danshen Dripping Pills can alleviate myocardial ischemia injury by inhibiting LOX-NF-κB inflammatory pathway.
Compound Danshen Dripping Pills; myocardial ischemia; inflammation; lipoxygenase; nuclear factor-κB
R285.5
A
0253 - 2670(2023)01- 0151 - 09
10.7501/j.issn.0253-2670.2023.01.018
2022-09-20
国家自然科学基金资助项目(82004095);国家自然科学基金资助项目(81903950);国家自然科学基金资助项目(81904169);中央高校基本科研业务费专项(2021-JYB-XJSJJ031,2019-JYB-JS-095,2022-JYB-XJSJJ008)
曹博雅,硕士研究生,研究方向为心血管药理学。E-mail: bucmcby@163.com
通信作者:张 建,讲师,研究方向为中医药防治心血管疾病的基础研究。E-mail: zhangjian3428@126.com
曹俊岭,主任药师,博士生导师,研究方向为药理学、医院药学。E-mail: caojunling72@163.com
[责任编辑 李亚楠]
