表小檗碱调控CD39-NLRP3-GSDMD焦亡路径改善脓毒症肺损伤的机制研究
2023-01-10吴嘉思兰悦嘉
吴嘉思,兰悦嘉,王 俊,王 欢
• 药理与临床•
表小檗碱调控CD39-NLRP3-GSDMD焦亡路径改善脓毒症肺损伤的机制研究
吴嘉思1,兰悦嘉2,王 俊3,王 欢2
1. 成都中医药大学针灸推拿学院,四川 成都 611137 2. 成都中医药大学药学院,四川 成都 611137 3. 雅安市人民医院药剂科,四川 雅安 625000
基于CD39-NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)-GSDMD焦亡路径探究表小檗碱改善脓毒症肺损伤的作用机制。通过AMP-Glo TM实验考察黄连异喹啉生物碱成分小檗碱、黄连碱、巴马汀、表小檗碱及药根碱的CD39酶促活性。小鼠ip脂多糖(lipopolysaccharide,LPS,12 mg/kg)建立脓毒症肺损伤模型,分别于造模前24 h和造模0.5 h后给予表小檗碱或MCC950,造模后24 h,采用苏木素-伊红(HE)染色法观察小鼠肺组织病理变化;计算肺组织湿质量/干质量,评价肺肿胀;ELISA法检测肺泡灌洗液中白细胞介素-1β(interleukin-1β,IL-1β)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和IL-17A水平。采用1 μg/mL LPS联合5 mmol/L三磷酸腺苷(adenosine triphosphate,ATP)/5 μmol/L nigericin/150 μg/mL MSU或转染0.5 μg/mL poly(dA:dT)刺激人源单核细胞白血病THP-1细胞复制炎症模型,给予表小檗碱或VX-765干预,采用Western blotting法检测细胞CD39-NLRP3-GSDMD路径蛋白表达;ELISA法检测上清液中IL-1β水平;采用免疫荧光评估NLRP3炎症小体组装情况;采用扫描电镜评价细胞焦亡情况;采用BzATP介导配体门控离子通道受体7(ligand-gated ion channel receptor 7,P2X7)通道开放,考察表小檗碱对P2X7功能的作用。表小檗碱的CD39酶促活性最佳,半数致死浓度(median effective concentration,EC50)值为14.23 μmol/L。与对照组比较,模型组小鼠肺组织结构异常并显示炎性浸润,且肺肿胀明显(<0.01),肺泡灌洗液中炎性因子水平显著上调(<0.01);表小檗碱干预后,以上变化得到了有效逆转(<0.05、0.01),并呈剂量相关性。以上药效与表小檗碱上调CD39蛋白表达水平、抑制P2X7过表达、干扰NLRP3炎症小体组装、降低GSDMD-N蛋白表达水平、逆转GSDMD介导的巨噬细胞焦亡并降低IL-1β水平有关(<0.05、0.01)。表小檗碱通过抑制脓毒症肺损伤小鼠肺泡灌洗液中IL-1β、MCP-1和IL-17A水平逆转肺损伤和肺肿胀,进一步改善脓毒症肺损伤,可能与调控CD39-NLRP3-GSDMD焦亡路径相关。
表小檗碱;脓毒症肺损伤;CD39;炎症小体;焦亡
脓毒症肺损伤(sepsis-induced acute lung injury,SALI)严重威胁生命健康,是重症监护室脓毒症患者死亡的重要原因,其特征包括中性粒细胞整合、多种细胞因子释放以及肺泡-毛细血管完整性破坏,同时可见非液体静力性肺水肿和通透性升高[1]。流行病学数据显示,全球每年新增约1800万例患者,发病率为0.3%,并以1.5%/年的速度增长[2]。历年来临床专家就SALI的生物标志物是否应纳入共识会议定义进行了激烈的讨论。目前SALI治疗方法包括静脉给予抗生素,此方法相应机制不明确,且针对不同细胞因子的不同抗生素联合使用容易导致不良反应的叠加[3]。另一方面,美国食品药品监督管理局批准分子修饰化学药带来的较大经济负担也阻碍其在SALI患者中的实际应用[4]。因此,揭示SALI潜在发病机制、寻求更易获取、更经济的新型替代药物需求迫切。
近年来,嘌呤能调节性“刹车”在炎症应答中的角色受到越来越多的关注。研究表明,CD39介导三磷酸腺苷(adenosine triphosphate,ATP)→二磷酸腺苷(adenosine diphosphate,ADP)→一磷酸腺苷(adenosine monophosphate,AMP)水解过程,而后AMP被CD73进一步水解为腺苷。胞外ATP与配体门控离子通道受体7(ligand-gated ion channel receptor 7,P2X7)受体绑定触发巨噬细胞促炎信号,而腺苷则与A2B腺苷受体绑定介导Mø抗炎信号,以上路径可对巨噬细胞炎症应答起到调节性“刹车”作用[5]。CD39-P2X7作为嘌呤能“正反馈”促炎路径,已有诸多证据明确了其对下游炎症小体-焦亡通路的调控作用。有关SALI发病机制的研究显示,NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体激活诱导的肺泡巨噬细胞焦亡是肺损伤和肺肿胀的主要原因之一[6]。CD39在肺泡巨噬细胞中也多有表达[7],CD39-P2X7路径很可能通过调控NLRP3炎症小体-焦亡参与SALI的发生与发展。故本研究关注CD39-NLRP3-GSDMD证据链的上游衔接环节,即CD39-P2X7路径在SALI病程的参与机制具有临床指导意义。
中医角度多从“湿邪致病”阐释脓毒症的病机,其特点包括“湿、热、毒、瘀、虚”[8]。黄连始载于《神农本草经》,归草部,列为上品,为苦寒燥湿的代表药物,功兼清热燥湿、泻火解毒。临床上黄连作为单味药治疗脓毒症的疗效显著[9]。现代学者针对黄连生物活性进行了诸多探索。成分-效用研究显示小檗碱、黄连碱、巴马汀、药根碱和表小檗碱为黄连的药效物质基础[10]。单味药黄连及其效应成分能负向调控巨噬细胞中众多炎症通路信号转导并发挥“多成分、多靶点”的抗炎作用,尤其是小檗碱,近年来积累了大量的研究,并保持稳定增长的研究热度[10-12]。本课题组前期研究发现,黄连碱及巴马汀抑制脂多糖(lipopolysaccharide,LPS)介导的巨噬细胞中核因子-κB(nuclear factor-κB,NF-κB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路激活,干扰LPS联合ATP介导的NLRP3炎症小体的启动和组装[13-16],而黄连成分是否以及如何调控CD39-NLRP3-GSDMD焦亡路径改善脓毒症肺损伤尚不清楚。故本研究拟从黄连主要异喹啉单体成分中筛选促CD39酶活性作用最强的成分,并针对此成分开展SALI改善作用及潜在作用机制研究。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠48只,8~9周龄,体质量(28±2)g,购自斯贝福(北京)生物技术有限公司,动物许可证号SCXK(京)2019-0010。动物于12 h昼夜交替环境下适应性喂养1周,许可文号SYXK(川)2014-124。动物实验经成都中医药大学动物保护与使用委员会批准(批准号2017-21)。
1.2 细胞系
人源单核细胞白血病THP-1细胞购自武汉普诺赛生命科技有限公司。
1.3 药品与试剂
表小檗碱(质量分数≥98%,批号6873-09-2)、小檗碱(质量分数≥98%,批号2086-83-1)、黄连碱(质量分数≥98%,批号3486-66-6)、盐酸巴马汀(质量分数≥98%,批号10605-02-4)、盐酸药根碱(质量分数≥94%,批号960383-96-4)、番泻苷A(质量分数≥97%,批号81-27-6)购自成都曼思特生物科技有限公司;AMP-GloTM试剂盒(批号V5011)购自美国Promega公司;LPS、ATP、β-巯基乙醇、YO-PRO-1、BzATP、二甲基亚砜(dimethylsulfoxide,DMSO)购自美国Sigma公司,批号分别为L4391-1MG、A1852-1VL、M3184、SML1792、B6396、RNBF8134;佛波酯(phorbol ester,PMA,批号S1819)购自上海碧云天生物技术有限公司;尼日尼亚菌素(nigericin,批号28643-80-3)、尿酸结晶(monosodium urate,MSU,批号1198-77-2)、poly(dA:dT,批号86828-69-5)购自InvivoGen公司;RPMI 1640培养基(批号D120705)购自上海源培生物技术有限公司;磷酸盐缓冲液(批号8118334)购自美国Gibco公司;NLRP3、半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)、CD39、P2X7、GSDMD抗体购自美国CST公司,批号分别为15101、2225、91851、13809、69469S;凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)抗体(批号sc-365611)购自美国Santa Cruz Biotechnology公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号180411)购自成都谷歌生物科技有限公司;Alexa Fluor 488标记的山羊抗兔IgG(H+L)二抗(批号A0423)、Alexa Fluor 555标记的驴抗小鼠IgG(H+L)二抗(批号A0460)购自上海碧云天生物技术有限公司;蛋白酶抑制剂(批号24348600)购自Roche公司;Caspase-1抑制剂Belnacasan(VX-765,批号S2228)、NLRP3抑制剂MCC950(批号S8930)购自美国Selleck公司;中等强度RIPA裂解液(批号AR0102)购自武汉博士德生物工程有限公司;人白细胞介素-1β(interleukin-1β,IL-1β)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、IL-17A ELISA试剂盒购自杭州联科生物技术有限公司,批号分别为70-EK106/2-96、70-EK187-96、70-EK117/2-96。
1.4 仪器
SpectraMaxR iD5型全波长多功能酶标仪[美国美谷分子仪器(上海)有限公司];Forma 3111型细胞培养箱(美国Thermo Fisher Scientific公司);SP8 SR STED型超高分辨激光共聚焦显微镜(德国Leica公司);JSM-IT510型InTouchScop扫描电子显微镜(SEM,日本电子公司);SW-CJ-2FD型超净作台(上海苏州安泰空气技术有限公司);AE2000型倒置显微镜(Motic股份有限公司);Mini PROTEAN型蛋白电泳仪、Mini Trans-Blot蛋白转印系统、ChemiDoc超高灵敏度化学发光成像系统(美国Bio-Rad公司);Milli-Q Plus超级纯水仪(美国Millipore公司);SK-O180-S型数显圆周摇床(上海珂淮仪器有限公司)。
2 方法
2.1 CD39酶活性促进筛选实验
按照AMP-GloTM试剂盒说明书,对黄连单体成分小檗碱、黄连碱、巴马汀、药根碱和表小檗碱进行CD39酶活性促进作用筛选,单体终浓度为10 μmol/L,另设对照组加入DMSO,采用酶标仪测定吸光度()值,采用GraphPad Prism 8.4.0软件拟合数据计算半数致死浓度(median effective concentration,EC50)值。
2.2 体内实验
2.2.1 分组、造模与给药 48只雄性C57BL/6小鼠适应性喂养1周后,随机分为对照组、模型组、MCC950组(10 mg/kg)和表小檗碱低、中、高剂量(30、60、120 mg/kg)[17]组,每组8只。除对照组外,其余各组ip 0.3 mL LPS(12 mg/kg)建立SALI模型,分别于造模前24 h和造模0.5 h后ip 0.3 mL MCC950或表小檗碱,造模后24 h收集各组小鼠肺组织及肺泡灌洗液。
2.2.2 肺组织病理学观察 每组取4只小鼠收集左肺组织,生理盐水清洗后用OCT包埋胶固定,冰冻切片成8 μm薄片,进行苏木素-伊红(HE)染色,于显微镜下观察肺组织病理变化。
2.2.3 肺肿胀度评估 取“2.2.2”项下各组小鼠右肺,生理盐水清洗后用滤纸吸干水分,称定质量标记为湿质量;60 ℃条件下烘干24 h,称定质量标记为干质量,记录湿质量/干质量。
2.2.4 ELISA法检测肺泡灌洗液中IL-1β、MCP-1和IL-17A水平 取各组剩余4只小鼠,参考文献方法[2]收集肺泡灌洗液,4000 r/min离心10 min,吸取上清,按照试剂盒说明书测定IL-1β、MCP-1和IL-17A水平。
2.3 体外实验
2.3.1 细胞培养 THP-1细胞用含10%胎牛血清、1%青霉素-链霉素、0.05 mmol/L β-巯基乙醇的RPMI 1640培养基,于37 ℃、5% CO2培养箱培养,取对数生长期细胞进行实验。
2.3.2 Western blotting法检测CD39、P2X7、GSDMD蛋白表达 THP-1细胞以1×106个/mL接种于6孔板中,加入100 nmol/L PMA诱导24 h,贴壁后随机分为对照组、模型组、小檗碱(10 μmol/L)或番泻苷A(10 μmol/L)组或VX-765(0.5 μmol/L)组和表小檗碱低、中、高剂量(3、10、30 μmol/L)组。除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组分别加入相应药物孵育3 h后,除对照组外各组另加入5 mmol/L ATP继续刺激45 min。收集细胞,加入RIPA裂解液提取蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%牛血清白蛋白中封闭,分别加入CD39、P2X7、GSDMD抗体,4 ℃孵育过夜;加入二抗,室温孵育2 h,加入超敏ECL化学发光试剂,于凝胶成像仪中曝光显影。
2.3.3 YO-PRO-1染料摄取实验 THP-1细胞以5×105个/mL接种于poly-D-赖氨酸包被的96孔板上,用检测缓冲液清洗细胞,加入含1 μmol/L YO-PRO-1和10 μmol/L表小檗碱的检测缓冲液80 μL,37 ℃孵育20 min;细胞在485 nm激发,530 nm记录发射,记录持续120 s,在20 s时加入300 μmol/L BzATP,以530 nm的最大变化量进行定量分析,评价P2X7通道蛋白开放功能。
2.3.4 ELISA法检测上清液中IL-1β水平 THP-1细胞接种于96孔板中,加入100 nmol/L PMA诱导24 h,贴壁后随机分为对照组、模型组、VX-765(0.5 μmol/L)组和表小檗碱低、中、高剂量(3、10、30 μmol/L)组。分别进行以下处理后,收集各组培养基上清液,按照试剂盒说明书测定IL-1β水平。
(1)LPS+ATP:除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组分别加入相应药物孵育3 h后,除对照组外各组另加入5 mmol/L ATP继续刺激45 min。
(2)LPS+nigericin:除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组加入相应药物孵育1 h后,除对照组外各组另加入5 μmol/L nigerincin继续刺激6 h。
(3)LPS+MSU:除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组加入相应药物孵育1 h后,除对照组外各组另加入150 μg/mL MSU继续刺激6 h。
(4)poly(dA:dT)转染:除对照组外,其余各组加入0.5 μg/mL Lip2000转染poly(dA:dT),4 h后更换新鲜培养基,各给药组加入相应药物继续孵育24 h。
2.3.5 免疫荧光法观察NLRP3炎症小体组装情况 THP-1细胞接种于96孔板中,加入100 nmol/L PMA诱导24 h,贴壁后随机分为对照组、模型组、VX-765(0.5 μmol/L)组和表小檗碱(30 μmol/L)组。除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组分别加入相应药物孵育3 h后,除对照组外各组另加入5 mmol/L ATP继续刺激45 min。以多聚甲醛固定细胞,加入NLRP3兔抗和ASC鼠抗,4 ℃孵育过夜;加入DAPI、Alexa Fluor 488标记的山羊抗兔IgG(H+L)二抗及Alexa Fluor 555标记的驴抗小鼠IgG(H+L)二抗,室温孵育2 h,于激光共聚焦显微镜下观察并拍照,评价NLRP3炎症小体组装情况。
2.3.6 SEM观察细胞焦亡 按“2.3.5”项下方法进行分组及处理,用2.5%戊二醛固定细胞,加入1%四氧化锇和3%亚铁氰化钾,4 ℃孵育1 h,于0.3%硫代卡波苷中室温孵育5 min,于1%四氧化锇中4 ℃浸泡20 min。样品经梯度乙醇脱水并嵌入切片后,使用含1%甲苯胺蓝和2%硼酸盐的溶液进行染色,于SEM下观察并拍照,评价细胞焦亡情况。
2.4 统计学分析

3 结果
3.1 黄连中CD39酶活性促进作用最强的异喹啉生物碱成分——表小檗碱
如图1所示,黄连生物碱小檗碱、黄连碱、药根碱、表小檗碱和巴马汀显示不同程度的CD39酶活性促进作用,其中表小檗碱作用最强(<0.01),EC50值为14.23 μmol/L,故选择表小檗碱进行后续实验。
3.2 表小檗碱减轻LPS诱导的脓毒症小鼠肺损伤
如图2所示,与对照组比较,模型组小鼠肺组织可见肺泡壁中度增厚,肺泡结构不清,肺泡轻度扩张并伴有中性粒细胞浸润,同时可见大量支气管上皮细胞坏死,黏液分泌增多。表小檗碱干预后肺泡结构趋于完整,炎性细胞明显减少,黏液分泌受到抑制,提示肺损伤程度减轻。与对照组比较,模型组小鼠肺湿质量/干质量值明显升高(<0.01),提示模型组小鼠肺肿胀;与模型组比较,MCC950及表小檗碱中、高剂量组小鼠肺湿质量/干质量值明显降低(<0.01)。与对照组比较,模型组小鼠肺泡灌洗液中促炎细胞因子IL-1β、MCP-1和IL-17A水平均明显升高(<0.01);与模型组比较,MCC950组小鼠肺泡灌洗液中IL-1β和IL-17A水平均明显降低(<0.01);表小檗碱中、高剂量组肺泡灌洗液中IL-1β、MCP-1和IL-17A水平均明显降低(<0.05、0.01),且呈剂量相关性。

与对照组比较:*P<0.05 **P<0.01
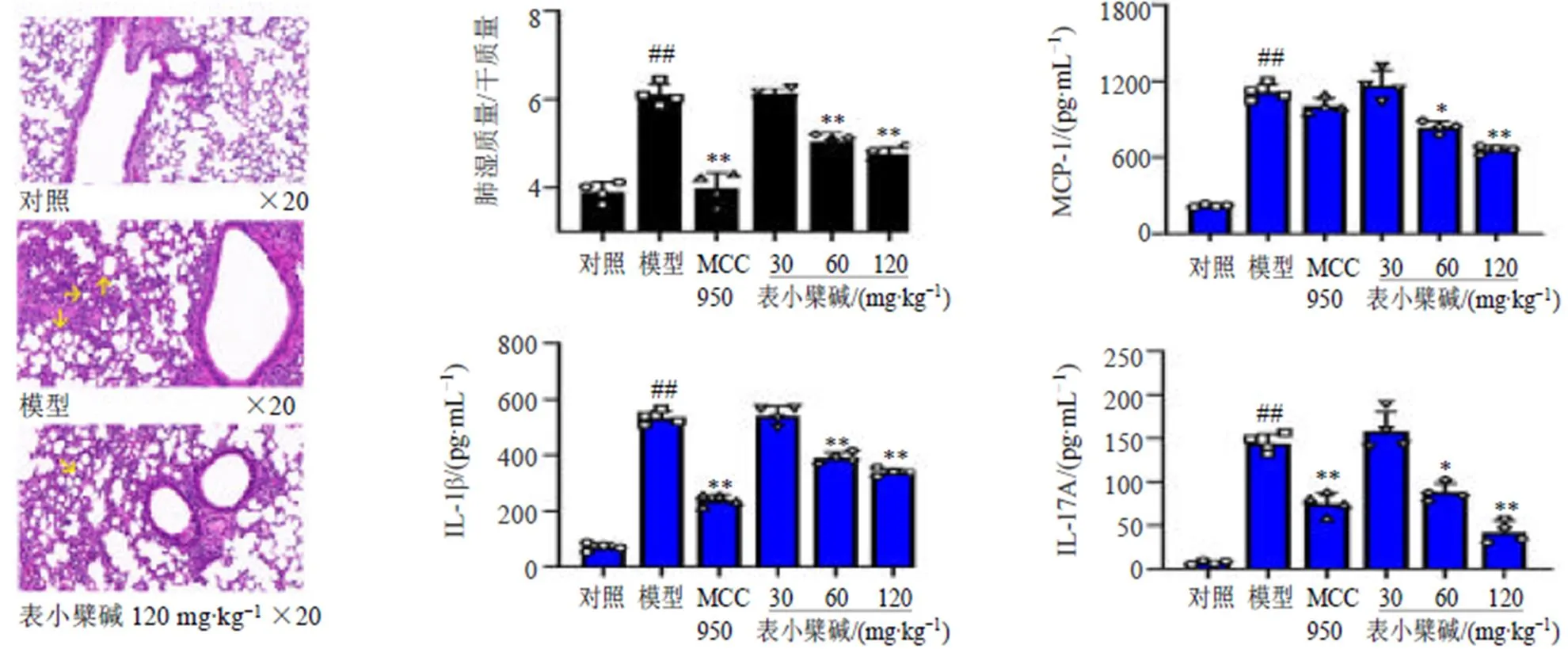
箭头表示肺泡扩张、中性粒细胞浸润及支气管上皮细胞坏死 与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
3.3 表小檗碱调控CD39-P2X7嘌呤能通路蛋白表达及功能
如图3-A所示,与对照组比较,LPS联合ATP介导CD39表达下调及P2X7蛋白过表达(<0.01);表小檗碱中、高剂量组显著上调CD39蛋白表达(<0.05、0.01),并抑制P2X7蛋白表达(<0.05、0.01),且呈剂量相关性;阳性对照药物小檗碱和番泻苷A分别上调CD39和下调P2X7蛋白表达水平(<0.05、0.01),与文献报道[18-19]一致。如图3-B所示,采用BzATP介导P2X7通道开放,表小檗碱干预后明显抑制YO-PRO-1染料摄取,提示表小檗碱抑制P2X7功能。

图3 表小檗碱调控CD39-P2X7嘌呤能通路蛋白表达(A) 及功能(B) (, n = 3)
3.4 表小檗碱抑制CD39-P2X7下游NLRP3和黑素瘤缺乏因子2(absent in melanoma 2,AIM2)炎症小体激活
如图4-A所示,与对照组比较,LPS联合ATP、LPS联合nigericin、LPS联合MSU(激活NLRP3)以及poly(dA:dT)质粒转染(激活AIM2)均引发炎症小体激活,引发IL-1β大量分泌(<0.01);Caspase-1特异性抑制剂VX-765以及各剂量表小檗碱不同程度抑制以上4组刺激物介导的IL-1β生成,且表小檗碱作用呈现浓度相关性。采用激光共聚焦显微镜考察NLRP3炎症小体的组装,如图4-B所示,LPS联合ATP诱导pro Caspase-1与ASC间、ASC与NLRP3间蛋白-蛋白相互绑定,VX-765及表小檗碱明显逆转以上蛋白间相互作用。
3.5 表小檗碱逆转LPS联合ATP介导的细胞焦亡
如图5-A所示,LPS联合ATP介导焦亡标志性蛋白GSDMD-N蛋白的过表达(<0.01),而Caspase-1特异性抑制剂VX-765及中、高剂量的表小檗碱明显降低GSDMD-N蛋白表达水平(<0.05、0.01),且表小檗碱的作用呈剂量相关性。如图5-B所示,LPS联合ATP刺激诱导细胞膜空洞的形成,提示细胞焦亡发生;VX-765及表小檗碱干预后细胞膜孔洞形成受到明显抑制,提示表小檗碱逆转LPS联合ATP诱导的细胞焦亡。
4 讨论
脓毒症的特征是宿主对入侵病原体的反应失调,可导致多个危及生命的器官功能障碍。其中肺是最先也是最常衰竭的器官,也是脓毒症患者死亡的最重要预后因素之一。目前针对SALI尚无特效疗法。中医以“湿邪致病”定义脓毒症病机,而黄连具有清热燥湿、泻火解毒的药效,且临床上治疗脓毒症疗效确切。本研究从CD39-P2X7嘌呤能路径入手,揭示了黄连异喹啉的单体成分表小檗碱调控NLRP3-GSDMD焦亡改善SALI的新机制。
本研究采用LPS建立小鼠SALI模型,肺组织HE染色发现肺泡壁中度增厚,肺泡结构不清,肺泡轻度扩张并伴有中性粒细胞浸润,同时可见大量支气管上皮细胞坏死,黏液分泌增多。而表小檗碱干预后,可明显观测到肺组织结构趋于完整,炎性细胞减少。通过考察肺组织湿质量/干质量,发现LPS造模后小鼠肺肿胀增加,而中、高剂量的表小檗碱能够明显缓解肺肿胀。进一步检测小鼠肺泡灌洗液中促炎细胞因子水平,结果显示表小檗碱有效抑制IL-1β、MCP-1和IL-17A产生。综合以上宏观指标和通路下游指标,表小檗碱对LPS介导的SALI具有明确的改善作用。目前已有文献报道证实单味药黄连[20]、小檗碱[21]、黄连碱[22]和巴马汀[23]可改善SALI,本研究补充证实了另一黄连异喹啉成分表小檗碱逆转SALI的药效,可为黄连的抗炎作用提供更多的数据支撑。
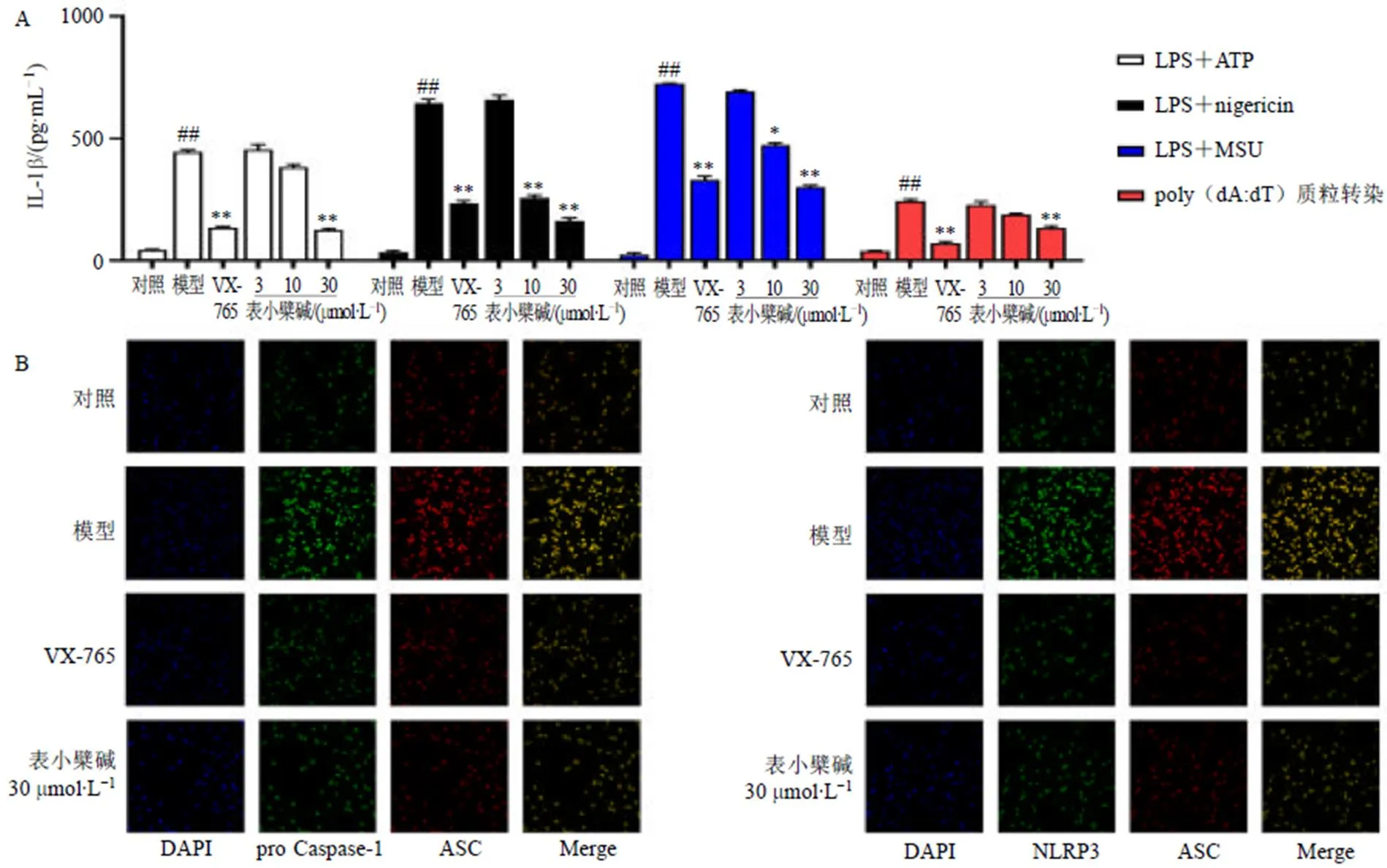
图4 表小檗碱抑制4组刺激物诱导的IL-1β过度分泌(A) 并能逆转LPS联合ATP介导的NLRP3炎症小体组装(B) (, n = 6)
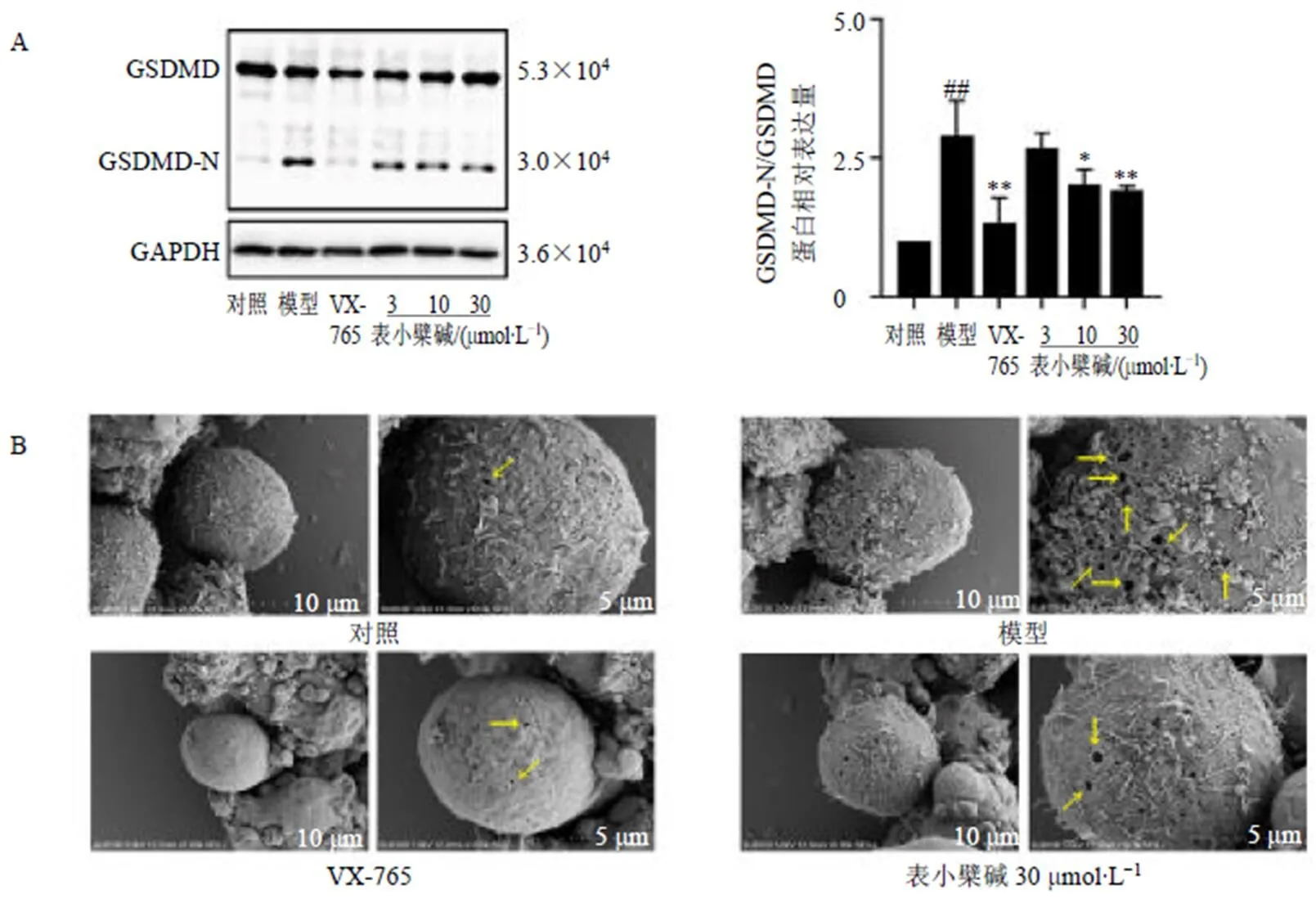
A-Western blotting检测焦亡蛋白表达 B-SEM检测细胞超微结构,箭头表示细胞膜上孔洞
目前SALI的发病机制尚不完全清楚,现有研究已明确了NLRP3炎症小体-焦亡路径参与介导SALI的部分机制[24],而CD39-P2X7嘌呤能路径作为NLRP3炎症小体的上游调控者,有关其对SALI发生发展的研究还很局限。为深入研究表小檗碱调控CD39-NLRP3-GSDMD路径并改善SALI的作用机制,本研究采用LPS联合ATP刺激THP-1细胞激活嘌呤能通路,发现CD39蛋白表达受到抑制而P2X7蛋白表达升高,且P2X7通道被打开,炎症应答明显,而表小檗碱干预后以上改变得到逆转,提示表小檗碱可介导嘌呤能调节性“刹车”。本研究结果证实表小檗碱从膜蛋白水平和功能层面便已开始行使抗炎药效。黄连其他异喹啉单体成分对CD39-P2X7路径的调节机制也有零星的证据。例如,在氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)刺激的巨噬细胞中,小檗碱下调P2X7受体水平[25];在糖尿病神经性疼痛大鼠模型中,巴马汀抑制海马P2X7受体表达[26]。本研究发现表小檗碱对CD39的上调作用及P2X7蛋白水平和功能的抑制作用,极大程度上为黄连调控嘌呤能通路提供了佐证。
进一步探究表小檗碱对炎症小体激活和组装的影响,发现与小檗碱类似,表小檗碱降低4组刺激物诱导的IL-1β分泌,提示表小檗碱干扰NLRP3(LPS联合ATP/nigericin/MSU)和AIM2炎症小体(polydA:dT)的激活。此外,表小檗碱逆转LPS联合ATP介导的pro Caspase-1-ASC间和ASC-NLRP3蛋白-蛋白相互作用,由此抑制NLRP3炎症小体组装。考虑到NLRP3炎症小体激活引起的Caspase-1剪切功能成熟可切割焦亡调控靶标GSDMD,游离的端GSDMD介导细胞膜孔洞的形成并最终导致焦亡。本研究发现表小檗碱与Caspase-1特异性抑制剂VX-765功能类似,可明显抑制LPS联合ATP诱导的GSDMD-N蛋白过表达并减少细胞膜孔洞的形成,阻碍细胞焦亡的发生(图6)。
焦亡作为有炎症参与的细胞程序性死亡方式,参与了多种炎症相关疾病的发生与发展。除本研究关注的脓毒症以外,近年来焦亡热点疾病类型包括自身免疫疾病、感染类疾病和肿瘤[27-28]。目前针对以上疾病治疗的代表性化学药包括甾体类药物、免疫抑制剂和单抗药物等,而该类药物存在不良反应多(代谢紊乱、诱发或加重感染等)以及经济负担相对较大的缺点。中医治疗SALI主要从改善“湿、热、毒、瘀、虚”入手,而黄连作为代表性清热燥湿、泻火解毒上品中药,具有靶点丰富、不良反应小和价格相对低廉的优势。本研究明确了黄连异喹啉单体成分表小檗碱改善SALI的药效并揭示了其调控CD39-NLRP3-GSDMD焦亡路径潜在机制,可为表小檗碱及黄连开发为抗脓毒症药物提供理论支撑,也有助于拓展中医药治疗脓毒症和焦亡相关疾病的思路。

标红部分为表小檗碱的直接靶位
利益冲突 所有作者均声明不存在利益冲突
[1] Vandewalle J, Libert C. Sepsis: A failing starvation response [J]., 2022, 33(4): 292-304.
[2] Englert J A, Bobba C, Baron R M. Integrating molecular pathogenesis and clinical translation in sepsis-induced acute respiratory distress syndrome [J]., 2019, 4(2): e124061.
[3] Zhang H, Zeng L, Xie M,. TMEM173 drives lethal coagulation in sepsis [J]., 2020, 27(4): 556-570.
[4] Fajgenbaum D C, June C H. Cytokine storm [J]., 2020, 383(23): 2255-2273.
[5] Dwyer K M, Kishore B K, Robson S C. Conversion of extracellular ATP into adenosine: A master switch in renal health and disease [J]., 2020, 16(9): 509-524.
[6] Jing W D, Pilato J L, Kay C,.α-toxin activates the NLRP3 inflammasome by engaging GPI-anchored proteins [J]., 2022, 7(71): eabm1803.
[7] Miyamoto E, Takahagi A, Ohsumi A,.delivery of regulatory T-cells for control of alloimmune priming in the donor lung [J]., 2022, 59(4): 2100798.
[8] 曾祥珲, 邓贤斌, 颜芳, 等. 基于六经辨证探讨血行感染脓毒症的治疗 [J]. 上海中医药杂志, 2022, 56(4): 38-41.
[9] 袁晓雯, 姜楠, 陈冰, 等. 单味中药治疗脓毒症的研究进展 [J]. 中国中医基础医学杂志, 2017, 23(5): 736-739.
[10] 陈美琳, 李芝奇, 范琦琦, 等. 小檗碱药理作用及其相关作用机制研究进展[J]. 中草药, 2022, 53(18): 5861-5872.
[11] Wu J S, Hu Y F, Xiang L,. San-Huang-Xie-Xin-Tang constituents exert drug-drug interaction of mutual reinforcement at both pharmacodynamics and pharmacokinetic level: A review [J]., 2016, 7: 448.
[12] 刘昊, 周志斌. 小檗碱调脂的研究进展[J]. 药物评价研究, 2019, 42(8): 1676-1679.
[13] Wu J S, Luo Y, Jiang Q,. Coptisine fromblocks NLRP3 inflammasome activation by inhibiting caspase-1 [J]., 2019, 147: 104348.
[14] Wu J S, Zhang H, Hu B Y,. Coptisine frominhibits production of inflammatory mediators in lipopolysaccharide-stimulated RAW264.7 murine macrophage cells [J]., 2016, 780: 106-114.
[15] 吴嘉思, 黄文戈, 罗煜, 等. 黄连异喹啉生物碱盐酸巴马汀对NLRP3炎症小体通路调控机制研究 [J]. 中药药理与临床, 2018, 34(5): 26-29.
[16] Wu J S, Luo Y, Deng D H,. Coptisine fromexerts diverse beneficial properties: A concise review [J]., 2019, 23(12): 7946-7960.
[17] Yu M, Ren L, Liang F,. Effect of epiberberine fromFranch on inhibition of tumor growth in MKN-45 xenograft mice [J]., 2020, 76: 153216.
[18] Cavaillon J M, Singer M, Skirecki T. Sepsis therapies: Learning from 30 years of failure of translational research to propose new leads. [J]., 2020, 12(4): e10128.
[19] Wu J, Lan Y, Shi X,. Sennoside A is a novel inhibitor targeting caspase-1. [J]., 2022,13(19): 9782-9795
[20] 崔蓉. 黄芩和黄连对急性肺损伤大鼠的保护作用及其与胆碱能抗炎通路的相关性实验研究 [D]. 成都: 成都中医药大学, 2012.
[21] Wang Y, Du P F, Jiang D H. Berberine functions as a negative regulator in lipopolysaccharide-induced sepsis by suppressing NF-κB and IL-6 mediated STAT3 activation [J]., 2020, 78(7): ftaa047.
[22] Hu Y F, Wang L, Xiang L,. Pharmacokinetic-pharmacodynamic modeling for coptisine challenge of inflammation in LPS-stimulated rats [J]., 2019, 9(1): 1450.
[23] Song Y D, Xu C Y, Wu J X,. Palmatine alleviates LPS-induced acute lung injury via interfering the interaction of TAK1 and TAB1 [J]., 2022, 202: 115120.
[24] Kang J Y, Xu M M, Sun Y,. Melatonin attenuates LPS-induced pyroptosis in acute lung injury by inhibiting NLRP3-GSDMD pathway via activating Nrf2/HO-1 signaling axis [J]., 2022, 109: 108782.
[25] Lu L, Huang J J, Xue X,. Berberine regulated miR150-5p to inhibit P2X7 receptor, EMMPRIN and MMP-9 expression in oxLDL induced macrophages [J]., 2021, 12: 639558.
[26] Shen Y L, Guan S, Ge H X,. Effects of palmatine on rats with comorbidity of diabetic neuropathic pain and depression [J]., 2018, 139: 56-66.
[27] Yu P, Zhang X, Liu N,. Pyroptosis: Mechanisms and diseases [J]., 2021, 6(1): 128.
[28] Kesavardhana S, Malireddi R K S, Kannegati T D. Caspases in cell death, inflammation, and pyroptosis [J]., 2020, 38: 567-595.
Mechanism of epiberberine on ameliorating sepsis-induced lung injury via modulation of CD39-NLRP3-GSDMD and downstream pyroptosis
WU Jia-si1, LAN Yue-jia2, WANG Jun3, WANG Huan2
1. School of Acupuncture and Tuina, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. Department of Pharmacy, Ya’an People’s Hospital, Ya’an 625000, China
To explore the mechanism of epiberberine on improving sepsis-induced lung injury based on CD39-NOD-like receptor thermal protein domain associated protein 3 (NLRP3)-GSDMD and downstream pyroptosis.CD39 enzymatic activity of isoquinoline alkaloids fromsuch as berberine, coptisine, palmatine, epiberberine and jatrorrhizine, were investigated by AMP-GloTMexperiment. Mice were ip lipopolysaccharide (LPS, 12 mg/kg) to establish sepsis-induced lung injury model, epiberberine or MCC950 were given 24 h before and 0.5 h after modeling, and pathological changes of lung tissue in mice were observed by hematoxylin-eosin (HE) staining at 24 h after modeling; Wet weight/dry weight ratio of lung tissue was calculated to evaluate lung swelling; Levels of interleukin-1β (IL-1β), monocyte chemotactic protein-1 (MCP-1) and IL-17A in alveolar lavage fluid were detected by ELISA. The 1 μg/mL LPS combined with 5 mmol/L adenosine triphosphate (ATP)/5 μmol/L nigericin/150 μg/mL MSU or transfection of 0.5 μg/mL poly(dA:dT) were used to stimulate THP-1 cells to replicate inflammatory model, epiberberine or VX-765 was given to intervene. The expressions of CD39-NLRP3-GSDMD pathway protein were detected by Western blotting; IL-1β level in supernatant was detected by ELISA; Immunofluorescence was used to evaluate the assembly of NLRP3 inflammatory bodies; Scanning electron microscope was used to evaluate the cell pyroptosis. BzATP-mediated channel opening of ligand-gated ion channel receptor 7 (P2X7) was used to investigate the effect of epiberberine on P2X7 function.Enzymatic activity of CD39 in epiberberine was the best, with median effective concentration (EC50) of 14.23 μmol/L. Compared with control group, mice in model group showed abnormal lung tissue structure and inflammatory infiltration, and lung swelling was obvious (< 0.01), and levels of inflammatory factors in alveolar lavage fluid were significantly increased (< 0.01); After epiberberine intervention, above changes were effectively reversed (< 0.05, 0.01), and with a dose-dependent relationship. Above effects were related to up-regulation of CD39 protein expression, inhibition of P2X7 over-expression, interference of NLRP3 inflammatory body assembly, reduction of GSDMD-N protein expression, reversal of GSDMD-mediated macrophage scorch and reduction of IL-1β level by epiberberine (< 0.05, 0.01).Epiberberine can reverse lung injury and lung swelling by inhibiting IL-1β, MCP-1 and IL-17A levels in alveolar lavage fluid of mice with septic lung injury, which may be related to regulating CD39-NLRP3-GSDMD and downstream pyroptosis.
epiberberine; sepsis-induced lung injury; CD39; inflammasome; pyroptosis
R285.5
A
0253 - 2670(2023)01 - 0112 - 10
10.7501/j.issn.0253-2670.2023.01.014
2022-08-30
国家自然科学基金青年基金项目(82104491);中国博士后科学基金面上资助地区专项支持计划(2021M693789);四川省自然科学基金面上项目(2023NSFCSC2036);成都中医药大学杏林学者提升计划项目(BSH2020024)
吴嘉思,讲师,博士后,硕士研究生导师,从事中药药理与毒理研究。E-mail: wujiasi@cdutcm.edu.cn
[责任编辑 李亚楠]
