杞属植物酰胺类成分及其生物活性研究进展
2023-01-10陈栋杰伊艳玲段金廒
陈栋杰,郭 盛*,伊艳玲,张 芳,段 然,徐 盼,段金廒*
杞属植物酰胺类成分及其生物活性研究进展
陈栋杰1,郭 盛1*,伊艳玲1,张 芳1,段 然2,徐 盼1,段金廒1*
1. 南京中医药大学 江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023 2. 宁夏枸杞创新中心,宁夏 银川 750002
茄科枸杞属植物是一类具有重要药用价值的资源植物类群。现代研究表明枸杞属植物中的化学成分种类繁多,类型多样,主要包括多糖类、类胡萝卜素类、酰胺类和有机酸类等。随着近几年对其小分子物质研究的深入,逐渐发现酰胺类成分结构类型多样、生物活性丰富,是一类值得关注和深入研究的资源性化学物质。为进一步阐明枸杞属植物中酰胺类成分的化学结构特征和生物活性,对已有报道的宁夏枸杞、枸杞、云南枸杞及黑果枸杞等枸杞属植物中的135个酰胺类成分的类型和生物活性进行综述,以期为枸杞属植物资源的高效利用提供参考。
枸杞属;酰胺类;生物活性;宁夏枸杞;枸杞;云南枸杞;黑果枸杞
茄科(Solanaceae)枸杞属L.植物是一类具有重要药用价值及经济价值的资源植物类群,《中国植物志》[1]中记载枸杞属植物全球约80种,主要分布在南美洲,少数分布于欧亚大陆温带,我国产7种3变种,主要分布于华北及西北地区,且近年发现了该属多种新种质资源[2]。《中国药典》2020年版规定宁夏枸杞L.的干燥成熟果实可作枸杞子入药,宁夏枸杞及枸杞Mill.的干燥根皮可作地骨皮入药。
目前有关枸杞属植物的化学研究主要集中于该属植物中具有较高经济价值的物种如宁夏枸杞、枸杞、黑果枸杞Murr.及云南枸杞Kuang et A. M. Lu等,其含有的化学成分类型多样,主要有多糖及寡糖类、类胡萝卜素类、香豆素类、木脂素类、黄酮类、酰胺类、生物碱类、有机酸类等化学成分[3-5],且研究相对较为集中的主要为多糖类[6-9]、类胡萝卜素类[10-12]、含氮有机物[13]等化学成分[14]。现代药理研究表明该属植物具有免疫调节、抗氧化、抗衰老、调血脂、降血糖、神经保护等生理活性[15-16]。
本团队在枸杞子功效物质系统研究的基础上,发现其中的酰胺类成分结构类型多样、生物活性丰富,是一类值得关注和深入研究的资源性化学物质。为此,本文对前人文献报道的枸杞属植物类群中含有的酰胺类化学成分及其生物活性进行了较为系统的梳理,以期为枸杞属植物资源开发利用和枸杞资源产业的高质量发展提供借鉴。
1 枸杞属植物中酰胺类成分类型
酰胺类化合物是指由共轭胺部分与含羧酸基团的化合物发生酰胺化反应生成的产物。以“”“amide”“枸杞”“酰胺”“枸杞属”等为关键词,在SciFinder、Web of Science、Pubmed、CNKI等文摘或全文数据库中进行系统检索,并参考前人综述,全面统计已报道的枸杞属植物中酰胺类化合物共135个。
酰胺类成分根据酚酰胺配体的类型可分为肉桂酰胺类、新木脂酰胺类、木脂素酰胺类和其他酰胺类,在植物体内参与多种生物活动[17-23]。
1.1 肉桂酰胺类
肉桂酰胺类的酚酰胺配体大多由香豆酸、咖啡酸、阿魏酸和二氢咖啡酸组成。其共轭胺部分主要由酪胺、苯乙胺、多巴胺、腐胺、色胺、精胺、亚精胺等组成,根据其胺部分的不同又将其分为芳香单胺缀合酚酰胺类和多胺缀合酚胺类。目前已报道的枸杞属植物肉桂酰胺类化合物共75个(表1),主要来源于枸杞、宁夏枸杞、黑果枸杞、云南枸杞及阿拉伯枸杞中,其化学结构见图1。对所得数据进行分析发现,目前这类化合物多发现于根及果实中,其中只在根中发现的有24个以及只在果实中发现的有36个。值得关注的是该类成分的糖苷化产物大多发现于果实中,特别是其中的亚精胺型衍生物的糖苷化产物,推测其是枸杞属植物的潜在生物标志物。
1.1.1 肉桂酰胺类成分的生物合成路径 肉桂酰胺类的生物合成路径[20]可分为酚酰胺配体部分和共轭胺部分。
酚酰胺配体部分是由苯丙氨酸在苯丙氨酸解胺酶(phenylalanine ammonia-lyase,PAL)作用下发生脱氨基反应生成肉桂酸,再由肉桂酸4-羟化酶作用下转化为对香豆酸,同时对香豆酸有可能发生羟基化转化为咖啡酸,咖啡酸再被咖啡酸/阿魏酸5-羟基化酶(caffeic acid--methyltransferase,COMT)催化生成阿魏酸,这一过程中生成的肉桂酸类衍生物均可能被4-羟基肉桂酰辅酶(4-coumarate CoA ligase,4CL)作用生成羟基肉桂酰辅酶A酯。
共轭胺部分则根据其类型分为两类:第1类,芳香单胺,如酪胺、色胺、章鱼胺等,其主要为色氨酸通过色氨酸5-羟化酶转化为5-羟色胺,及酪氨酸在酪氨酸脱羧酶的作用下发生脱羧反应生成酪胺,酪胺则经过酪胺羟化酶催化进一步生成章鱼胺。第2类,多胺,如尸胺、腐胺、亚精胺等,其主要由鸟氨酸通过鸟氨酸脱羧酶或精氨酸通过脱羧酶作用发生脱羧反应生成腐胺,腐胺再由精胺合酶及亚精胺合酶催化,转化为精胺或亚精胺。其中精胺和亚精胺可在相应酶作用下相互转化。
酚酰胺配体部分和共轭胺部分在酰基转移酶催化下生成最终的肉桂酰胺。这类酰基转移酶目前已报道有4条能够表达出相关功能的基因序列[21]。共轭胺部分为亚精胺及其糖苷化后的产物目前多在该属植物果实中发现,推测果实为亚精胺与肉桂酸衍生物发生酰基化反应所需酶及糖苷化所需酶的潜在作用部位。
1.1.2 肉桂酰胺类成分的含量研究 肉桂酰胺类成分在枸杞属植物中的含量相对较高。据报道宁夏枸杞果实中芳香单胺缀合酚酰胺类的含量为0.000 7~11.109 6 μg/g[22],其中-反式-阿魏酸酰酪胺(A15)含量最高,达(11.111±0.140)μg/g;-反式阿魏酰基-3--甲基多巴胺(A14)、-反式-阿魏酰基多巴胺(A20)、-反式-咖啡酰酪胺(A7)和-反式-咖啡酰多巴胺(A17)含量分别为(0.634±0.021)、(0.517±0.027)、(0.238±0.006)、(0.107 2±0.002 3)μg/g;- (α,β-二氢咖啡酰)酪胺(A1)、-反式-阿魏酰基苯乙胺(A18)、-反式-阿魏酰 3, 4-二甲氧苯乙胺(A19)及-反式-阿魏酰色胺(A40)则在宁夏枸杞果实中的含量较低,分别为(0.012 1±0.000 3)、(0.003 1±0.000 1)、(0.000 9±0.000 0)μg/g及(0.000 7±0.000 0)μg/g[22]。

表1 枸杞属植物肉桂酰胺类化合物

续表1

图1 枸杞属植物肉桂酰胺类化合物
Fig. 1 Cinnamamide compounds from Lycium genus
宁夏枸杞叶片中含量最高的为-反式阿魏酰基-3--甲基多巴胺(A14)、-反式-阿魏酸酰酪胺(A15)、-反式-咖啡酰酪胺(A7)和(α,β-二氢咖啡酰)酪胺(A1),分别为(42.200 3±1.692 6)、(20.762 2±1.304 2)、(2.143 2±0.053 0)、(1.694 2±0.064 5)μg/g[23]。
宁夏枸杞根皮中则以-反式-咖啡酰酪胺(A7)、-反式-阿魏酸酰酪胺(A15)、-反式阿魏酰基-3--甲基多巴胺(A14)及-(α,β-二氢咖啡酰)酪胺(A1)含量较高,分别为(26.45±0.15)、(10.6±0.51)、(5.39±0.24)、(4.864±0.075)μg/g;含量较低的-反式-阿魏酰基多巴胺(A20)、-3, 4-二羟基桂皮酰多巴胺(A6)、-反式-咖啡酰多巴胺(A17)及-反式-咖啡酰色胺(A39)分别为(0.611 3±0.010 6)、(0.324 3±0.008 0)、(0.317 6±0.021 9)、(0.049 6±0.002 8)μg/g;化合物-反式-咖啡酰基苯乙胺(A16),反式-阿魏酰基苯乙胺(A18),-反式-阿魏酰 3, 4-二甲氧苯乙胺(A19),-反式- 阿魏酰色胺(A40),3,4-二羟基桂皮酰苯乙胺(A5)和-3,4-二羟基桂皮酰色胺(A38)虽然也可检测到,但其含量较低[23]。地骨皮甲素(A69)和地骨皮乙素(A72)在枸杞根皮中大量存在,且根据产地的不同其含量也有所不同,含量范围分别为(1.13±0.02)~(9.65±0.26)mg/g和(3.39±0.22)~(22.08±0.11)mg/g[48]。
1.2 新木脂酰胺类成分
新木脂酰胺类化学成分的酚酰胺配体大多由新木脂素类组成,其共轭胺部分与肉桂酰胺类一致,均由多胺及芳香单胺组成。目前已报道枸杞属植物新木脂酰胺类化合物共34个(表2),主要来源于枸杞、宁夏枸杞及云南枸杞中,其化学结构式见图2。该类型化合物多发现于根及茎部位,在果实中仅发现11个。
该类型化合物的生物合成途径暂无报道,推测其与肉桂酰胺类相似,首先由肉桂酸衍生物发生聚合,然后生成相对应的乙酰辅酶A,再在酰基转移酶的催化下与共轭胺部分结合形成新木脂酰胺。
1.3 木脂酰胺类成分
木脂酰胺类化学成分的酚酰胺配体大多由木脂素类组成,其共轭胺部分与肉桂酰胺类一致,均由多胺及芳香单胺组成。
该类型化合物的生物合成途径及含量研究尚未见报道,推测其生物合成路径与肉桂酰胺类相似,均由木脂素类生成相对应的辅酶A,再在酰基转移酶的催化下与共轭胺部分结合形成木脂酰胺类成分。
目前枸杞属植物中木脂酰胺类成分共报道有15个(表3),主要来源于枸杞、宁夏枸杞及云南枸杞中,其化学结构见图3。该类型化合物目前多发现于根及茎部位,在果实中仅发现4个该类型成分。
1.4 其他酰胺类
目前枸杞属植物中已报道的其他酰胺类化合物共6个(表4),主要来源于枸杞中,其化学结构式见图4。其中化合物D3~D6是由几种氨基酸聚合而成。
2 生物活性
酰胺类化合物在植物中可起到调节植物生长发育、协助对抗环境胁迫及防御病害等作用[54]。现代研究显示,该类化合物具有抗氧化、抗炎及免疫调节、调血脂、治疗神经系统疾病等多重作用[57]。
2.1 抗氧化作用
研究表明氧化应激与许多疾病的病理进程有关[58],如炎症、神经退行性疾病等。酰胺类成分已被证实具有较强的抗氧化作用[24, 30-31, 34, 37, 43, 52-53],常用的评价方法有1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)法、氮蓝四唑(nitro-blue tetrazolium,NBT)法、氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法以及大鼠肝微粒体中的脂质过氧化损伤法等。DPPH法实验结果表明宁夏枸杞果实中的-反式-对香豆酰酪胺(A9)及-反式-阿魏酸酰酪胺(A15)抗氧化活性优于阳性药丁基大茴香醚(butyl hydroxy anisole,BHA),清除率分别为96.3%、96.1%。同时在大鼠肝微粒体脂质过氧化损伤试验中也表现出较强的抗氧化活性[52],两者的抗氧化能力无显著性差异。NBT法实验结果表明枸杞根皮中的-反式-咖啡酰酪胺(A7)及-顺式-咖啡酰酪胺(A25)的半数抑制浓度(IC50)值分别为(16.19±1.05)μg/mL和(12.66±1.53)μg/mL,表明-咖啡酰酪胺的顺反构型对抗氧化活性的发挥无明显影响[24]。
研究还发现该类化合物的抗氧化活性可因测定方法的不同而有所差异,如枸杞根皮中的- (α,β-二氢咖啡酰)酪胺(A1)、-反式-阿魏酰基章鱼胺(A13)、-顺式-阿魏酰章鱼胺(A32)采用DPPH 法测得的IC50值与采用NBT法测得的IC50值相差2倍,具有显著性差异,且顺反异构不会影响其活性[30]。不同来源的相同化合物抗氧化活性存在不同,如基于DPPH法进行评价,枸杞根皮中-(α,β-二氢咖啡酰)酪胺(A1)的IC50值为(61.2±2.3)μmol/L[30],而云南枸杞根中该化合物的IC50则为(21.15±0.66)μmol/L[53]。
2.2 抗炎及免疫调节作用
炎症是机体对潜在破坏性刺激的免疫反应。长期的急性炎症反应可显著增加哮喘、癌症和神经退行性疾病的风险[59]。常见的评价方法多为测定小鼠单核巨噬细胞白血病细胞(RAW 264.7)在脂多糖(lipopolysaccharide,LPS)刺激下的一氧化氮(nitric oxide,NO)释放水平。据报道,酰胺类成分大多具有抗炎活性[22-23, 25-27, 31, 33, 37, 50, 53]。Ho课题组[22-23]通过化学合成的方法得到了15个枸杞属植物中的酰胺类化合物并进行了抗炎活性评价,其细胞增殖实验结果表明具有反式咖啡酸及3,4-二羟基肉桂酸结构的化合物能够显著抑制细胞增殖,但苯环C-4位上的羟基甲基化后其对细胞增殖无明显影响,提示酰胺类化合物中的苯环上的邻位双羟基化对细胞增殖的影响相对较大。抗炎活性评价结果表明,具有反式咖啡酸结构的酰胺类成分对抗炎活性的发挥具有较大影响,具有反式阿魏酸以及二氢咖啡酸结构的酰胺类化合物则表现出较弱的抗炎活性。

表2 枸杞属植物新木脂酰胺类化合物
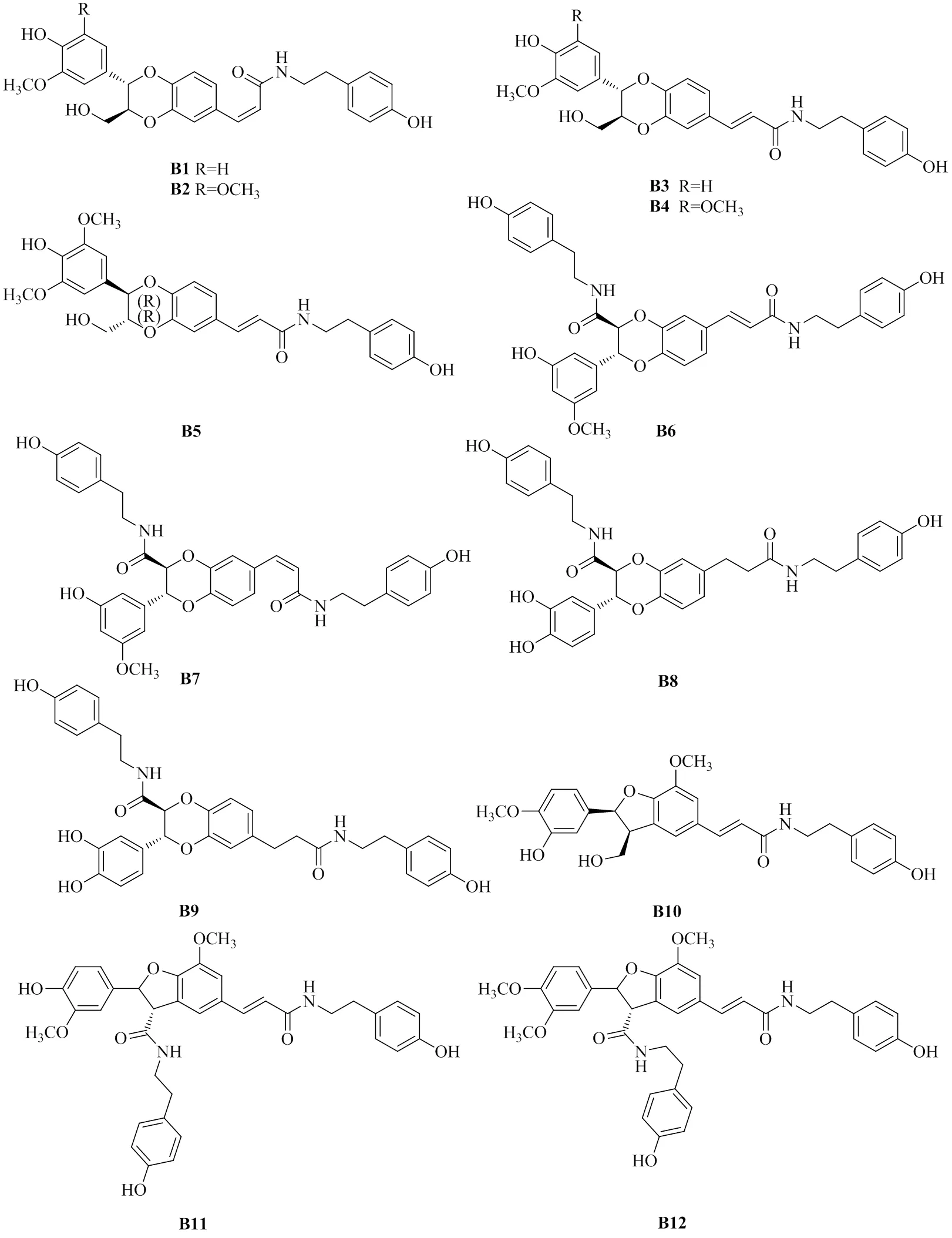
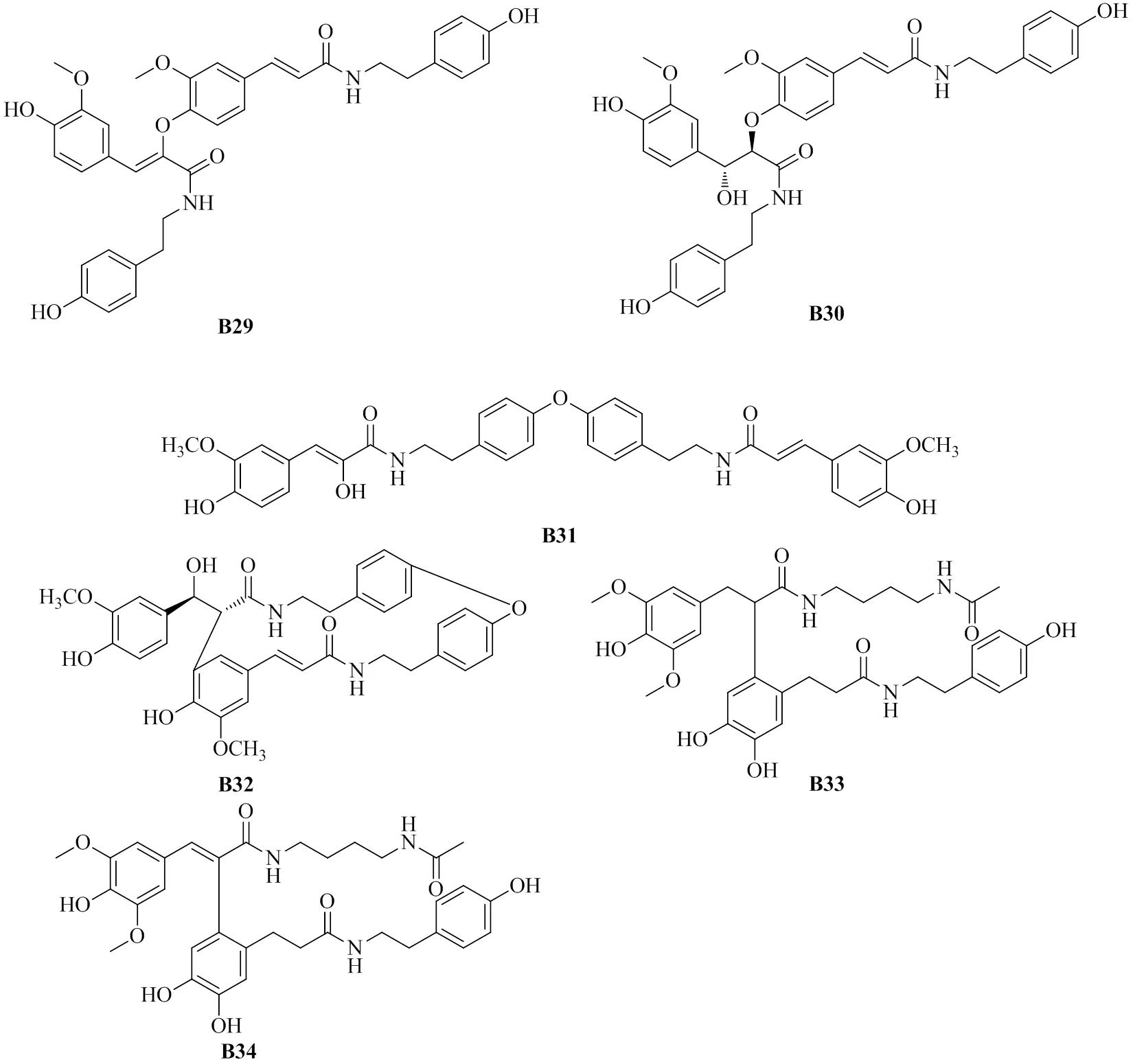
图2 枸杞属植物新木脂酰胺类化合物

表3 枸杞属植物木脂酰胺类化合物

图3 枸杞属植物木脂酰胺类化合物

表4 枸杞属植物其他酰胺类化合物
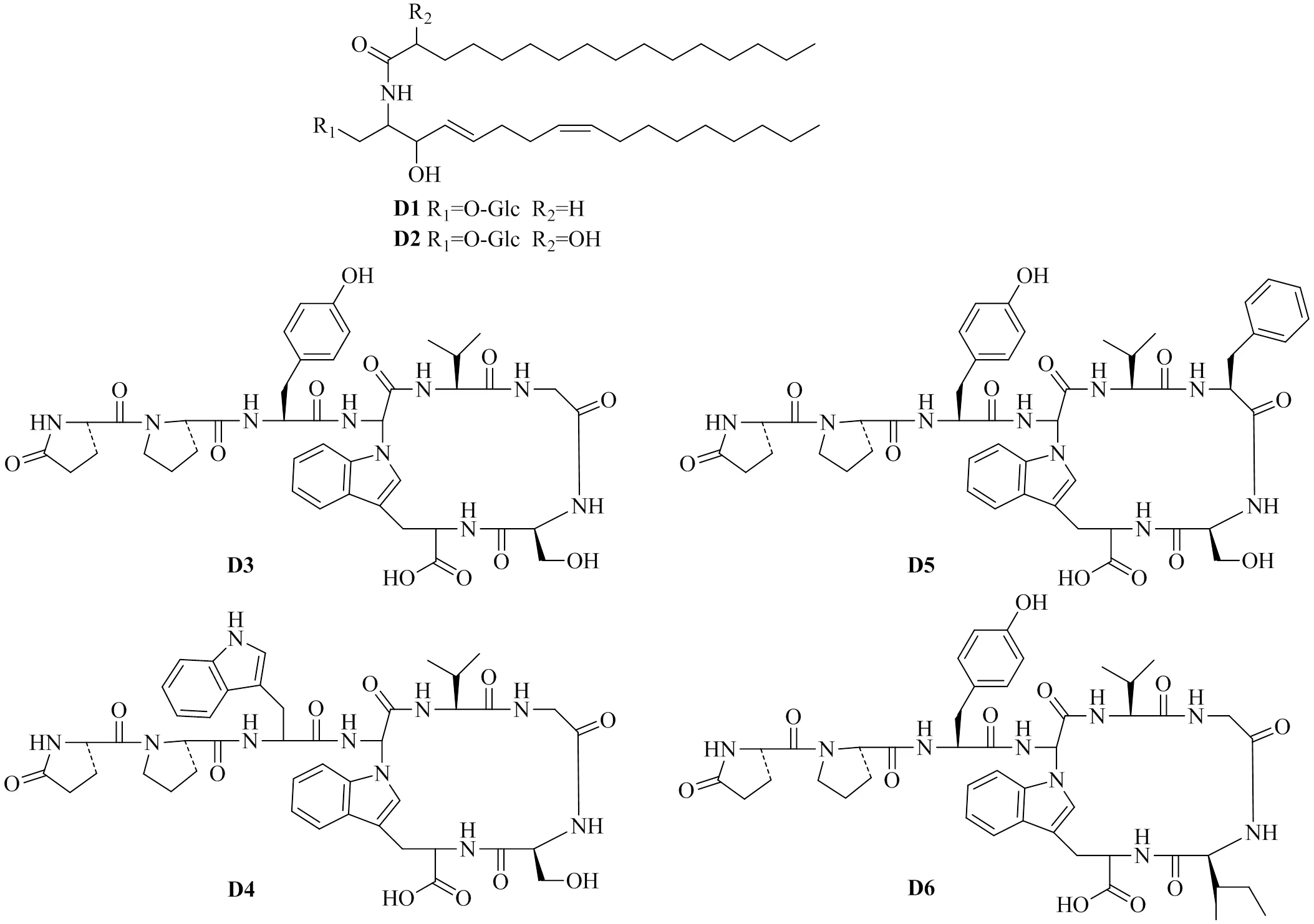
图4 枸杞属植物其他酰胺类化合物
环氧合酶(cyclooxygenase,COX)家族包括COX-1及COX-2均参与炎性介质和炎症疾病的调节[60]。枸杞根皮中的- (α,β-二氢咖啡酰)酪胺(A1)能够抑制伏波醇12-十四酸酯13-乙酸酯(phorbol 12-myristate 13-acetate,PMA)诱导的RAW 264.7细胞中前列腺素E2(prostaglandin E2,PGE2)的产生,且呈剂量相关性。同时能够通过阻断人细胞外信号调节激酶和c-Jun氨基末端激酶的催化活性,抑制CCAAT增强子结合蛋白β(CCAAT enhancer binding protein β,C/EBPβ)和激活物蛋白-1(activator protein-1,AP-1)的激活,从而抑制PMA诱导下RAW 264.7细胞中COX-2的表达[25]。罗晓东课题组[33]采用强的松致免疫缺陷小鼠模型注射二硝基氟苯以诱导迟发性超敏反应的方法,以其免疫器官指数和细胞因子水平为指标,对枸杞子总酚酰胺组分进行活性评价。研究结果发现该组分的免疫恢复活性优于枸杞多糖。体外实验结果表明总酰胺组分中的-反式阿魏酰基-3--甲基多巴胺(A14)、(±)-克罗酰胺(B11)、(,)-,-dityramin-4,4′-dihydroxy-3,5′-dimethoxy-β,3′-bicinnamamide(B23)及(±)-大麻酰胺 D(C9)在 20.0 μg/mL浓度下能够显著促进LPS刺激下的B淋巴细胞增殖,以及(±)-克罗酰胺(B11)、(,)-,-dityramin-4,4′-dihydroxy-3,5′-dimethoxy-β,3′-bicinnamamide(B23)及(±)-大麻酰胺 D(C9)能在20.0 μg/mL下促进刀豆蛋白刺激下的T淋巴细胞增殖。
综上结果表明,酰胺类成分具有较强的抗炎活性以及与枸杞多糖相当的免疫调节能力。但目前研究多集中于体外活性筛选,缺少体内实验的相关研究。
2.3 调血脂作用
高血脂症常导致动脉粥样硬化、冠心病等心血管疾病的发生。冯卫生课题组[51]基于地骨皮的降血压、降血糖和调血脂活性,采用人肝癌HepG2细胞模型对所得化合物的抗高脂血症活性进行了筛选。油红O染色实验结果表明其中7个化合物在10 mol/L浓度下具有较强的抗血脂活性,进一步研究表明7个化合物均具有抑制细胞内总甘油三酯(total triglyceride,TG)的活性,其中的()-2-(4,5-dihydroxy-2-{3-[(4-hydroxyphenethyl) amino]-3-oxopropyl} phenyl)-3-(4-hydroxy-3,5-dimethoxyphenyl)--(4-acetami-do butyl) acrylamide(B25)、()-2-(4,5-dihydroxy-2-{3-[(4-hydroxyphenethyl) amino]-3-oxopropyl}phenyl)-3-(4-hydroxy-3-methoxyphenyl)--(4-acetamidobutyl) acrylamide(B24)及-反式-咖啡酰酪胺(A7)具有抑制细胞内总胆固醇的活性。对其构效关系进行分析发现,不对称二聚体的活性较对称二聚体以及单体-(α,β-二氢咖啡酰)酪胺(A1)的调血脂活性强,且C-7/C-8处的双键结构也有助于增强其调血脂活性及选择性抑制TG和总胆固醇(total cholesterol,TC)的能力。N-(4-氨基丁基)-乙酰胺位于C-8位较位于C-8'位的降血脂活性更强,以及苯环上的羟基甲基化对TG的选择性抑制作用具有一定的影响[51]。
综上,酰胺类成分具有较好的调血脂活性。根据现有构效关系推测新木脂酰胺及木脂酰胺类的降血脂活性比肉桂酰胺类强,但仍需进一步实验验证。
2.4 治疗神经退行性疾病
神经退行性疾病是一种常见的老年病,主要为帕金森(parkinson’s disease,PD)和阿尔兹海默病(Alzheimer's disease,AD)。周正群等[33]采用转基因AD果蝇对所得的酰胺类化合物进行活性测试。结果表明,测试所用的15个化合物均有一定的抗AD作用,且与阳性药药效相当,随后又对化合物进行了硫磺素T(thioflavin T,ThT)结合实验、乙酰胆碱酯酶(acetylcholinesterase,AchE)酶抑制实验、DPPH自由基清除实验及ORAC实验对可能的机制进行研究。结果表明这类化合物可能是由于其较强的抗氧化和自由基清除能力从而产生抗AD作用。
在神经毒素诱导的帕金森病模型中,赵庆春课题组[61]发现地骨皮甲素能够通过调亡抑制和自噬增强来达到保护神经的作用,同时还对脑缺血状态下的神经具有一定的保护作用[62]。
2.5 其他
枸杞果实中的酰胺类化合物cerebrosides A(D1)和cerebrosides B(D2)能够显著抑制肝细胞在四氯化碳刺激下谷丙转氨酶(以及山梨醇脱氢酶的释放水平[54]。黑果枸杞果实中的N1,N3-bis(dihydrocaffeoyl)spermidine(A41)对NAD-依赖性去乙酰化酶Sirtuin-1(NAD-dependent deacetylase Sirtuin-1,SIRT1)具有较好的抑制活性且呈剂量依赖性,证明其在与SIRT1相关疾病中具有潜在的应用价值[35]。地骨皮乙素则可以通过调节核转录因子(如NF-κB)来改变脂质代谢,减少慢性炎症,最终达到促进代谢稳态,减轻2型糖尿病症状的目的。且该化合物在调节脂质代谢、脂肪氧化和抗炎方面具较好的效果[63]。研究还表明地骨皮甲素和地骨皮乙素具有预防和治疗2型糖尿病的作用[64-66]以及改善高脂饮食小鼠的胰岛素抵抗和脂肪肝的作用[67]。
此外,枸杞属植物中的酰胺类成分还报道有抗菌[36]、抗肿瘤[32]的作用,但相关研究多停留在体外实验,缺乏体内实验证据。
3 结语
枸杞属植物遍布全球,在我国因其较高的药用与经济价值而被广泛种植,其中尤以宁夏枸杞栽培范围较广且栽培面积较大,可分为宁夏、内蒙古、青海、新疆、甘肃五大栽培产区[68-71]。该属植物的果、叶、花、根均具有较好的开发前景[72-73],尤以宁夏枸杞及黑果枸杞的果实在国内外备受欢迎[68]。我国虽有庞大的枸杞产业,但目前枸杞资源的利用主要以简单加工的干果形式进行流通[69]。枸杞子的相关产品也都主要集中在枸杞多糖、枸杞药酒、枸杞果软糖、枸杞籽油等低附加值产品,其小分子资源性成分的利用率不高[14, 70, 74-76],造成了枸杞资源的极大浪费。
随着近年对枸杞属植物中小分子资源性成分研究的逐渐深入,酰胺类成分因其丰富的类型以及较好的生物活性成为近年来的研究热点。研究显示,该类化合物具有抗炎、抗氧化及降血脂等多种生理活性以及强于枸杞多糖的免疫调节活性。亚精胺类衍生物在宁夏枸杞中的含量可达2.1 g/kg且具有较好的抗AD活性[31]。地骨皮乙素(kukoamine B)在枸杞属植物根皮中的含量较高,具有治疗帕金森症、预防和治疗2型糖尿病等生物活性,同时被认为是治疗脓毒症的潜在候选药物,并已开始I期临床试验。肉桂酰胺类成分对几种革兰氏阳性和阴性菌均有较好的抑制作用[71]以及良好的抗氧化作用,在美国和日本作为食品防腐剂均已被批准使用[20]。
但目前对于酰胺类成分的活性研究大多停留在体外活性筛选,缺乏体内活性、代谢过程以及生物利用度的相关研究,限制了其开发和利用。因此,基于体内体外相关联的枸杞属植物酰胺类成分生物活性筛选,充分释放其潜在资源价值,将为枸杞属植物资源的开发利用提供重要支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 [M]. 北京: 科学出版社, 1978: 13.
[2] 钱丹, 纪瑞锋, 郭威, 等. 中国枸杞属种间亲缘关系和栽培枸杞起源研究进展[J]. 中国中药杂志, 2017, 42(17): 3282-3285.
[3] Qian D, Zhao Y X, Yang G,. Systematic review of chemical constituents in the genus(Solanaceae) [J]., 2017, 22(6): E911.
[4] Kulczyński B, Gramza-Michałowska A. Goji berry (): Composition and health effects–a review [J]., 2016, 66(2): 67-75.
[5] 吴励萍, 卢有媛, 李海洋, 等. 不同干燥方法对枸杞子药材多类型功效成分的影响及其分析评价 [J]. 中草药, 2022, 53(7): 2125-2136.
[6] Zhang F, Zhang X, Guo S,. An acidic heteropolysaccharide from: Purification, characterization, neurotrophic and neuroprotective activities[J]., 2020, 249: 116894.
[7] Zhou Y, Duan Y H, Huang S C,. Polysaccharides fromameliorate amyloid pathology and cognitive functions in APP/PS1transgenic mice [J]., 2020, 144: 1004-1012.
[8] Zhang S H, He F, Chen X,. Isolation and structural characterization of a pectin fromMurr and its anti-pancreatic ductal adenocarcinoma cell activity [J]., 2019, 223: 115104.
[9] Zhou L S, Liao W F, Zeng H,. A pectin from fruits ofL. decreases β-amyloid peptide production through modulating APP processing [J]., 2018, 201: 65-74.
[10] Xiao J, Gao H, Zhou Z Q,. Recent progress in the study of Zeaxanthin dipalmitate [J]., 2017, 62(16): 1691-1698.
[11] Zhang Q Y, Chen W W, Zhao J H,. Functional constituents and antioxidant activities of eight Chinese native goji genotypes [J]., 2016, 200: 230-236.
[12] Hempel J, Schädle C N, Sprenger J,. Ultrastructural deposition forms and bioaccessibility of carotenoids and carotenoid esters from goji berries (L.) [J]., 2017, 218: 525-533.
[13] Liu W J, Xia M Q, Yang L,. Development and optimization of a method for determining betaine and trigonelline in the fruits ofspecies by using solid-phase extraction combined with high-performance liquid chromatography-diode array detector [J]., 2020, 43(11): 2073-2078.
[14] 张芳, 郭盛, 钱大玮, 等. 枸杞子中多类型小分子化学物质研究开发现状及前景分析 [J]. 中药材, 2016, 39(12): 2917-2921.
[15] Yao R Y, Heinrich M, Weckerle C S. The genusas food and medicine: A botanical, ethnobotanical and historical review [J]., 2018, 212: 50-66.
[16] 如克亚·加帕尔, 孙玉敬, 钟烈州, 等. 枸杞植物化学成分及其生物活性的研究进展 [J]. 中国食品学报, 2013, 13(8): 161-172.
[17] Edreva A M, Velikova V B, Tsonev T D. Phenylamides in plants [J]., 2007, 54(3): 287-301.
[18] Bassard J E, Ullmann P, Bernier F,. Phenolamides: bridging polyamines to the phenolic metabolism [J]., 2010, 71(16): 1808-1824.
[19] Facchini P J, Hagel J, Zulak K G. Hydroxycinnamic acid amide metabolism: Physiology and biochemistry [J]., 2002, 80(6): 577-589.
[20] Leonard W, Zhang P Z, Ying D Y,. Tyramine-derived hydroxycinnamic acid amides in plant foods: Sources, synthesis, health effects and potential applications in food industry [J]., 2022, 62(6): 1608-1625.
[21] 钱丹. 枸杞中苦味物质分离鉴定及其生物合成相关酶研究 [D]. 北京: 中国中医科学院, 2019.
[22] Wang S Y, Suh J H, Zheng X,. Identification and quantification of potential anti-inflammatory hydroxycinnamic acid amides from wolfberry [J]., 2017, 65(2): 364-372.
[23] Wang S Y, Suh J H, Hung W L,. Use of UHPLC-TripleQ with synthetic standards to profile anti-inflammatory hydroxycinnamic acid amides in root barks and leaves of[J]., 2018, 26(2): 572-582.
[24] Han S H, Lee H H, Lee I S,. A new phenolic amide frommiller [J]., 2002, 25(4): 433-437.
[25] Han E H, Kim J Y, Kim H G,. Dihydro-N-caffeoyltyramine down-regulates cyclooxygenase-2 expression by inhibiting the activities of C/EBP and AP-1 transcription factors [J]., 2010, 48(2): 579-586.
[26] Lan T, Xu W, Xu T Q,. Barbaram, a bicyclic neolactam from the root and stem of[J]., 2021, 23(1): 82-88.
[27] 郑新恒, 陈芳, 梁秋萍, 等. 云南枸杞根中酰胺类化学成分及其抗炎活性研究 [J]. 天然产物研究与开发, 2018, 30(4): 603-609.
[28] Affes M, Fakhfakh J, Daoud I,. UHPLC/HR-ESI-MS/MS profiling of phenolics from Tunisianboiss. antioxidant and anti-lipase activities' evaluation [J]., 2017, 14(9):
[29] Zhang J X, Guan S H, Sun J H,. Characterization and profiling of phenolic amides from Cortex Lycii by ultra-high performance liquid chromatography coupled with LTQ-Orbitrap mass spectrometry [J]., 2015, 407(2): 581-595.
[30] Zhang J X, Guan S H, Feng R H,. Neolignanamides, lignanamides, and other phenolic compounds from the root bark of[J]., 2013, 76(1): 51-58.
[31] Huang H C, Chen L C, Chang T H,. A new lignanamide derivative and bioactive constituents of[J]., 2019, 55(6): 1002-1006.
[32] Zhu P F, Dai Z, Wang B,. The anticancer activities phenolic amides from the stem of[J]., 2017, 7(6): 421-431.
[33] Zhu P F, Zhao Y L, Dai Z,. Phenolic amides with immunomodulatory activity from the nonpolysaccharide fraction offruits [J]., 2020, 68(10): 3079-3087.
[34] 周正群. 枸杞子抗阿尔茨海默病活性成分研究 [D]. 广州: 暨南大学, 2016.
[35] Qi J J, Yan Y M, Cheng L Z,. A novel flavonoid glucoside from the fruits ofruthenicun [J]., 2018, 23(2): E325.
[36] Lee D G, Park Y, Kim M R,. Anti-fungal effects of phenolic amides isolated from the root bark of[J]., 2004, 26(14): 1125-1130.
[37] 兰婷, 黄远鹏, 梁秋萍, 等. 宁夏枸杞根和茎的化学成分及抗炎活性研究 [J]. 天然产物研究与开发, 2019, 31(9): 1491-1497.
[38] 邹澄, 赵庆, 陈昌祥. 枸杞酰胺甲的结构 [J]. 云南植物研究, 1999, 21(3): 378-380.
[39] Zhao J, Xu F, Ji T F,. A new spermidine from the fruits of[J]., 2014, 50(5): 880-883.
[40] 王琪, 唐惠儒. 黑果枸杞和宁夏枸杞果实中多酚类物质组成的差异研究 [J]. 上海交通大学学报: 医学版, 2019, 39(1): 39-46.
[41] Lopatriello A, Previtera R, Pace S,. NMR-based identification of the major bioactive molecules from an Italian cultivar of[J]., 2017, 144: 52-57.
[42] Ahad H, Jin H L, Liu Y F,. Chemical profiling of spermidines in goji berry by strong cation exchange solid-phase extraction (SCX-SPE) combined with ultrahigh-performance liquid chromatography-quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF/MS/MS) [J]., 2020, 1137: 121923.
[43] Zhou Z Q, Fan H X, He R R,. Lycibarbarspermidines A-O, new dicaffeoylspermidine derivatives from wolfberry, with activities against Alzheimer's disease and oxidation [J]., 2016, 64(11): 2223-2237.
[44] Jin H L, Zhao J Q, Liang X M, et al. Preparative separation of a challenging anthocyanin fromMurr. by two-dimensional reversed-phase liquid chromatography/hydrophilic interaction chromatography [J]., 2015, 5: 62134-62141.
[45] Zhou Z Q, Fan H X, He R R,. Four new dicaffeoylspermidine derivatives from[J]., 2016, 2(4): 1-5.
[46] Chen D J,. Chemical constituents from(Solanaceae) and their chemophenetic significance [J]., 2021, 97: 104292.
[47] Funayama S,. Structure of kukoamine A, a hypotensive principle ofroot barks1 [J]., 1980, 21(14): 1355-1356.
[48] Li Y Y, Di R, Hsu W L,. Quality control ofand() by HPLC using kukoamines as markers [J]., 2017, 12: 4.
[49] Funayama S,. Kukoamine B, a spermine alkaloid from[J]., 1995, 38(6): 1529-1531.
[50] Chen F, Huang X J, Liang Q P,. Three new lignanamides from the root ofwith anti-inflammatory activity [J]., 2019, 33(23): 3378-3382.
[51] Chen H, Li Y J, Sun Y J,. Lignanamides with potent antihyperlipidemic activities from the root bark of[J]., 2017, 122: 119-125.
[52] Gao K, Ma D W, Cheng Y,. Three new dimers and two monomers of phenolic amides from the fruits ofand their antioxidant activities [J]., 2015, 63(4): 1067-1075.
[53] Xia Z, Xu T Q, Xu W,. Lyciyunin, a new dimer of feruloyltyramine and five bioactive tyramines from the root ofKuang [J]., 2021, 35(3): 447-454.
[54] Yang Y N, An Y W, Zhan Z L,. Nine new compounds from the root bark ofand their α-glucosidase inhibitory activity [J]., 2017, 7(2): 805-812.
[55] Kim S Y, Choi Y H, Huh H,. New antihepatotoxic cerebroside fromfruits [J]., 1997, 60(3): 274-276.
[56] Yahara S, Shigeyama C, Ura T,. Cyclic peptides, acyclic diterpene glycosides and other compounds fromMill [J].:, 1993, 41(4): 703-709.
[57] Edreva A M, Velikova V B, Tsonev T D. Phenylamides in plants [J]., 2007, 54(3): 287-301.
[58] Zhang H L, Nagatsu A, Sakakibara J. Novel antioxidants from safflower (L.) oil cake [J]., 1996, 44(4): 874-876.
[59] Chen L L, Deng H D, Cui H M,. Inflammatory responses and inflammation-associated diseases in organs [J]., 2017, 9(6): 7204-7218.
[60] Burnett B P, Jia Q, Zhao Y,. A medicinal extract ofandacts as a dual inhibitor of cyclooxygenase and 5-lipoxygenase to reduce inflammation [J]., 2007, 10(3): 442-451.
[61] Hu X L, Song Q, Li X,. Neuroprotective effects of Kukoamine A on neurotoxin-induced Parkinson's model through apoptosis inhibition and autophagy enhancement [J]., 2017, 117: 352-363.
[62] Liu J, Jiang X W, Zhang Q,. Neuroprotective effects of Kukoamine A against cerebral ischemia via antioxidant and inactivation of apoptosis pathway [J]., 2017, 107: 191-197.
[63] Li Y Y, Stewart D A, Ye X M,. A metabolomics approach to investigate kukoamine B-A potent natural product with anti-diabetic properties [J]., 2018, 9: 1575.
[64] Cooper G J, Willis A C, Clark A,. Purification and characterization of a peptide from amyloid-rich pancreases of type 2 diabetic patients [J]., 1987, 84(23): 8628-8632.
[65] Westermark P, Wernstedt C, Wilander E,. Amyloid fibrils in human insulinoma and islets of Langerhans of the diabetic cat are derived from a neuropeptide-like protein also present in normal islet cells [J]., 1987, 84(11): 3881-3885.
[66] Jiang G D, Takase M, Aihara Y,. Inhibitory activities of kukoamines A and B fromon amyloid aggregation related to Alzheimer's disease and type 2 diabetes [J]., 2020, 74(1): 247-251.
[67] Wang Q P, Li H Y, Sun Z,. Kukoamine A inhibits human glioblastoma cell growth and migration through apoptosis induction and epithelial-mesenchymal transition attenuation [J]., 2016, 6: 36543.
[68] Ulbricht C, Bryan J K, Costa D,. An evidence-based systematic review of goji (spp.) by the natural standard research collaboration [J]., 2015, 12(2): 184-240.
[69] 张芳, 郭盛, 钱大玮, 等. 枸杞多糖的提取纯化与分子结构研究进展及产业化开发现状与前景分析 [J]. 中草药, 2017, 48(3): 424-432.
[70] 张芳, 郭盛, 钱大玮, 等. 基于国内外专利分析的枸杞多糖资源产业化途径及策略 [J]. 中国中药杂志, 2016, 41(23): 4285-4291.
[71] Samita F, Ochieng C O, Owuor P O,. Isolation of a new β-carboline alkaloid from aerial parts ofsacleuxii and its antibacterial and cytotoxicity effects [J]., 2017, 31(5): 529-536.
[72] 王晓宇, 陈鸿平, 银玲, 等. 中国枸杞属植物资源概述 [J]. 中药与临床, 2011, 2(5): 1-3.
[73] 卢有媛, 郭盛, 张芳, 等. 枸杞属药用植物资源系统利用与产业化开发 [J]. 中国现代中药, 2019, 21(1): 29-36.
[74] Lu Y Y, Guo S, Zhang F,. Comparison of functional components and antioxidant activity ofL. fruits from different regions in China [J]., 2019, 24(12): E2228.
[75] Amagase H, Farnsworth N R. A review of botanical characteristics, phytochemistry, clinical relevance in efficacy and safety offruit (Goji) [J]., 2011, 44(7): 1702-1717.
[76] Wu D T, Lam S C, Cheong K L,. Simultaneous determination of molecular weights and contents of water-soluble polysaccharides and their fractions fromcollected in China [J]., 2016, 129: 210-218.
Research progress on amides fromand their biological activities
CHEN Dong-jie1, GUO Sheng1, YI Yan-ling1, ZHANG Fang1, DUAN Ran2, XU Pan1, DUAN Jin-ao1
1. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, State Administration of Traditional Chinese Medicine Key Laboratory of Chinese Medicinal Resources Recycling Utilization, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Ningxia Innovation Center of Goji R & D, Yinchuan 750002, China
Thegenus (Solanaceae) is a kind of resource plant group with important medicinal value. Modern studies have shown that the chemical constituents of thegenus are various, including polysaccharides, carotenoids, amides and organic acids. In recent years, with the deepening of the research on these chemical constituents, it was found that amides ws a kind of resource chemicals worthy of attention and further study because of their diverse structural types and rich biological activities. In order to further elucidate the chemical structure characteristics and biological activities of amides in thegenus, 135 amides were summarized in this research which were found in,,and, which could provide reference for the efficient utilization ofgenus resources.
L.; amides; biological activity;L.;Mill.;L.;Murr.
R286
A
0253 - 2670(2023)01 - 0317 - 16
10.7501/j.issn.0253-2670.2023.01.033
2022-08-09
国家自然科学基金项目(U21A20408);宁夏重点研发计划重点项目(2021BEF02009,2021BEF02010)
陈栋杰,硕士研究生,研究方向为中药资源化学。E-mail: chen529491219@163.com
通信作者:郭 盛,副研究员,E-mail: guosheng@njucm.edu.cn
段金廒,博士,教授。Tel: (025)85811291 E-mail: dja@njucm.edu.cn
[责任编辑 时圣明]
