大黄及其有效成分抗炎作用的研究进展
2023-01-10韩思琪师彦平
韩思琪,哈 伟,师彦平
大黄及其有效成分抗炎作用的研究进展
韩思琪1, 2,哈 伟1*,师彦平1*
1. 中国科学院兰州化学物理研究所,中国科学院西北特色植物资源化学重点实验室,甘肃省天然药物重点实验室,甘肃兰州 730000 2. 中国科学院大学,北京 100049
大黄为廖科植物药用大黄、掌叶大黄或唐古特大黄的干燥根和根茎,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄等功效,是我国用药历史悠久的大宗中药材。现代药理学研究表明大黄药材、提取物和单体化合物具有优良的抗炎活性,可调节炎症小体的激活,其主要通过调控氧化应激、细胞凋亡、免疫应答等细胞过程,以及调控炎症相关蛋白和相关炎症通路等多种途径对心血管、胃肠道和中枢神经系统相关疾病表现出显著的药理活性,特别是具有较好的抗神经炎症效果。总结了大黄提取物和蒽醌类、鞣质类、二苯乙烯类成分在炎症相关疾病中的药理活性及作用机制的研究进展,并对其发展趋势进行了展望,为大黄的临床应用、进一步开发利用和新药研发提供理论支持。
大黄;抗炎;大黄素;大黄酸;大黄素甲醚;芦荟大黄素;大黄酚;没食子酸;儿茶素;表儿茶素;表儿茶素没食子酸酯;白藜芦醇
大黄et始载于《神农本草经》[1],以干燥根及根茎入药,“主下瘀血,血闭寒热,破症,积聚”。东汉张仲景所著的《伤寒论》复方中也多处涉及大黄,应用范围广[2]。大黄的种类繁多,大黄属植物全球约有60种[3],分布在亚洲温带及亚热带的高寒山区,其中我国约有40种,主要分布于新疆、甘肃、青海、云南、四川、陕西和湖北等地区[4]。《中国药典》2020年版收录的中药大黄主要来源于唐古特大黄Maxim. ex Balf.、掌叶大黄L.和药用大黄Baill.[5],除此之外,我国还有多种非正品大黄,如河套大黄C. Y. Cheng et Kao、华北大黄Munt.、藏边大黄D. Don等也在民间作为大黄的替代药材使用[6]。大黄的药用历史悠久,传统中医理论认为大黄味苦,性寒,主归胃、大肠、肝经,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经和利湿退黄等功效[5]。大黄化学成分的研究最早可追溯到1824年,并在20世纪八九十年代取得了很大进展,目前已从大黄中分离鉴定得到200多个化合物,包括蒽醌类、蒽酮类、二苯乙烯类、鞣质类、苯丁酮类、色原酮类、萘苷类和其他类化合物[7]。体内外的活性实验表明大黄的蒽醌类化合物具有较好的抗炎、抗菌和抗肿瘤作用[8-9];蒽酮类化合物具有强泻下作用[10];二苯乙烯类化合物具有较强的抗氧化和抗炎活性,还有降血压、扩张毛细管血管和保肝等作用[11-13];鞣质类化合物具有抗氧化、抗炎、止血、抗肿瘤和抗病毒作用[14];苯丁酮和色原酮类主要发挥镇痛消炎的作用[2]。
炎症是机体为抵抗致病因素,免受病原体侵害的一种防御行为,主要通过免疫细胞发动免疫反应实现[15]。但是过度的炎症反应会导致心血管疾病、造成中枢神经系统神经损伤、加剧消化系统中的炎症性肠炎、肝纤维化、胰腺炎等疾病[16-20]。炎症和多种疾病密切相关,通过抗炎治疗可能会对相关的疾病有所改善。大黄作为一种安全有效且不良反应少的中药,从传统中医理论到现代的药理活性均表明大黄具有抗炎、抗菌、保肝利胆、抗肿瘤和抗氧化等广泛的功效,对于炎症性的相关疾病具有独特的药理活性。
近年来,大黄研究进展的综述文章多集中在化学成分的分离鉴定和药理作用研究,Cao等[2]在2017年综述了大黄的生物活性成分、药理和临床应用,将大黄的不同活性成分和疾病相关联,并总结了临床应用和作用机制。Li等[9]在2019年综述了大黄的蒽醌类化合物对中枢神经系统疾病的神经保护作用。但是较少有综述将大黄中的抗炎活性成分及其在炎症相关疾病中的作用机制进行总结。基于此,本文归纳总结了大黄提取物和大黄中蒽醌类、鞣质类和二苯乙烯类化合物的抗炎作用,尤其关注了大黄中单体化合物的抗炎活性及作用机制。通过对近年来大黄的抗炎活性研究进展进行综述,归纳整理了大黄抗炎药效物质和作用机制,对大黄的综合利用和新药研发具有十分重要的意义。
1 大黄提取物
以大黄作为君药的中药复方提取物是这几年的研究热点,从现代药理学角度探究大黄复方提取物的用药规律和作用机制,有助于为大黄复方的临床应用提供理论支持。中药进行配伍后,药效物质基础可能会发生变化,已有研究表明大黄配伍后会提高抗炎活性并降低其不良反应[21]。大黄灵仙方由生大黄、威灵仙和芒硝等组成,可改善原发性肝内胆管结石(primary intrahepatic stones,PIS)胆管组织变性、炎症浸润等病理特征,经ig及ip后,在PIS大鼠模型中测得肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukins-6,IL-6)水平、细胞内Ca2+水平及Wnt家族成员5a()、蛋白激酶C(protein kinase C,)mRNA及IL-6蛋白表达水平较模型组相比均有降低,表明大黄灵仙方可能抑制了Wnt5a-Ca2+-PKC炎症通路进而降低了炎症导致的肝内胆管组织损伤[22]。大黄牡丹汤是一种中药方剂,由大黄、牡丹皮和桃仁等经煎煮、水提、浓缩得到,常用于治疗溃疡性结肠炎(ulcer colitis,UC)。通过硫酸葡聚糖钠盐(dextran sulfate,DSS)诱导的UC小鼠模型,表明大黄牡丹汤可通过调节肠道微生物菌群及其相关代谢产物,调节Th17/Treg细胞平衡,进而发挥抗炎作用,对于UC有一定治疗效果[23-24]。大黄附子汤是由大黄、附子、细辛组成的重要中药方剂,经水煎后广泛应用于肠梗塞和肠道损伤等肠道相关疾病。通过体外内毒素诱导的人结直肠腺癌Caco-2细胞实验表明大黄附子汤的含药血清可抑制含半胱氨酸的天冬氨酸蛋白水解酶-11(cysteinyl aspartate-specific proteinase-11,Caspase-11)的激活和TNF-α和IL-3促炎细胞因子的释放,进而减轻了肠道炎症反应,在治疗肠道损伤方面表现出一定潜力[25]。
大黄炮制品提取物在体内外活性实验中被证明具有抑制炎症的药理作用,王志旺等[26]发现唐古特熟大黄水提液可通过抑制白三烯B4的生成,发挥其抗炎作用。王亚等[27]发现酒大黄水提液能明显改善口腔溃疡大鼠黏膜组织和肺炎大鼠体内的炎性渗出和组织坏死等病理特征,抑制促炎因子TNF-α、IL-6的释放,治疗效果优于生大黄。熟大黄、酒大黄和生大黄在抗炎效果上的差异,可能是酒蒸酒炒后提高了大黄酚、大黄素和大黄素甲醚的体内吸收,进一步提高了蒽醌类化合物的生物利用度[28],以及炮制过程中的加热可使游离型蒽醌的含量增加[29]引起的,近年来大黄炮制品提取物在炎症相关疾病中的作用机制也受到广泛关注。熟大黄水提物会通过表观遗传机制影响相关促炎因子基因的甲基化从而减轻炎症反应[30],为治疗酒精暴露引起的胰腺炎症损伤提供了一种新的治疗思路。Wang等[31]利用蛋白质组学和代谢组学的方法研究发现,酒大黄醇提物可通过抗炎和抗氧化应激反应,下调血小板激活因子,抑制白细胞和血管内皮细胞相互作用,发挥保护血脑屏障和脑出血中的神经细胞的作用。上述研究结果表明酒大黄中的化学成分或其代谢产物可穿透血脑屏障发挥抗炎作用,但是相关疾病的作用机制研究较少。
大黄根部干燥后,经溶液提取得到的大黄提取物通过发挥抗神经炎症作用,对中枢神经系统(central nervous system,CNS)相关疾病有着较好的治疗效果。掌叶大黄的75%乙醇回流提取物对脑出血(intracerebral hemorrhage,ICH)大鼠模型表现出较好的脑保护功能,其具体机制可能是抗炎和抗氧化应激的双重作用。研究表明掌叶大黄的75%乙醇提取液可显著上调抑炎因子IL-4和IL-10的表达,下调促炎因子TNF-α、IL-6、g干扰素(interferon-g,IFN-g)的表达,同时也通过增加核红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)蛋白的表达提高谷胱甘肽的含量,进一步保护了血脑屏障[32]。体外细胞实验表明,掌叶大黄的95%乙醇提取物会减少神经细胞的死亡和活性氧(reactive oxygen species,ROS)的产生,进而通过缓解神经细胞抗辐射诱导的氧化应激降低神经炎症[33]。大黄的甲醇提取物能够调节炎症相关介质和相关酶活性,调控小胶质细胞M2表型极化和抑制核因子-kB(nuclear factor-kB,NF-kB)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、信号传导与转录激活因子1(signal transducer and activator of transcription 1,STAT1)信号通路,能够在mRNA和蛋白质水平上调IL-10,并且抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)的表达,显著抑制一氧化氮(nitric oxide,NO)和ROS的产生,从而具有抗神经炎症的作用[34-35]。体内研究也发现大黄乙醇提取物可抑制脂多糖(lipopolysaccharide,LPS)诱导的小鼠黑质和海马区胶质细胞激活以及COX-2的表达,具有抗神经炎症的药理活性[35]和阿尔茨海默病(Alzheimer’s disease,AD)治疗效果。大黄提取物可通过发挥抗炎作用,影响氧化应激反应,从而表现出对心血管系统炎症性疾病的治疗效果。将3种中药大黄根部切片后粉碎过筛,将所得大黄粉使用甲醇超声提取得到醇提物。Li等[36]通过网络药理学和分子对接实验对大黄抗血管内皮损伤(vascular endothelial cell injury,VEI)机制进行研究,筛选出能够抑制VEI的活性成分,并进一步通过LPS诱导的EA.hy926细胞实验,证明了大黄甲醇提取物均会作用于磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/NF-kB信号通路,进一步抑制该通路上相关蛋白的表达和磷酸化,同时也抑制了氧化应激反应,减少了促炎细胞因子TNF-α、IL-6、IL-1β、NO和ROS的释放,进而抑制了VEI。通过比较促炎细胞因子、ROS和NO的含量,发现3种中药大黄抑制VEI的作用差异具有统计学意义,但从综合疗效来看,唐古特大黄(265.5 μg/mL)的VEI抑制效果最优。大黄可通过调节微生物区系和数量以及影响肠道屏障来调节炎症反应,改善酒精诱导的肝损伤(alcoholic liver disease,ALD)。Neyrinck等[37]通过对ALD小鼠模型连续17 d喂养0.3%大黄提取物,观察到大黄提取物给药组通过调节肠道微生物菌群增加了小鼠体内与肠黏膜更新相关整联蛋白(intectin)的表达,从而增强了肠道黏膜功能。大黄提取物还抑制了肝组织的Toll样受体4(Toll-like receptor 4,TLR4)相关炎症反应和氧化应激的关键标记物IL-6、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和TNF-1,从而对ALD有一定治疗作用。上述研究表明肠道微生物菌群的变化在ALD中起重要作用,进一步推测肠道微生物区系的变化可能由大黄提取物中含量较高的大黄酸或结合型蒽醌衍生物引起的。
上述研究表明大黄提取物可通过调控炎症相关蛋白的表达和炎性介质的分泌以及炎症相关的通路,直接发挥抗炎作用,而对于调节肠道微生物和氧化应激间接发挥抗炎作用还值得进一步探究。此外,不同溶剂和不同种类大黄提取物在相同动物模型上的治疗效果存在差异,针对不同提取物药效物质基础和多靶点、多机制的协同作用研究也对于阐明大黄抗炎作用机制具有重要意义。
2 蒽醌类化合物
目前已从正品大黄中分离鉴定出30多种蒽醌类化合物[7,38-40],蒽醌类化合物是大黄中最具代表性的化学成分,大黄中总蒽醌的质量分数为1.15%~5.19%,是《中国药典》2020年版中大黄质量控制的指标成分[41],主要分为游离型和结合型蒽醌,游离型蒽醌大黄素、大黄酸、大黄素甲醚、芦荟大黄素、大黄酚具有显著的抗炎活性,其化学结构见图1。Choi等[42]通过观察游离蒽醌组分(含大黄素、芦荟大黄素、大黄酸、大黄酚、大黄素甲醚等)对LPS诱导的小鼠单核巨噬细胞白血病RAW264.7细胞NO的产生情况,发现不同官能团取代对游离蒽醌的抗炎活性会产生影响。大黄素、芦荟大黄素和大黄酸对NO的产生有不同程度的抑制作用,而大黄酚和大黄素甲醚则没有,表明酚羟基、羧基或羟甲基等取代对抗炎活性的发挥比较重要[43]。通过对这5种游离蒽醌类化合物药动学的分析比较,有助于药物的配伍和更好地理解药效作用。通过脑缺血再灌注(ischemia-reperfusion,I/R)模型大鼠,借助UPLC-MS/MS分析比较了芦荟大黄素、大黄素、大黄酸、大黄酚和大黄素甲醚5种蒽醌类化合物的治疗效果以及2种不同化合物配伍后药动学的变化。结果表明大黄酚的抗脑缺血能力最强,配伍组中芦荟大黄素+大黄素甲醚组的抗脑缺血作用最强,并且其他蒽醌类化合物和芦荟大黄素合用时,会减弱抗脑缺血作用。进一步推测大黄素、大黄酚和大黄酸在脑I/R模型中可能有着相同的作用靶点,因为三者有着相似的药动学特性[9]。上述研究表明大黄的蒽醌类组分具有较好的抗炎作用,大黄素、大黄酸、大黄素甲醚、芦荟大黄素、大黄酚可能是蒽醌类组分发挥抗炎作用的主要药效物质。

图1 大黄中具有抗炎活性的蒽醌类化合物的化学结构
2.1 大黄素
张昊悦等[44]通过体外LPS诱导的巨噬细胞实验证实,大黄素不仅能够抑制细胞炎症,还可抑制和炎症相关的氧化应激反应,其主要通过调节Nrf2/血红素加氧酶-1(heme oxygenase-1,HO-1)和MAPK与炎症性肠炎(inflammatory bowel disease,IBD)密切相关的信号通路,减少了炎症相关因子IL-6、iNOS、IL-1b、ROS和NO的释放,这为大黄素治疗IBD提供了证据。大黄素还可抑制LPS诱导的小胶质细胞的神经炎症,其主要通过激活腺苷酸活化蛋白激酶(5-AMP activated protein kinase,AMPK)/Nrf2途径,抑制了NF-kB、激活蛋白-1(activator protein-1,AP-1)、应激活化蛋白激酶1(-Jun-terminal kinase1,JNK1)和p38 MAPK的表达,下调了iNOS和COX-2炎症相关酶的表达以及抑制炎性介质的释放[45]。Li等[46]发现大黄素还可通过调节PI3K/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,抑制人神经母细胞瘤SH-SY5Y细胞炎症因子和ROS的释放,减少细胞凋亡、减轻神经炎症和氧化应激反应,进而发挥神经保护作用,对神经退行性疾病具有潜在治疗效果。
2.2 大黄酸
大黄酸可通过调节肠道微生物菌群、嘌呤代谢、恢复肠上皮屏障、巨噬细胞极化、氧化还原介导炎症小体的激活和炎症相关信号通路来发挥抗炎作用,对肠炎以及神经炎症等相关疾病有一定治疗效果。大黄酸的口服生物利用度较差[47],但仍表现出明显抗炎活性,所以在大黄酸治疗肠炎的研究中,研究人员推断肠道菌群是大黄酸发挥抗炎作用的重要机制之一。Wu等[48]发现大黄酸能通过调节肠道微生物区系和间接调节肠道中的嘌呤代谢降低肠道尿酸水平,以缓解慢性结肠炎。研究发现大黄酸可通过抑制巨噬细胞极化、调节氧化还原介导的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体激活来缓解结肠炎症状[49-50]。其中,大黄酸主要通过促进巨噬细胞M1促炎型到M2抑炎型的极化和抑制趋化因子介导的巨噬细胞等白细胞迁移到肠炎部位,进而减轻炎症反应[49]。Zhuang等[50]发现大黄酸可调控NADPH氧化酶的非吞噬细胞氧化酶2(non- phagocytic cell oxidase 2,NOx2)、Nrf2、MAPK和NF-kB多条信号通路,一方面通过抑制NLRP3炎症小体的激活减少巨噬细胞中IL-1b等促炎介质的产生,另一方面通过调节NF-kB通路抑制肌球蛋白轻链激酶(myosin light chain kinase,MLCK)的蛋白表达和磷酸化,进而抑制紧密连接蛋白ZO-1的重排和转录,实现对肠上皮细胞屏障的保护作用。目前对于肠炎的研究表明,PI3K/Akt/mTOR信号通路的异常激活会导致促炎因子的释放,因此PI3K/Akt/mTOR信号通路可能是治疗UC患者的重要靶点。Dong等[51]利用网络药理学方法进一步确认了炎症信号通路PI3K/Akt/ mTOR作用蛋白和UC密切相关,并且通过体内外实验证明大黄酸可抑制促炎细胞因子TNF-α、IL-6和IL-1b的产生,下调PI3K/Akt/mTOR上相关蛋白水平,进而减轻肠炎的病理症状。大黄酸具有穿过血脑屏障的特点,因此在抗神经炎症方面受到广泛关注。Zheng等[52]在体外LPS诱导的小胶质细胞的抗神经炎症实验中发现大黄酸具有较好的抗神经炎症作用,其主要通过调节PI3K/Akt、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases1/2,ERK1/2)和TLR4/NF-kB等多条炎症信号通路,抑制了促炎因子和iNOS炎性介质的产生,并促进了抑炎因子IL-10的释放。Wen等[53]对大黄酸抑制NF-kB信号通路的详细机制进行了研究,通过建立体外LPS诱导的巨噬细胞炎症模型,发现大黄酸可通过激活过氧化物酶体增殖物激活受体g(peroxisome proliferator-activated receptorg,PPARg)受体促进NF-kB、PPARg和组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)复合炎症小体的形成,炎症小体的形成可阻止NF-κB的乙酰化并抑制NF-kB信号通路释放促炎因子,进而减轻炎症反应。
上述体内外实验均表明大黄酸可通过多条炎症相关通路调节炎症反应,但是肝脏的葡萄糖醛酸化代谢会降低其溶解性和生物利用度[47],从而限制了大黄酸的进一步应用。针对这一问题,通过结构修饰、改变给药途径或开发新剂型来改善大黄酸生物利用度和给药安全性的研究受到了关注。如Zhou等[54]发展了一种大黄酸-壳聚糖凝胶给药体系,该体系具有较好的大黄酸缓释性能和较高的生物相容性。体外LPS诱导的小胶质细胞实验进一步表明大黄酸-壳聚糖凝胶具有持续的强抗神经炎症作用,其主要是通过抑制MAPK信号通路中的JNK、ERK和p38相关靶点蛋白的磷酸化,抑制了促炎细胞因子IL-1b和TNF-α的释放。另一项研究中,Zheng等[55]设计制备了一种大黄酸定向自组装的超分子水凝胶,该水凝胶是由大黄酸通过分子间p-p和氢键相互作用自组装形成的三维纳米纤维网络,具有上述凝胶的优点。与大黄酸相比,大黄酸水凝胶更容易被细胞吸收,并且大黄酸水凝胶纳米纤维通过缓慢解体释放出的大黄酸聚集体有助于和TLR4受体结合,进而抑制NF-kB信号通路,使得大黄酸水凝胶具有更好的抗神经炎症作用和更低的细胞毒性,可显著减轻神经炎症。Li等[56]制备了大黄酸赖氨酸盐(rhein lysinate,RHL),有效提高了大黄酸的水溶性和体内药效。体内小鼠实验结果表明RHL可通过提高沉默调节蛋白1(sirtuin1,SIRT1)的表达,一方面减少氧化应激反应和抑制促炎因子的释放,另一方面可降低小鼠脑组织中Ab蛋白的表达,在AD治疗方面具有很大潜力。
2.3 大黄素甲醚
大黄素甲醚对中枢神经系统疾病有治疗作用[57]。体外细胞实验表明大黄素甲醚可抑制缺氧缺糖/再灌注(oxygen and glucose deprivation,OGD/R)诱导的SH-SY5Y细胞分泌的TLR4、p-p65和p-IkB蛋白和炎症细胞因子IL-1b、TNF-α、IL-6、MCP-1等。大鼠脑I/R模型实验也表明大黄素甲醚可通过调节TLR4/NF-kB通路抑制炎症反应,有助于减轻脑I/R损伤[58]。大黄素甲醚还可通过抑制炎症小体的激活发挥抗炎作用。利用对乙酰氨基酚诱导的小鼠药物性肝损伤模型,李纪丰等[59]研究发现大黄素甲醚可改善小鼠肝组织坏死和组织炎性浸润等病理特征,其主要通过抑制氧化应激介导的高迁移率族蛋白B1(high mobility group protein B1,HMGB1)-NLRP3炎症小体信号通路的激活或NLRP3炎症小体的组装,从而抑制了IL-1b和IL-18的释放,减少了药物性肝损伤中的炎症反应。
2.4 芦荟大黄素
芦荟大黄素是大黄发挥抗炎作用的重要生物活性成分,其主要通过NF-kB、MAPK和PI3K途径抑制LPS诱导的巨噬细胞中的iNOS、COX-2和炎症相关酶的表达,以及抑制炎性介质NO、IL-1b和IL-6的产生[43]。芦荟大黄素可以调节多条炎症相关通路来抑制炎症反应,对中枢神经系统具有保护作用。分子对接实验表明芦荟大黄素对TNF-α、半胱氨酸天冬氨酸蛋白酶-3、iNOS和糖皮质激素受体均有较强的抑制作用,对大鼠双侧颈总动脉诱导的脑损伤也具有保护作用[60]。脑I/R大鼠模型实验证明芦荟大黄素能够穿过血脑屏障,改善脑I/R大鼠的脑梗死面积和行为学评分,其主要是通过调节PI3K/Akt/mTOR、NF-kB和MAPK等多条信号通路,实现抗氧化和抗神经炎症的双重作用,进而对脑I/R损伤发挥保护作用[61]。血管内皮障碍会显著减低紧密连接蛋白ZO-1/2的表达,导致内皮细胞损伤和炎症,引起和高血压相关的心血管疾病。芦荟大黄素可以促进NLRP3泛素化抑制炎症小体的激活,恢复紧密连接蛋白ZO-1/2的表达,减轻血管紧张素转换酶II(angiotensin II,Ang II)诱导的血管内皮损伤的炎症反应,对预防高血压引起的心血管疾病有着潜在的治疗价值[62]。
上述体内外实验均表明芦荟大黄素具有较好的抗炎作用,但是其溶解度差导致生物利用度低。针对这些问题,开展芦荟大黄素结构修饰或开发新型药物递送系统的研究受到了广泛关注。郭静等[63]对芦荟大黄素开展了结构修饰研究,通过引入含氮基团和亲水哌嗪基团得到了芦荟大黄素衍生物(AE-YJ)。体外LPS诱导的RAW264.7细胞实验表明,同等剂量下,AE-YJ的抗炎效果强于芦荟大黄素。AE-YJ可通过PI3K/Akt/NF-kB和MAPK/NF-kB途径,抑制iNOS和COX-2的蛋白表达和炎性介质的产生。Shi等[64]发展了Soluplus®-甘草酸混合胶束药物递送体系,该递送体系提高了芦荟大黄素的水溶性和生物利用度,并且在单钠尿酸盐诱导的关节炎模型具有更强的抗炎活性。
2.5 大黄酚
大黄酚具有显著的抗炎、抗氧化应激和神经保护等活性,对CNS疾病如神经退行性疾病、创伤性脑损伤、ICH和脑I/R损伤等均有治疗效果。邴小三等[65]利用缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBI)大鼠模型,发现大黄酚可抑制促炎因子TNF-α、IL-6的释放和iNOS的活性,同时大黄酚可促进抗炎因子IL-10的释放和调节自噬相关蛋白的表达并抑制了mTOR/p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)自噬信号通路磷酸化,发挥神经保护和抗炎作用。因此推测大黄酚的抗炎作用机制与对脑组织的保护作用可能和脑组织自噬有关。Jadaun等[66]借助ICH大鼠模型证明,大黄酚可通过PI3K/Akt/mTOR信号通路调节细胞凋亡并减少IL-1b、IL-6和TNF-α等炎性介质的产生,抑制炎症反应,从而发挥神经保护功能和改善ICH的病理特征。NLRP3炎症小体对促炎因子的调控也非常重要,Zhang等[67]利用小鼠短暂性大脑中动脉闭塞模型证明大黄酚通过抑制NLRP3炎症小体的激活进而有效抑制脑I/R期间的神经损伤和组织损伤。
大黄素、大黄酸、大黄素甲醚、芦荟大黄素和大黄酚的抗炎作用机制涉及抑制炎症小体的激活,调控氧化应激、细胞凋亡、炎症相关蛋白和相关炎症通路,以及促炎相关因子的释放,其抗炎机制见图2。
3 鞣质类化合物
鞣质类化合物属于多酚类化合物[6],是大黄中的重要活性成分,其在生药中的含量高达10%~30%。大黄中鞣质分为水解型和缩合型2类,其中没食子酸和儿茶素类化合物为主要的抗炎药效成分[14]。利用高效液相色谱对大黄中的非蒽醌类成分进行含量测定,发现没食子酸(0.3~11.7 mg/g)、儿茶素(4.4~51.9 mg/g)、表儿茶素(0.2~15.5 mg/g)和表儿茶素没食子酸酯(epigallocatechin gallate,EGCG)(1.2~20.6 mg/g)在大黄中含量很高。药理学研究表明鞣质类化合物具有调节基因毒性、抗炎和抗氧化应激等作用[2],本文将重点归纳总结大黄中高含量的没食子酸、儿茶素、表儿茶素及EGCG等鞣质组分的抗炎活性及其作用机制,其化学结构见图3。
3.1 没食子酸
Bai等[68]在没食子酸抗炎活性相关综述中提到,没食子酸在过敏性炎症、类风湿关节炎、结肠炎、胃炎和盆腔炎等疾病中发挥了较好的抗炎活性,其主要通过调节MAPK和NF-kB通路实现抗炎作用,本文将对没食子酸近期抗炎机制方面的研究进展进行补充。代谢紊乱可以引发全身炎症,加重疾病的病理进程,炎症和代谢紊乱之间的联系备受关注。Hu等[69]采用代谢组学的方法,借助LC-MS分析了角叉菜胶诱导的急性炎症大鼠的血清代谢变化,发现没食子酸参与了亚油酸、抗坏血酸和糖醛酸、戊糖和葡萄糖醛酸相互转换环节以及花生四烯酸代谢途径中的12种代谢物的调节过程,其主要通过提高抗氧化能力、调节脂质代谢、减轻炎症级联反应的放大、抑制免疫细胞的增殖和促进免疫平衡来发挥抗炎作用,这一抗炎机制也进一步通过相关实验得到了验证。没食子酸可以通过Th17的免疫调节,抑制特应性皮炎小鼠模型中的促炎因子并促进IL-10和转化生长因子-b(transforming growth factor-b,TGF-β)抑炎因子的产生,改善特应性皮炎[70]。没食子酸还可通过调节Nrf2/HO-1氧化还原相关信号通路,增加基因的表达、抑制氧化应激反应和NF-κB通路、减少促炎介质的释放,进而发挥抗炎作用和改善弹性蛋白酶诱导的肺损伤[19]。没食子酸可抑制炎症小体发挥抗炎和抗氧化作用,其可通过上调Nrf2的表达,进而阻断NLRP3-丝氨酸/苏氨酸蛋白激酶7相互作用和凋亡相关斑点样蛋白寡聚,抑制NLRP3炎症小体的组装,减少关节中白细胞的渗透和IL-1b的释放,减轻单钠尿酸盐诱导的痛风性关节炎[71]。此外,没食子酸还具有抗神经炎症作用,对CNS的神经退行性疾病可发挥神经保护作用。Liu等[72]采用大鼠黑质内注射LPS建立了帕金森神经炎症动物模型,研究表明没食子酸可通过抑制神经炎症(胶质细胞的激活、促炎因子的产生、α-突触核蛋白聚集)、氧化应激和细胞凋亡,从而发挥抗神经保护作用。

图2 蒽醌类化合物的抗炎作用机制

图3 大黄中具有抗炎活性的鞣质类化合物的化学结构
3.2 儿茶素
Sunil等[73]通过体外LPS诱导的细胞实验发现儿茶素可通过抑制NF-kB和MAPK激酶的激活进一步抑制COX、iNOS、NO和TNF-α等炎症相关介质的释放,并可同时促进IL-10的释放,表明儿茶素具有较好的抗炎作用。Tu等[74]通过冠心病大鼠模型实验证明了儿茶素可抑制IL-6和TNF-α等炎症细胞因子,显著下调NF-kB的表达进而发挥抗炎作用,改善冠心病的病理特征。此外,还发现儿茶素对大鼠中法尼醇X受体(farnesoid X receptor,FXR)、STAT3和Akt会产生影响,但是信号通路之间是否存在串扰还有待进一步探究。
3.3 表儿茶素
表儿茶素具有抗氧化和抗炎作用[75],并且表儿茶素具有穿越血脑屏障和神经保护作用,其在治疗神经系统相关疾病方面具有巨大潜力。Ling等[76]通过LPS诱导的脓毒症小鼠模型发现表儿茶素可通过调节AMPK信号通路改善神经炎症和调节线粒体功能,发挥抗炎和抗氧化作用,并且表儿茶素还可增强小鼠突触的可塑性、改善记忆缺陷和行为表现,为脓毒症相关脑部疾病的治疗提供新的药物选择。Navarrete-Yañez等[77]发现在小鼠衰老模型中,表儿茶素会降低炎性介质的释放并促进抗炎因子的释放,还可改善tau蛋白过度磷酸化和增加可溶性b-淀粉样蛋白水平,这些结果表明表儿茶素可以抑制神经炎症并改善大脑功能。
3.4 EGCG
EGCG是儿茶素类化合物的重要成分,也被证明具有较好的抗氧化、抗细胞凋亡和抗炎活性。Wang等[78]发现EGCG可通过抑制STAT3通路减少IL-6的释放、减轻炎症反应、抑制神经元凋亡,进而改善心肌梗死治疗后的焦虑行为。Zhang等[79]研究发现EGCG还可抑制LPS诱导产生的iNOS和COX-2的升高,这一结果证明EGCG具有一定的抗神经炎症作用,但其具体抗炎机制有待进一步探究。
没食子酸、儿茶素、表儿茶素和EGCG的抗炎作用机制涉及NF-kB等炎症信号通路、Nrf2氧化还原信号通路以及炎症因子调节和炎症相关酶的表达,其抗炎机制见图4。

图4 鞣质类化合物的抗炎作用机制
4 二苯乙烯类化合物
目前已从大黄中分离鉴定出16种二苯乙烯类化合物[7,38-40],大黄中具有抗炎活性的二苯乙烯类化合物的化学结构见图5。白藜芦醇是一种存在于大黄、虎杖、花生和葡萄等多种药用植物中的多酚类化合物,是大黄中最具代表性的二苯乙烯类化合物,具有抗炎、神经保护、心血管保护等药理作用,可用于防治多种自身免疫性和炎症相关疾病[80]。白藜芦醇还能穿透血脑屏障,抑制CNS中的小胶质细胞激活,进而对神经炎症有调节作用[81]。研究白藜芦醇的抗炎活性及其作用机制对于阐明大黄的抗炎药效物质基础和作用机制具有重要的意义[13]。
4.1 白藜芦醇
在心血管疾病中,交感神经系统的过度激活会激活NLRP3炎症小体,进而释放IL-18并引起心脏炎症,从而导致心肌损伤。Wang等[82]通过网络药理学方法预测了白藜芦醇抗心脏炎症的作用机制,研究发现Akt1是心脏炎症中的一个重要靶点。进一步通过细胞和动物实验验证了白藜芦醇可通过抑制Akt1磷酸化从而抑制炎症小体的早期激活,发挥保护心脏的作用。Gal等[83]选取60名心力衰竭患者进行为期3个月的临床试验,结果表明白藜芦醇治疗组中收缩性心力衰竭患者的白细胞活性和促炎细胞因子(IL-1和IL-6)均有降低。临床试验表明白藜芦醇可以抑制患者炎症反应,改善患者的心脏功能和临床状况。
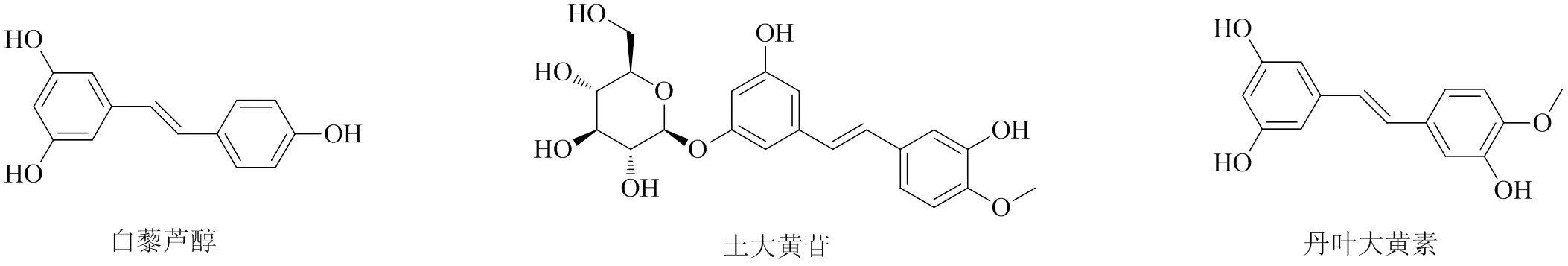
图5 大黄中具有抗炎活性的二苯乙烯类化合物的化学结构
神经退行性疾病中,小胶质细胞在神经炎症中起着非常重要的作用。激活的小胶质细胞会产生ROS并诱导氧化应激反应,进一步激活了JNK信号通路,促进炎性介质释放和加剧炎症反应,表明氧化应激和神经炎症密切相关。白藜芦醇可以发挥抗氧化和抑制炎症相关通路等作用对大脑起保护作用。Recalde等[84]证明白藜芦醇可调节Nrf2氧化还原和SIRT1炎症相关信号通路,进而缓解雄性大鼠由于奥沙利铂引起的周围神经病理性疼痛。Cong等[85]发现白藜芦醇可通过调控SIRT1信号通路,促进JNK、NF-kB和STAT3的磷酸化,从而减少炎性介质TNF-α、IL-1b和COX-2的释放,同样证明白藜芦醇可通过抑制神经炎症和氧化应激,发挥神经保护作用。Le等[86]研究发现白藜芦醇可通过激活SIRT1抑制小胶质细胞释放乙酰化HMGB1,进而抑制TLR4/髓样分化因子88(myeloid differentiation primary response gene 88,MyD88)/NF-κB炎症相关信号通路,发挥抗神经炎症和神经保护作用和改善HIBI小鼠的认知和记忆障碍[87]。白藜芦醇通过调节SIRT1/NF-kB信号通路,还可抑制脊髓损伤后的炎症反应,进而恢复脊髓损伤后大鼠的神经元损伤[88]。SIRT1可以去乙酰化后调节和炎症反应密切相关的Yes相关蛋白(Yes-associated protein,YAP)信号,白藜芦醇会上调LPS诱导的C57BL/6J雄性小鼠的SIRT1表达,进而抑制YAP表达,可减轻神经炎症诱导的焦虑行为[89]。G蛋白偶联受体中的甲酰肽受体(formyl peptide receptor,FPR)在神经退行性疾病的炎症反应中发挥着重要的作用[90]。Calvello等[91]证明白藜芦醇能上调小鼠体内FPR1和SIRT1受体的表达,促进抗炎介质IL-1RA和IL-10产生并抑制促炎介质TNF-α和IL-1b的生成,从而减轻神经炎症。以上研究表明白藜芦醇是一种天然的SIRT1激动剂,其可通过激活SIRT1影响TLR4、NF-κB和STAT3等炎症通路,发挥抗神经炎症作用,同时也发现YAP蛋白和FPR1受体可能是治疗神经炎症的潜在靶点。此外,硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)和神经炎症关系密切,白藜芦醇可通过调节TXNIP/硫氧还蛋白(thioredoxin,TRX)信号通路抑制NLRP3炎症小体的激活,发挥抗神经炎症作用,可为阿尔茨海默症的治疗提供新的靶点[92]。白藜芦醇不仅可通过调节氧化应激影响神经炎症反应,还可通过促进细胞自噬改善炎症。研究表明白藜芦醇可通过调节髓系细胞触发受体2(triggering receptor expressed on myeloid cell 2,TREM2)受体相关的自噬通路,抑制小胶质细胞的激活和促炎因子TNF-α、IL-6和IL-1b的释放,进而减轻神经炎症引起的神经病理性疼痛[93]。白藜芦醇还可抑制小胶质细胞的活化和表型极化减轻神经炎症。Ma等[94]研究发现白藜芦醇可通过抑制miR-155促进小胶质细胞的M2表型极化,从而减轻脑缺血后的神经炎症。
综上,白藜芦醇的抗炎作用机制涉及多种和炎症、细胞自噬以及免疫相关信号通路,并涉及多个作用靶点,其抗炎机制见图6。
4.2 土大黄苷
土大黄苷是另外一种代表性的二苯乙烯类化合物,广泛存在于其他众多大黄属植物中,已被广泛证明具有抗菌、调血脂、降血糖、抗肿瘤、调节机体免疫防御系统、抗炎及抗氧化等功能[95],基于这些药理活性的基础上,近几年对其作用机制的研究也逐年增多[96]。土大黄苷可以通过抑制炎症因子表达、减少炎症介质产生和调节炎症相关信号通路发挥其抗炎作用,进而对多种疾病具有治疗作用。
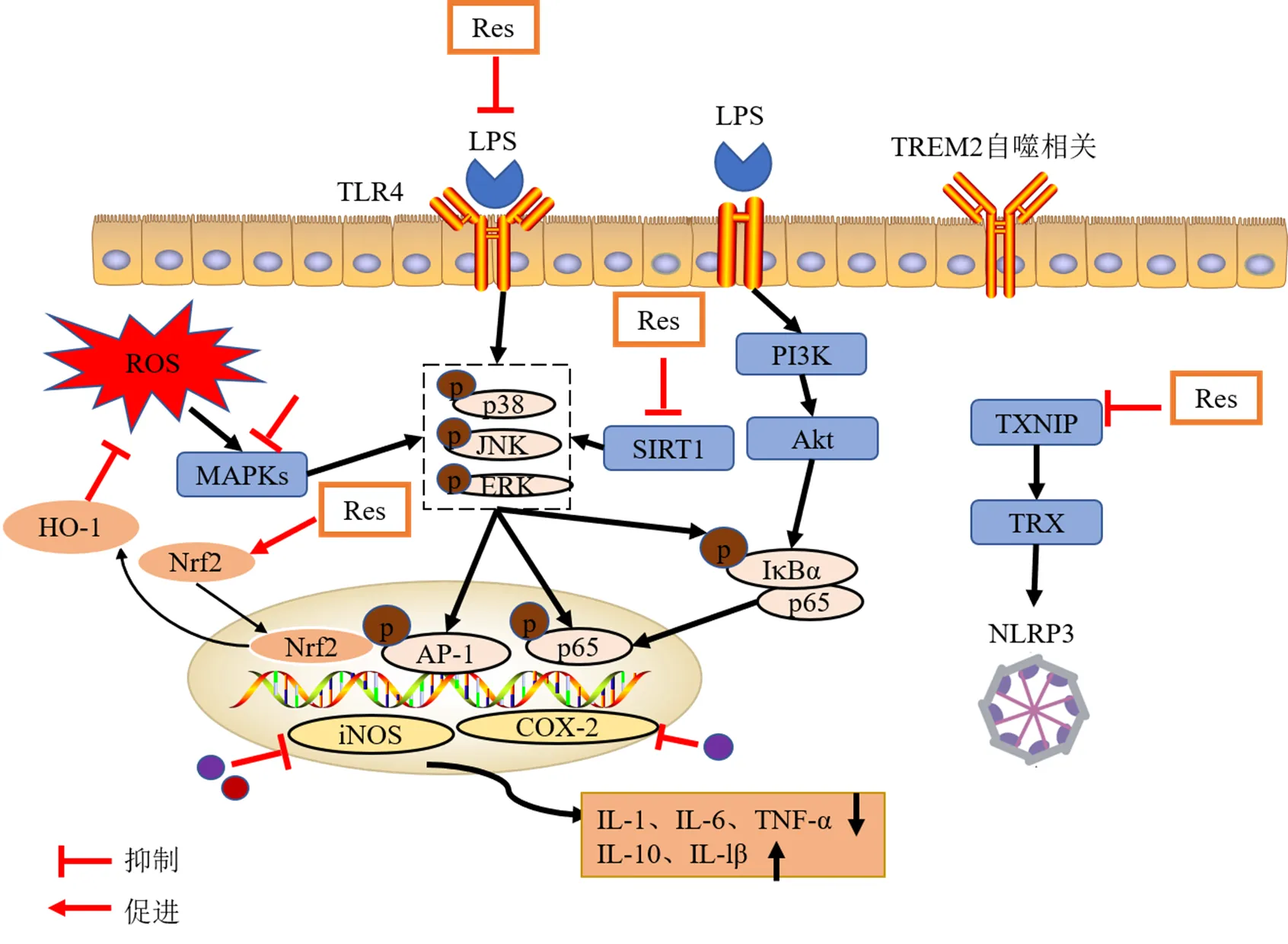
图6 白藜芦醇的抗炎作用机制
Kolodziejczyk-Czepas等[12]在土大黄苷相关综述中总结了其可能的抗炎机制,主要包括3个方面:(1)土大黄苷抑制了COX、脂氧合酶(lipoxygenase,LOX)和透明质酸酶(hyaluronidase,HYAL)等和炎性介质相关酶的活性;(2)土大黄苷抑制NF-kB、PI3K和Akt炎症相关通路[97]和上调SIRT1蛋白的表达;(3)土大黄苷抑制了补体的激活和黏附分子的表达[12]。Li等[98]通过体外实验发现土大黄苷还可下调iNOS、COX-2、NOx蛋白的基因表达,并调节NF-kB和MAPK炎症信号通路,抑制促炎介质的释放和LPS诱导的内皮细胞的炎症。
近年来,土大黄苷的抗神经炎症作用被广泛研究。Zhao等[99]通过体外LPS诱导小鼠的小胶质细胞实验证明,土大黄苷能抑制小胶质细胞分泌的促炎因子TNF-α、IL-6和IL-1b以及前列腺素E2等细胞因子,并抑制NO和ROS的产生,进而通过调节细胞中的氧化还原平衡发挥抗神经炎症作用。还借助1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森小鼠模型考察了土大黄苷的神经保护作用,结果表明土大黄苷能改善小鼠的运动障碍异常等行为,并且还通过抑制促炎因子减弱氧化应激反应,保护了纹状体多巴胺能神经元。
5 结语
蒽醌类组分是大黄的主要活性成分,目前对大黄素、大黄酸、大黄素甲醚、芦荟大黄素和大黄酚的抗炎机制研究较多。大黄鞣质类成分中的没食子酸和儿茶素以及二苯乙烯类成分白藜芦醇等化合物可能会通过抑制炎症小体的激活、调节肠道微生物菌群和嘌呤代谢、恢复肠上皮屏障、调控巨噬细胞极化、调控氧化应激、细胞凋亡、炎症相关蛋白和相关炎症通路等途径,对心血管、胃肠道系统和中枢神经系统等疾病具有一定治疗效果,尤其是都具有较好的抗神经炎症药理作用。大多数实验研究表明这些大黄中的单体化合物可通过某条信号通路或某几个作用靶点发挥其抗炎作用,但是信号通路之间的串扰或协同作用研究较少,这可能是由于单一的细胞或动物模型限制了多种作用途径的研究[68]。此外,大黄中不同的单体化合物在相同的疾病中可通过不同的作用机制发挥作用,表明不同单体化合物的作用机制也可以相互补充,但单体化合物之间的相互作用对大黄抗炎作用的具体影响尚不清楚。
大黄中单体化合物的稳定性、生物利用度和安全性问题可能会限制其在临床上的进一步应用。基于此,对这些单体化合物进行构效关系研究可从化学结构层面加深其抗炎活性、稳定性和生物利用度等方面的理解。此外,随着药物控释材料和技术的发展,利用药物递送的理念和策略开展大黄提取物、组分及活性单体化合物的缓控释研究将有望改善其在炎症相关疾病方面的治疗效果,提高大黄单体化合物的成药性。大黄活性成分在模型动物体内各器官的代谢和分布研究对于阐明其抗炎活性和作用机制具有十分重要的意义,目前采用高效液相色谱质谱联用技术研究大黄蒽醌类化合物的体内代谢及组织分布较多,而对各器官和组织内大黄活性成分及其代谢产物的精准定位分析较少,而且除蒽醌类化合物外的其他成分的体内代谢分布研究也较少,在未来的研究中,质谱成像技术有望在该方面发挥重要的作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 李安仁. 中国植物志(第25卷, 第1分册) [M]. 北京: 科学出版社, 1998: 181-182.
[2] Cao Y J, Pu Z J, Tang Y P,. Advances in bio-active constituents, pharmacology and clinical applications of rhubarb [J]., 2017, 12: 36.
[3] Zheng Q X, Wu H F, Guo J,. Review of rhubarbs: Chemistry and pharmacology [J]., 2013, 5(1): 9-32.
[4] 孟岩, 李焐仪, 单家明, 等. 不同产地大黄药材中13种活性成分含量测定及其HPLC-FP研究 [J]. 江西中医药大学学报, 2022, 34(2): 76-83.
[5] 中国药典[S]. 一部. 2020: 24.
[6] 张开弦, 姚秋阳, 吴发明, 等. 大黄属药用植物化学成分及药理作用研究进展 [J]. 中国新药杂志, 2022, 31(6): 555-566.
[7] Zhang L, Liu H Y, Qin L L,. Global chemical profiling based quality evaluation approach of rhubarb using ultra performance liquid chromatography with tandem quadrupole time-of-flight mass spectrometry [J]., 2015, 38(3): 511-522.
[8] Huang Q, Lu G D, Shen H M,. Anti-cancer properties of anthraquinones from rhubarb [J]., 2007, 27(5): 609-630.
[9] Li R R, Liu X F, Feng S X,. Pharmacodynamics of five anthraquinones (aloe-emodin, emodin, rhein, chysophanol, and physcion) and reciprocal pharmacokinetic interaction in rats with cerebral ischemia [J]., 2019, 24(10): 1898.
[10] 赵天池. 大黄药效成分及其药理活性研究进展 [J]. 中国民康医学, 2021, 33(11): 104-105.
[11] Malaguarnera L. Influence of resveratrol on the immune response [J]., 2019, 11(5): 946.
[12] Kolodziejczyk-Czepas J, Czepas J. Rhaponticin as an anti-inflammatory component of rhubarb: A minireview of the current state of the art and prospects for future research [J]., 2019, 18(5): 1375-1386.
[13] Meng T T, Xiao D F, Muhammed A,. Anti-inflammatory action and mechanisms of resveratrol [J]., 2021, 26(1): 229.
[14] 邓瑞雪, 黄玉阳, 张玉秀, 等. 掌叶大黄鞣质类化学成分研究 [J]. 中草药, 2020, 51(4): 908-911.
[15] Kim J M, Heo H J. The roles of catechins in regulation of systemic inflammation [J]., 2022, 31(8): 957-970.
[16] Olsen M B, Gregersen I, Sandanger Ø,. Targeting the inflammasome in cardiovascular disease [J]., 2021, 7(1): 84-98.
[17] Luo H, Cao G Q, Luo C,. Emerging pharmacotherapy for inflammatory bowel diseases [J]., 2022, 178: 106146.
[18] 张瑛, 周德生. 脑出血后神经炎症的研究进展 [J]. 中国急救医学, 2022, 42(4): 347-352.
[19] Sohrabi F, Dianat M, Badavi M,. Gallic acid suppresses inflammation and oxidative stress through modulating Nrf2-HO-1-NF-κB signaling pathways in elastase-induced emphysema in rats [J]., 2021, 28(40): 56822-56834.
[20] Gao L, Chong E, Pendharkar S,. The effects of NLRP3 inflammasome inhibition in experimental acute pancreatitis: A systematic review and meta-analysis [J]., 2022, 51(1): 13-24.
[21] 麦蓝尹, 陈勇, 谢臻, 等. 基于抗炎作用的大黄药对配伍规律 [J]. 医药导报, 2016, 35(9): 925-929.
[22] 张曼, 戴建业, 俞渊, 等. 大黄灵仙方对LPS诱导的肝内胆管组织损伤大鼠炎症反应及Wnt5a-Ca2+-PKC信号转导通路的影响 [J]. 中国免疫学杂志, 2022, 38(1): 39-44.
[23] Luo S, Wen R Y, Wang Q,. Rhubarb Peony Decoction ameliorates ulcerative colitis in mice by regulating gut microbiota to restoring Th17/Treg balance [J]., 2019, 231: 39-49.
[24] 温如燕, 罗霞, 郑彦懿, 等. 大黄牡丹汤改善DSS诱导的溃疡性结肠炎小鼠炎症状态及其贫血症 [J]. 中华中医药学刊, 2016, 34(12): 2998-3001.
[25] Du X H, Chen Q J, Song J B,. Rhubarb-Aconite Decoction (RAD) drug-containing serum alleviated endotoxin-induced oxidative stress injury and inflammatory response in caco-2 cells[J]., 2020, 2020: 5834502.
[26] 王志旺, 郭玫, 马丹, 等. 甘南栽培唐古特大黄抗炎作用及机制分析 [J]. 中国实验方剂学杂志, 2016, 22(1): 158-161.
[27] 王亚, 芮天奇, 杨军辉, 等. 酒炙对大黄作用于上焦炎症及肝脏能量代谢的影响 [J]. 中药材, 2015, 38(1): 53-57.
[28] Zhang J, Fu Y D, Li L,. Pharmacokinetic comparisons of major bioactive components after oral administration of raw and steamed rhubarb by UPLC-MS/MS [J]., 2019, 171: 43-51.
[29] 张桥, 陈艳琰, 乐世俊, 等. 大黄及其不同炮制品中16种化学成分的含量变化研究 [J]. 中华中医药杂志, 2022, 37(2): 1036-1040.
[30] Zhao X L, Zhu S F, Li J,. Epigenetic changes in inflammatory genes and the protective effect of cooked rhubarb on pancreatic tissue of rats with chronic alcohol exposure [J]., 2022, 146: 112587.
[31] Wang K, Guan D S, Zhao X,. Proteomics and metabolomics of raw rhubarb and wine-processed rhubarb in the treatment of rats with intracerebral hemorrhage [J]., 2020, 8(24): 1670.
[32] 吴冬梅, 赵旭, 汪坤, 等. 大黄对脑出血大鼠的脑保护作用 [J]. 郑州大学学报: 医学版, 2021, 56(2): 258-265.
[33] Lu K, Zhang C, Wu W J,. Rhubarb extract has a protective role against radiation-induced brain injury and neuronal cell apoptosis [J]., 2015, 12(2): 2689-2694.
[34] Meng J, Ni J J, Wu Z,. The critical role of IL-10 in the antineuroinflammatory and antioxidative effects ofon activated microglia [J]., 2018, 2018: 1083596.
[35] Hwang D S, Gu P S, Kim N,. Effects ofon lipopolysaccharide-induced neuroinflammationand[J]., 2018, 33(1): 23-31.
[36] Li X, Huang S L, Zhuo B Y,. Comparison of three species of rhubarb in inhibiting vascular endothelial injury via regulation of PI3K/AKT/NF-κB signaling pathway [J]., 2022, 2022: 8979329.
[37] Neyrinck A M, Etxeberria U, Taminiau B,. Rhubarb extract prevents hepatic inflammation induced by acute alcohol intake, an effect related to the modulation of the gut microbiota [J]., 2017, doi: 10.1002/mnfr.201500899.
[38] 高亮亮, 许旭东, 南海江, 等. 唐古特大黄化学成分研究 [J]. 中草药, 2011, 42(3): 443-446.
[39] Gao L L, Guo T, Xu X D,. Rapid identification and simultaneous analysis of multiple constituents fromMaxim. ex Balf. by UPLC/Q-TOF-MS [J]., 2017, 31(13): 1529-1535.
[40] Jin W, Wang Y F, Ge R L,. Simultaneous analysis of multiple bioactive constituents inMaxim. ex Balf. by high-performance liquid chromatography coupled to tandem mass spectrometry [J]., 2007, 21(14): 2351-2360.
[41] 金丽霞, 金丽军, 栾仲秋, 等. 大黄的化学成分和药理研究进展 [J]. 中医药信息, 2020, 37(1): 121-126.
[42] Choi R J, Ngoc T M, Bae K,. Anti-inflammatory properties of anthraquinones and their relationship with the regulation of P-glycoprotein function and expression [J]., 2013, 48(1/2): 272-281.
[43] Hu B Y, Zhang H, Meng X L,.-emodin from rhubarb () inhibits lipopolysaccharide- induced inflammatory responses in RAW264.7 macrophages [J]., 2014, 153(3): 846-853.
[44] 张昊悦, 赵蓓, 王业皇, 等. 大黄素通过调节Nrf2/HO-1和MAPKs抑制炎症和氧化应激机制研究 [J]. 中国免疫学杂志, 2021, 37(9): 1063-1068.
[45] Park S Y, Jin M L, Ko M J,. Anti-neuroinflammatory effect of emodin in LPS-stimulated microglia: Involvement of AMPK/Nrf2 activation [J]., 2016, 41(11): 2981-2992.
[46] Li R, Liu W Z, Ou L,. Emodin alleviates hydrogen peroxide-induced inflammation and oxidative stress via mitochondrial dysfunction by inhibiting the PI3K/ mTOR/GSK3β pathway in neuroblastoma SH-SY5Y cells [J]., 2020, 2020: 1562915.
[47] Wu W J, Hu N, Zhang Q W,.glucuronidation of five rhubarb anthraquinones by intestinal and liver microsomes from humans and rats [J]., 2014, 219: 18-27.
[48] Wu J W, Wei Z H, Cheng P,. Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis [J]., 2020, 10(23): 10665-10679.
[49] Zhou Y Y, Gao C F, Vong C T,. Rhein regulates redox-mediated activation of NLRP3 inflammasomes in intestinal inflammation through macrophage-activated crosstalk [J]., 2022, 179(9): 1978-1997.
[50] Zhuang S, Zhong J, Zhou Q L,. Rhein protects against barrier disruption and inhibits inflammation in intestinal epithelial cells [J]., 2019, 71: 321-327.
[51] Dong L L, Du H L, Zhang M Y,. Anti-inflammatory effect of Rhein on ulcerative colitis via inhibiting PI3K/Akt/mTOR signaling pathway and regulating gut microbiota [J]., 2022, 36(5): 2081-2094.
[52] Zheng P, Tian X F, Zhang W,. Rhein suppresses neuroinflammation via multiple signaling pathways in LPS-stimulated BV2 microglia cells [J]., 2020, 2020: 7210627.
[53] Wen Q, Miao J F, Lau N,. Rhein attenuates lipopolysaccharide-primed inflammation through NF-κB inhibition in RAW264.7 cells: Targeting the PPAR-γ signal pathway [J]., 2020, 98(6): 357-365.
[54] Zhou J, Zheng J, Zhang Y,. Chitosan hydrogel delivery system containing herbal compound functions as a potential antineuroinflammatory agent [J]., 2019, 4(6): 10185-10191.
[55] Zheng J, Fan R, Wu H Q,. Directed self-assembly of herbal small molecules into sustained release hydrogels for treating neural inflammation [J]., 2019, 10(1): 1604.
[56] Liu J, Hu G, Xu R,. Rhein lysinate decreases the generation of β-amyloid in the brain tissues of Alzheimer’s disease model mice by inhibiting inflammatory response and oxidative stress [J]., 2013, 15(7): 756-763.
[57] Li X, Chu S F, Liu Y J,. Neuroprotective effects of anthraquinones from rhubarb in central nervous system diseases [J]., 2019, 2019: 3790728.
[58] Dong X, Wang L, Song G,. Physcion protects rats against cerebral ischemia-reperfusion injury via inhibition of TLR4/NF-kB signaling pathway [J]., 2021, 15: 277-287.
[59] 李纪丰, 王瑞婕, 张宇欣, 等. 大黄素甲醚通过HMGB1-NLRP3信号通路缓解药物性肝损伤的作用研究 [J]. 中草药, 2022, 53(7): 2095-2102.
[60] Pasala P K, Abbas Shaik R, Rudrapal M,. Cerebroprotective effect of aloe emodin:andstudies [J]., 2022, 29(2): 998-1005.
[61] Xian M H, Cai J L, Zheng K N,.-emodin prevents nerve injury and neuroinflammation caused by ischemic stroke via the PI3K/AKT/mTOR and NF-κB pathway [J]., 2021, 12(17): 8056-8067.
[62] Zhang Y, Song Z Q, Huang S,. Aloe emodin relieves Ang II-induced endothelial junction dysfunction via promoting ubiquitination mediated NLRP3 inflammasome inactivation [J]., 2020, 108(6): 1735-1746.
[63] 郭静, 尚海, 马丽炎, 等. 芦荟大黄素衍生物AE-YJ通过PI3K-Akt/NF-κB和MAPK/NF-κB途径抑制LPS诱导RAW264.7细胞炎症介质的释放 [J]. 中国药理学通报, 2021, 37(12): 1700-1708.
[64] Shi F, Chen L, Wang Y P,. Enhancement of oral bioavailability and anti-hyperuricemic activity of aloe emodin via novel Soluplus®-glycyrrhizic acid mixed micelle system [J]., 2022, 12(3): 603-614.
[65] 邴小三, 望燕妮, 赵申, 等. 大黄酚抑制自噬改善HIBI新生大鼠脑组织病理损伤和炎症反应 [J]. 中国免疫学杂志, 2019, 35(24): 3015-3020.
[66] Jadaun K S, Mehan S, Sharma A,. Neuroprotective effect of chrysophanol as a PI3K/AKT/mTOR signaling inhibitor in an experimental model of autologous blood-induced intracerebral hemorrhage [J]., 2022, 42(2): 249-266.
[67] Zhang N, Zhang X J, Liu X X,. Chrysophanol inhibits NALP3 inflammasome activation and ameliorates cerebral ischemia/reperfusion in mice [J]., 2014, 2014: 370530.
[68] Bai J R, Zhang Y S, Tang C,. Gallic acid: Pharmacological activities and molecular mechanisms involved in inflammation-related diseases [J]., 2021, 133: 110985.
[69] Wu Y, Li K Y, Zeng M L,. Serum metabolomics analysis of the anti-inflammatory effects of gallic acid on rats with acute inflammation [J]., 2022, 13: 830439.
[70] Hu G, Zhou X. Gallic acid ameliorates atopic dermatitis-like skin inflammation through immune regulation in a mouse model [J]., 2021, 14: 1675-1683.
[71] Lin Y Q, Luo T Y, Weng A L,. Gallic acid alleviates gouty arthritis by inhibiting NLRP3 inflammasome activation and pyroptosis through enhancing Nrf2 signaling [J]., 2020, 11: 580593.
[72] Liu Y L, Hsu C C, Huang H J,. Gallic acid attenuated LPS-induced neuroinflammation: Protein aggregation and necroptosis [J]., 2020, 57(1): 96-104.
[73] Sunil M A, Sunitha V S, Santhakumaran P,. Protective effect of (+)-catechin against lipopolysaccharide-induced inflammatory response in RAW 264.7 cells through downregulation of NF-κB and p38 MAPK [J]., 2021, 29(4): 1139-1155.
[74] Tu S, Xiao F, Min X Y,. Catechin attenuates coronary heart disease in a rat model by inhibiting inflammation [J]., 2018, 18(5): 393-399.
[75] Prince P D, Fischerman L, Toblli J E,. LPS-induced renal inflammation is prevented by (−)-epicatechin in rats [J]., 2017, 11: 342-349.
[76] Ling J M, Wu Y Q, Zou X J,. (−)-epicatechin reduces neuroinflammation, protects mitochondria function, and prevents cognitive impairment in sepsis-associated encephalopathy [J]., 2022, 2022: 2657713.
[77] Navarrete-Yañez V, Garate-Carrillo A, Rodriguez A,. Effects of (−)-epicatechin on neuroinflammation and hyperphosphorylation of tau in the hippocampus of aged mice [J]., 2020, 11(12): 10351-10361.
[78] Wang J P, Li P, Qin T,. Protective effect of epigallocatechin-3-gallate against neuroinflammation and anxiety-like behavior in a rat model of myocardial infarction [J]., 2020, 10(6): e01633.
[79] Zhang S, Zhu Q, Chen J Y,. The pharmacological activity of epigallocatechin-3-gallate (EGCG) on Alzheimer's disease animal model: A systematic review [J]., 2020, 79: 153316.
[80] 张琪, 苏兰, 何龙希, 等. 白藜芦醇的药理作用及其临床应用的研究进展 [J]. 华西药学杂志, 2022, 37(2): 214-217.
[81] 黄南渠, 金海, 石京山, 等. 白藜芦醇抑制小胶质细胞激活在神经炎症中的研究进展 [J]. 中国药学杂志, 2018, 53(2): 85-91.
[82] Wang R, Wang Y M, Wu J M,. Resveratrol targets AKT1 to inhibit inflammasome activation in cardiomyocytes under acute sympathetic stress [J]., 2022, 13: 818127.
[83] Gal R, Deres L, Horvath O,. Resveratrol improves heart function by moderating inflammatory processes in patients with systolic heart failure [J]., 2020, 9(11): 1108.
[84] Recalde M D, Miguel C A, Noya-Riobó M V,. Resveratrol exerts anti-oxidant and anti-inflammatory actions and prevents oxaliplatin-induced mechanical and thermal allodynia [J]., 2020, 1748: 147079.
[85] Cong L, Lei M Y, Liu Z Q,. Resveratrol attenuates manganese-induced oxidative stress and neuroinflammation through SIRT1 signaling in mice [J]., 2021, 153: 112283.
[86] Le K, Chibaatar Daliv E, Wu S S,. SIRT1-regulated HMGB1 release is partially involved in TLR4 signal transduction: A possible anti-neuroinflammatory mechanism of resveratrol in neonatal hypoxic-ischemic brain injury [J]., 2019, 75: 105779.
[87] Peng X, Wang J, Peng J,. Resveratrol improves synaptic plasticity in hypoxic-ischemic brain injury in neonatal mice via alleviating SIRT1/NF-κB signaling-mediated neuroinflammation [J]., 2022, 72(1): 113-125.
[88] Zhao H S, Mei X F, Yang D F,. Resveratrol inhibits inflammation after spinal cord injury via SIRT-1/NF-κB signaling pathway [J]., 2021, 762: 136151.
[89] Tian Q Y, Fan X F, Ma J S,. Resveratrol ameliorates lipopolysaccharide-induced anxiety-like behavior by attenuating YAP-mediated neuro-inflammation and promoting hippocampal autophagy in mice [J]., 2020, 408: 115261.
[90] Braun B J, Slowik A, Leib S L,. The formyl peptide receptor like-1 and scavenger receptor MARCO are involved in glial cell activation in bacterial meningitis [J]., 2011, 8(1): 11.
[91] Calvello R, Cianciulli A, Porro C,. Formyl peptide receptor (FPR)1 modulation by resveratrol in an LPS-induced neuroinflammatory animal model [J]., 2021, 13(5): 1418.
[92] Feng L F, Zhang L L. Resveratrol suppresses Aβ-induced microglial activation through the TXNIP/TRX/NLRP3 signaling pathway [J]., 2019, 38(8): 874-879.
[93] Wang Y P, Shi Y, Huang Y Q,. Resveratrol mediates mechanical allodynia through modulating inflammatory response via the TREM2-autophagy axis in SNI rat model [J]., 2020, 17(1): 311.
[94] Ma S, Fan L L, Li J C,. Resveratrol promoted the M2 polarization of microglia and reduced neuroinflammation after cerebral ischemia by inhibiting miR-155 [J]., 2020, 130(8): 817-825.
[95] 徐颖, 郭增军, 谭林. 土大黄苷研究进展 [J]. 中国现代应用药学, 2009, 26(7): 549-552.
[96] 辛杰, 王振, 陈敏, 等. 土大黄苷的药理作用及机制研究进展 [J]. 中国药房, 2020, 31(11): 1386-1390.
[97] Mickymaray S, Alfaiz F A, Paramasivam A,. Rhaponticin suppresses osteosarcoma through the inhibition of PI3K-Akt-mTOR pathway [J]., 2021, 28(7): 3641-3649.
[98] Li R G, Chinnathambi A, Alharbi S A,. Anti-inflammatory effects of rhaponticin on LPS-induced human endothelial cells through inhibition of MAPK/NF-κB signaling pathways [J]., 2021, 35(5): e22733.
[99] Zhao F F, Tian H J, Chinnathambi A,. Neuroprotective effect of rhaponticin against Parkinson disease: Insights from in vitro BV‐2 model and in vivo MPTP‐induced mice model [J]., 2021, 35(1): 1-9.
Research progress on anti-inflammatory effect ofetand its active components
HAN Si-qi1, 2, HA Wei1,SHI Yan-ping1
1. Key Laboratory for Natural Medicine of Gansu Province, Key Laboratory of Chemistry of Northwestern Plant Resources, Chinese Academy of Sciences, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China 2. University of Chinese Academy of Sciences, Beijing 100049, China
Dahuang (et) is the dried root and rhizome of,or. It has the functions of cooling blood and detoxification, removing blood stasis and clearing the meridians, and reducing dampness and yellowing. Modern pharmacological studies have shown thatetand its extracts or isolated compounds have excellent anti-inflammatory activities and can regulate the activation of inflammasomes, mainly by regulating cellular processes such as oxidative stress, apoptosis, and immune response, and also can regulate inflammation-related proteins and pathways.ethave shown significant pharmacological activities in cardiovascular, gastrointestinal system and central nervous system diseases, especially have good anti-neuroinflammatory effects. Research progress on anti-inflammatory activities and mechanism ofextracts, anthraquinones, tannins, and stilbenes in inflammatory related diseases were reviewed in this paper, and its development trend was prospected, in order to provide theoretical support for clinical application, further development and utilization ofand research and development of new drugs.
; anti-inflammatory; emodin; rhein; emodin methyl ether; aloe emodin; chrysophanol; gallic acid; catechin; epicatechin; epicatechin gallate; resveratrol
R282.710.5
A
0253 - 2670(2023)01 - 0303 - 14
10.7501/j.issn.0253-2670.2023.01.032
2022-10-11
国家重点研发计划项目(2021YFE0103700);国家自然科学基金资助项目(U21A20407);内蒙古自治区科技成果转化项目(院区科技合作项目)
韩思琪(1998—),女,硕士研究生,研究方向为药物分析化学。E-mail: hansiqi@licp.cas.cn
通信作者:哈 伟(1984—),男,研究员,主要从事中药化学成分与药物分析化学研究。E-mail: hawei2012@licp.cas.cn
师彦平(1965—),男,研究员,主要从事药物化学成分与分析技术研究。E-mail: shiyp@licp.cas.cn
[责任编辑 崔艳丽]
