瑞香狼毒的化学成分研究
2023-01-10刘丽颖周官红
周 地,刘丽颖,周官红,陈 刚,李 宁
瑞香狼毒的化学成分研究
周 地,刘丽颖,周官红,陈 刚,李 宁*
沈阳药科大学中药学院,辽宁省重大慢病中药创新药重点实验室,沈阳市中药药效物质研究与创新药开发重点实验室,辽宁 沈阳 110016
对瑞香狼毒的主要活性二萜成分南香大环素进行化学成分研究。选用D101型大孔吸附树脂、硅胶柱色谱、ODS及HPLC等多种色谱学方法进行分离纯化,并运用波谱学技术对化合物进行结构鉴定,通过计算ECD光谱确定化合物的绝对构型。从瑞香狼毒根95%乙醇水提取物中分离得到3个化合物,分别鉴定为(−)-异狼毒素C(1)、芫花萜烷J(2)和狼毒愈创木酮D(3)。化合物1~3均为新化合物,其中,化合物1为双黄酮类化合物,化合物2、3为萜类化合物。
瑞香狼毒;(−)-异狼毒素C;芫花萜烷J;狼毒愈创木酮D;绝对构型
瑞香狼毒L.为瑞香科(Thymelaeaceae)狼毒属Linn. 多年生草本植物,又称燕子花、断肠草等[1-2]。狼毒属植物10~12种,我国有台湾狼毒Hayata ex Li和瑞香狼毒2种,主要分布于我国台湾、北方各省及西南地区。瑞香狼毒作为传统有毒中药,其药用部位主要为根,传统功效为祛痰、消积、止痛,外敷可治疥癣。现代药理研究表明,瑞香狼毒具有抗艾滋病病毒、抗肿瘤、抗结核、抗白血病、抗癫痫等多种活性[3-4]。
南香大环素是瑞香烷型二萜的典型代表。1976年,南香大环素首次从瑞香科近心格尼迪木(Meissn.) Engl.的乙醇提取物中分离得到[5-6]。后期研究发现,该化合物亦存在于瑞香狼毒中。南香大环素具有显著的抗HIV、抗肿瘤等生物学活性,为瑞香狼毒中的主要活性成分之一。
本研究对瑞香狼毒根95%乙醇水提取物进行系统分离,以期发现更多活性较好的先导化合物。利用多种色谱分离手段(硅胶吸附柱色谱、大孔吸附柱色谱、开放ODS柱色谱、Sephadex LH-20柱色谱、HPLC)和重结晶等,共分离得到3个新的单体化合物,分别鉴定为(−)-异狼毒素C [(−)- isochamaejasmenin C,1]、芫花萜烷J(genkwadane J,2)和狼毒愈创木酮D(stelleraguaianone D,3)。其中,化合物1为双黄酮类化合物,化合物2、3为萜类化合物,结构见图1。

图1 化合物1~3的化学结构
1 仪器与材料
Bruker-ARX、Bruker-AV型核磁共振波谱仪(400、600 MHz)、micro TOF Q型质谱仪(瑞士Bruker公司);Shimadzu LC-6AD型高效液相色谱仪(日本岛津公司);Bio-Logic SAS MOS-500型圆二色光谱仪(法国Bio-Logic公司);Perkin-Elmer 341MC型旋光仪(珀金埃尔默仪器上海有限公司);D101型大孔吸附树脂(河北沧州宝恩吸附树脂材料科技有限公司);薄层色谱(200~300目)、柱色谱(200~300目)硅胶(青岛海洋化工厂);ODS填料(50 μm)、YMC-Pack ODS-A C18分析柱(250 mm×4.6 mm,5 μm)、YMC-Pack ODS-A C18制备柱(250 mm×10 mm,5 μm),日本YMC公司。
实验所用瑞香狼毒为2016年8月采集于甘肃省庆阳市正宁县,经沈阳药科大学中药鉴定教研室潘英妮教授鉴定为瑞香科瑞香狼毒L.的干燥根。标本(20160801)保存于沈阳药科大学中药学院天然药物化学实验室。
2 提取与分离
瑞香狼毒干燥根的药材饮片(10 kg)经初步粉碎后,采用95%乙醇水加热回流提取3次,每次3 h,合并提取液,浓缩得到总提取物2.64 kg,采用D101型大孔吸附树脂经60%乙醇水溶液和95%乙醇水溶液2个梯度依次洗脱,分别得到2.26 kg和0.326 kg相应乙醇洗脱物。在60%乙醇水溶液洗脱流分中取出180 g浸膏进行常规硅胶色谱柱分离,洗脱剂为不同比例的二氯甲烷-甲醇(100∶0、5∶1、2∶1、0∶100),共得到4个流分(Fr. 1~4)。
Fr.1(9 g)经开放硅胶柱色谱分离,利用不同比例的石油醚-醋酸乙酯按照100∶0~0∶100的比例进行洗脱得到8个流分(Fr. 1-1~1-8)。将Fr. 1-4(323 mg)进一步利用ODS柱色谱分离,洗脱剂为甲醇-水,并由HPLC分离(流动相为甲醇-水90∶10)得到化合物3(2.3 mg,R=23 min)。Fr. 3(26 g)经开放硅胶柱色谱分离,利用不同比例的二氯甲烷-甲醇按照100∶0→0∶100的比例进行洗脱得到10个流分(Fr. 2-1~2-10),将Fr. 1-8(350 mg)进一步利用ODS柱色谱分离,洗脱剂为甲醇-水,并由HPLC分离(流动相为甲醇-水95∶5)得到化合物2(4.7 mg,R=36 min)。将Fr. 2-2(850 mg)进一步利用ODS柱色谱分离,洗脱剂为甲醇-水,并由HPLC分离(流动相为甲醇-水80∶20)得到化合物1(24.7 mg,R=43 min)。
3 结构鉴定
化合物1:黄色无定形粉末(甲醇);[α]20 D−22.7 (0.5, MeOH);三氯化铁-铁氰化钾反应为阳性,提示其结构含有游离酚羟基。HR-ESI-MS给出准分子离子峰[M-H]−/: 555.129 2(理论值C31H23O10,555.129 7),确定其分子式为C31H24O10,计算其不饱和度为20。1H-NMR (600 MHz, Acetone-6) 中,H5.82 (2H, overlapped, H-6, 6), 5.97 (2H, overlapped, H-8, 8) 为2组典型的5,7-二羟基取代二氢黄酮A环和A环氢信号;H7.23 (2H, d,= 8.5 Hz, H-2, 6), 7.00 (2H, d,= 8.5 Hz, H-3, 5) 和H7.13 (2H, d,= 8.3 Hz, H-2, 6), 6.90 (2H, d,= 8.3 Hz, H-3, 5) 为2组二氢黄酮B环和B环AABB偶合系统氢信号;H4.96 (2H, brs, H-2, 2), 3.93 (2H, brs, H-3, 3) 为2组二氢黄酮C环和C环氢信号;H3.83 (3H, s, 4-OCH3) 为甲氧基氢信号。13C-NMR (150 MHz, Acetone-6) 中给出31个碳信号,包括2组二氢黄酮A环和A环的12个碳信号C164.0 (C-5), 95.9 (C-6, 6), 167.8 (C-7, 7), 97.2 (C-8), 165.4 (C-9, 9), 102.5 (C-10) 和C164.1 (C-5), 95.9 (C-6, 6), 167.8 (C-7, 7), 97.2 (C-8), 165.4 (C-9, 9), 102.6 (C-10);2组二氢黄酮B环和B环12个碳信号C129.7 (C-1), 130.6 (C-2, 6), 115.1 (C-3, 5), 161.6 (C-4) 和C128.6 (C-1), 130.7 (C-2, 6), 116.5 (C-3, 5), 159.4 (C-4);2组二氢黄酮C环和C环6个碳信号C81.9 (C-2), 48.6 (C-3), 196.4 (C-4) 和81.9 (C-2), 48.3 (C-3), 196.4 (C-4);以及1个甲氧基碳信号C55.7 (4-OCH3)。根据化合物1的1D NMR谱图推测化合物为瑞香科狼毒属特征的双二氢黄酮类化合物,并根据HSQC谱的相关信息对其碳氢数据进行了归属,见表1。
HMBC谱中,观察到H3.83 (4-OCH3) 与C161.6 (C-4) 有远程相关,提示甲氧基连接在B环的C-4位;NOESY谱中,H3.83 (4-OCH3) 与H7.00 (H-3, 5) 相关,进一步证明甲氧基连接在B环的C-4位,见图2。该化合物H-2和H-2为宽单峰,提示H-2/H-3和H-2/H-3均为顺式构型。
根据冯宝民[6]的研究总结,以DMSO-6、CD3OD和Acetone-6为氘代试剂时,该类型化合物H-3/H-3相对构型可通过2, 2, 3, 3位氢化学位移规律确定,当H-2/2''为5.30~6.20,H-3/3''为2.60~3.10时,H-3/H-3为顺式构型;当H-2/2''为4.70~5.00,H-3/3''为3.30~3.90时,H-3/H-3为反式构型。根据以上规律,该化合物H-2/H-2化学位移为4.96,H-3/H-3化学位移为3.93,即H-3/H-3为反式构型。由此,确定化合物1相对构型,即H-2/H-3和H-2/H-3为顺式构型,H-3/H-3为反式构型。进一步测试化合物1的ECD光谱,与计算ECD谱图进行对比分析,确定化合物1的绝对构型为2, 3, 2, 3,见图3。综上,经检索该化合物为一未经报道的新化合物,命名为(−)-异狼毒素C。
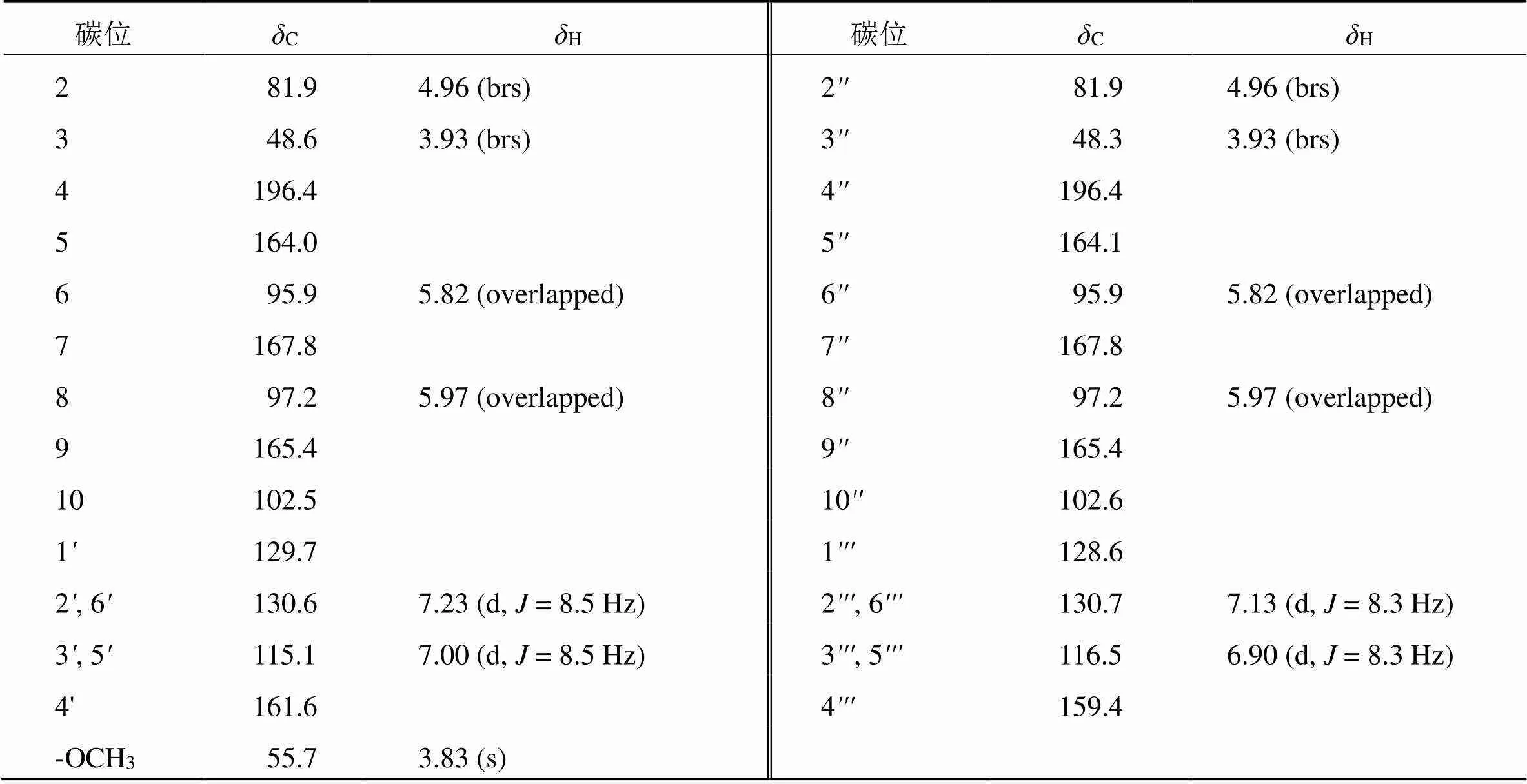
表1 化合物1的1H-NMR和13C-NMR数据(600/150 MHz)

图2 化合物1的关键HMBC和NOESY信号

图3 化合物1的实测和计算ECD谱图
化合物2:白色无定型粉末(甲醇);[α]20 D+4.8 (0.2, MeOH);HR-ESI-MS给出准分子离子峰[M-H]–/: 655.347 8(理论值C37H51O10, 655.349 6),确定其分子式为C37H52O10,计算其不饱和度为12。该化合物的13C-NMR (150 MHz, CDCl3) 给出37个碳信号,其中1组末端双键碳信号C146.5 (C-15), 111.3 (C-16)以及C48.1 (C-1), 36.1 (C-2), 79.0(C-3), 83.2(C-4), 77.5(C-5), 77.3(C-6), 77.2 (C-7), 36.4 (C-8), 81.8 (C-9), 52.4 (C-10), 35.7 (C-11), 38.1 (C-12), 84.4 (C-13), 85.1 (C-14), 19.0(C-17), 22.7 (C-18), 14.8 (19-CH3), 67.5 (C-20) 构成瑞香烷型二萜母核的20个特征碳信号,且C77.3(C-6), 77.2 (C-7) 表明C-6, C-7环氧结构氧化变成2个羟基。1H-NMR (600 MHz, CDCl3) 中,低场区给出1组末端双键氢信号H4.98 (1H, s, H-16a), 4.88 (1H, s, H-16b);4个连氧次甲基氢信号H4.10 (1H, d,= 6.0 Hz, H-3), 3.66 (1H, d,= 4.8 Hz, H-5), 4.43 (1H, s, H-7), 4.36 (1H, d,= 2.4 Hz, H-14);1组连氧亚甲基氢信号H4.89 (1H, d,= 12.0 Hz, H-20a), 4.58 (1H, d,= 12.0 Hz, H-20b);5个次甲基氢信号H2.48 (1H, m, H-1), 2.07 (1H, t,= 6.0 Hz, H-2), 2.33 (1H, d,= 1.2 Hz, H-8), 2.91 (1H, d,= 6.0 Hz, H-10), 2.89 (1H, t,= 7.2 Hz, H-11);高场区给出3组甲基氢信号H1.75 (3H, s, 17-CH3), 1.46 (3H, d,= 7.2 Hz, 18-CH3), 1.04 (3H, d,= 7.2 Hz, 19-CH3)。上述氢信号为瑞香烷型二萜母核上氢信号。13C-NMR (150 MHz, CDCl3) 中,C119.8 (C-1) 提示该结构含有瑞香烷型二萜类化合物特征的原酸酯结构;C130.0 (C-1), 129.9 (C-2, 6), 128.6 (C-3, 5), 133.4 (C-4) 为苯甲酰氧基苯环碳信号;C167.3 (C-OBz) 为苯甲酰氧基羰基碳信号;1H-NMR (600 MHz, CDCl3) 中,H8.07 (2H, d,= 7.8 Hz, H-2, 6), 7.46 (2H, t,= 7.8 Hz, H-3, 5), 7.58 (1H, t,= 7.8 Hz, H-4) 为苯甲酰氧基苯环氢信号;H0.77 (3H, d,= 6.6 Hz, H-10) 为侧链上甲基氢信号。根据HSQC谱的相关信息对其碳氢数据进行了归属,见表2。
在HMBC谱中,观察到H4.36 (H-14) 与C119.8 (C-1) 有远程相关,提示该化合物含有原酸酯结构;H2.07 (H-2), 2.91 (H-10) 与C36.4 (C-9) 有远程相关,H0.77 (H-10) 与C35.8 (C-8), 48.1 (C-1) 有远程相关,提示长侧链与母核C-1相连形成大环结构;H8.07 (H-14) 与C167.3 (C-OBz) 有远程相关,H4.89 (H-20a), 4.58 (H-20b) 与C167.3 (C-OBz) 有远程相关,H4.43 (H-7), 3.66 (H-5) 与C67.5 (C-20) 有远程相关,提示苯甲酰氧基与C-20相连;NOESY谱中,H3.66 (H-5) 与H4.10 (H-3), 2.91 (H-10), 4.89 (H-20a), 4.58 (H-20b) 相关,H4.10 (H-3) 与H2.91 (H-10) 相关,提示H-3/H-5/ H-10/H-20为同侧;H2.33 (H-8) 与H2.89 (H-11) 相关,提示H-18/H-8为异侧;H4.36 (H-14) 与H1.75 (H-17) 相关,提示H-14/H-17为同侧;H-14为2.4 Hz,提示H-14/H-8为同侧;H-7为单峰,提示H-7/H-8为同侧。该化合物与芫花萜烷C(genkwadane C)结构很相似,不同之处在于该化合物的碳谱数据为48.1 (C-1), 36.4 (C-9), 35.8 (C-8),而芫花萜烷C为50.1 (C-1), 38.0 (C-9), 22.5 (C-8),提示C-9构型发生了改变[7-8],NOESY谱中H2.48 (H-1) 与H1.04 (H-19), 0.77 (H-10) 相关,H-8与H-18相关,H-9与H-10相关也进一步证明该化合物为芫花萜烷C在C-9位的异构体,详见图4。自然界中1位烷基化,且含有原酸酯结构的瑞香烷型二萜类化合物五元环与七元环为反式骈合,19-CH3为构型,由此确定该化合物的构型[7]。综上,经检索该化合物为1个未经报道的新化合物,命名为芫花萜烷J。
化合物3:白色粉末(甲醇);HR-ESI-MS给出准分子离子峰[M+H]+/: 235.164 3(理论值C15H23O2,235.169 8);结合1H-和13C-NMR可确定其分子式为C15H22O2。化合物3的1H-NMR (600 MHz, CDCl3) 在低场区给出1组末端双键氢信号H4.73 (1H, m, H-13a) 和4.76 (1H, m, H-13b);4组亚甲基氢信号H2.47 (1H, dd,= 19.3, 1.2 Hz, H-2α), 2.55 (1H, m, H-2β), 2.44 (1H, dd,= 19.3, 0.9 Hz, H-6α), 2.80 (1H, brd,= 19.3 Hz, H-6β), 1.42 (1H, m, H-8α), 1.89 (1H, m, H-8β), 1.88 (1H, m, H-9α), 2.02 (1H, m, H-9β);2个次甲基氢信号H3.19 (1H, m, H-10), 2.37 (1H, brt,= 10.9 Hz, H-7)。在高场区给出3个甲基氢信号H0.95 (3H, brs, CH3-14), 1.66 (3H, d,= 0.9 Hz, CH3-15), 1.77 (3H, brs, CH3-12)。13C-NMR (150 MHz, CDCl3) 谱中给出15个碳信号C208.3 (C-3), 138.4 (C-4), 172.2 (C-5), 150.4 (C-11), 109.6 (C-13), 74.8 (C-1), 52.0 (C-10), 46.7 (C-9), 43.9 (C-7), 37.6 (C-2), 37.8 (C-6), 32.0 (C-8), 20.4 (CH3-12), 21.0 (CH3-14), 8.3 (CH3-15),提示其为愈创木烷型倍半萜类化合物,且其NMR数据与已知化合物狼毒愈创木酮A(stelleraguaianone A)类似[8]。
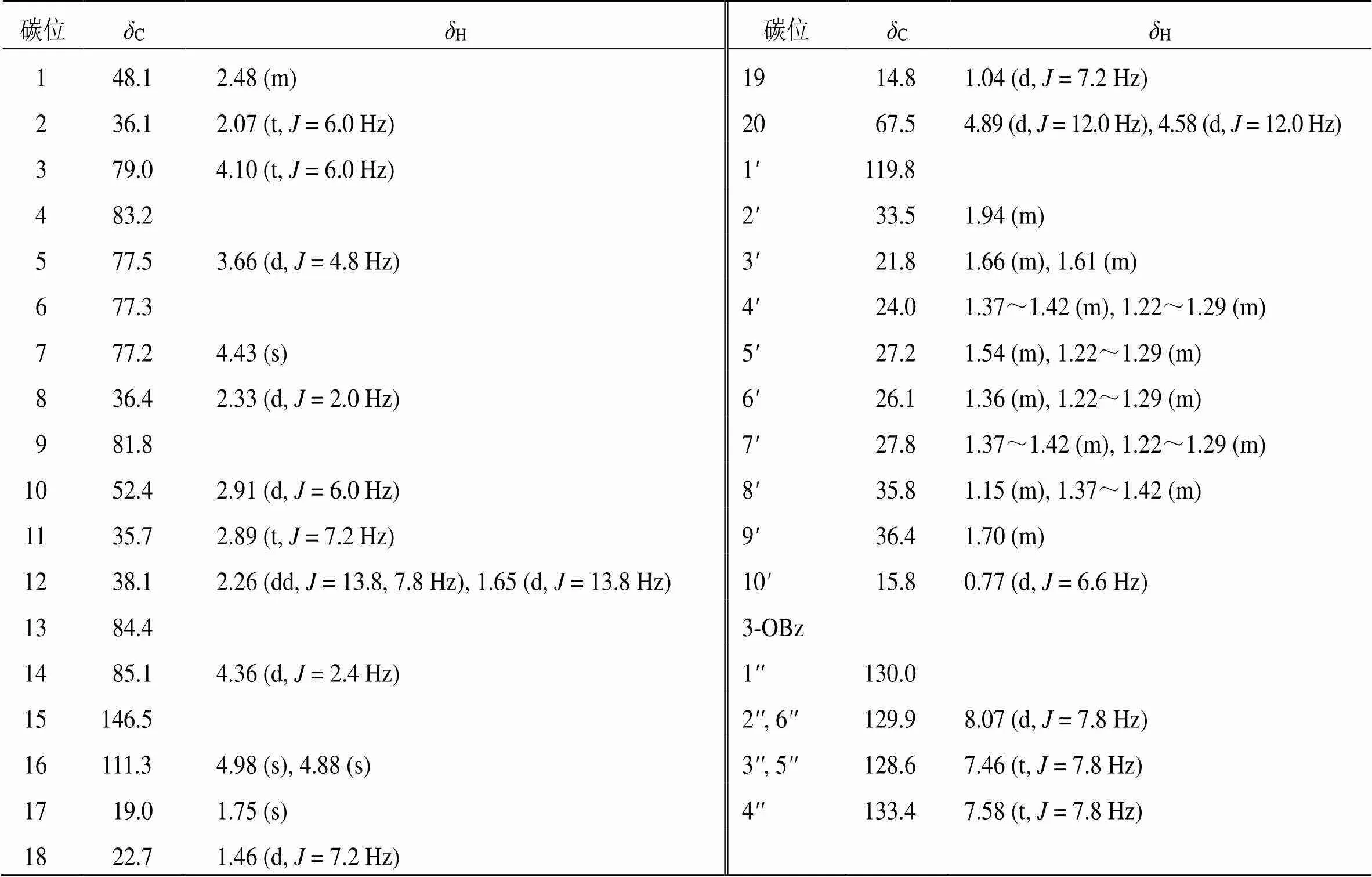
表2 化合物2的1H-NMR 和13C-NMR数据(600/150 MHz)

图4 化合物2的关键HMBC和NOESY信号
HMBC谱中,观察到H2.47 (H-2)与C138.4 (C-4)、172.2 (C-5) 有远程相关,H2.80 (H-6β) 与C138.4 (C-4)、32.0 (C-8) 有相关,H2.37 (H-7) 与C46.7 (C-9)、172.2 (C-5) 有远程相关,H3.19 (H-10) 与C37.6 (C-2)、C172.2 (C-5) 有远程相关,H4.76 (H-13b)、1.77 (CH3-12) 与43.9 (C-7) 有远程相关,进一步确定化合物3为愈创木烷型倍半萜骨架。H0.95 (CH3-14) 与C74.8 (C-1)、46.7 (C-9)有远程相关提示CH3-14取代在C-10位,H1.66 (CH3-15) 与C208.3 (C-3)、172.2 (C-5) 有远程相关提示CH3-15取代在C-4位,见图5。与已知化合物狼毒愈创木酮A的NMR相比,化合物3多出1个次甲基氢信号,且C-10位的化学位移向高场位移,推测该化合物C-10位无羟基取代。由此,确定了该化合物的平面结构,NMR数据归属见表3。
化合物3的相对构型通过NOESY谱进行解析,H1.66 (CH3-15) 与H2.44 (H-6α), 2.37 (H-7)相关,提示C-4, 5的双键为型。H3.19 (H-10) 与H2.37 (H-7) 相关,提示H-10和H-7为同侧,NOESY谱中并未出现1-OH信号,但根据该类倍半萜的生源合成途径推测1-OH和H2.37 (H-7)、3.19 (H-10) 在同侧,经文献检索,化合物3为未见文献报道的新化合物,鉴定为狼毒愈创木酮D。

图5 化合物3的关键HMBC和NOESY信号

表3 化合物3的1H-NMR和13C-NMR数据(600/150 MHz)
4 结论
从瑞香狼毒中发现抗HIV活性化合物南香大环素的基础上,进一步对瑞香狼毒提取物的有效部位进行系统分离,得到3个新化合物,分别属于双黄酮类化合物和萜类化合物,为该植物的进一步应用和研究提供了丰富的物质基础,为更充分地实现其药用价值提供科学依据,后续会继续对从中分离的新化合物抗HIV活性进行生物评价。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 (第52卷) [M]. 北京: 科学出版社, 2004: 397-398.
[2] 国家中医药管理局《中华本草》编委会. 中华本草 [M]. 上海: 上海科学技术出版社, 1999: 231-232.
[3] 中国药典 [S]. 一部. 2020: 298.
[4] 叶云云, 韩璐, 魏萍, 等. 狼毒属植物化学成分及药理活性研究进展 [J]. 中国中药杂志, 2015, 40(22): 4324-4332.
[5] 朱宇惠, 杨彩霞. 瑞香狼毒根乙酸乙酯提取部分的化学成分研究 [J]. 食品与药品, 2013, 15(5): 323-325.
[6] 冯宝民. 瑞香狼毒和柚皮抗癫痫活性成分的研究 [D]. 沈阳: 沈阳药科大学, 2002.
[7] Hayes P Y, Chow S, Somerville M J,. Pimelotides A and B, diterpenoid ketal-lactone orthoesters with an unprecedented skeleton from[J]., 2009, 72(12): 2081-2083.
[8] Lin R W, Tsai I L, Duh C Y,. New lignans and cytotoxic constituents from[J]., 2004, 70(3): 234-238.
Chemical constituents from
ZHOU Di, LIU Li-ying, ZHOU Guan-hong, CHEN Gang, LI Ning
Liaoning Key Laboratory of Innovative Traditional Chinese Medicine for Major Chronic Diseases, Key Laboratory for TCM Material Basis Study and Innovative Drug Development of Shenyang City, School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
To systematically study the main active diterpenoids, gnidimacrin, chemical constituents of.D101 macroporous adsorption resin, silica gel column chromatography, ODS, HPLC and other chromatographic methods were used for separation and purification, and the compounds were identified by spectroscopic techniques. The absolute configuration of the compound was determined by ECD.Three compounds were isolated from. They were identified as (−)-isochamaejasmin C (1), genkwadane J (2) and stelleraguaianone D (3), respectively.Compounds 1—3 are new compounds, among which compound 1 is a biflavonoid and compounds 2 and 3 are terpenes.
L.; (−)-isochamaejasmenin C; genkwadane J; stelleraguaianone D; absolute configuration
R284.1
A
0253 - 2670(2023)01 - 0029 - 06
10.7501/j.issn.0253-2670.2023.01.004
2022-11-07
辽宁省自然科学基金资助项目(2022-MS-242);辽宁省教育厅科技项目(LJKZ0949,LJKZ0945);沈阳市中青年科技创新人才计划(团队)项目(RC200408)
周 地(1993—),女,副教授,从事传统中药的活性成分研究。E-mail: zhoudi930322@163.com
通信作者:李 宁,教授,沈阳药科大学中药学院副院长,主要从事中药、天然药物药效物质基础和质量控制研究。Tel: (024)43520739 E-mail: liningsypharm@163.com
[责任编辑 王文倩]
