EGFR对宫颈癌SiHa细胞调控作用机制的体外研究*
2023-01-10热依兰木买赛地韩莉莉
热依兰木·买赛地,韩莉莉
(新疆维吾尔自治区人民医院妇科,乌鲁木齐 830001)
宫颈癌是女性常见的恶性肿瘤之一,其发病率和死亡率在全球女性恶性肿瘤中均处于第四位[1]。宫颈癌的致病因素已明确,通过筛查可早期发现癌前病变,但我国宫颈癌筛查尚未广泛普及[2],大部分病例就诊时已处于晚期,术后复发率也较高。中晚期宫颈癌的标准治疗方案是以放射治疗联合以顺铂为基础的同步化学疗法为主[3],但肿瘤细胞耐药性阻碍了疾病的治疗,造成晚期宫颈癌转移和复发。因此,制定宫颈癌个体化治疗方案,克服化疗耐药性,研究开发作用于特定靶点的高选择性的新型抗癌药物已成为宫颈癌研究的热点[4]。表皮生长因子受体(epidermal growth factor receptor,EGFR)作为肺癌、乳腺癌等恶性肿瘤的抗肿瘤药物的靶基因,其在宫颈癌中的机制也成为研究热点[5]。本研究对EGFR在宫颈癌中的作用及其机制进行了初步研究。
1 材料与方法
1.1 材料与仪器 宫颈癌SiHa细胞株(上海中乔新舟生物科技有限公司),微量移液器、超净工作台(苏州集团安泰空气技术有限公司),CO2恒温培养箱(SANYO),低速离心机(Eppendorf),酶标仪(Thermo),细胞培养皿、细胞培养瓶(Corning),小鼠单抗EGFR(160kD)。武汉俊杰JT-12J电脑生物组织脱水机,德国Leica RM 2016轮转式切片机,日本羽毛R35一次性刀片,武汉俊杰JK-6生物组织摊烤片机,载玻片及盖玻片(江苏世泰实验器材有限公司),抗原修复用电陶炉(SKG),奥林巴斯BX53型生物显微镜,包埋机(武汉俊杰JB-P5),无水乙醇、二甲苯、苏木素、包埋石蜡、中性树胶均来自国药集团。
1.2 方法
1.2.1 载体构建与转染 宫颈癌SiHa置于DMEM+10%FBS+1%(Penicillin-Streptomycin Solution)培养基,37℃、5%CO2培养箱中培养。待细胞培养至78%汇合度时,根据实验分组参照说明书将EGFR过表达和敲除载体和空载体转染至SiHa细胞。分组:正常组(无添加载体)、过表达对照组(OE-NC)、过表达组(OE)、敲除组(395、1211、1499:针对靶基因,设计并合成3条siRNA采用PCR筛选出一条最佳序列,构建干扰质粒),敲除对照组(si-NC),对过表达质粒、干扰质粒进行细胞顺时转染,转染24h后进行检测。转染5h后以新鲜培养液替换原培养液后继续培养,48h后以胰蛋白酶消化收集各组细胞,实时荧光定量PCR和Western blot法检测各组细胞中EGFR表达水平以评价转染效果。EGFR-siRNA由上海中乔新舟生物科技有限公司合成,其干扰序列见表1。

表1 干扰序列表
1.2.2 检测宫颈癌SiHa细胞生物学行为 转染后继续培养细胞48、72h,MTT检测细胞增殖能力,酶标仪测定各孔490nm波长下的OD值。细胞侵袭实验检测各组细胞的侵袭能力,划痕试验检测各组细胞的迁移行为,流式细胞技术分析细胞周期。
1.2.3 Western blot检测SiHa中STAT3、EGFR、PKM2表达 将PBS洗净细胞中加120μL含PMSF裂解液,于冰上裂解30min,4℃ 12000r/min离心5min,取适当稀释的上清液,BCA法来测定蛋白浓度。调整蛋白质浓度,Western blot法检测细胞中STAT3、EGFR、PKM2表达,结果用Quantity-one图像软件分析并进行光密度值扫描,分别计算目的蛋白条带与GAPDH强度比值(%)。
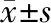
2 结 果
2.1 EGFR转染效果验证 RT-PCR和Western blot结果显示,过表达组的EGFR mRNA和蛋白相对表达量显著高于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。3条EGFR敲除组中EFGR mRNA相对表达量显著低于空白对照组和EGFR NC组,差异有统计学意义(P<0.05)。其中395组效果最好,后期细胞实验选择该干扰组,见图1。

图1 RT-PCR和Western blot验证EGFR过表达和敲除的效果
2.2 EGFR转染后对宫颈癌SiHa细胞增殖能力的影响 MTT检测结果显示,过表达组的SiHa细胞增殖活性显著升高,差异有统计学意义(P<0.05)。低表达EGFR组的SiHa细胞增殖活性较空白对照组明显降低,P<0.05。提示,抑制EGFR表达可显著抑制宫颈癌SiHa细胞增殖,且具有时间依赖效应,见图2。
2.3 EGFR转染后对宫颈癌SiHa细胞侵袭和迁移能力的影响 侵袭实验结果显示,EGFR过表达组的侵袭细胞数显著高于空白对照组和空载组,敲除组的侵袭细胞数明显降低。划痕实验结果显示,EGFR过表达组的SiHa细胞迁移能力显著高于其余对照组。敲除组的细胞迁移能力明显降低,见图3。

图2 MTT检测细胞增殖活性

图3 侵袭和迁移实验
2.4 Western blot法检测PKM2、STAT3、EGFR蛋白表达 过表达EGFR组的EGFR、PKM2、STAT3蛋白表达显著升高,差异有统计学意义(P<0.05)。EGFR敲除组的EFGR、PKM2、STAT3蛋白表达显著低于空白对照组和EGFR NC组,差异有统计学意义(P<0.05),见图4。

图4 Western blot检测PKM2、STAT3、EGFR蛋白表达
2.5 EGFR转染后对宫颈癌SiHa细胞周期的影响 EGFR过表达组的G1期细胞数显著减少、S期显著升高,EFGR敲除组的G1期细胞数增加,G2期和S期相对减少。表明EGFR过表达组的宫颈癌SiHa细胞生长失控,分裂活跃,S期和G2期细胞明显增多。见图5。

图5 EGFR转染后对宫颈癌SiHa细胞周期的影响
3 讨 论
人乳头状瘤病毒(human papillomavirus,HPV)持续感染是宫颈癌的致病因素。HPV感染可增加细胞膜上暴露的EGF受体数量[6]。研究发现,HPV感染与未感染细胞比较时,作为HPV病毒主要转化蛋白的E5、E6与E7都通过EGFR通路增强增殖信号[7]。各研究报道,宫颈癌细胞中EGFR表达上调6%~90%,这可能与检测方法不一致有关[8],且EGFR高表达与宫颈癌进展[9-10]及低生存率相关[11]。EGFR被认为是一种参与宫颈癌进展的受体,但具体机制仍不清楚。
魏莉等[12]通过体内外实验证实,EGFR是miR-186的下游靶因子之一,miR-186通过下调EGFR来抑制宫颈癌SiHa、HeLa细胞的增殖。有研究发现[13],转染miR-134-5模拟物的宫颈癌HeLa和SiHa细胞的EGFR mRNA和EGFR蛋白表达显著下调,其中SiHa细胞下调41%,该变化间接影响SiHa细胞G0/G1期细胞比例显著上升,细胞凋亡率显著增加。研究发现[14],HeLa细胞在低糖高乳酸环境中的存活状况更好,且EGFR和mTOR基因表达水平升高。多项研究表明,EGFR高表达与宫颈癌的多重恶性生物学行为有关。这与本研究结果类似,EGFR高表达能促进SiHa宫颈癌细胞生长、增殖、凋亡、侵袭等生物学行为,抑制EGFR表达可影响宫颈癌细胞的增殖。目前关于EGFR下游蛋白分子及其机制的研究较少,且与EGFR相关的信号通路繁杂[15]。本研究还发现,PKM2、STAT3与EGFR表达存在正相关,EGFR可能通过PKM2/STAT3途径参与宫颈癌的发生与发展。
EGFR在肺癌中研究最为广泛,EGFR抑制剂在肺癌的应用更使其成为癌症化疗的关键靶标之一[16]。深入探讨EGFR介导的PKM2-STAT3信号通路在宫颈癌中的作用机制,进而探寻EGFR对宫颈癌细胞的作用及其与下游PKM2、STAT3受体、癌细胞增殖抑制与功能蛋白表达的关系,明确其作用机制,为临床开展相关药物提供理论基础,是一个极具临床应用价值的研究领域。
