我国温带地区无机碳源对土壤二氧化碳释放的贡献及驱动因子
2023-01-09徐昕昕李金全方文卓方长明
徐昕昕,李金全,方文卓,聂 明,方长明
(复旦大学 生命科学学院 生物多样性与生态工程教育部重点实验室,上海 200438)
无机碳库作为土壤碳库的重要组成部分,约占土壤总碳库的33%,主要分布在降水相对稀少的干旱、半干旱区[1-2]。近年来由于气候变化,如全球变暖、极端气候事件频发,加剧了全球干旱区域面积的扩张[3],对土壤无机碳过程产生重要影响。根据来源的不同,土壤无机碳/土壤碳酸盐(Soil Inorganic Carbon, SIC)可分为岩石成因和土壤成因无机碳两种类型[4]。岩石成因碳酸盐来源于母岩或成土母质,未经过风化成土过程与环境发生交换作用,而土壤成因无机碳是指岩石成因无机碳被碳酸(CO2溶于水生成)溶解后,在土壤含水量降低时,溶液中游离的钙离子(Ca2+)、镁离子(Mg2+)与碳酸氢根离子结合,以CaCO3或MgCO3的形式在土壤中重新沉淀而形成的碳酸盐岩[5]。由于受到土壤水分有效性和CO2分压的影响,土壤成因碳酸盐会发生溶解-再沉淀的物理化学过程[6],即为碳酸盐循环(式(1)),该反应既可能固定CO2也可能释放CO2。干旱地区水资源收支不平衡,大气沉降与硅酸盐风化会带来额外Ca2+与Mg2+的补充,导致碳酸盐过程沉淀强于溶解[7],当1 mol CaCO3或MgCO3重新沉淀时会释放出等体积的CO2。因此,无机碳同样可能成为土壤CO2排放的潜在来源。碳酸盐循环的主要过程为:
(1)
土壤CO2排放源的划分对认识土壤与大气之间的碳通量具有重要意义[8]。然而,目前研究主要集中在土壤呼吸方面[9-10],无机碳源对土壤碳排放的影响往往被忽略[11-12]。土壤呼吸包括异养呼吸(微生物呼吸)和自养呼吸(根呼吸),是陆地生态系统的第二大碳通量[13]。然而,由于碳酸盐基岩的风化速度相对较低,因此一般研究认为其对土壤CO2释放的影响可以忽略[14-16]。但越来越多的研究结果显示,土壤CO2释放中存在很高非生物碳源贡献[12,17-22],并且在干旱地区,土壤无机碳风化过程可能是大气的重要碳源,对大气CO2浓度产生重要影响[23]。Emmerich等[19]对亚利桑那州东南部灌木和草地群落CO2通量进行4年的观测,发现半干旱区土壤没有成为大气碳汇,土壤总碳储量呈下降趋势,碳损失主要源自无机碳的分解释放。最新有研究报道发现,人类活动可能会促进源自无机碳过程的碳排放[24]。土壤呼吸和碳酸盐过程的碳排放均会对大气CO2浓度、气候变化和全球碳平衡产生重要影响[22]。因此,从土壤总碳通量中分离源自有机碳和无机碳的CO2排放通量并分别开展研究,对于评估不同碳源对环境因素及气候变化的响应至关重要[21]。本研究选取我国温带地区由东向西沿经向分布的13个样点(图1),并采集不同土层样品。利用碳稳定同位素技术分离土壤有机碳源与无机碳源CO2通量,计算源自无机碳过程的释放通量占总CO2释放量的比例,定义为无机碳源对土壤CO2释放的贡献(fSIC)。与此同时,为了研究温度和水分变化对fSIC的影响,本研究还设定不同温度和土壤含水量试验组。本文初步探究了无机碳过程对土壤碳排放的贡献及其驱动因子,以期为评估无机碳源对土壤碳过程的影响提供理论和数据支撑。
图1 采样点分布图Fig.1 Distribution map of sampling sites
1 材料与方法
1.1 研究区概况
本研究选取我国温带地区13个采样点,包括从东到西依次为辽宁丹东、辽宁沈阳、河北秦皇岛、北京、山西太原、内蒙古呼和浩特、宁夏银川、甘肃金昌、甘肃张掖、甘肃嘉峪关、新疆哈密、新疆乌鲁木齐和新疆伊犁。横跨40个经度(81.02°~124.29°E),年平均降水量变化范围为90~908 mm(气候数据来自中国气象数据网)。采样地气候信息见表1。

表1 采样点地理位置与气候信息
1.2 样品采集及预处理
在每个采样点,随机选取相距一定距离(>1 km)的4个取样位置,分0~10、35~50和70~100 cm深度采集土壤样品,挑拣出较大砾石后装入自封袋,尽快寄回实验室。所有样品过2 mm土筛并挑去肉眼可见的细根、腐殖质等。取出部分土壤样品自然风干用于后续理化性质的测定,其余放入4 ℃冷库中备用。同时,用环刀(200 cm3)采集土壤样品,用于容重(BD)的测定。
1.3 土壤理化性质测定
按照土水比1∶2.5加入去离子水,充分搅拌,静置30 min后用数字酸度计(Seven Excellence S479-uMix, Mettler-Toledo, Switzerland)pH和电导率(Electrical Conductivity, EC)。利用激光粒度分析仪(Laser Particle Sizer, LS-CWM (2), OMEC, China)进行粒径分布分析。采用三氯化六氨合钴([Co(NH3)6]Cl3)浸提—分光光度法[25]测定阳离子交换量(Cation Exchange Capacity, CEC)。使用电感耦合等离子体光谱仪(ICP)测定土壤钙离子(Ca2+)、镁离子(Mg2+)含量。土壤样品过0.15 mm孔径筛后,用元素分析仪(FlashSmart EA, ThermoFisher Scientific, USA)测定总碳(Total Carbon, TC)、土壤有机碳(Soil Organic Carbon, SOC)和总氮(Total Nitrogen, TN)含量,测定SOC时需预先将样品酸化并烘干,土壤无机碳(SIC)含量为TC与SOC的差值。土壤微生物量碳(Microbial Biomass Carbon, MBC)的测定,氯仿熏蒸后采用0.5 mol L-1K2SO4浸提,再利用有机碳分析仪(vario TOC cube, Elementar, Germany)测试上清液中溶解性有机碳(DOC)含量,同时制备非氯仿处理的对照样品[26]。土壤溶解性无机碳(Dissolved Inorganic Carbon, DIC)测定使用MBC试验中的对照组(非氯仿熏蒸浸提土壤),有机碳分析仪可通过向液体样品滴加3%的磷酸直接测试DIC含量。
1.4 样品同位素分析
土壤有机碳同位素丰度值(δ13CSOC): 土壤样品研磨后过0.1 mm筛,利用同位素比质谱仪(DELTA V Advantage, ThermoFisher Scientific, USA)测定样品有机碳同位素值。在测定前需将样品酸化预处理,烘箱60 ℃干燥脱酸后测试[20]。
土壤无机碳同位素丰度值(δ13CSIC): 对上述研磨过筛后样品利用GasBench Ⅱ-IRMS(ThermoFisher Scientific, USA)测定,样品吹扫气为高纯氦气,利用无水磷酸与无机碳反应释放CO2,无水磷酸使用前需放置在70 ℃加热盘上热熔[27]。
1.5 室内培养实验
称取相当于20 g干重的新鲜土壤样品培养于100 mL集气瓶中,调节土壤含水量分别为田间最大持水量(Water Holding Capacity, WHC)的35%、60%和85%。集气瓶口用丁基橡胶塞密封,安装取气阀以便后续气体采集,样品设置4个重复。将所有样品在20 ℃下预培养7 d,以减小前期处理带来的扰动[28]。预培养结束后,将所有培养瓶转移至低温恒温槽(DC0530,上海比朗仪器有限公司)。本研究将变温培养的温度范围设定为5~30 ℃,以5 ℃为一个变温步长。变温培养从20 ℃开始,逐次升温至30 ℃再降温至5 ℃,最后回到20 ℃。每次改变温度后,考虑到初始状态对碳稳定同位素丰度值(以下简称碳同位素值)的影响,需要令土壤样品在目标温度下稳定3~5 h,本研究中的稳定时间计算参照Zhou等[29]的模型。稳定期间,通过分流气路一直往培养瓶内通入零点空气(无CO2的高纯空气,约0.75 L/min),目的在于排除瓶内累积的CO2并保持与后续密闭培养时相对一致的背景气环境。在稳定末期,利用真空泵抽取培养瓶内空气至真空,以便于排除土壤孔隙中初始的CO2.具体操作为先关闭瓶口一侧三通阀,连接另一侧三通阀与真空泵装置,利用真空泵抽气约10 min可保证瓶内真空环境,并及时补充等量零点空气保证瓶内气压与外界大气压相等。真空到达时间和零点空气补充体积在预试验中利用真空检测仪与气压检测器共同确定。上述操作完成后,将所有培养瓶密闭培养2~60 h(各温度下密闭时间由预实验确定),培养结束时,使用注射器采集瓶内顶空气体10 mL,利用气体同位素分析仪(G2201-i, Picarro, USA)测定CO2气体浓度与碳同位素值。在升温和降温过程中均需测定各温度的CO2释放,取两次测量平均值作为该培养温度下土壤碳释放的速率和碳同位素值。最终,利用二元混合模型[30]计算各温度下无机碳源对土壤碳释放的贡献,二元混合模型计算公式为:
δ13CCO2=fSIC×δ13CSIC-(1-fSIC)×δ13CSOC,
(2)
式中,δ13CCO2为土壤碳排放CO2的碳同位素值(‰);fSIC为土壤无机CO2通量占土壤总碳排放通量的百分比;δ13CSOC为土壤有机碳同位素值(‰);δ13CSIC为土壤无机碳同位素值(‰)。
此外,考虑到无机碳过程发生的碳同位素值温度和扩散分馏,使用下列方法共同对实测气体的同位素值进行校正。温度分馏公式为:
103lnα=-3.63 + 1.194×106/T2,
(3)
式中,α为碳酸盐固体到CO2(g)之间的同位素分馏因子;T为开式温度[31]。
扩散分馏: 土壤CO2是指在给定土壤深度下填满土壤孔隙的CO2,而土壤呼吸CO2是指在土壤—大气连续体中扩散的CO2,即土壤释放的CO2.土壤呼吸CO2的同位素值由于分子扩散作用产生分馏,其δ13C值比土壤剖面CO2的δ13C值低4.4‰[32]。
1.6 数据分析
采用线性回归模型拟合表层土壤(0~10 cm)fSIC的经向变化趋势。采用单因素方差分析检验不同土层间(0~10、35~50、70~100 cm)fSIC的差异显著性,两两比较使用LSD检验(α=0.05)。利用Friedmen双向秩方差分析检验不同温度下fSIC的差异。使用Kruskal-Wallis检验不同土壤含水量情况下fSIC的差异显著性。所有数据在分析前均进行正态性和方差齐性检验。此外,采用Pearson相关分析fSIC与地理、气候、土壤因子的相关性,并利用主成分分析(Principal Component Analysis, PCA)研究fSIC的主要驱动因子。上述统计分析使用R(版本3.6.2)软件完成,作图采用SigmaPlot 12.5(Systat Inc., Point Richmond, California, USA)和R(版本3.6.2)共同完成。
2 结 果
2.1 无机碳源对土壤碳释放贡献的经向变化趋势
在培养温度20 ℃、含水量为60% WHC时,研究区域表层土壤(0~10 cm)无机碳源对土壤碳释放贡献(fSIC)的变化范围为0.72%~4.44%,并呈现明显经向变化趋势(图2)。总体而言,沿经度从东向西,fSIC表现出增大趋势,并与干旱度(Aridity Index, AI)、土壤无机碳含量(SIC/TC)呈现显著正相关关系(P<0.01)。
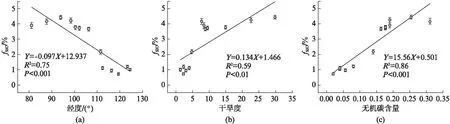
图2 表层土壤无机碳源对碳释放的贡献(fSIC)与经度(a)、干旱度(b)及无机碳含量(c)的关系Fig.2 The relationship between the contribution of soil inorganic carbon to carbon efflux (fSIC) and longitude (a), arid index (b) or inorganic carbon content (c) in topsoil图中误差棒表示标准误差(n=4).
2.2 无机碳源对土壤碳释放贡献的剖面特征
培养温度20 ℃、含水量60% WHC时,fSIC随土层深度增加呈增大趋势,不同土层间存在显著性差异(P<0.05),中层(35~50 cm)和底层(70~100 cm)土壤fSIC要显著高于表层土壤(0~10 cm)(图3)。在沿经度从东到西的所有样品中,0~10 cm土壤fSIC为2.70%±0.20%;35~50 cm土壤fSIC为3.50%±0.28%;70~100 cm土壤fSIC为3.58%±0.28%。

图3 不同土层无机碳源对土壤碳释放贡献(fSIC)的差异Fig.3 Differences of the contribution of inorganic carbon to soil carbon efflux (fSIC) among soil layers图中误差棒表示标准误差(n=13),误差棒上不同字母表示组间差异显著(α=0.05).
2.3 不同温度下无机碳源对土壤碳释放的贡献
当土壤含水量为60% WHC时,在不同培养温度下,所有样品fSIC有显著差异(P<0.001),且随培养温度的升高而增大(图4)。以表层土壤(0~10 cm)为例(图4(a)),在相对较低的温度下(如5、10、15 ℃),fSIC随着温度上升略有增加,但上升不显著。当培养温度继续上升,无机碳贡献比例出现较大幅度增加,高温(如20、25、30 ℃)fSIC比低温fSIC显著增加。中层(35~50 cm)和底层(70~100 cm)土壤有相似规律(图4(b, c))。随培养温度变化,0~10、35~50和70~100 cm的fSIC范围分别为(2.14±0.17)%~(2.88±0.23)%、(3.06±0.23)%~(4.00±0.33)%和(3.41±0.23)%~(4.84±0.44)%。
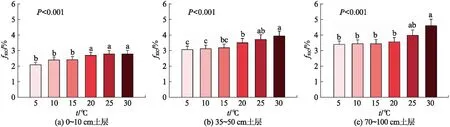
图4 不同温度无机碳源对土壤碳释放贡献(fSIC)的差异Fig.4 Differences of the contribution of inorganic carbon to soil carbon efflux (fSIC) among different incubation temperatures图中误差棒表示标准误差(n=13),误差棒上不同小写字母表示组间差异显著(α=0.05).
2.4 不同含水量下无机碳源对土壤碳释放的贡献
培养温度为20 ℃时,不同土壤含水量(35%、60%、85% WHC)下,所有试验组fSIC均随土壤含水量的增加而减小(图5,见第128页)。0~10和70~100 cm土层中,不同土壤含水量的试验组间差异显著(P<0.05),85% WHC试验组比35% WHC组fSIC显著下降(图5(a, c))。35~50 cm土层的3个土壤水分试验组,组间差异不显著(P=0.238,图5(b))。0~10、35~50和70~100 cm土层fSIC的变化范围分别为(2.44±0.18)%~(3.06±0.23)%、(3.24±0.26)%~(3.91±0.30)%和(3.34±0.25)%~(4.10±0.31)%。
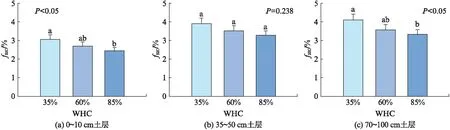
图5 不同土壤含水量的无机碳源对土壤碳释放贡献(fSIC)的差异Fig.5 Differences of the contribution of soil inorganic carbon to carbon efflux (fSIC) among different soil water contents图中误差棒表示标准误差(n=13),误差棒上不同小写字母表示组间差异显著(α=0.05).
2.5 无机碳源对土壤碳释放贡献的相关性分析
采用Pearson相关分析fSIC与地理、气候、主要土壤因子间的相关性,以相关系数达到“±0.8”为筛选标准,剔除共线性较强的变量。变量间相关系数的绝对值热图(图6,见第128页)表明,经度与pH、DIC、土壤无机碳含量(SIC/TC)均存在强的共线性,DIC与SIC/TC有强共线性,EC和土壤粉粒含量(Silt)分别与Ca2+、土壤砂粒含量(Sand)有强共线性。故根据因子间相关分析结果和生态学实际意义,选择删去经度、DIC、EC、Silt、BD和海拔指标。
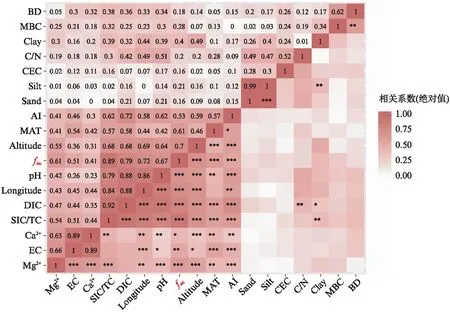
图6 fSIC与地理、气候及土壤因子的相关性系数热图(Pearson相关系数)Fig.6 Correlation heatmap of fSIC, geography, climate and soil properties (Pearson correlation coefficients)图中标注系数均为原始相关系数的绝对值(0~1).MAT为年均气温;AI为干旱度;BD为土壤容重;EC为电导率;CEC为阳离子交换量;Ca2+为土壤中钙离子含量;Mg2+为土壤中镁离子含量;Clay为土壤黏粒含量;Silt为土壤粉粒含量;Sand为土壤砂粒含量;C/N为碳氮比;MBC为微生物量碳含量;SIC/TC代表土壤无机碳含量;DIC为可溶性无机碳含量.***P<0.001;**P<0.01;*P<0.05.
按照土层深度(0~10、35~50、70~100 cm)划分,使用PCA法分析筛选后的气候与土壤因子对fSIC的影响。PCA结果显示,在3个土层上,AI、年均气温(Mean Annual Temperature, MAT)、SIC/TC、pH、Mg2+、Ca2+对fSIC的变化均有主要影响,其中AI与SIC/TC是fSIC最主要的驱动因子(图7(a, b, c))。结合前文相关分析结果,AI、SIC/TC、pH、Mg2+、Ca2+与fSIC有显著正相关关系(P<0.05,图6),MAT与fSIC有显著负相关关系(P<0.05,图6)。此外,土壤黏粒含量在部分土层中对fSIC有较强负效应。C/N、MBC、Sand和CEC对fSIC无显著影响。

图7 在不同土壤层,fSIC与气候、土壤因子的相关结构关系Fig.7 Correlational structure of climate, soil properties and fSIC (the contribution of soil inorganic carbon) among different layers
3 讨 论
3.1 无机碳源对土壤碳释放影响的经向变化趋势和土壤剖面分布特征
在以往研究中,主要针对单个或少量样点上对无机碳源的贡献进行量化[12,17-22],未见区域尺度变化规律报导。本项研究在横跨40个经度范围上选取13个样点,首次揭示区域尺度上无机碳源对土壤碳释放贡献沿经度呈显著上升趋势(P<0.001),发现土壤无机碳分解释放的CO2通量占总碳排放通量的0.02%~12.94%,表明无机碳源对土壤碳释放的贡献有明显经向变化趋势。
另外,本文还发现,无机碳源释放通量占总碳通量的比例随着土层深度增加表现出显著增大趋势(P<0.05),该发现与先前研究的结论一致[17,27,33]。在最近研究报道中,学者以0~180 cm不同深度的土层作为研究对象,利用碳稳定同位素技术分离有机碳源和无机碳源通量,发现在表层土壤中,无机碳源对土壤碳排放的贡献约为20%;而在底部土壤中,无机碳源的贡献度可达60%[17]。在本研究中,表层土壤中源自无机碳分解释放的CO2通量约占总碳排放的2.70%,深层土壤中无机碳源的贡献比例约为3.58%,无机碳过程的相对贡献较小,这可能是因为土壤无机碳含量的差异所导致。同时,底层土壤的强碱性和高无机碳含量等性质,可能极大限制了土壤中的生物过程,进而加速了碳酸盐反应[33]。
3.2 温度和土壤含水量对无机碳源贡献的影响
本研究结果显示,无机碳过程受到温度变化的影响,高温会显著促进土壤无机碳的分解释放,该结论与先前研究报道的结果一致[34-35]。温度会影响CO2在土壤溶液的溶解度,改变碳酸盐循环中可溶性碳酸盐离子的含量。根据亨利定律(Herry’s Law),土壤温度上升会导致亨利系数上升并造成溶液表面CO2分压的下降[36-37],土壤空气中CO2的溶解度减小,使得更多CO2从土壤水中析出并向大气释放。故在一定范围内升高温度,虽然土壤微生物活性增强,加速有机质的分解快速产生CO2,但由于土壤溶液表面分压的下降,碳酸盐平衡依旧向无机碳沉淀的方向进行[38]。同时,微生物在分解有机碳过程中产生酸根离子,会与土壤胶体吸附的金属阳离子发生离子交换,从而提高金属阳离子(Ca2+和Mg2+)的浓度,促进无机碳过程向沉淀碳酸盐的方向进行[39-40]。此外,由于碳酸盐矿质表面疏松的孔结构和内部晶体结构,低温下,其表面对CO2有较强吸附能力,短期内有一定储存气体分子的能力。但当温度上升,吸附力减弱,低温下被吸附的CO2分子会逐步释放,重新回到大气中[34]。曾有研究以火星表面风化层的玄武岩和黏土混合物为样本,发现该混合物在温度下降时吸收CO2,而温度升高时解吸CO2[41-42]。
土壤含水量也会对碳酸盐过程产生明显影响,随着土壤水分的下降,无机碳源对总CO2释放量有更高贡献。该结果与Schindlbacher[27]、Ramnarine[21]及Cater[18]等人的研究结果一致。土壤水分充足时会促进碳酸盐平衡向溶解无机碳的方向进行[7,43]。水分同样影响土壤通气性,水分增加会减小土壤孔隙度,不利于气体的扩散,土壤空气中的CO2会倾向于溶解[38]。而环境湿度的增加也有利于有机碳的积累,其矿化导致在相同温度下土壤溶液表面CO2分压的升高,促进反应朝溶解碳酸盐的方向进行[44]。此外,土壤湿度上升也会削弱矿物对CO2的吸附作用,即使在低温下,高湿度环境中的矿物对气体的吸附能力也较干燥状况时显著下降[42]。
3.3 无机碳源对土壤碳释放贡献的影响因子
地区气候和土壤性质是影响土壤碳排放的重要因素,最终对陆地生态系统过程起调节作用[45]。本研究发现,表层至深层土壤中,AI、MAT、SIC/TC、pH、Mg2+和Ca2+含量是影响fSIC的主要驱动因子。结合碳酸盐反应平衡式(式(1)),推测在无机碳(SIC)含量丰富的地区,当湿润季节水分充足时,土壤空气中的CO2与水生成碳酸,溶解部分无机碳固体,增加溶解性碳酸盐的含量。而富含溶解性碳酸盐的土壤环境又有助于CO2溶解反应的进行[46]。Cardinael等[17]在试验中发现,无机碳源CO2对总碳通量的贡献(fSIC)受到土壤碳酸盐占总碳含量比例(SIC/TC)的控制,两者呈显著正相关关系。同时,全球尺度上的遥感影像数据表明,无机碳储量与土壤pH呈现显著正相关[47-49]。高pH的土壤环境可以促进CO2的溶解,有利于溶解性碳酸盐的生成,为无机碳积累提供所需的碱性环境[44,50-51]。pH的变化还会影响土壤微生物群落组成[52],伴随pH上升,土壤中细菌和放线菌占据比例明显升高[53]。有研究发现,在Ca2+浓度充足的情况下,细菌可以在几天内产生可观测的碳酸盐堆积[54]。土壤酸度还会直接影响土壤胶体表面分子或原子团的解离,改变胶体表面可变电荷的数量,而土壤胶体表面电荷数量会直接影响其吸附离子的能力[55]。土壤颗粒表面可为阳离子吸附提供位点,如土壤黏粒通过与金属离子间紧密的桥接作用,降低阳离子的含量[56]。CO2溶解生成的碳酸电离出的质子会与土壤黏粒吸附的阳离子发生交换,增加金属阳离子(如Mg2+、Ca2+)的含量[57-58]。当土壤含水量发生下降时,游离态的Mg2+、Ca2+会与土壤中丰富的碳酸氢根离子结合,碳酸盐平衡又会向着沉淀无机碳的方向进行,同时释放出源于无机碳源的CO2[57]。先前有报道发现,土壤溶液的电导率对碳酸盐过程有促进作用,电导率差距较大的不同盐碱性土壤,会出现无机CO2通量的显著差异[59],但其中的调控机制并不清楚。由于土壤溶液的导电性能与碱土离子含量有直接关联,本文通过相关分析同样发现两者间有很强的共线性(图6),推测土壤电导率可能本质上是通过影响Mg2+、Ca2+含量,进而调控碳酸盐循环。
与此同时,AI与MAT可能通过影响土壤因子进而调控碳酸盐反应平衡。随着AI上升,水资源成为重要的限制因素,离子的移动能力下降,土壤剖面上几乎没有淋溶作用造成的离子损失,无机碳更易沉淀,同时淋溶作用也会使碳酸氢盐和Mg2+、Ca2+迁移至土层深处或随地下水流失,无机碳通常难以累积或仅在深层积累[44]。该现象也在一定程度上解释了无机碳源在深层土壤中有较高贡献的原因。MAT会促进土壤黏粒结构的形成[60],因此其可能通过影响土壤黏粒含量进而调控无机碳过程。MAT还可能与AI共同作用影响植被类型和丰富度,影响外源有机质的输入[61]。本文还发现MAT对fSIC的影响程度有随土层深度增加而上升的趋势(图7),这与以往在有机碳分解研究中,发现气候因素的影响主要体现在表层土壤的结论存在差异[62],未来可能需要更大范围的采样与研究分析进行论证。
3.4 无机碳源对土壤碳释放影响的不确定性
尽管本研究证实了无机碳分解释放对土壤总碳排放有贡献,但由于无机碳过程十分复杂,不仅受到众多环境因素的影响,还与有机碳分解过程密不可分[63],对于无机碳库在土壤碳平衡中究竟是“源”还是“汇”,一直是学术界争议的话题[64]。因为要确定某个土壤碳过程并确认其是碳源或碳汇,考虑的时间与空间尺度必须足够大,并且要经受住物质平衡理论的考验[65]。本文通过控制试验发现土壤无机碳随着温度升高和土壤含水量下降,会出现分解释放现象,但先前的一些报道中,在无机碳过程较为活跃的干旱荒漠区,低温时期检测到CO2“负通量”现象,即一段时间内,土壤并未向大气释放CO2,反而吸收了附近空气中的CO2,造成大气CO2浓度的降低,在一定时期主导了土-气界面碳交换的方向[66-68]。研究人员推测干旱、半干旱地区盐碱土壤的改良过程伴随溶解性无机碳向深层淋洗,进入沙漠下的咸水层,在水平迁移后形成量级巨大的碳汇[69]。当前对于土壤碳酸盐循环的研究还非常匮乏且存在争议,迄今为止,众多研究未能完全解释土壤中复杂的无机碳过程。未来研究中可能需要更精细化的试验手段(如多元素的同位素标记示踪、长时间尺度的控制实验),进而深入探究无机碳源与土壤碳过程的关系以及对全球碳循环的影响,以助于准确进行全球碳评估与气候变化预测。
4 结 论
无机碳源对土壤碳释放通量的贡献(fSIC)存在明显经向变化趋势和土壤剖面分布特征。在我国温带地区,fSIC沿经度由东到西、随剖面由表层至底层呈增大趋势,并受到温度和水分因子的调控。与此同时,土壤性质SIC/TC、pH、Mg2+、Ca2+含量和气候因素AI、MAT对fSIC有主要影响,其中AI与SIC/TC是无机碳源对土壤碳释放贡献最重要的两个驱动因子。本研究结果表明,忽视无机碳源释放通量会高估土壤有机碳的分解释放,进而影响对全球碳周转的评估。
