基于数据挖掘的药品风险监测指标体系构建
2023-01-07孙洁胤王乐健吴惠芳曾平莉
孙洁胤,王乐健,吴惠芳,曾平莉
(浙江药科职业大学,浙江 宁波 315100)
0 引言
进入大数据时代,构建高效的“药品风险监测预警防控系统”,对药品全生命周期中潜在的风险进行预警,有利于及时、灵敏地感知药品安全运行态势,及早发现潜在安全风险,提高处置靶向性和有效性,快速消除药品安全隐患,提升药品安全风险管控能力。因此,本文对药品全生命周期中的安全风险因素进行梳理,以建立一套基于跨部门多源数据的风险指标体系[1]。
1 研究方法
收集药品全生命周期中可能影响药品安全的因素,包括以下几个。
1)对药品生产企业进行调研,分析影响药品安全各环节的因素。
2)来自药品监督管理部门系统内的数据,包括国家局与各地药品抽检不合格公告、各药品生产企业GMP检查报告以及浙江省药品不良反应中心的药品不良反应(adverse drug reactions,ADR)信息等。清洗后的数据,采用SAS JMP pro软件进行聚类分析。
3)来自浙江省大数据局、省疾控、医保中心、经信委等机构的数据。首先,对收集的大量数据进行数据挖掘,数据清洗和统计分析;其次,建立药品风险专家库,采用德尔菲法对风险因素清单进行梳理,根据专家经验对风险因素与风险结果进行关联分析;最终构建药品安全风险指标体系如图1所示。

图1 药品风险监测指标体系构建工作流程
2 结果与讨论
2.1 生产企业数据的风险指标分析
对浙江省药品生产企业通过电话访问、座谈、问卷调查、研讨会等方式进行调研,分析药品生产中可能对药品安全产生影响的风险指标。
药品批准文号有效期5年,到期6个月前应提出申请,企业在到期6个月内仍尚未申请提示企业可能会放弃该品种,这类放弃行为可能是处于经济原因,也可能是由于产品本身存在潜在的风险,因此将该因素列入重要的风险指标。
供应商变更,特别是原辅料来源的改变,可能会对产品的质量产生一定的影响,即使是乳糖、淀粉这些常见的辅料改变来源后,都有可能影响某些口服制剂的溶出行为,从而影响产品的生物等效性。原料的来源改变影响更甚,不同厂家由于生产工艺不能保证完全一致,其原料的粒径甚至晶型都会发生变化。
工艺变更带来的风险是巨大的,“缬沙坦事件”是典型案例,即使华海药业生产的缬沙坦原料药工艺变更通过了各国监管机构的批准,但仍然发生了因工艺改变而导致的极微量基因毒性杂质亚硝基二甲胺(NDMA)的产生,该事件提示监管机构在工艺变更审批中更应关注科学性。
企业定期向监管部门上报数据,特别是疫苗生产企业。目前国家实行药品生产企业企业年报制度,企业需要每年向省级监管部门申报其产品的生产销售、上市后研究以及风险管理方面诸多数据。年报的异常能反映出药品的质量波动。
退货率异常、工艺控制中关键指标离散度异常、中控报废率异常这些数据能反映出潜在的药品质量变化,但此类数据属于企业内部数据,通常监管机构很难获取。浙江省目前已试点了药品生产企业的“黑匣子”数字监管,生产企业的各种数据以区块链方式上传至“黑匣子”,监管机构通过对“黑匣子”数据实时或延时地抓取,能敏锐地对异常数据进行感知。通过“黑匣子”模式,监管机构可以实现某种程度上的企业QA角色。冷链异常数据对于温敏型药品非常重要,特别是对于大部分疫苗产品,目前冷链配送的药品若存在异常数据,接收单位将予以拒收。
结合以上分析,将文号临期、供应商变更、工艺变更、上报数据异常、退货率异常、工艺控制中关键指标离散度异常、中控报废率异常、冷链异常等数据列入风险指标[2-3]。药品生产企业的自控数据可以很好地反映药品生产环节的风险,如果能将此类风险在药品流通之前及时发现,能大大提升药品安全水平。
2.2 药品监管部门数据挖掘与风险指标分析
2.2.1 药物不良反应
分析浙江省5年内ADR数据48万余条,结果显示浙江省内ADR平均每月发生数量呈正态分布,偶有超出控制范围的月份(见图2)。提示当某个月ADR发生率明显超过控制范围时,应当予以重视。
考察5年间48万余条ADR的严重程度,其中严重ADR虽然占比不高,死亡和出现后遗症合计占0.1%,但因后果严重,应特别重视,对于抗癌药等特殊品种,也应当注意到疾病本身的特点。根据ADR数据挖掘结果,将严重ADR率和普通ADR率列入风险体系,前者的权重应大于后者。

(a)浙江省每月ADR发生数量正态分布图 (b)浙江省每月ADR发生数量控制图
2.2.2 全国化学药品抽检不合格数据
通过对全国抽检数据的分析,对不合格数据进行数据清洗后,采用Ward法对风险因素进行层次聚类分析,得到系统树图和星座图,如图3所示。

图3 化学药品不合格公告信息层次聚类结果
抽检不合格品种前3位为盐酸金霉素眼膏、氯霉素滴眼液和诺氟沙星胶囊,其生产厂家分布于全国,提示药品风险监测预警系统除关注省内生产厂家风险外,还应重视输入性风险;不合格产品的具体剂型以片剂、注射剂、胶囊剂最多,但对于单一品种而言其风险较为分散,反而是眼用制剂盐酸金霉素眼膏、氯霉素滴眼液风险较高。不合格项目主要体现为可见异物、含量、有关物质、溶出度,这些均与药品的安全性、有效性密切相关,是产品出厂检验的重要项目,应可将风险控制在出厂前,提示风险预警系统中应考虑企业质量自控环节。不合格供样来源主要为医药公司、药店、医院,通过生产厂家上报仅占5%,说明目前的药品安全风险管控仍停留在事后监管,大多数不合格药品是在已经进入了流通领域后才被发现问题,提示应当将风险监管的重心向前迁移,重视药品在生产环节中的安全隐患,将风险消除在流通之前。
2.2.3 药品GMP检查
汇总5年的GMP检查报告、飞行检查报告等数据,对企业发生的缺陷项进行分析统计。零缺陷报告几乎不存在,缺陷数量和严重程度反映了企业内部质量管理问题的严重程度。若存在严重缺陷,即使只有1条严重缺陷,企业的风险也显著高于有数条普通缺陷的企业。提示缺陷严重程度比缺陷数量重要,但由于GMP检查中缺陷的严重程度判定存在一定人为主观因素,目前通过严重缺陷及普通缺陷的数量来进行评价。
2.2.4 投诉举报
药品生产企业偶有来自患者的投诉或者内部员工举报,但有时可能出自打击报复。根据对药品稽查部门数据的分析,药监部门收到举报后第一时间组织飞行检查,结果显示大部分企业虽然存在一些GMP缺陷,但与举报内容没有相关性。少量举报经飞行检查被证实。根据数据分析结果,认为投诉举报的绝对数量与风险相关性不高,若一旦举报被证实,则存在巨大风险。
2.2.5 企业生产线风险等级
药品生产企业存在高风险产品时,发生ADR的概率会显著增加,其中风险最大的是疫苗及生物制品,其次为无菌药品如注射剂、眼用制剂,其他产品的风险相对较低。抗癌药虽然ADR较多,但可能受疾病本身的影响,难以判断是产品风险还是疾病原因。经研判,将企业是否存在高风险产品线作为风险指标之一。
2.3 监管机构外部大数据挖掘及其风险指标分析
通过对浙江省大数据局、省疾控、医保中心、经信委等机构的数据进行分析,发现来自企业层面的数据是重要的风险指标组成,包括行政处罚、企业信用异常、行业信用异常、法人失信、企业经济问题、政策环境高风险、药品质量舆情等。
行政处罚会被记录到企业信用中,并且从招投标、投资融资、土地出让、政府奖励等各个方面影响企业的发展;企业或者行业的信用异常以及法人失信会减弱或丧失公众对其信任度;企业经济问题反映了企业在运营中存在的风险,导致企业不能正常有序地开展业务;政策环境存在高风险时,企业的发展势必收到影响;当药品质量出现舆情问题时,要特别予以关注,无论“长春长生”事件还是“山东疫苗”事件,都在网络上发酵了一段时间后才被监管部门关注到,提示舆情获取、分析及反应要迅速准确。
除了来自产品和企业的风险,区域层面也应受到重视。当一个区域普遍存在高风险产品和企业时,反映出当地监管部门可能存在一定程度的问题。
2.4 风险清单梳理和指标体系构建
建立药品风险专家库,采用德尔菲法对来自生产企业数据、监管部门数据以及其他省级部门的数据进行风险因素与风险结果关联分析,并经专题座谈和专家问卷调查,得到风险监测的指标体系[4],如图4所示。
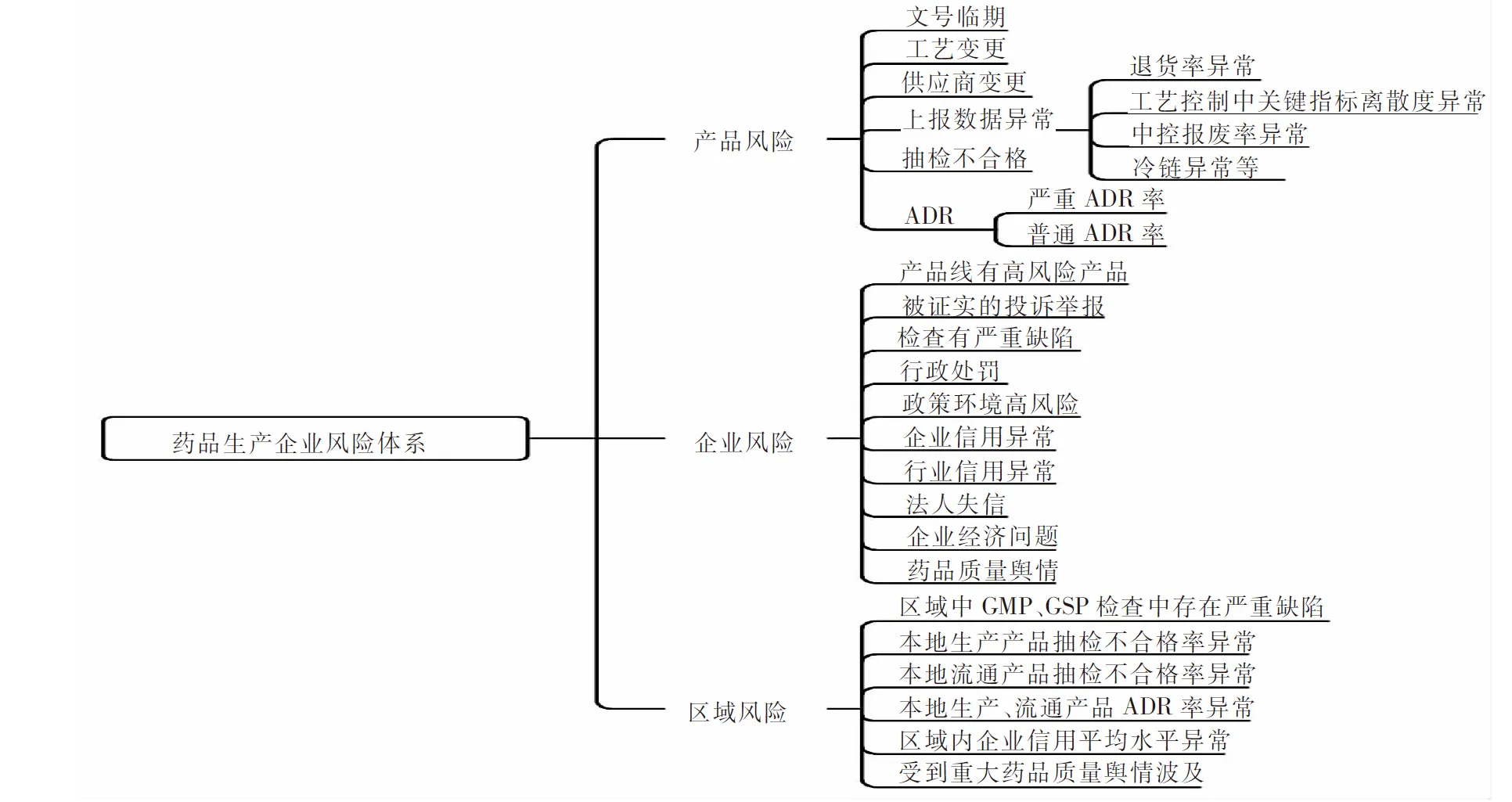
图4 药品生产环节中安全风险指标体系
在药品的生产、配送、流通、使用全生命周期中,安全风险来自于产品自身、企业、区域3个层面。产品层面指标有抽检不合格、严重ADR率、普通ADR率、文号临期、供应商变更、工艺变更、上报数据异常、退货率异常、工艺控制中关键指标离散度异常、中控报废率异常、冷链异常等;企业层面指标如产品线有高风险产品、被证实的投诉举报、检查有严重缺陷、行政处罚、政策环境高风险、企业信用异常、行业信用异常、法人失信、企业经济问题、药品质量舆情等。针对各地市药品安全监管,设置了地市区域风险指标,包括区域中各类检查、不合格率、ADR率、企业信用、舆情等。
3 结论
通过对药品生产企业、药品监管部门以及监管部门外部机构的数据挖掘,从药品产品、生产企业、区域3个层次,建立了一套可以科学灵敏地反映药品风险的指标体系。对各项指标进行权重赋值并数学建模,并通过一定手段对风险进行监测和预警,从而达到药品智慧监管目的。
