对两道2022年高考化学反应原理试题的探析
2023-01-07董爱杰
董爱杰
(山东省华侨中学)
化学反应原理题是高考必考题,每年的考查中都会有一些“信息的接纳与转化”题作为亮点.以下是对2022年高考全国卷理综试题中的两道相关试题的探析.

(2)在1.0×105Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图1所示.
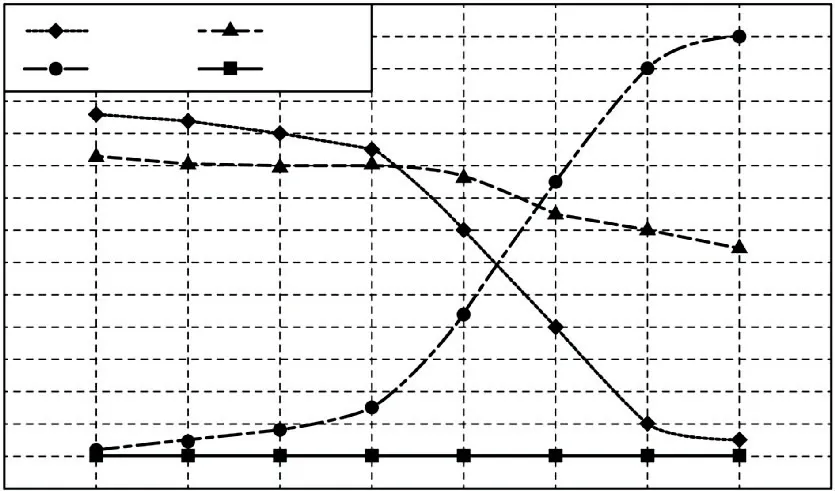
图1
①反应C(g)+CO2(g)=2CO(g)的平衡常数Kp(1400 ℃)=Pa.

②碳氯化的反应趋势远大于直接氯化,因为碳氯化反应气体分子数增加,ΔH<0,是熵增、放热的过程,熵判据与焓判据均是自发过程,而直接氯化的体系气体分子数不变,且是吸热过程.
③对于碳氯化反应(ⅱ),产物气体计量数大,故增大压强,平衡向左移动;该反应ΔH2<0,正向放热,温度升高,平衡向左移动,平衡转化率变小.
(2)①由图可知,1400 ℃,体系中CO 占总量的0.6,CO2占总量的0.05,则

②实际生产中需要综合考虑反应的速率、产率等,以达到最佳效益,实际反应温度要远高于200 ℃,就是为了提高反应速率,在相同时间内得到更多的TiCl4产品.
(3)固体颗粒越小,比表面积越大,反应接触面积越大,越有利于TiO2-C“固—固”接触.因此可将二者粉碎后混合,同时鼓入Cl2,使固体粉末“沸腾”,增大接触面积.
原理对接 1)盖斯定律不仅符合能量守恒,也符合质量守恒.所以,多元反应方程式可以加合,其反应的ΔH也同样可以进行加合.
2)多元反应方程式加合时得出反应的平衡常数与各个单元反应的平衡常数是积、商的关系:若反应
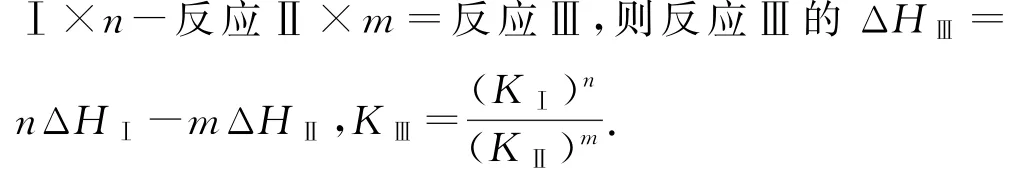
例2 (2022年全国乙卷第28题,节选)(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g)ΔH1=-1036kJ·mol-1,
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g)ΔH2=94kJ·mol-1,
③2H2(g)+O2(g)=2H2O(g) ΔH3=-484kJ·mol-1.
计算H2S 热分解反应④2H2S(g)=S2(g)+2H2(g)的ΔH4=________kJ·mol-1.
(2)较普遍采用的H2S处理方法是克劳斯工艺,即利用反应①和②生成单质硫.另一种方法是:利用反应④高温热分解H2S.相比克劳斯工艺,高温热分解方法的优点是________;缺点是_________.
(3)在1470K、100kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应.平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为.平衡常数Kp=kPa.
(4)在1 373 K、100 Pa 反 应 条 件 下,对 于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19 的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如图2所示.

图2
①n(H2S)∶n(Ar)越小,H2S平衡转化率______,理由是________.
②n(H2S)∶n(Ar)=1∶9对应图中曲线______,计算其在0~0.1s之间,H2S 分压的平均变化率为______kPa·s-1.


(4)① 因为正反应是体积增大的可逆反应,n(H2S)∶n(Ar)越小,p(H2S)越小,越有利于平衡向正反应方向移动,H2S平衡转化率越高.
②n(H2S)∶n(Ar)=1∶9的比值与图像同温下的转化率顺序相反,即对应图中曲线d.由图像可知,0~0.1sH2S分解24%,根据三段式可知

试题不仅体现了变化观念和平衡思想,而且体现了模型认知与证据推理.因此,在学习时一定要夯实基础知识,在解决问题时学会举一反三.
