传统与强化发酵羊肉香肠微生物多样性及代谢物差异分析
2023-01-07田海勇母应春
田海勇,苏 伟,2,*,母应春,2,姜 丽,赵 驰
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025)
发酵香肠是自然或人工控制条件下利用微生物发酵制成的具有良好贮藏性和特殊风味的肉制品。羊肉因其低脂肪、低胆固醇和高优质蛋白等属性优于猪肉[1]。以羊肉为原料,添加香辛料经拌料、腌制、灌肠、发酵、干燥等工艺生产的羊肉香肠营养价值高于传统的猪肉香肠。然而,传统发酵羊肉香肠存在生产周期长、品质不稳定、易受杂菌污染等问题,限制了羊肉发酵香肠标准化和规模化生产。为提高香肠风味品质,且满足消费者对营养健康追求,外源微生物被作为发酵剂用于制作香肠[2]。
目前,发酵剂广泛应用于肉制品中,通过接种特定发酵剂可以提高产品品质;促进醛类、酯类、醇类等良好风味物质形成。此外,添加发酵剂还可缩短成熟时间,提高产品安全性[3]。研究表明,乳酸菌作为发酵香肠中活性微生物在不同类型发酵香肠中具有促进蛋白质水解和积累小分子肽的作用,还可利用碳水化合物产生的乙酸、甲酸、琥珀酸,使香肠具有特殊风味[4]。其次,乳酸菌,尤其是乳酸菌属和片球菌属,可产生有机酸,主要是乳酸和乙酸,使肉糜酸化,抑制大多数有害食品微生物生长[5]。如,曾志刚等[6]从香肠中分离得到了产细菌素的乳酸片球菌(Pediococcus acidilactici)。在许多发酵香肠制品,如意大利[7]、希腊[8]等香肠表面都发现了霉菌,这些霉菌的生长,为香肠提供了特有风味。米根霉(Rhizopus oryzae)在共同培养下生长不受乳酸菌抑制,可明显促进乳酸菌生长,且其代谢的酶具有分解蛋白和脂肪的能力,对产品风味形成有重要作用[9]。
高通量测序(high throughput sequencing,HTS)技术是分析复杂环境中微生物群落及相对丰度的重要工具,被广泛用于发酵食品微生物多样性的研究[10]。如Hu Yingying等[11]通过HTS研究发现,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为东北5 个地区干香肠的优势菌门。代谢组学是一种旨在全面监测内源性代谢产物的新型组学技术,在近几十年发展迅速[12];其中,高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)法具有检出限低、灵敏度高等优点,可同时用于定性和定量分析,已在食品杂环胺检测[13]、代谢物检测[14]等诸多领域广泛应用,适用于香肠中非挥发性成分的检测分析。目前文献多以探究羊肉香肠微生物多样性和挥发性风味物质为主[15-16],关于传统和强化发酵羊肉香肠中核心微生物挖掘鲜有报道。
本研究采用HTS技术、顶空-固相微萃取-气相色谱-质谱联用(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)和HPLC-MS/MS技术对传统与强化发酵羊肉香肠中微生物群落及代谢物差异进行分析,并评价微生物与显著差异代谢物(significantly differential metabolites,SDMs)之间的关系,以期为羊肉香肠中功能微生物的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
羊瘦肉、羊肥膘 贵州麻阳河食品有限责任公司;食盐、蔗糖、白酒、肠衣 贵州省花溪区合力超市;乳酸片球菌 中国工业微生物发酵剂保藏管理中心;米根霉 广东省微生物发酵剂保藏管理中心。
E.Z.N.A.®Soil DNA提取试剂盒 美国Omega BioTek公司;FastPfu聚合酶 北京全式金生物技术有限公司;建库试剂盒 美国Bioo Scientific公司;MiSeq Reagent Kit v3测序试剂盒 美国Illumina公司。
1.2 仪器与设备
Quantus™ Fluorometer微型荧光计 美国Promega公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;MiSeq测序仪美国Illumina公司;Trace1300-TSQ8000气相色谱-质谱联用仪 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 发酵羊肉香肠的制备
菌液及羊肉香肠的制备参考李静雯[17]的方法。以传统(不添加菌种)为对照组。每个样品重复制备3 次。
乳酸片球菌按说明书活化2 代,接种于乳酸片球菌种子培养基中,37 ℃培养24 h,再从种子培养基中取2%菌液加入扩大培养基中,37 ℃培养24 h,6 000 r/min离心10 min,去上清液,用生理盐水清洗3 次,加入无菌水,调整活菌数至 108CFU/mL。
米根霉按说明书活化2 代,转接至斜面培养基中,30 ℃培养3 d,取斜面培养基加入5 mL无菌水并轻轻刮下孢子,重复清洗3 次,合并孢子液反复振荡后用带有灭菌脱脂棉的漏斗过滤,得到孢子液,调整孢子液浓度为107CFU/mL。
传统发酵(CT):羊肉瘦肥质量比8∶2,加入2%盐、0.7%蔗糖、1.5%高度白酒、15%冰水(4 ℃冷藏1 d)。
强化发酵(QH):羊肉瘦肥质量比8∶2,加入2%盐、0.7%蔗糖、1.5%高度白酒、15%冰水(4 ℃冷藏1d),2%复配菌液(复配比为乳酸片球菌-米根霉1∶1)。
1.3.2 总DNA 提取和PCR扩增
按E.Z.N.A.®Soil试剂盒说明书进行总DNA抽提。用正反引物(338F:5’-ACTCCTACGGGAGGCAGCA-3’和806R:5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA的V3-V4可变区进行PCR扩增,真菌使用引物ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’和5’-GCTGCGTTCTTCATCGATGC-3’)在ITS1区进行PCR扩增。扩增程序为:95 ℃预变性3 min,27 个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃ 延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.3.3 挥发性物质分析
色谱条件:色谱柱为DB-5MS(30 m×0.25 mm,0.25 μm),载气为氦气,流速为1.0 mL/min,不分流模式。升温程序:50 ℃保持5 min,以5 ℃/min速率升至200 ℃,最后以20 ℃/min的速率升至250 ℃并保持10 min。
质谱条件:电子电离源,电子能量为70 eV,传输线和离子源温度为280 ℃和230 ℃,扫描范围m/z50~450。
定量分析:以20 μg/mL环己酮为内标,采用内标法计算样品中各物质含量,公式如下:
式中:Ci和Ai分别为待测挥发性物质含量/(μg/kg)和峰面积;Cis和Ais分别为内标物含量/(μg/kg)和峰面积。
1.3.4 非挥发性物质分析
1.3.4.1 代谢物提取
将50 mg样品4 ℃、10 000 r/min 离心15 min,移取上清液10 μL至EP管,加入含有内标(L-2-氯苯丙氨酸,2 μg/mL)的1 000 μL提取液(乙腈∶甲醇∶水=2∶2∶1)。在30 s涡旋后,在冰浴超声5 min,重复2 次以上操作。在-40 ℃孵育1 h后于4 ℃、10 000 r/min离心15 min。将825 μL上清液移至新管,在真空浓缩器中于37 ℃干燥水分。在200 μL 50%乙腈溶液中重构10 min。将构造物4 ℃、13 000 r/min离心15 min,取75 μL上清液于进样瓶中用于HPLC-MS/MS分析。
1.3.4.2 非挥发性代谢物分析
使用配有UPLC BEH Amide柱(2.1 mm×100 mm,1.7 μm)的Waters 1290 Infinity系列超高效液相色谱系统进行分离。流动相由25 mmol/L乙酸铵-25%氢氧化铵溶液(pH 9.75)(A)和乙腈(B)组成。梯度洗脱(0~0.5 min,5% A、95% B;0.5~0.7 min,5%~35% A、95%~65% B;7.0~8.0 min,35%~60% A、65%~40% B;8.0~9.0 min,35% A、40% B;9.0~9.1 min,60%~5% A、40%~95% B;9.1~12.0 min,5% A、95% B);柱温25 ℃;进样器温度4 ℃,进样体积1 μL。TripleTOF 6600质谱用于在HPLC-MS/MS实验期间在信息依赖性下获取MS/MS谱图。电喷雾离子源设定如下:气体1为60 psi,气体2为60 psi,帘幕气体为35 psi,源温度为600 ℃,去聚集电位为60 V,离子喷雾电压浮动为5 000 V。
1.4 数据处理
利用Student’sttest确定P<0.05的显著性水平。使用SIMCA 14.1对代谢物数据集进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)。基于OPLS-DA模型,以差异倍数(fold change,FC)结合变量重要性投影(variable importance for the projection,VIP)值大于1的代谢物作为SDMs(|FC|>2,P<0.05,VIP>1)。Cytoscape v3.8.2用于相关性网络可视化。
2 结果与分析
2.1 羊肉香肠微生物多样性分析
采用Illumina MiSeq测序对传统和强化发酵羊肉香肠微生物群落组成进行检测。质量过滤后,所有样品细菌和真菌分别获得216 815 条和309 844 条优列。由图1和表1可知,基于可操作分类单元(operational taxonomic unit,OTU)的稀释曲线趋于平坦,且覆盖率均大于99%,说明获得的序列足以代表每个样本的多样性[18]。

图1 CT和QH细菌(A)和真菌(B)稀释性和Shannon指数曲线Fig. 1 Rarefaction and Shannon index curves of bacteria (A) and fungi (B)in naturally fermented and starter culture-fermented mutton sausages
分别用Chao 1指数和Shannon指数描述样本中微生物群落的物种丰富度和多样性[19]。如表1所示,在细菌丰富度和多样性方面,QH组Chao 1和Shannon指数均高于CT组,但无显著差异,表明强化发酵对细菌的丰富度和多样性无显著影响。在真菌丰富度和多样性方面,CT组Chao 1指数略大于QH组,而QH组Shannon指数显著高于CT组(P<0.05),表明强化发酵对真菌多样性影响显著。

表1 样品中微生物的物种丰富度和多样性分析Table 1 Species richness and diversity analysis of microorganisms in sausage samples
2.2 羊肉香肠中菌群组成分析
根据OTU在不同分类水平的物种分类信息,由图2A可知,CT和QH均以厚壁菌门(Firmicutes)为优势细菌门,在CT和QH中分别占91.46%和77.49%;Kamilari等[20]也在研究中发现厚壁菌门为优势菌。真菌方面,子囊菌门(Acomycota)为CT和QH的优势真菌门,分别占99.86%和99.11%;Wen Rongxin等[21]研究发现哈尔滨干香肠中真菌以子囊菌门为主。此外,QH组接合菌亚门(Mucoromycota,0.33%)高于CT组(0.01%),这可能与QH中接种的米根霉适应发酵环境快速繁殖有关。
在属水平上共鉴定出43 个细菌属,选取平均丰度前10的属进行分析。由图2B1可知,CT以明串珠菌属(Leuconostoc,71.77%)占优势,其次为拉恩氏菌属(Rahnella,5.88%)。QH以明串珠菌属(30.72%)、环丝菌属(Brochothrix,24.65%)、嗜冷杆菌属(Psychrobacter,19.12%)、片球菌属(Pediococcus,13.59%)占优势。与CT(71.77%)相比,QH(30.72%)组明串珠菌属占比减小,而片球菌属占比显著增大(CT:0.57%;QH:13.59%),可能是明串珠菌属与接种的乳酸片球菌在发酵环境中存在拮抗或营养竞争。本研究鉴定出多个乳酸菌,如明串菌属、片球菌属、肠球菌属(Enterococcus)、unspecified_Lactobacillales和肉杆菌属(Carnobacterium)。有研究报道乳酸菌是发酵香肠中的主要优势细菌,不仅通过发酵产生细菌素,还参与生化反应(如糖酵解、蛋白质水解和脂解)对发酵制品pH值变化及风味物质的产生至关重要[22]。此外,还检测出一些条件致病菌(如拉恩氏菌属、葡萄球菌属(Staphylococcus)、unspecified_Enterobacteriaceae),它们在QH组相对丰度均小于CT组;该结果表明强化发酵不仅影响细菌丰度变化,也有利于提高产品安全性。
样品中共检测出33 个真菌属,选取丰度前10的真菌进行分析(图2B2)。德巴利氏酵母属(Debaryomyces)是两组香肠中的优势属,但其在CT组(94.78%)的相对丰度显著高于QH组(58.99%)。青霉菌属(Penicillium,32.44%)是QH组中第2优势属;说明强化发酵对羊肉香肠的优势真菌有重要影响。强化发酵后,样品中曲霉属(Aspergillus)、unspecified_Aspergillaceae、unspecified_Capnodiales、unspecified_Pleosporales、根霉属(Rhizopus)等丰度均高于CT组。这些结果表明强化发酵对真菌群落结构产生影响,提高了物种多样性和复杂性,这与上述真菌多样性结果一致。
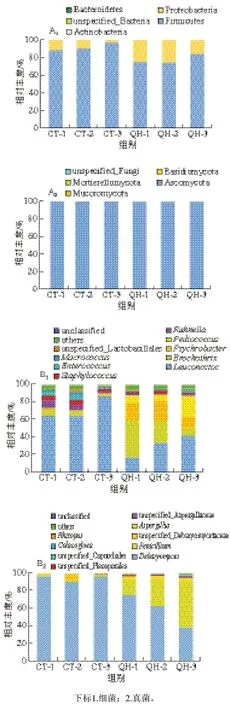
图2 香肠样品中细菌、真菌在门水平(A)和属水平(B)上的相对丰度Fig. 2 Relative abundance of bacteria and fungi at phylum (A) and genus levels (B) in sausage samples
2.3 传统与强化发酵香肠中挥发性物质分析
2.3.1 传统与强化发酵香肠挥发性物质组成
如表2所示,所有共鉴定出76种挥发性组分,包含酯类17种、醛类16种、醇类13种、烃类10种、酸类8种、酮类3种及其他类9种。其中CT组66种,以醛类为主,QH组70种,以酯类和醛类为主。
酯类主要由醇类和酸类发生酯化反应生成,对发酵香肠风味有特殊贡献[23]。两组香肠中酯类存在显著差异,QH组中酯类含量为300.82 μg/kg,较CT组(73.56 μg/kg)显著提高。癸酸乙酯和辛酸乙酯为样品中主要酯类,而乙酸乙酯、正己酸乙酯、庚酸乙酯、乳酸乙酯仅在QH组中检出,它们分别呈果香、酒香、菠萝味、蜂蜜香[24]。表明强化发酵对羊肉香肠特有风味形成有重要作用。
两组香肠中醛类占比较大,均达到35.75%以上。说明醛类是香肠中的主要风味物质,由于其阈值较低对香肠风味有重要作用。两组香肠中壬醛(柑橘味)、苯甲醛(焦糖味)、反式-2-壬醛(黄瓜味)含量均较高[25]。己醛具青草味,其含量可反映脂肪氧化程度。QH组己醛含量为56.06 μg/kg,是CT(10.35 μg/kg)的5.4 倍;此结果表明强化发酵促进了香肠醛香味的生成。
醇类和酸类是香肠中重要的挥发性物质。醇类源于微生物对糖的代谢或脂类的氧化和降解。本研究共鉴定出12种醇,其中1-辛烯-3-醇((15.66±0.65)μg/kg)是QH组中含量最高的醇类,是CT组的2.9 倍。1-辛烯-3-醇由脂质氧化形成,具有较低的阈值,呈典型的蘑菇味[26]。酸类可能来源于甘油和磷脂的氧化降解及美拉德反应,短链酸由于其低嗅觉阈值而在香气形成中起重要作用;而较长链酸,如辛酸阈值较高,不会直接影响香肠的风味感知,但其可作为其他风味的前体[27]。本研究发现,CT组酸类和醇类显著高于QH组,可能是强化发酵促进了QH组中酸和醇类物质发生酯化反应生成酯,这一推断与上述酯类物质含量变化结果一致。此外,两组香肠中烃类、酮类和其他类代谢物含量无显著差异。

表2 CT和QH中挥发性成分Table 2 Volatile components in sausage samples
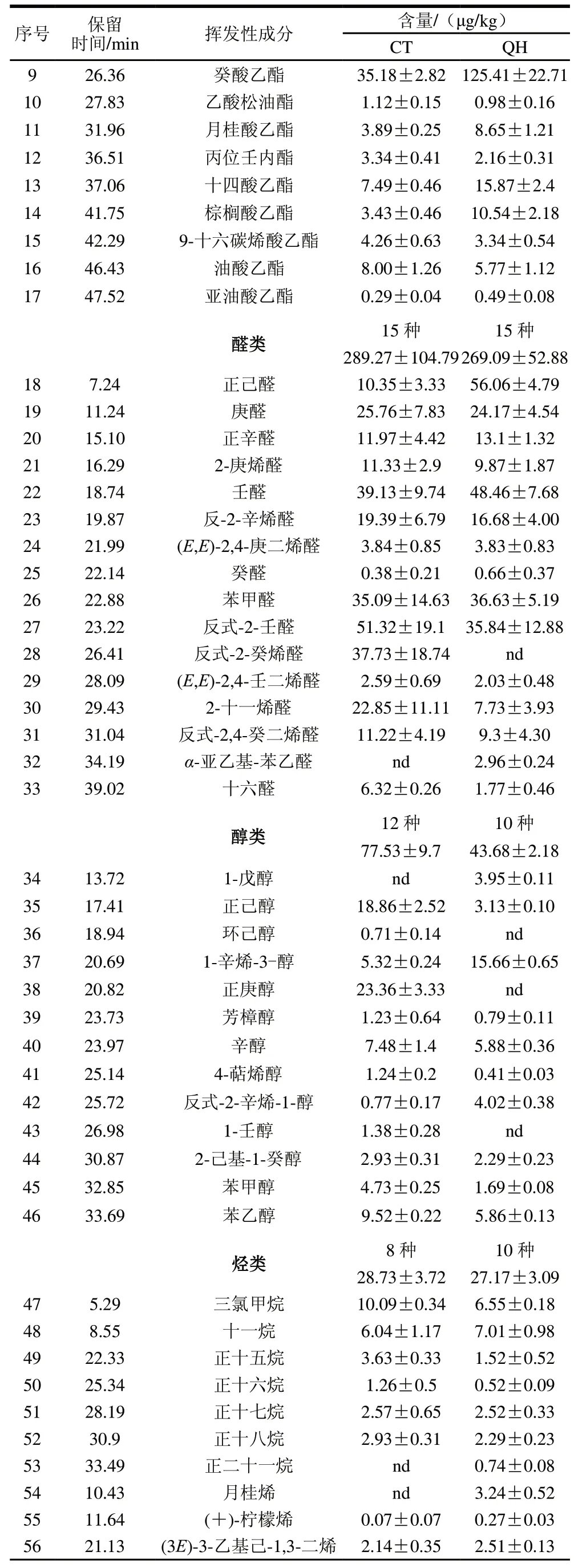
续表2

续表2
2.3.2 多元统计分析

图3 CT和QH中挥发性代谢物OPLS-DA得分图(A)和置换检验图(B)Fig. 3 OPLS-DA score (A) and permutation test (B) plots for volatile metabolites in sausage samples
2.3.3 传统与强化发酵香肠显著差异挥发性代谢物变化分析
基于OPLS-DA结果,以|FC|>2且VIP>1、P<0.05为指标,共筛选出29种SDMs(表3),其中上调的物质有14种,包含酯类7种、醇类3种、醛类2种、烯烃1种和2-甲基戊酸酐1种。下调的物质有15种,包括醛类2种,醇类5种,酸类5种,烷烃、酮类和醚各1种。

表3 CT和QH中挥发性SDMs分析Table 3 Analysis of significantly differential volatile metabolites in sausage samples
2.4 传统与强化发酵羊肉香肠中非挥发性代谢物分析
2.4.1 传统与强化发酵香肠非挥发性代谢物分析
采用配备Q-TOF高分辨率分析仪的HPLC-MS/MS对两组香肠样品进行分析。结果显示,共鉴定出375种非挥发性代谢物,有氨基酸及其衍生物108种、生物碱59种、有机酸及其衍生物54种、萜类44种、酯类32种、核酸及其衍生物18种、甾体18种、维生素及其衍生物13种、碳水化合物9种、其他20种。

图4 CT与QH中非挥发性代谢物OPLS-DA得分图(A)和置换检验(B)Fig. 4 OPLS-DA score (A) and permutation test (B) plots for nonvolatile metabolites in sausage samples
为更好地了解样品组间的非挥发性代谢物,进行了OPLS-DA。由图4可知,两组样品完全分离,模型和Q2值分别为0.924、0.992和0.984。说明模型构建成功,具有很高的拟合度和预测能力,适合探索不同发酵方式下羊肉香肠的非挥发代谢物差异。
2.4.2 传统与强化发酵香肠显著差异非挥发性代谢物变化分析
基于OPLS-DA结果,以|FC|>2且VIP>1、P<0.05为指标,共筛选出16种SDMs(表4),其中上调9种,有氨基酸及其衍生物3种,有机酸4种,生物碱和萜类物质各1种;下调7种,包括碳水化合物2种,核酸及其衍生物2种,生物碱、维生素及其衍生物、酯类各1种。

表4 CT和QH中非挥发性SDMsTable 4 Significantly differential non-volatile metabolites in sausage samples
2.5 羊肉发酵香肠微生物与SDMs的相关性分析
羊肉发酵香肠中代谢物的产生与微生物活动密不可分,为挖掘与羊肉香肠SDMs呈强相关性的核心微生物。基于Pearson相关系数揭示微生物与SDMs之间的相关性。图5A表明,7 个细菌属(明串珠菌属、环丝菌属、片球菌属、嗜冷杆菌属、肠球菌属、拉恩氏菌属和葡萄球菌属)与SDMs高度相关(|r|>0.8,P<0.05)。其中明串珠菌属、片球菌属、肠球菌属和葡萄球菌属已经被证实为发酵香肠中的重要细菌属,它们在香肠发酵和成熟过程中发挥着重要的作用。乳酸菌的酸化作用对羊肉香肠发酵过程中风味发展和不良菌群的控制具有重要作用[20]。明串珠菌属、嗜冷杆菌属分别与40种和42种SDMs具有强相关性,表明它们对香肠风味形成有重要贡献作用。其中明串珠菌属与麦芽糖、海藻糖、烟酰胺、肌苷和次黄嘌呤呈强正相关,与酯类、醛类、氨基酸和醇类呈强负相关。这与Lee等[28]研究结果不符,可能是由其与QH中接种的乳酸片球菌存在竞争关系导致。嗜冷杆菌属与酯类(V1~V6)、氨基酸(N1~N5)、醛类、醇类呈正相关,与酸类、碳水化合物、肌苷和次黄嘌呤呈负相关;这可能与其能水解蛋白质和分解脂类有关[29]。环丝菌属与D-脯氨酸、鸟氨酸、DL-正缬氨酸和月桂烯呈正相关,与正十五烷呈负相关。此外,葡萄球菌属、拉恩氏菌属虽为条件致病菌,但它们可以产生一系列酶,有助于风味形成。据报道,葡萄球菌属蛋白酶和脂肪酶活性较高,有助于发酵肉制品中特征风味的生成[30]。
图5B显示,7 个真菌属(德巴利氏酵母属、青霉属、曲霉属、unspecified_Aspergillaceae、unspecified_Capnodiales、根霉属和unspecified_Basidiomycota)与SDMs高度相关(|r|>0.8,P<0.05)。曲霉属、德巴利氏酵母属、青霉属分别与43、25、21种SDMs具有强相关性,对香肠风味形成贡献较大。曲霉属与酯类(V1~V7)、D-脯氨酸、硬脂炔酸、鸟氨酸、3-吲哚乙酸等呈强正相关,与碳水化合物、酸类和醇类呈负相关。曲霉属能够分泌糖化酶用以分解淀粉,是传统发酵食品中与风味形成相关的重要微生物[31]。青霉属与酯类(V2~V7)、正己醛、1-辛烯-3-醇等呈正相关,与碳水化合物、次黄嘌呤、肌苷等呈负相关。Mu等[32]研究发现青霉属与有机酸密切相关。而有机酸可进一步与醇类反应形成酯。德巴利氏酵母属与大多数醇类和酯类之间呈强负相关,这与陈倩等[33]研究发现一致,unspecified_Capnodiales与癸酸乙酯和棕榈酸乙酯呈强正相关。根霉菌属与DL-正缬氨酸呈强正相关。这可能与米根霉能在适宜条件下产蛋白酶有关[34]。unspecified_Basidiomycota与9,10-二羟基-12(Z)-十八碳烯酸呈正相关,而unspecified_Aspergillaceae与单油酸甘油酯呈负相关。

图5 细菌(A)、真菌(B)与SDMs间相关性网络图Fig. 5 Correlation network diagrams for bacteria (A) and fungi (B)versus SDMs
3 结 论
以不同发酵方式下的羊肉香肠为研究对象,采用Illumina HTS技术结合代谢组学分析其微生物组成和代谢产物之间的差异,并通过相关性分析确定香肠中与代谢物形成相关的核心微生物。结果表明,强化发酵显著影响了羊肉香肠菌落结构及微生物丰度,在属水平上,传统发酵中明串珠菌属、环丝菌属和德巴利氏酵母属为主要微生物;而强化发酵中的主要微生物为明串珠菌属、环丝菌属、嗜冷杆菌属、片球菌属、德巴利氏酵母属和青霉属。从两种香肠中分别筛选出29种挥发性和16种非挥发性代谢物为SDMs。相关性结果显示,7 个细菌属(明串珠菌属、环丝菌属、片球菌属、嗜冷杆菌属、肠球菌属、拉恩氏菌属和葡萄球菌属)和7 个真菌属(德巴利氏酵母属、青霉属、曲霉属、unspecified_Aspergillaceae、unspecified_Capnodiales、根霉属和unspecified_Basidiomycota)被视为两种羊肉香肠的核心微生物。这为羊肉香肠产品功能微生物的研究奠定了理论基础。
