血清细胞因子预测晚期NSCLC患者PD-1阻断剂治疗反应的临床研究
2023-01-07朱健荣靳建峰陈美凤
朱健荣,靳建峰,陈美凤
(临汾市中心医院 呼吸与危重症医学科,山西 临汾 041000)
非小细胞肺癌(NSCLC)是肺癌最常见的组织学类型,通常预后不良[1]。近年来,免疫检查点抑制剂(ICI)应用越来越广泛,例如程序性死亡受体1(PD-1)或其配体(PD-L1)阻断剂,极大地改变了晚期NSCLC的治疗结局[2-3]。抗PD-1/PD-L1单克隆抗体可有效阻断免疫抑制信号,从而恢复对肿瘤的免疫反应[4]。但由于延迟动力学和非典型反应模式,PD-1阻断剂的治疗有效性难以区分和预测[5]。因此,迫切需要识别生物标志物,以筛选可能受益于PD-1阻断剂的患者。细胞因子是先天性和适应性免疫系统的主要调节因子,它允许免疫细胞以旁分泌和自分泌的方式进行短距离通信[6]。鉴于免疫系统识别和摧毁癌细胞的能力,一些细胞因子已被探索用于癌症的治疗[7-8]。然而到目前为止,能够可靠预测抗PD-1/PD-L1治疗结果的细胞因子标志物仍有待发现。本研究通过重点调查11种循环细胞因子是否可以在接受PD-1阻断剂治疗的NSCLC患者中发挥改善预后或预测作用,以期为改进临床免疫治疗策略提供依据。
1 资料与方法
1.1 一般资料
这是一项由当地医院伦理委员会批准的前瞻性研究,并根据良好临床实践(GCP)指南进行。所有患者在纳入研究前均提供书面知情同意书。2015年1月至2019年10月共招募91例晚期NSCLC患者(NSCLC组),其中男68例,女23例,年龄34~81岁,中位年龄56.0岁。纳入标准:年龄≥18岁;组织学证实诊断为晚期或转移性NSCLC,免疫组织化学检测PD-L1表达≥1%,所有患者接受PD-1阻断剂免疫单药治疗;东部肿瘤协作组(ECOG)表现状态0~2分,器官功能充足,精神状态正常;表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)易位均为阴性;预计生存期至少为12周。排除既往有间质性肺病、全身免疫抑制治疗或活动性自身免疫性疾病病史的患者。另外选择同期在本院体检的90例健康志愿者的血清样本作为对照组,其中男60例,女30例,中位年龄54.0岁,性别构成、年龄与NSCLC组相匹配(P>0.05)。
1.2 治疗
入选患者接受tislelizumab(百济神州生物制药有限公司,批准文号S20190045)作为单药治疗(未接受化疗的患者为200 mg,每3周1次;以前接受化疗的患者为2 mg·kg-1),或每2周静脉注射nivolumab(百时美施贵宝公司,批准文号S20180015),剂量为3 mg·kg-1。药物选择基于PD-L1状态和患者先前的治疗史(一线或二线治疗)。
1.3 疗效判断
通过计算机断层扫描或磁共振成像测量疾病的严重程度,并使用实体瘤疗效评价标准1.1(RECIST 1.1)[9]评估治疗反应。每8周评估1次PD-1阻断剂治疗的临床反应,并在其后不少于4周通过后续评估予以确认。根据RECIST 1.1标准,靶病变的完全消失被评估为完全缓解(CR),总靶病变减少30%以上被评估为部分缓解(PR),总靶病变增加20%以上被评估为进展性疾病(PD),靶病变总数减少30%或增加20%以下被评定为稳定疾病(SD)。无进展生存期(PFS)是从PD-1阻断剂治疗开始到影像学评估的首次疾病进展的时间。由两名研究人员独立审查电子医疗图表,以分配临床反应组。有反应者以无病、病情稳定或肿瘤体积减少超过6个月来定义,无反应者以肿瘤生长或≤6个月的临床获益来定义。
1.4 血清细胞因子检测
于开始PD-1阻断剂治疗前使用标准方案收集和处理血清样本,等分并储存在-80 ℃,直到化验。使用AimPlex流式高通量多因子试剂盒(美国AimPlex Biosciences)和BD-FACS Calibur系统(美国BD Biosciences)测定血清白细胞介素(IL)-5、IL-8、IL-6、IL-10、IL-12、IL-13、IL-2、IL-4、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)水平。先将45 μl血清样品和45 μl试剂磁珠混合,室温下培养1 h。孵育后,添加0.5 ml洗涤缓冲液,离心5 min。用生物素结合单克隆抗体孵育样品30 min,然后用链霉亲和素结合单克隆抗体孵育样品20 min。最后,在所有样品中加入洗涤读取缓冲液上机检测。
1.5 统计学处理
使用SPSS 26.0软件处理数据,非正态分布连续变量表示为M50(四分位距:IQR),进行Mann-WhitneyU检验。采用Logistic回归模型分析血清细胞因子与PD-1阻断剂治疗反应的关系。采用受试者工作特征(ROC)曲线评估血清细胞因子对PD-1阻断剂治疗反应的预测价值。采用Kaplan-Meier生存曲线和Log-rank法分析血清细胞因子与预后的相关性。采用Cox回归比例风险模型分析影响NSCLC患者预后的危险因素。所有检验均为双侧检验,统计学显著性假设为α=0.05。
2 结 果
2.1 2组血清细胞因子水平比较
NSCLC组患者血清IL-4、IL-5、IL-8、IFN-γ、TNF-α水平显著高于对照组(P<0.05),见表1。

表1 2组血清细胞因子水平比较[M50(IQR)] pg·ml-1Tab 1 Comparison of serum cytokine levels between the two groups[M50(IQR] pg·ml-1
2.2 血清细胞因子与PD-1阻断剂治疗反应的关系
根据肿瘤反应,55例被评估为PR或SD的患者被归为有反应者。有反应者患者血清IL-5、IFN-γ水平显著高于无反应者(P<0.05,表2)。进一步校正PD-1阻断剂类型后,经多因素Logistic回归分析,血清IL-5(OR=1.891,95%CI1.142~5.159,P=0.001)、IFN-γ(OR=2.018,95%CI1.336~5.007,P<0.001)仍是影响治疗反应的相关因子。血清IL-5、IFN-γ预测PD-1阻断剂治疗反应的ROC曲线下面积分别为0.708(95%CI0.594~0.823)、0.825(95%CI0.735~0.914),对应截断值分别为2.930、5.365 pg·ml-1,特异度分别为74.5%、78.2%,敏感度分别为63.9%、77.8%,见图1。
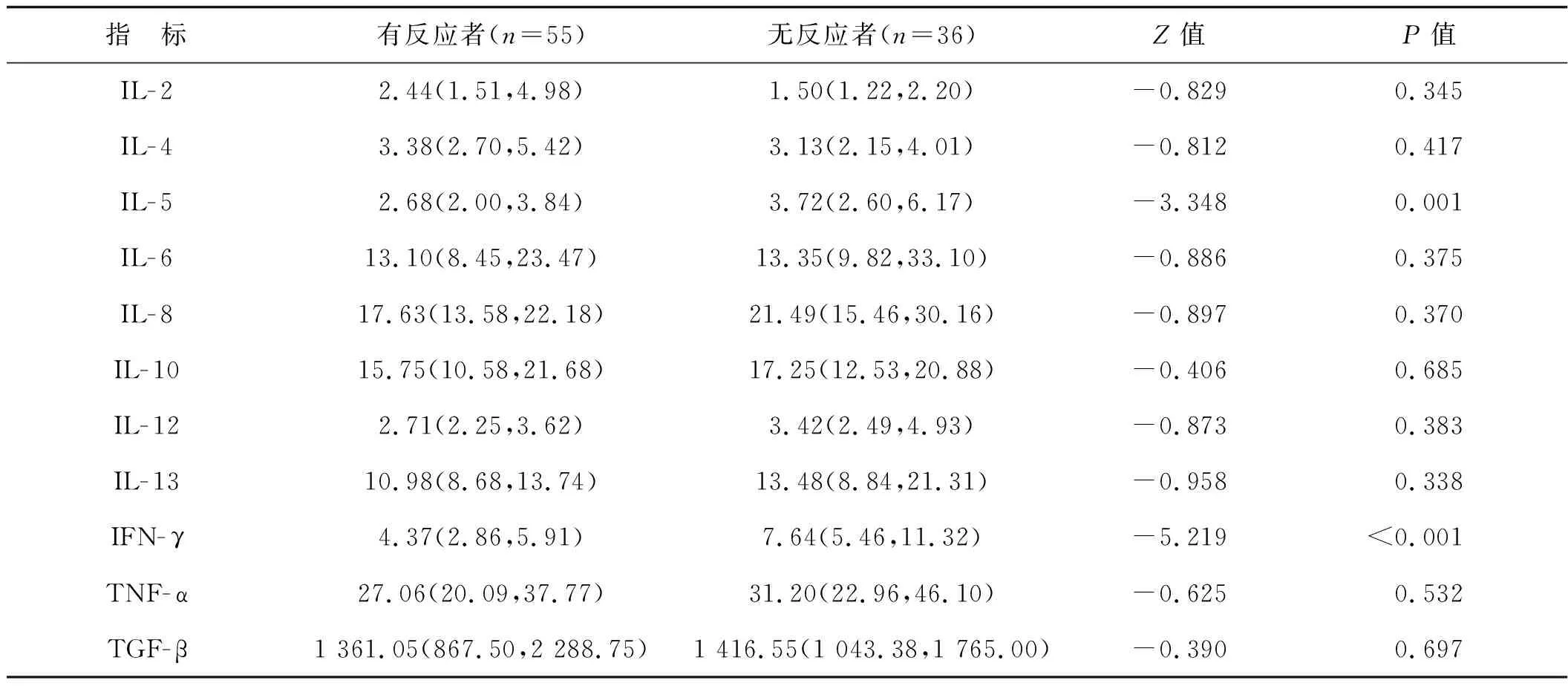
表2 NSCLC患者不同治疗反应血清细胞因子水平比较[M50(IQR)] pg·ml-1Tab 2 Comparison of serum cytokine levels in NSCLC patients with different treatment responses[M50(IQR)] pg·ml-1
2.3 单因素和多因素Logistic回归分析血清细胞因子水平与PD-1阻断剂治疗反应的关系
经单因素和多因素Logistic回归分析显示,血清IL-5、IFN-γ是PD-1阻断剂治疗反应的独立预测因子(P<0.05,表3)。用于预测PD-1阻断反应的血清细胞因子的Logistic回归模型构建如下:logit(P=有反应者)=0.114×(IL-5)+0.079×(IFN-γ)-19.548,(IL-5)和(IFN-γ)分别是治疗早期IL-5和IFN-γ的血清浓度。通过使用该模型,AUC确定为0.832(95%CI0.748~0.916),敏感度为86.1%,特异度为88%,这表明血清细胞因子在区分有反应者和无反应者方面表现良好(图1)。

表3 单因素和多因素Logistic回归分析血清细胞因子表达水平与PD-1阻断剂治疗反应的关系Tab 3 The relationship between the expression of serum cytokines and the response to PD-1 blocker treatment by univariate and multivariate Logistic regression analysis
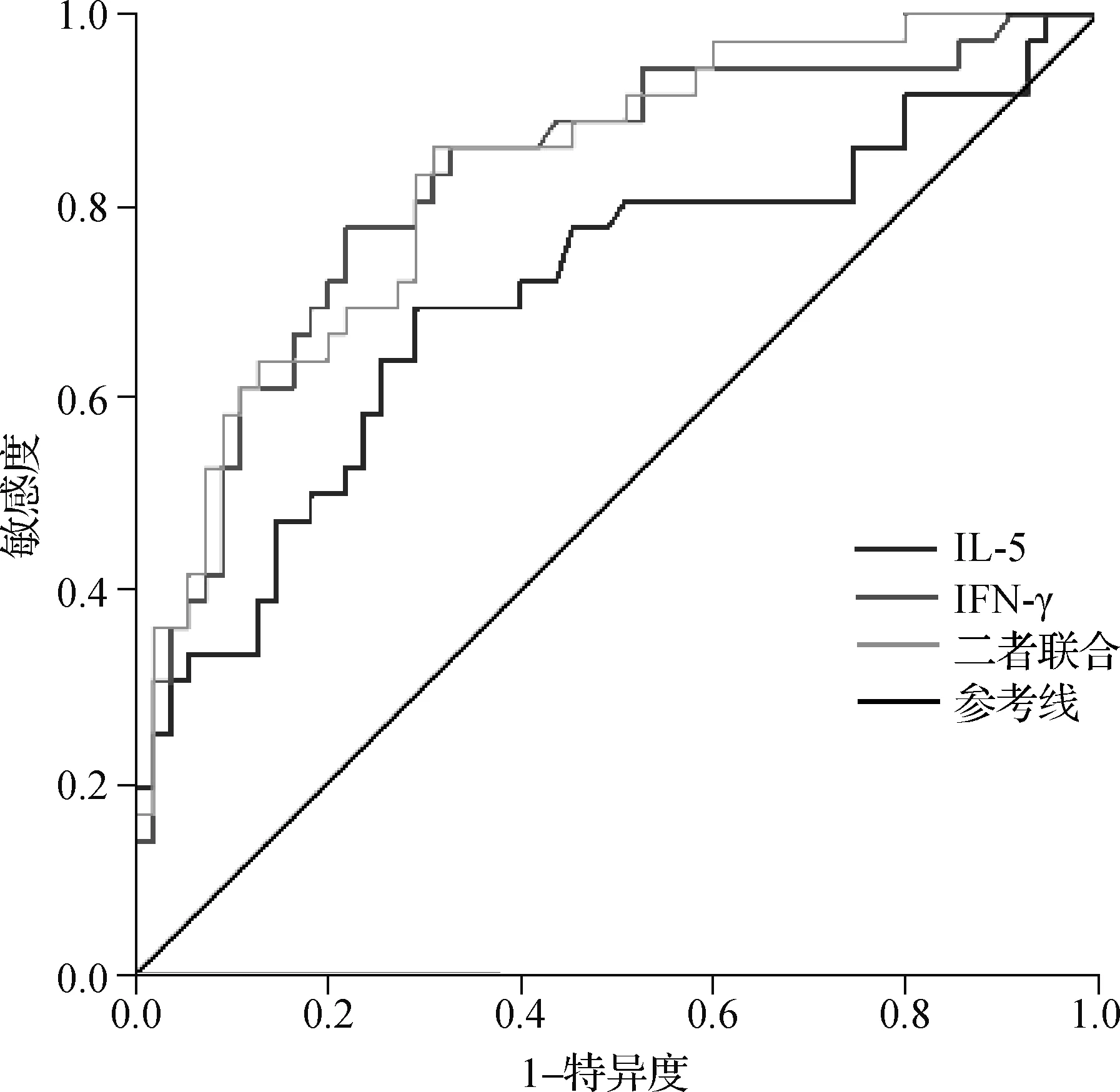
图1 血清IL-5、IFN-γ及二者联合预测PD-1阻断剂治疗反应的ROC曲线Fig 1 ROC curve of serum IL-5, IFN-ϒand their combined prediction of PD-1 blocker response
2.4 Cox回归分析影响NSCLC患者预后的危险因素
经单因素和多因素Cox比例风险回归模型分析显示,血清IL-5、IFN-γ与PFS、OS之间的相关性具有高度的统计学显著性和独立性(P<0.05,表4、5)。
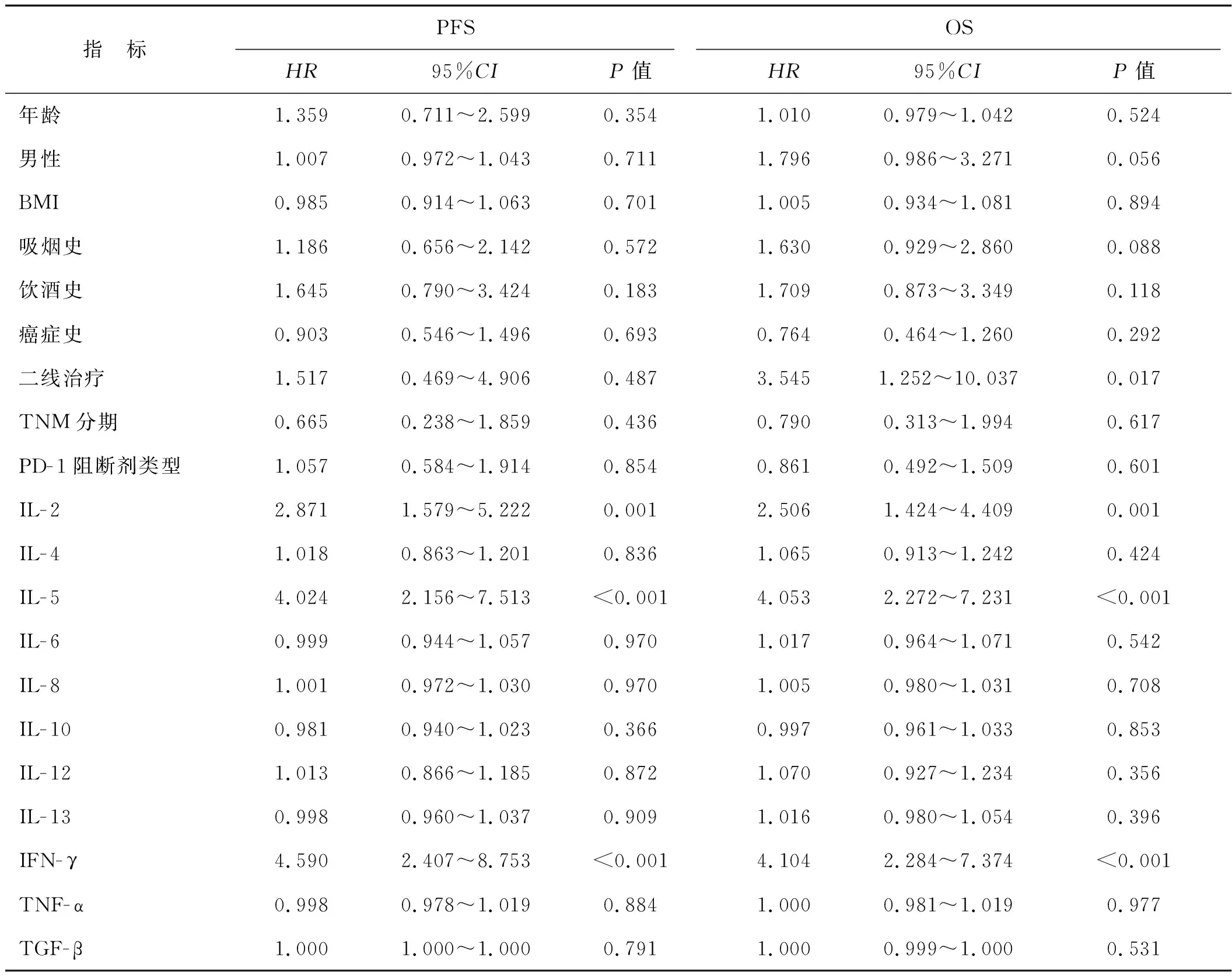
表4 单因素Cox回归分析影响NSCLC患者预后的危险因素Tab 4 Risk factors influencing prognosis of NSCLC patients by univariate Cox regression analysis

表5 多因素Cox回归分析影响NSCLC患者预后的危险因素Tab 5 Risk factors influencing prognosis of NSCLC patients by multivariate Cox regression analysis
2.5 血清细胞因子水平与NSCLC患者预后的关系
根据中位值(IL-5为2.70 pg·ml-1,IFN-γ为4.72 pg·ml-1)将患者分成高水平组和低水平组。随访期间,高IL-5水平组和低IL-5水平组中位OS时间分别为12.7、15.7个月,差异有统计学意义(χ2=13.876,P<0.001);中位PFS时间分别为4.5、6.4个月,差异有统计学意义(χ2=19.671,P<0.001)。高IFN-γ水平组和低IFN-γ水平组中位OS时间分别为12.8、15.7个月,差异有统计学意义(χ2=17.614,P<0.001);中位OS时间分别为4.5、6.5个月,差异有统计学意义(χ2=18.100,P<0.001)。见图2。

图2 Kaplan-Meier生存曲线Fig 2 Kaplan-Meier survival curve
3 讨 论
使用靶向PD-1/PD-L1抗体的ICI治疗已证明对晚期NSCLC具有深远的临床疗效[10-11],识别生物标志物以预测检查点阻断的反应至关重要。外周血采集是一种创伤小、安全、方便、可重复的样本采集方法,此外,外周血可以提供宿主免疫状态的系统视图。近年来,血液循环中的一些生物标志物在预测患者对免疫治疗反应方面显示出了价值。在本研究中,我们证明血清IL-5和IFN-γ水平与晚期NSCLC患者抗PD-1治疗的疗效相关;进一步的分析也阐明了这两种分子对于OS和PFS的预测价值。
细胞因子作为免疫活性的重要调节剂,将免疫细胞募集到肿瘤免疫微环境中,并在抗肿瘤活性过程中促进某些免疫检查点分子的表达[12]。因此,这些细胞因子可能是对PD-1阻断剂治疗反应的潜在预测生物标志物。IFN-γ是一种在先天性和适应性免疫中发挥作用的细胞因子,主要由用于天然免疫的T细胞和 NK细胞产生,但也由用于适应性免疫的CD4+和CD8+T细胞产生[13]。在肿瘤中,肿瘤浸润淋巴细胞是IFN-γ的主要来源[14]。IFN-γ在对感染和癌症的免疫反应中起重要作用,它可以通过改善主要组织相容性复合体(MHC)介导的抗原呈递、增强辅助性T细胞1(Th1)反应、调节白细胞运输、促进Toll样受体信号传导以及增强抗肿瘤和抗菌功能来发挥免疫调节作用[5]。有研究[15]表明,基线IFN-γ基因表达特征与ICI治疗的晚期NSCLC癌症患者的临床结局相关。本研究中我们发现治疗有反应组血清IFN-γ和IL-5水平显著高于治疗无反应组,且校正混杂因素后血清IL-5和IFN-γ是PD-1阻断剂治疗反应的独立预测因子。这可以通过以下机制来解释:一方面IFN-γ信号通过直接上调肿瘤、免疫浸润和基质细胞中的配体PD-L1和PD-L2,使PD-1信号轴活化,这些配体与肿瘤浸润T细胞上的PD-1相互作用,从而下调细胞毒效应;另一方面,IFN-γ可以上调肿瘤微环境中其他关键免疫抑制分子(如IDO1)的表达,肿瘤细胞利用这种正负免疫信号因子的微妙平衡得以继续生存和发展。
IL-5主要由辅助性T细胞-2亚型(Th2)淋巴细胞和Ⅱ型固有淋巴细胞(ILC2)产生[16],通过促进B细胞的分化和生长增加抗体分泌,增强Th2细胞介导的体液免疫应答[17]。ILC2是原始肺组织中的常驻群体,通过快速释放效应细胞因子(如IL-5)和影响Th2细胞的共刺激配体,介导先天性和适应性2型炎症,进而促进肿瘤转移[5]。ILC2还可以通过以IL-5依赖的方式招募和激活嗜酸粒细胞来介导其免疫抑制作用[18]。本研究中,我们发现血清IL-5水平升高与PD-1阻断剂治疗反应不良密切相关,IL-5是ILC2释放的主要细胞因子,一方面ILC2衍生的IL-5对于嗜酸粒细胞介导的NK细胞功能抑制非常重要,在一定程度上能够抑制PD-1阻断剂的抗肿瘤免疫;此外ILC2通过抑制PD-1信号传递使肿瘤细胞能够控制适应性免疫反应,从而促进肿瘤生长和转移。事实上,以IL-5及其受体为靶点的免疫治疗策略已经引起普遍关注[19]。
综上所述,早期治疗血清中细胞因子标志物的鉴定可作为选择NSCLC患者的预测工具,例如低血清IL-5和IFN-γ水平的患者将从抗PD-1治疗中获益。因此,IL-5和IFN-γ可能成为预测晚期NSCLC患者PD-1阻断剂治疗反应和预后的可靠生物标志物。但本研究具有一定局限性,收集样本量较小且血清细胞因子在NSCLC中的潜在机制尚不明确,有必要进行更多更大的临床研究来进一步证实其在NSCLC中的临床应用价值。
