计算分子极性探讨几种分子内氢键物质的沸点
2023-01-06叶益晨
叶益晨
摘要:运用Gaussian软件对分子的极性、电荷分布等数据进行计算并结合理论分析,探讨几种有机物分子内氢键的形成及其对分子极性的影响。结果表明,分子内氢键的形成可能改变分子不同构象的占比及共价键的极性,进而改变整个分子的极性,并对物质的沸点产生影响。
关键词:有机物分子内氢键;分子极性;沸点;Gaussian计算
文章编号:10056629(2022)12009503
中图分类号:G633.8
文献标识码:B
ACS(美国化学学会)发表在Industrial & Engineering Chemistry Resarch杂志上的一篇文章“Group Contribution Methods for Predicting the Melting Points and Boiling Points of Aromatic Compounds”[1](“预测芳香族化合物熔点和沸点的基团贡献法”)分析了影响芳香族化合物熔点和沸点的各种因素,文中指出氢键对物质沸点的影响与氢键对分子极性的影响有关,且分子内氢键的形成往往会减小该分子的极性,进而影响物质的沸点。本文通过对几种分子内氢键物质的分子极性变化及共价键极性变化的分析,探讨分子内氢键影响物质沸点的可能原因,旨在丰富分子内氢键的相关内容。
1 形成分子内氢键后分子结构的变化分析
邻硝基苯酚是化学教材介绍分子内氢键所用的经典素材,本文将其与结构较为接近的邻硝基甲苯进行对比分析,见图1。
相对分子质量和分子的极性是影响分子间作用力(主要指范德华力)的主要因素。相对分子质量越大,范德华力越大,沸点越高;分子的极性越大,范德华力也越大,沸点也越高。分析可知,A的相对分子质量和极性均大于B,由此推知A的分子间作用力应大于B,即A的沸点更高。但实测数据表明B的沸点(498.15K)高于A(488.15K),初步判断,笔者认为这可能是由于A分子形成的分子内氢键所致,具体分析见下:
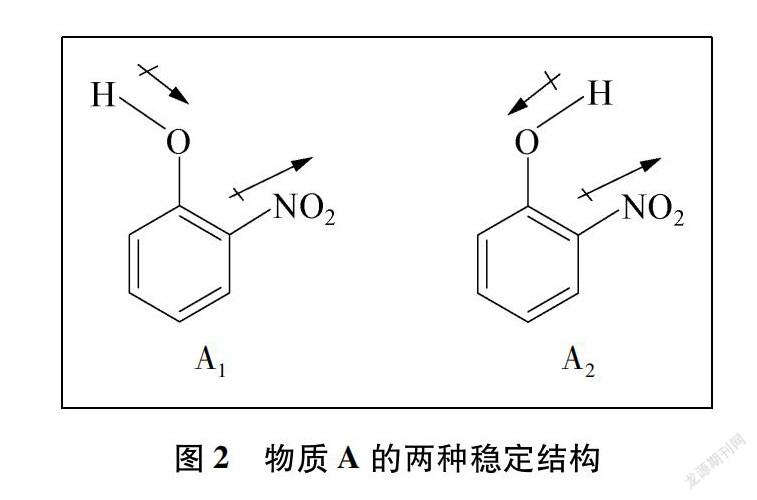
由于共轭效应[2]的影响,分子A存在两种相对稳定的平面构象A1与A2,如图2所示(来自于碳氧单键的旋转)。
对比分析上述两种构象,不难发现A1的空间位阻更小,有利于提升A1的稳定性,即仅考虑位阻效应,A1的实际占比应更大。进一步分析A2的结构,可以发现A2具备了形成分子内氢键(O—H…N)的条件,当分子内氢键形成之后,将较大幅度地降低该构象的能量,使得A2的占比大幅增加,以致超过A1的占比。笔者尝试通过O—H键极性方向来比较A1与A2两种构象的极性大小,发现A1中的O—H键极性与分子的整体极性矢量叠加后可增大分子极性,而A2则由于O—H极性方向与分子整体的极性方向相反,抵消了部分极性,故A1的分子极性更大[3]。
综上,在A未形成分子内氢键时,极性较大的A1构象由于位阻效应占有优势,而在A形成分子内氢键后,由于分子内氢键的影响,极性较小的A2成为优势构象,占比更大,整体上削弱了A分子的极性,导致A分子的极性反而小于B分子,故B分子的取向力更大,沸点更高。
2 Gaussian软件计算分析几种有机物分子的极性变化
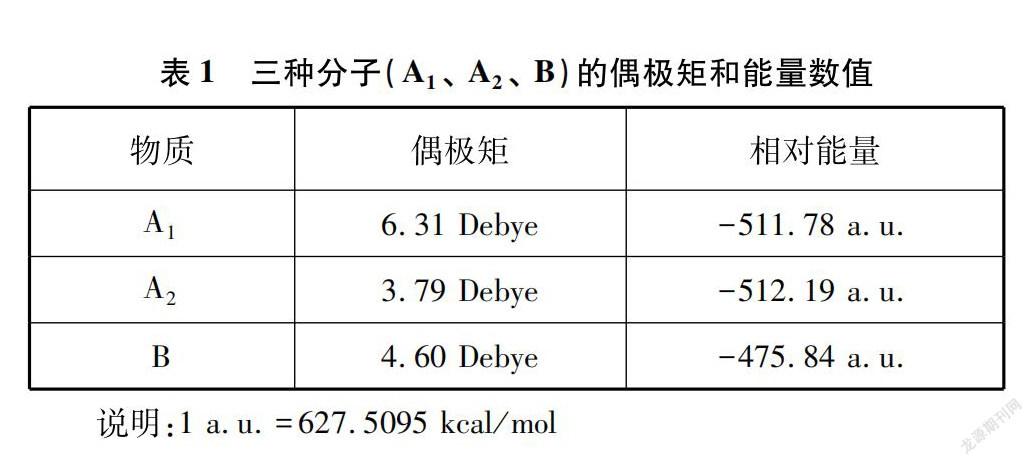
在上述理论分析的基础上,笔者运用Gaussian软件[4],先采用基組Hf/631G(d) opt freq进行结构优化,后采用基组mp2/aug-cc-pVDZ计算A1、 A2和B三个分子的偶极矩和相对能量,获得了一系列数据见表1。
Gaussian计算结果表明极性:A1(6.31 Debye)>A2(3.79 Debye);能量:A1(-511.78 a.u.)>A2(-512.19 a.u.),因此A分子的整体极性更接近能量更低的A2构象,故A的极性小于B,与上述理论分析相符,较好地印证了“分子内氢键的形成可能改变分子不同构象的占比,进而影响分子的极性和物质沸点”的观点。
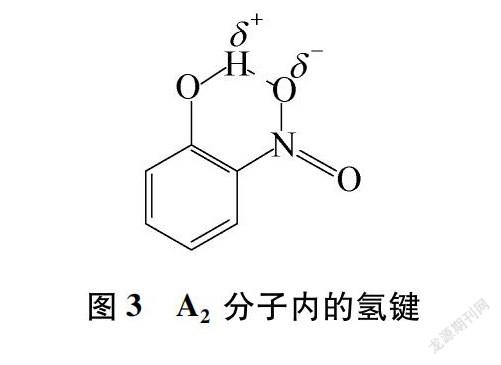
事实上,在上组例子(A和B)中,分子内氢键的形成不仅可通过增加“分子最稳定构象”的占比改变分子的极性,还可通过改变O—H键的键长和极性来加强分子极性的变化。仍以A分子为例:A2构象所形成的分子内氢键(见图3),可以看成由—NO2中的O原子将电子填入了O—H键的反键轨道上,导致—NO2中的O原子与H原子的作用能力增强,O—H键键能减小,键长增长。同时羟基上的O原子负电荷和H原子正电荷都会更加集中,使得O—H键偶极矩显著增强,更大幅度地削弱了A2分子的整体极性。
笔者同样运用Gaussian软件计算获得了A1与A2构象中的羟基O与羟基H的电荷分布,计算结果见图4。该计算结果证明A在形成分子内氢键后,O原子的负电性更加明显(O原子的电荷分布数值从-0.671降低到-0.714),H原子的正电性同样更加明显(H原子的电荷分布数值则从+0.397增加达+0.435),与理论分析一致。
为提高分析方法的可靠性和适用性,笔者寻找到四个有机芳香族分子(见图5),继续探讨相关沸点问题(见表2)。
根据分子的结构特点可将它们分成两组:第一组(C和E),第二组(D和F),而后从“相对分子质量”和“分子极性大小”两个角度进行对比分析。
第一组的C和E均有两种稳定的分子构象,见图6。笔者运用Gaussian软件计算获得了以下四种稳定构象的极性,见表3。
相对分子质量方面:C(180)大于E(167),C占优势(色散力更大)。
分子极性大小方面:E分子的两种构象中仅E1能形成分子内氢键,E1占比优势明显,因此E分子的整体极性更接近于E1的极性(5.61 Debye)。C分子的两种构象C1和C2均能形成分子内氢键,能量相近,占比相当,因此C分子极性与两种构象的均值(4.62 Debye)相近,故E分子的整体极性大于C分子,极性方面E占有优势(取向力更大)。
鉴于E的沸点(582.35K)与C的沸点(553.15K)相差近30K,可推知分子极性的差异是造成两者沸点差距的主要原因。
第二组的D和F均不能形成分子内氢键,因此可直接比较相对分子质量和分子极性大小。
相对分子质量方面:D(226.5)大于F(199.5),D占有优势(色散力更大)。
分子极性大小方面:D分子的偶极矩(4.47 Debye)略小于F分子的偶极矩(4.60 Debye),F占有优势(取向力更大)。鉴于D的沸点(628.15K)高于F的沸点(585.55K),推知在均无形成分子内氢键的情况下,相对分子质量的差距是造成两者沸点差距的主要原因,而较小的极性差对沸点的影响是微弱的。
综上,分子内氢键的形成可能会改变不同构象分子的占比以及共价键的极性,而优势构象的极性将对分子的整体极性产生较大影响,从而影响物质的沸点。多数情况下,分子内氢键的形成可以提高极性较小的构象占比(如A分子),使得分子的整体极性降低,因此形成分子内氢键常使得物质的沸点降低;少数情况下,分子内氢键的形成可能对分子的整体极性无影响(如C分子),甚至可能增大分子的整体极性(如E分子),反而使得物质的沸点升高。
3 结语
将Gaussian软件、工具化、模型化解决问题的方法,引入到能形成分子内氢键的物质的极性分析中,通過将量子化学计算与分子结构的理论分析相结合,准确分析了几组不同分子内氢键物质的极性变化和沸点问题,此分析方法具有一定的推广和应用价值。由于本文使用的计算并非十分精准,当有更大的影响因素占主导地位或其他各种因素叠加影响时,可能会导致本分析方法所得结果的准确性有所降低。
参考文献:
[1]Pahala Simamora,Samuel H. Yalkowsky. Group Contribution Methods for Predicting the Melting Points and Boiling Points of Aromatic Compounds[J]. Ind. Eng. chem. Resarch,1994,(33):1405~1409.
[2]邢其毅,裴伟伟,徐瑞秋,裴坚. 基础有机化学(第4版)[M]. 北京:北京大学出版社,2017:767~768.
[3]刘庆文. 判断分子极性和空间构象的简单方法[J]. 化学教学,2014, (8):79~82.
[4]刘恒,王雅鑫. 从计算化学角度理解分子极性[J]. 中小学数字化教学,2019, (12):55~57.
