术中腹腔热灌注化疗在胃癌患者中的应用效果观察
2023-01-06梁忠平彭晓飞唐超明成光辉
梁忠平,彭晓飞,唐超明,成光辉
(广州医科大学附属第六医院<清远市人民医院>胃肠外科 广东 清远 511500)
胃癌是我国常见消化道肿瘤疾病,虽然现阶段治疗方式有极大进步,但患者长期生存率依然较低,疾病5 年内复发率可达40%左右,病死率可达50%。主要原因和肿瘤局部复发、转移,术中肿瘤细胞脱落、微小转移灶残留有重要关系。如何防止肿瘤腹腔内转移,改善胃癌患者预后效果,提升生存率是当前研究的重要方向。有学者提出可采用腹腔化疗干预,可有效降低消化道肿瘤术后复发率,但在长期治疗效果上却有一定局限性[1]。腹腔热灌注化疗,此种方式结合区域性化疗和热疗,可充分协调两种治疗方式效果,提升患者术后远期生存率[2]。本研究旨在探讨术中腹腔热灌注化疗在胃癌中的应用效果,以期提升胃癌的疾病治疗效果,现报道如下。
1.资料与方法
1.1 一般资料
回顾性分析2013年6 月—2016年12 月广州医科大学附属第六医院收治的189 例胃癌患者,根据治疗方式不同分为对照组(n= 92)和观察组(n= 97)。对照组男42 例,女5 0例;年龄4 1~7 4岁,平均年龄(54.28±2.27)岁。观察组男45 例,女52 例;年龄42 ~78 岁,平均年龄(56.31±2.34)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。符合《赫尔辛基宣言》要求。
纳入标准:①符合疾病诊断标准者[3];②身体状态稳定,无化疗禁忌证。排除标准:①患有严重传染性疾病者;②语言功能障碍者;③合并免疫缺陷型疾病者。
1.2 方法
对照组患者为手术方式治疗。手术方式为开腹或腹腔镜D2 胃癌根治性切除。观察组患者为对照组基础上联合腹腔热灌注化疗干预。0.9%氯化钠溶液2 000 mL+顺铂(Hospira Australia Pty Ltd;注册证号H20140372)60 ~70 mg,使用腹腔热灌注装置进行腹腔循环热灌注(40 ℃)化疗1 h。两组分别于术前、手术结束、腹腔热灌注化疗结束时留取200 mL 腹腔冲洗液进行游离细胞学检查。术后根据NCCN 指南进行全身化疗。
1.3 观察指标
①对比两组患者术后并发症率,主要并发症为肺部感染、切口感染或开裂、吻合口漏、粘连性肠梗阻。②对比两组患者治疗后2 年复发率和转移率状况。主要分析失访、其他疾病致死、腹腔内肿大淋巴结或肝肺转移。③对比治疗后两组患者生存率,主要分析2 年后、3 年后生存率。④对比两组患者治疗前后腹腔冲洗液游离细胞阳性率状况。⑤分析患者质量过程中各生命指标、血常规、肝肾功能变化状况。⑥血清指标:分别于治疗前、治疗后,采用化学发光免疫分析法检测血清胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、表皮生长因子受体(epidermal growth factor receptor, EGFR)水平。
1.4 统计学方法
使用SPSS 24.0 统计软件进行数据处理。符合正态分布的计量资料采用(± s)表示,行t检验;计数资料用频数(n)和百分率(%)表示,组间比较采用χ2检验。P<0.05 表示差异有统计学意义。
2.结果
2.1 两组患者术后并发症发生率对比
两组患者术后并发症发生率比较,差异无统计学意义(P<0.05),见表1。

表1 两组胃癌患者术后并发症[n(%)]
2.2 两组患者治疗后2 年内复发、转移、失访等状况
两组患者失访、死于其他疾病例数比较,差异无统计学意义(P>0.05);观察组患者2 年复发转移率低于对照组,差异有统计学意义(P<0.05),见表2。
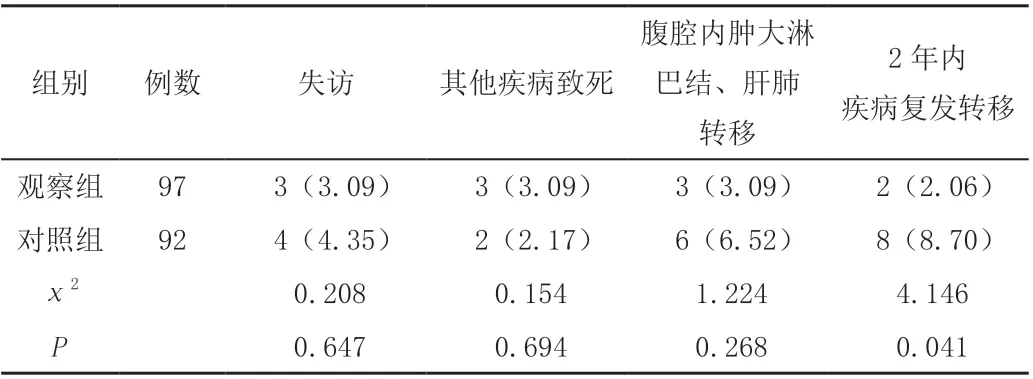
表2 两组胃癌患者疾病复发率和转移状况[n(%)]
2.3 两组患者治疗后生存率比较
排除失访及其他疾病致死患者,观察组患者治疗后2 年、3年生存率高于对照组,差异有统计学意义(P<0.05),见表3。
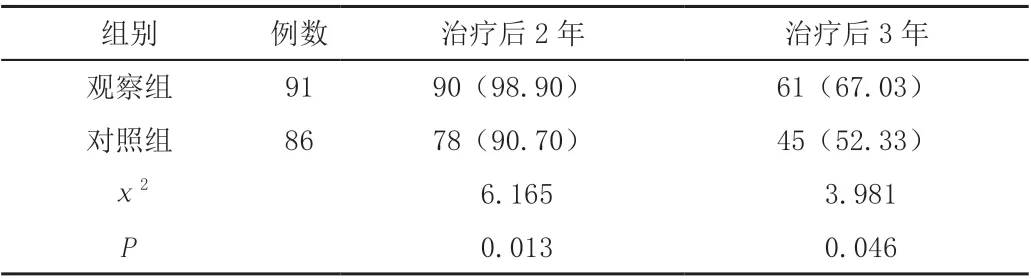
表3 两组胃癌患者生存率比较[n(%)]
2.4 两组不同治疗方式下患者腹腔冲洗液游离细胞阳性率比较
两组患者治疗前腹腔冲洗液游离细胞阳性率比较,差异无统计学意义(P>0.05);两组患者治疗后对比,差异无统计学意义(P>0.05),见表4。
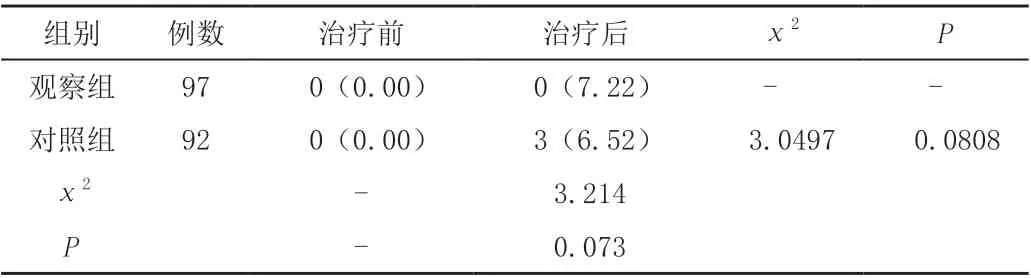
表4 两组胃癌患者腹腔冲洗液游离细胞阳性率状况[n(%)]
2.5 两组患者生命体征指标变化比较
对照组:血常规异常0 例、肝肾功能异常0 例、呼吸异常0 例、体温异常0 例;观察组患者:血常规异常0 例、肝肾功能异常0 例、呼吸异常0 例、体温异常0 例。两组患者生命指标和肝肾、血常规比较,差异无统计学意义(P>0.05)。
2.6 两组血清指标比较
治疗前,两组IGF-1、VEGF、EGFR 水平比较,差异无统计学意义(P>0.05);治疗后,观察组IGF-1、VEGF、EGFR 水平低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组胃癌患者血清指标比较( ± s)

表5 两组胃癌患者血清指标比较( ± s)
VEGF/(pg•mL-1)治疗前 治疗后 治疗前 治疗后观察组 97 312.96±10.44 206.78±10.50 365.15±11.30 307.45±10.44对照组 92 313.25±10.25 228.66±10.17 364.25±11.29 315.58±10.30 t 0.193 14.539 0.548 5.386 P 0.848 <0.001 0.585 <0.001组别 例数IGF-1/(μg•L-1)EGFR/(ng•mL-1)治疗前 治疗后观察组 97 533.78±12.50 329.74±11.40对照组 92 534.58±12.74 387.58±11.55 t 0.436 34.641 P 0.664 <0.001组别 例数
3.讨论
胃癌晚期患者手术治疗时肿瘤切缘癌细胞可持续脱离,手术切断淋巴管、血管后也会随着癌栓进入腹腔,进而引发腹腔种植转移[4]。加之手术所引发的腹膜缺损、机体免疫降低,也会使得腹腔为癌细胞游离提供机会,进而可引发术后腹腔种植转移。
有研究表明,腹腔化疗也可有效进行疾病控制。化疗时药物有较高区域选择性,同时腹腔内药物浓度可达400 倍,肝、腹膜表面浓度最高其次为肠道[5]。化疗药物注入腹腔之后患者腹腔脏器接触药物浓度可显著更高,同时多数抗癌药物也会被毛细血管、淋巴管吸收,通过门静脉进入肝脏,更加便于疾病预防以及门静脉内癌细胞、肝内微小病症转移。进行灌注治疗时多数药物可通过肝代谢无毒方式于患者体内进行血液循环,通过此种方式可有效提升患者对药物耐受度。腹膜自身对药物轮廓清力也较缓,可使得癌细胞可较长时间接触高浓度抗癌药物,进而有效提升癌细胞杀伤效果[6]。腹腔热灌注化疗的治疗对象主要是转移肿瘤、原发肿瘤,该治疗方式具有自身独特药物动力学优势、温热效应优势。其主要原理为:大量腹腔持续灌注通过机械冲刷作用可有效清除胃肠原发性癌灶、区域淋巴结腹腔残留癌细胞。在化疗时药物温度达43 ~45 ℃,在持续性高温化疗药物冲洗下,术野内渗出纤维蛋白较难使得癌细胞纤维素隔离层被隔离,同时也更佳便于机体免疫细胞进行癌细胞吞噬[7-8]。进行热灌注治疗时也会似的癌细胞表面结构蛋白出现变性,进而提升细胞膜自身通透性,也会使得药物更加便于肿瘤细胞内,使得病灶位置保持较高药物浓度,进而便于有效杀死残余癌细胞。
肿瘤细胞处于42 ℃之上温度时会引发不可逆损害,其中主要为处于S、M时期癌细胞。当温热、化疗药物在相互作用影响下可相互协同,当药物温度处于42 ~43 ℃时顺铂化疗敏感度可由5%提升至32%。同时腹腔化疗也可提升杀瘤效果,有效提升生存期,且并无严重全身性毒副效果[9-11]。本文结果显示,两组患者并发症发生率比较,差异无统计学意义(P>0.05)。分析原因为,为患者进行治疗时手术治疗自身安全性较高,同时热灌注干预时严格遵循执行标准,降低了肺部感染、切口感染或开裂以及吻合口漏的发生率,因此治疗过程十分安全。观察组患者2 年复发转移率低于对照组,差异有统计学意义(P<0.05)。排除失访及其他疾病致死患者,观察组患者治疗后2 年、3 年生存率高于对照组,差异有统计学意义(P<0.05)。两组患者治疗前、治疗后腹腔冲洗液游离细胞阳性率比较,差异无统计学意义(P>0.05),两组患者治疗后与治疗前对比,差异无统计学意义(P>0.05)。两组患者生命指标和肝肾、血常规比较,差异无统计学意义(P>0.05)。与沈爱忠等[12]研究结果基本一致。提示热灌注时通过提升药物温度,不仅可提升患者疾病治疗效果,同时对疾病转移和复发也有良好效果。
IGF-1 主要分泌器官为肝脏,能参与调节癌细胞的增殖、分化,促进疾病进展;VEGF 作为特异性生长因子,可促进血管生成,降低细胞凋亡;EGFR 水平过高,会使肿瘤细胞生长调节失控[13]。当机体发生胃癌后,IGF-1、VEGF、EGFR 水平会异常升高。本文结果显示,治疗后,观察组IGF-1、VEGF、EGFR 水平低于对照组,差异有统计学意义(P<0.05)。说明手术和腹腔热灌注化疗治疗可改善胃癌患者的血清指标。手术和腹腔热灌注化疗可增强抗肿瘤药物的活血,减少胃癌细胞的增殖,促进癌细胞凋亡,且还能抑制新生血管产生,阻断肿瘤因子和受体之间的重要,改善IGF-1、VEGF、EGFR 水平[14]。
综上所述,胃癌患者采用手术和腹腔热灌注化疗治疗时可有效长期生存率以及疾病复发转移,治疗过程安全,值得临床应用。
