陆地棉AGPase 基因家族的鉴定及表达分析
2023-01-06晁毛妮董洁胡根海黄玲张金宝付远志王清连
晁毛妮,董洁,胡根海,黄玲,张金宝,付远志,王清连*
(1. 河南科技学院/ 现代生物育种河南省协同创新中心/ 河南省棉麦分子生态与种质创新重点实验室,河南新乡 453003;2. 山东农业大学农学院,山东 泰安 271018)
淀粉是植物中碳水化合物的主要贮藏形式,广泛存在于水稻、小麦等粮食作物的籽粒,是人类饮食中重要的碳水化合物和能量来源。 在植物中,淀粉的生物合成过程较为复杂,涉及腺苷二磷酸葡萄糖焦磷酸化酶(adenosine diphosphateglucose pyrophosphorylase,AGPase)、淀粉合成酶(starch synthase,SS)、淀粉分支酶(starch branching enzyme,SBE)和淀粉脱分支酶(starch de-branching enzyme,DBE)等多种酶[1-3]。 其中,AGPase 是淀粉生物合成途径的限速酶,在调控植物生长发育[4]、籽粒淀粉积累[5]以及植株对干旱[5]、盐[6]和冷害[7]等环境胁迫的适应性方面发挥着重要作用。
AGPase 主要负责淀粉生物合成途径的第一个步骤,即催化葡萄糖-1- 磷酸(glucose-1-phosphate, G-1-P) 和ATP 生 成ADP- 葡 萄 糖(ADP-glucose,ADPG), 为淀粉的生物合成提供葡萄糖基供体[8]。 由于ADPG 不仅是淀粉生物合成过程的起始底物,也是形成直链淀粉和支链淀粉的骨架[9],其浓度直接影响淀粉生物合成的速率和效率, 因此AGPase 也被认为是淀粉生物合成的限速酶。 研究发现,AGPase 蛋白是由2 个大亚基(AGPL)和2 个小亚基(AGPS)组成的异源四聚体[10],其中小亚基具有催化和调控功能,大亚基主要负责调控功能[11]。近年来,随着生物信息学技术的快速发展,许多物种的基因组测序工作已经完成, 并在多种植物中开展了AGPase基因家族的系统鉴定工作, 如拟南芥(Arobidopsis thaliana)[12]、水稻(Oryza sativa)[13-14]、玉米[15-16]、木薯[17]、香 蕉[18]、莲 子[19]和 芋[20]等。 尽 管 不 同 物 种AGPase基因家族成员数量存在差异, 但是它们的蛋白序列却相对保守, 均含有植物AGPase 家族典型的NTP 转移结构域[1,16]。 研究发现,植物AGPase基因的表达水平与组织器官中AGPase活性和淀粉积累密切相关[5,21]。 过表达AGPase基因还可增加粒重[22-23]。 此外,AGPase基因还参与调控植物对多种逆境胁迫的响应。 例如,在木薯中,MeAGPL3基因的表达量在干旱胁迫条件下显著增加[17];在香蕉中,63%的MaAGPase基因在低温、 干旱和盐胁迫条件下表达量发生变化,其中MaAGPS1受低温、干旱和盐等非生物胁迫诱导强烈上调表达[18];在低磷和低氮处理下,水稻AGPL1和AGPS1的表达量显著升高[24]。因此,研究植物AGPase基因的表达调控与功能可为未来提高农作物产量和抗逆性提供新思路。
棉花是我国重要的经济作物,纤维发育决定了棉花的产量和品质。 已有研究表明,淀粉合成和蔗糖代谢等相关基因参与了棉纤维的发育过程[25-26]。 AGPase 是淀粉生物合成的限速酶,但其在棉花纤维发育中的功能尚不清楚,棉花中关于该基因家族的系统研究工作也尚未开展。 本研究利用已公布的陆地棉(Gossypium hirsutum)标准系TM-1 的基因组数据, 通过生物信息学方法对陆地棉AGPase家族基因(GhAGP)进行全基因组鉴定,并对其基本特性、系统进化关系、启动子区顺式作用元件以及表达模式进行了系统分析。相关结果可为今后深入研究棉花AGPase家族基因的功能奠定基础。
1 材料与方法
1.1 陆地棉AGPase 基因家族的全基因组鉴定
从CottonGen 网 站(https://www.cottongen.org/)下载陆地棉基因组数据(TM-1_V2.1)[27]并建立本地BLAST 数据库。 从TAIR 网站(http://www.arabidopsis.org) 调取拟南芥AGPase家族成员AT5G48300(AtAPS1)、AT1G05610(AtAPS2)、AT5G19220(AtAPL1)、AT1G27680(AtAPL2)、AT4G39210(AtAPL3)、AT2G21590(AtAPL4)的蛋白序列。 以拟南芥AGPase家族成员的蛋白序列作为查询序列, 运行本地BLASTp 检索程序,设置筛选阈值为1×e-10, 初步筛选获得陆地棉AGPase基因家族候选基因。 进一步通过在线工具NCBICDD-Search(https://www.ncbi.nlm.nih.gov/cdd/)和Search Pfam(http://pfam.xfam.org/search)对这些候选基因进行结构域的验证,从而确定陆地棉AGPase基因家族成员。
1.2 蛋白理化性质及序列分析
利用在线网站ExPASy[28](https://www.expasy.org/)预测分析GhAGP 蛋白的氨基酸残基数量、 分子质量和等电点。 通过在线工具WoLF PSORT[29](https://www.genscript.com/wolf-psort.html?src=leftbar) 预测GhAGP 蛋白的亚细胞定位。 利用SMART[30]蛋白质结构域分析数据库(http://smart.embl-heidelberg.de/)预测GhAGP 蛋白的功能结构域及其位置。 采用BioEdit 软件[31]分析GhAGP 蛋白序列间的一致性。
1.3 系统进化树构建
利用Clustal X 软件对拟南芥、水稻[32]和陆地棉AGPase基因家族成员的蛋白序列进行多序列比对;利用MEGA 5.02 软件中的邻接法(neighborjoining,NJ)构建系统进化树[33],主要参数设置如下:校验参数Bootstrap 值为1 000,距离模型为p-distance, 空位缺失数据处理为成对删除(pairwise deletion)。
1.4 基因结构和保守基序分析
从已下载的陆地棉基因组数据中获取GhAGP的编码序列(coding sequence,CDS)和基因序列, 然后利用Gene Structure Display Server(GSDS)[34]在线工具(http://gsds.gao-lab.org/)绘制GhAGP的外显子-内含子结构图。利用MEME[35]在线网站(https://meme-suite.org/meme/tools/meme)分析GhAGP 蛋白的保守基序(motif),主要参数设置如下:基序最大发现数目为15,基序最长长度为50 个核苷酸(nucleotide,nt),最小长度为6 nt。利用InterProScan[36]数据库(http://www.ebi.ac.uk/interpro/)对预测的保守基序进行功能结构域注释。
1.5 启动子区顺式作用元件分析
从CottonFGD 网 站[37](https://cottonfgd.org/)获取GhAGP基因起始密码子上游2 000 bp 序列,作为启动子分析序列。 利用PlantCARE 在线工具[38](http://bioinformatics.psb.ugent.be/webtools/plantcare/html/) 对GhAGP基因启动子区的顺式作用元件进行预测分析。
1.6 利用转录组数据分析基因表达特性
从NCBI 网站SRA 数据库(SRA: PRJNA-248163)获取[27]陆地棉GhAGP在不同组织(根、茎、叶、花瓣和不同发育时期的胚珠、纤维)和低温(4 ℃)、高温(37 ℃)、盐(0.4 mol·L-1NaCl)、干旱(200 g·L-1PEG 6000)4 种非生物胁迫条件下的转录组数据。利用SolexQA 软件[39]对数据进行质量控制,Tophat 2 软件[40]进行有参比对,Cufflinks[40]软件计算表达量FPKM(fragments per kilobase of exon model per million mapped reads,每千个碱基的转录每百万映射读取的片段)。 对获取的组织表达数据和非生物胁迫表达数据分别进行log2(FPKM+1)和log2[(Stress_FPKM+1)/(CK_FPKM+1)] 均一化处理后, 其中Stress_FPKM+1和Stress_FPKM+1 分别表示胁迫和对照处理下基因的FPKM,利用MeV 软件[41]绘制基因表达的热图。
1.7 胁迫处理与表达量分析
将陆地棉品种百棉1 号的种子播种于营养土中,在生长室内(光照强度为450 μmol·m-2·s-1,光照/黑暗时间为14 h/10 h, 昼/夜温度为30~33 ℃/23~26 ℃)培养至1 片真叶期,将其转移至1/2 Hoagland's 营养液中进行培养。 生长7 d 后,选取长势一致的幼苗分别在4 ℃、38 ℃、20%PEG 6000 和0.2 mol·L-1NaCl 条件下进行处理;其中4 ℃和38 ℃处理均在光照培养箱内进行,培养箱条件为16 h 光照/8 h 黑暗、湿度70%。 在胁迫处理后的0 h、6 h、12 h、24 h、36 h 和48 h 取棉花幼苗叶片,然后迅速置于液氮中速冻,并保存于-80 ℃冰箱。
按照植物多糖多酚RNA 提取试剂盒(TIANGEN,DP441)说明书中的操作方法对棉花不同组织进行总RNA 的提取。 取2 μg 左右的RNA,利用反转录试剂盒[货号:6210A,宝日医生物技术(北京)有限公司]进行反转录,合成cDNA。 以陆地棉Actin作为内参基因, 利用SYBR Green 染料法进行实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)。 qRT-PCR 反应体系包含10 μL 2×SYBR Premix Ex Taq[货号:RR820L,宝日医生物技术(北京)有限公司],0.8 μL 10 mmol·L-1正向引 物,0.8 μL 10 mmol·L-1反 向 引 物,1.0 μL cDNA,7.4 μL ddH2O。 扩增程序为95 ℃30 s,循环1 次;95℃5 s,60℃20 s,循环40 次。每个样品设置3 次重复, 采用2-ΔΔCt 法计算基因的相对表达量。 所用的引物序列见表1。
表1 本研究所用引物序列Table 1 Primer sequences used in the study
2 结果与分析
2.1 陆地棉AGPase 基因家族成员的鉴定
在陆地棉基因组中共鉴定到20 个AGPase基因(GhAGP),包括12 个AGPase 大亚基基因(GhAGPL) 和8 个AGPase 小亚基基因(GhAGPS)。根据它们在染色体上的位置信息,分别将其命名为GhAGPL1~GhAGPL12和GhAGPS1~GhAGPS8。 经预测,GhAGP基因长度为2 668~3 803 bp,CDS 长度为1 476~1 740 bp;GhAGP蛋白包含491~579 个氨基酸残基, 分子质量为54.65~64.60 ku,理论等电点为6.06~9.13,其中80%以上的GhAGP 蛋白的等电点大于7,表明陆地棉AGPase 蛋白主要呈弱碱性。 20 个GhAGP基因不均匀地分布在陆地棉的16 条染色体上(包括A 亚基因组的8 条染色体和D亚基因组的8 条染色体),GhAGP在不同染色体上的分布数量存在明显差异, 其中A07 和D07 染色体均包含3 个GhAGP,其他14 条染色体均含有1 个GhAGP。亚细胞定位预测结果表明,AGPase 大亚基定位于叶绿体和细胞质, 而AGPase 小亚基均定位于叶绿体(表2)。
2.2 陆地棉GhAGP 蛋白序列一致性分析
功能结构域预测分析表明,GhAGP 蛋白均含有植物AGPase 家族特有的NTP_transferase保守结构域(表2)。蛋白序列一致性分析表明,陆地棉AGPase 大亚基的氨基酸序列一致性为54.10%~99.20%,其中GhAGPL4 和GhAGPL10的序列一致性最高,GhAGPL3 和GhAGPL5 的序列一致性最低。 AGPase 小亚基AGPS 间的氨基酸序列一致性为42.60%~99.20%, 其中GhAGPS2 和GhAGPS6 的序列一致性最高,GhAGPS1和GhAGPS2 的序列一致性最低(附表1)。
2.3 AGPase 蛋白的系统进化分析
为进一步研究陆地棉AGPase 家族蛋白的系统进化关系,选取陆地棉(20 个)、拟南芥(6 个)和水稻(7 个)3 个物种共33 个AGPase 蛋白序列构建系统进化树。 结果表明,33 个AGPase 蛋白在进化上可明显地聚为2 类: 一类是大亚基群组, 包括12 个陆地棉、4 个拟南芥、4 个水稻共20 个AGPase 蛋白; 另一类是小亚基群组,包括8 个 陆 地 棉、2 个 拟 南 芥、3 个 水 稻 共13 个AGPase 小亚基蛋白(图1)。
在陆地棉AGPase 小亚基蛋白中,GhAGPS1、GhAGPS5 与拟南芥AtAPS2 亲缘关系较近,聚在一 个 分 支;GhAGPS6、GhAGPS2、GhAGPS3、GhAGPS7、GhAGPS4、GhAGPS8 与AtAPS1 亲缘关系较近,聚在另外一个分支。 在陆地棉大亚基蛋白中,GhAGPL4、GhAGPL10 与水稻OsAGPL4聚在一个分支;GhAGPL5、GhAGPL11 与拟南芥AtAPL1、 水 稻 OsAGPL1 聚 在 一 个 分 支;GhAGPL2、GhAGPL8、GhAGPL3、GhAGPL9 与 拟南 芥 AtAPL2 聚 在 一 个 分 支;GhAGPL1、GhAGPL7、GhAGPL6、GhAGPL12 与 拟 南 芥AtAPL3、AtAPL4 聚在一个分支; 表明它们之间亲缘关系较近,可能具有相似的功能(图1)。
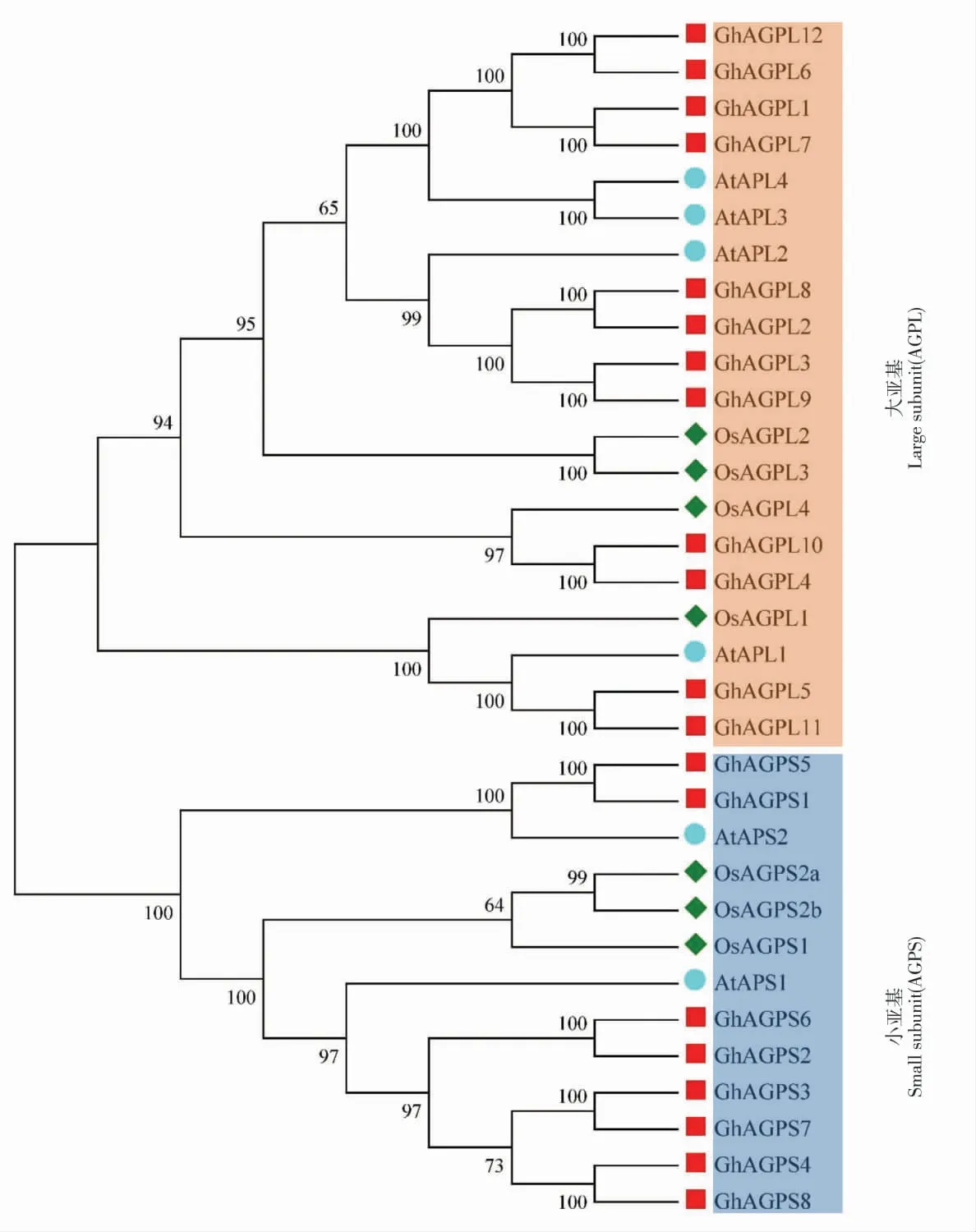
图1 陆地棉、拟南芥与水稻中AGPase 蛋白的系统进化分析Fig. 1 Phylogenetic analysis of AGPase proteins in G. hirsutum, A. thaliana%and O. sativa%
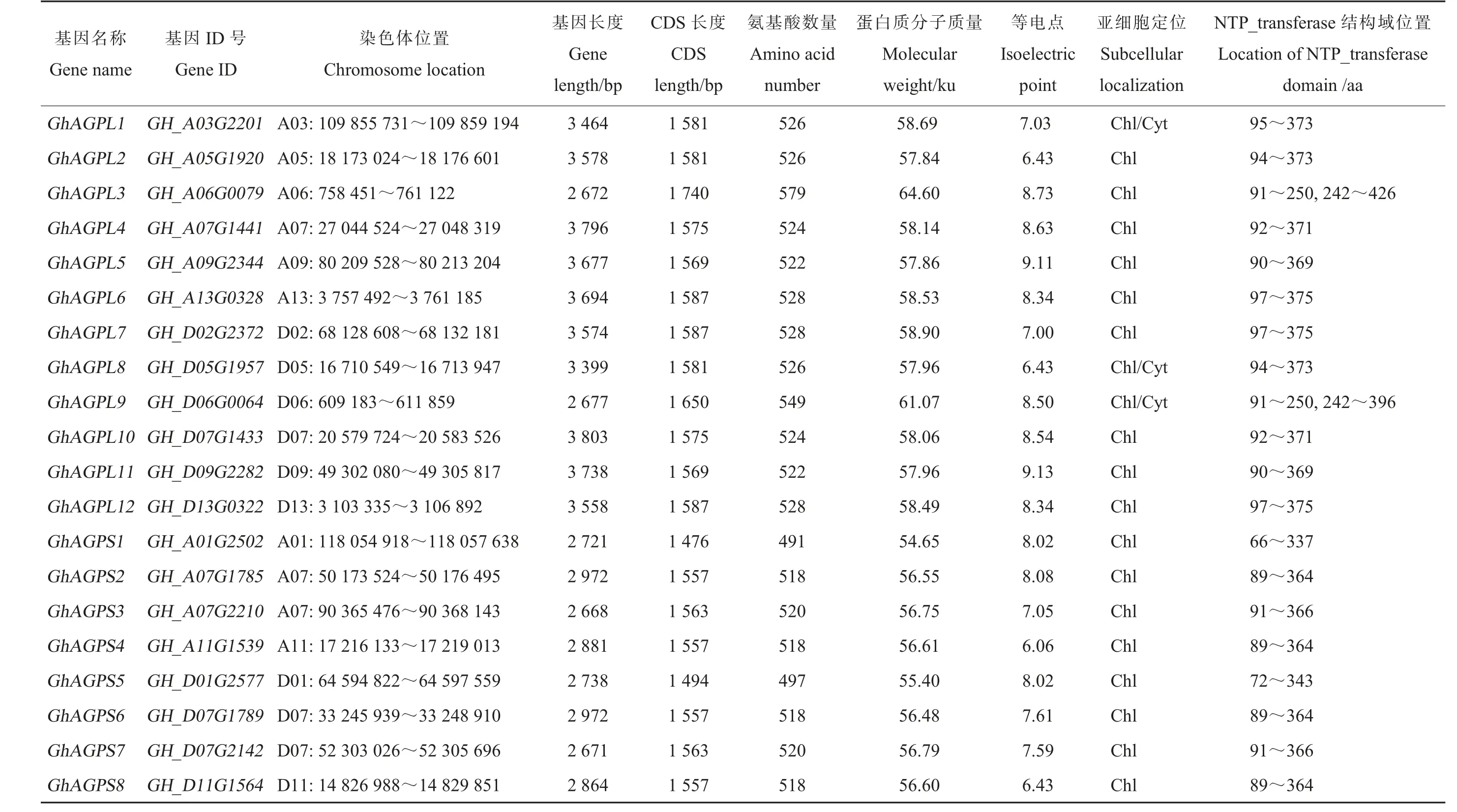
表 陆地棉 基因的基本信息2AGPaseTable 2The basic information of AGPase genes in G. hirsutum
2.4 陆地棉AGPase 基因的结构特征分析
经预测分析,陆地棉GhAGP 蛋白共包含15个保守基序(图2A)。 基序1、基序3 和基序6 这3 个保守基序被注释为NTP_transferase 结构域,存在于所有的GhAGP 蛋白中。基序1 和基序5 为GhAGPL 蛋白所特有的保守基序, 所有GhAGPL均 含 有 基 序11, 除GhAGPL4、GhAGPL10、GhAGPL11 和GhAGPL5 外的GhAGPL 均含有基序15。基序12 和基序13 是GhAGPS 特有的保守基序, 其中所有的GhAGPS 蛋白均含有基序13, 除GhAGPS1 和GhAGPS5 外的GhAGPS蛋白均含有基序12。 另外, 位于同一分支的GhAGP 蛋白具有相似的基序数目、类型和分布,暗示着它们可能具有相似的功能。
基因结构分析发现,GhAGP基因的外显子数量均较多。GhAGPL基因外显子数量为12~15 , 其 中GhAGPL2、GhAGPL8、GhAGPL12、GhAGPL6、GhAGPL1、GhAGPL7、GhAGPL5和GhAGPL11均 含 有14 个 外 显 子,GhAGPL4和GhAGPL10均 含 有15 个 外 显 子,GhAGPL3和GhAGPL9分别含有12 和13 个外显子。GhAGPS基因均含有9 个外显子。 另外,在进化上亲缘关系较近的GhAGP具有相似的外显子-内含子结构(图2B)。
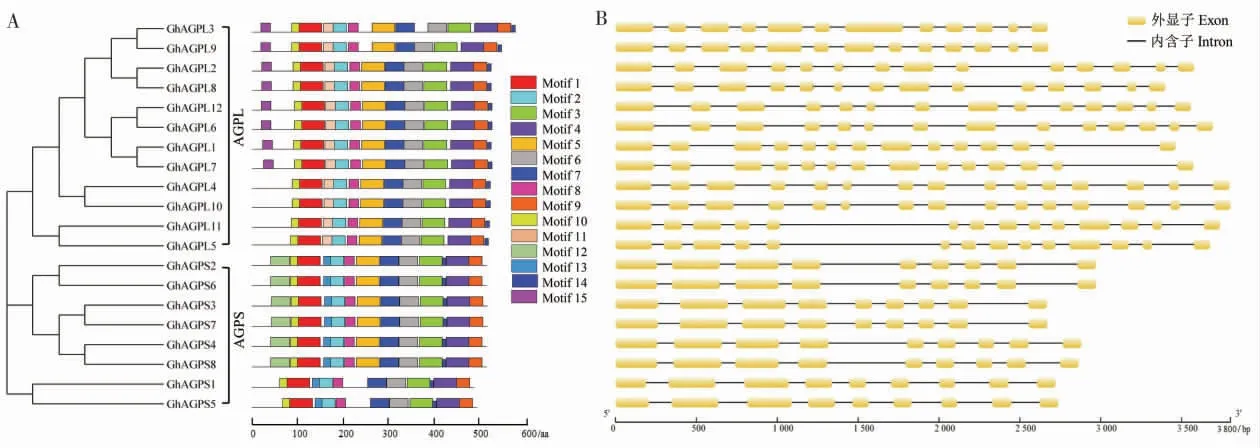
图2 陆地棉AGPase 基因家族成员的保守基序(A)和基因结构(B)分析Fig. 2 Conserved motifs (A) and gene structure (B) analyses of AGPase genes family members in G. hirsutum
2.5 陆地棉AGPase 基因启动子区的顺式作用元件分析
对陆地棉GhAGP基因启动子区的顺式作用元件进行预测分析,结果表明:6 个GhAGP含有低温响应元件LTR,7 个GhAGP含有防御和胁迫响应元件TC-rich repeats,5 个GhAGP含有干旱诱导响应元件MBS,6 个GhAGP含有水杨酸响应元件TCA-element,12 个GhAGP含有茉莉酸 响 应 元 件TGACG-motif/CGTCA-motif,14 个GhAGP含有脱落酸响应元件ABRE,1 个GhAGP含有赤霉素响应元件GARE-motif,4 个GhAGP含有赤霉素响应元件P-box,1 个GhAGP含有生长素响应元件TATC-box,1 个GhAGP含有生长素响应元件AuxRR-core,4 个GhAGP含有生长素响应元件TGA-element (图3 和附图1)。 表明陆地棉AGPase基因家族成员可能参与植物对外界环境胁迫和植物激素的响应。
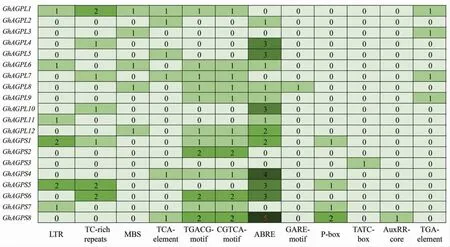
图3 陆地棉GhAGP 基因启动子区的顺式作用元件分析Fig. 3 Cis-acting element analysis of the promoter region of%GhAGP genes in G. hirsutum
2.6 GhAGP 基因的组织特异性表达分析
利用转录组数据对GhAGP基因在棉花不同组织中的表达情况进行分析(图4),发现GhAGP的表达具有组织特异性。 根据表达模式可将其聚为两大类:I 类和II 类,其中I 类的基因主要是一些在各组织中均不表达的基因和一些仅在个别组织表达的基因;II 类主要是一些在多个组织中表达量均较高的基因和无组织特异性表达的基因。其中,GhAGPL5和GhAGPL11在叶片中特异性高表达,在其他组织中表达量很低或者基本不表达,表明它们在棉花“源”器官——叶片的淀粉积累过程中可能起着重要作用。 多个GhAGP基因GhAGPL4、GhAGPL10、GhAGPL3、GhAGPS1、GhAGPS5、GhAGPS2、GhAGPL9和GhAGPS6在棉花根、茎、叶片、花瓣、胚珠和纤维组织中的表达量较低或者基本不表达。GhAGPL1、GhAGPL7和GhAGPS8在开花后10 d (10 days post anthesis,10 DPA)的胚珠中表达量相对较高,表明这3 个基因在棉花种子淀粉合成与积累过程中可能发挥重要作用。
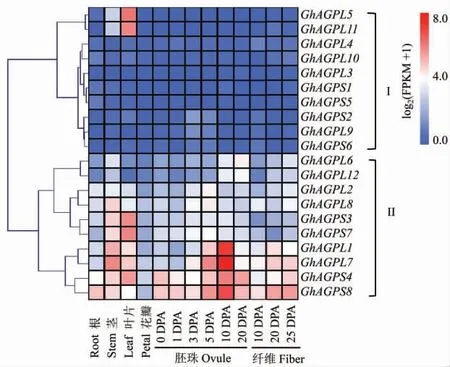
图4 陆地棉GhAGP 基因的表达特性分析Fig. 4 Expression pattern analysis of GhAGP genes in G. hirsutum
2.7 陆地棉AGPase 基因在非生物胁迫下的表达模式分析
分析不同胁迫条件下的陆地棉转录组数据,发现GhAGP基因在低温、高温、盐和干旱胁迫条件下的表达模式存在差异(图5),其中GhAGPL1和GhAGPL7对低温、高温、盐和干旱胁迫均表现出明显地响应。 在低温胁迫条件下,GhAGPL1和GhAGPL7的表达量先下降,处理后24 h,其表达量又明显升高。 在高温胁迫条件下,GhAGP基因的表达呈现出不同的响应模式, 其中GhAGPL7在高温处理后1 h 表达量迅速上升, 随着处理时间的延长表达量下降; 其他对高温胁迫响应的GhAGP基因GhAGPL11、GhAGPL5、GhAGPS4、GhAGPS3、GhAGPS7和GhAGPS8在 高 温 胁 迫后1 h 表达量迅速下降, 随着处理时间的延长表达量又有所升高。 盐胁迫下,GhAGPL1和GhAGPL7先下调表达(处理后1 h)然后上调表达(处理后3 h 和6 h),处理后12 h 再次下调表达,然后在处理后24 h 又上调表达;而GhAGPL2在处理后1 h 先下调表达, 然后随着时间延长,表达量上升。 在干旱胁迫条件下,GhAGPL1和GhAGPL7的表达量呈现出先上升后下降的趋势,在处理前期(1~6 h)上调表达,在处理后12 h下调表达。
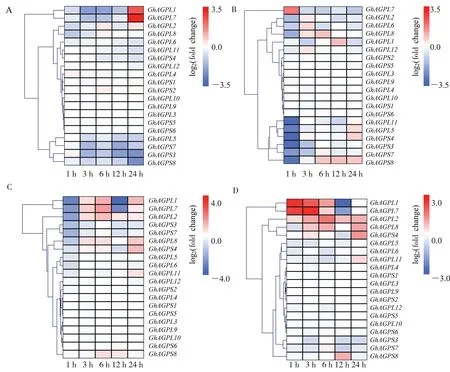
图5 陆地棉GhAGP 基因在不同胁迫处理下的表达模式分析Fig. 5 Expression pattern analysis of GhAGP genes under different stress treatments in G. hirsutum
2.8 GhAGPL1 和GhAGPL7 基因在非生物胁迫下的表达模式
实时定量表达分析结果(图6)表明GhAGPL1和GhAGPL7基因响应低温、高温、盐和干旱胁迫诱导表达。 在低温胁迫条件下, 胁迫处理后6 h时,GhAGPL1和GhAGPL7基因的表达量有所上升,随着处理时间的延长,其表达量显著降低。 高温胁迫处理6 h 后,GhAGPL1和GhAGPL7基因的表达量显著升高至最高值, 随着时间延长,表达量显著降低。 在盐胁迫处理条件下,GhAGPL1的表达量在6 h 和12 h 显著降低,在胁迫处理后24 h 显著上调至最高,随后又开始下降,并在胁迫处理48 h 表达量又出现显著上调;GhAGPL7基因在盐胁迫处理6 h 和12 h 表达量显著下降,在胁迫处理48 h 时,表达量显著上调至最高。 在干旱胁迫处理6 h 和12 h,GhAGPL1 和GhAGPL7 基因的表达量显著降低,24 h 和48 h 表达量均显著升高,并在胁迫处理后48 h 达到最高。 上述结果表明,GhAGPL1 和GhAGPL7 基因可对多种非生物胁迫产生应答,它们可能参与了棉花对逆境胁迫的响应过程。
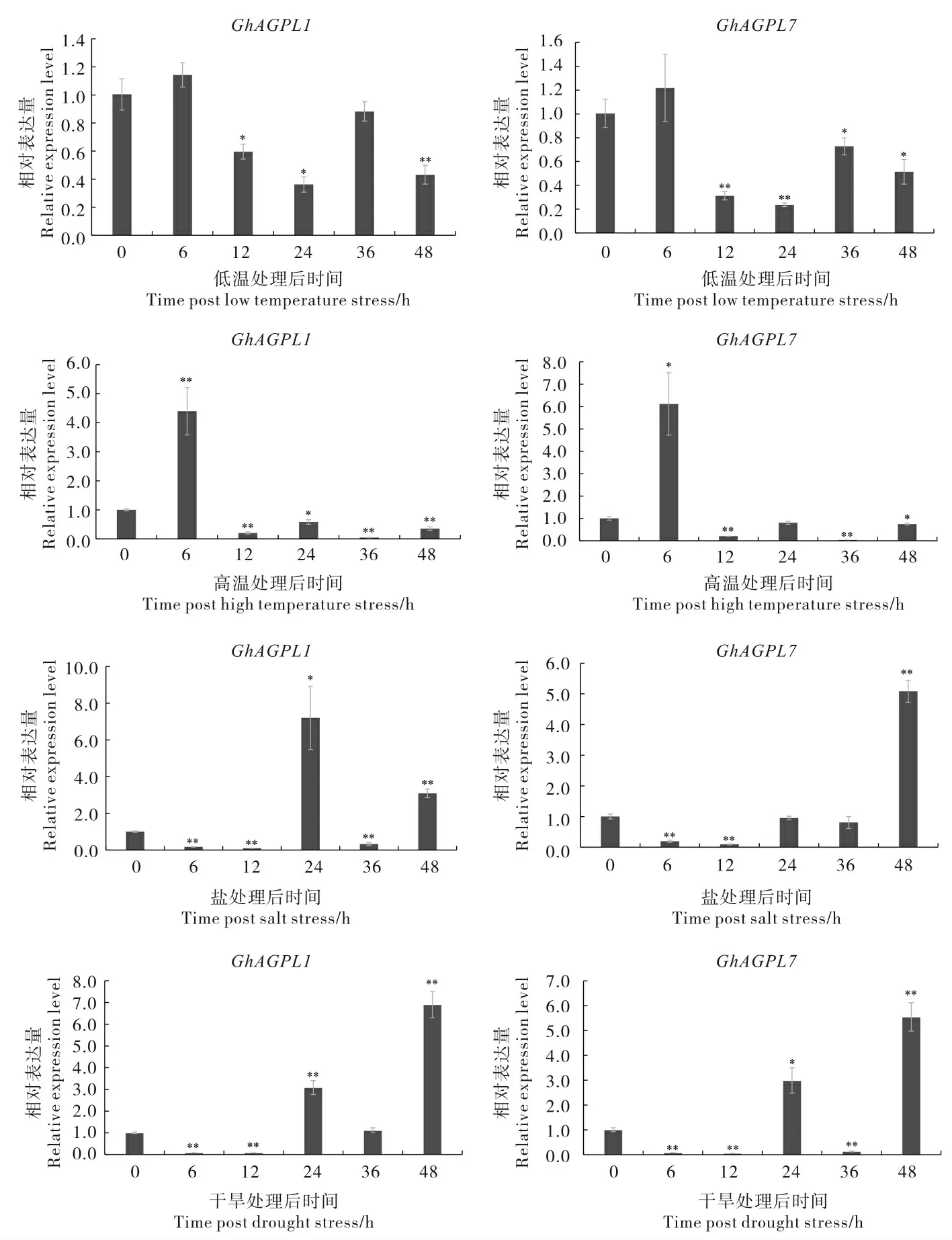
图6 不同非生物胁迫处理下GhAGPL1 和GhAGPL7 基因的表达模式分析Fig. 6 Expression pattern analysis of GhAGPL1 and GhAGPL7 under different abiotic stress
3 讨论
AGPase 是淀粉生物合成的限速酶, 由于其在淀粉生物合成中起关键作用[42],已成为研究者们关注的热点。目前,关于棉花AGPase 基因的克隆与功能研究鲜有报道。 本研究基于最新公布的陆地棉TM-1 基因组数据, 对陆地棉AGPase 基因家族进行全基因组鉴定, 共鉴定出20 个GhAGP 基因,明显多于拟南芥(6 个)[12]和水稻(7个)[13-14]等物种。陆地棉是异源四倍体,大约在100万~160 万年前由亚洲棉、 非洲棉共同的祖先与雷蒙德氏棉杂交、染色体加倍,随后经过驯化改良形成现在的异源四倍体[43]。 多倍体化会增加基因的拷贝数, 因此陆地棉基因组中数量较多的GhAGP 基因可能与其进化过程中经历的基因组加倍事件有关。
系统进化分析表明, 陆地棉AGPase 蛋白可分为大亚基蛋白(AGPL)和小亚基蛋白(AGPS)2个亚群,这与木薯、香蕉中AGPase 蛋白的系统进化分析结果相一致[17-18]。 目前普遍认为,植物AGPase 可能主要定位于叶绿体和造粉体[32,42,44],负责叶片和贮藏器官(块茎)的淀粉合成。 但是,越来越多的研究发现,AGPase 不仅存在于质体中,也存在于细胞质中[45-46]。 本研究预测陆地棉AGPL 蛋白主要定位于叶绿体和细胞质中, 表明陆地棉AGPase 蛋白可能与水稻中的AGPase 蛋白[36]一样,也存在胞质型和质体型两种类型,但是仍需进一步通过亚细胞定位实验来验证。
植物中有些基因只在特定的组织、器官或发育阶段表达,对这类基因的研究有助于了解其功能,同时通过应用组织特异性表达技术,可以实现目标基因在特定组织和器官中的靶向表达[47]。本研究发现, 不同的GhAGP基因具有不同的组织表达模式,其中GhAGPL5和GhAGPL11在叶片中特异性高表达, 多个GhAGP基因在被检测的组织中表达量较低或者基本不表达,GhAGPL1、GhAGPL7和GhAGPS8在10 DPA 胚珠中表达量较高,暗示这些基因在棉花生长发育过程中可能具有不同的功能,这与木薯[17]、香蕉[18]和芋[20]中的相关研究结果较为一致。 另外,前期研究表明,籽粒灌浆过程合成的淀粉和储藏蛋白可满足种子发育对光合同化产物的需求[48]。 在棉花中,胚珠的发育与棉纤维和种子的发育之间存在紧密又复杂的关系, 胚珠发育形成棉花的种子,而在棉纤维发育阶段,需要大量的光合同化物来满足纤维素生物合成的需求;胚珠中淀粉的合成与积累不仅可满足种子发育对光合同化物的需求,也可满足纤维发育过程中对营养物质的需要[25]。 本研 究 中,GhAGPL1、GhAGPL7和GhAGPS8在10 DPA 胚珠中特异性高表达, 表明其在棉花种子的淀粉积累、种子发育以及棉纤维的发育过程中可能起着重要作用。 因此,通过基因工程方法调控这些基因的表达可能是今后提高棉花籽指和改良纤维品质的有效途径之一,类似的研究策略已成功应用于玉米和小麦等作物[22-23]。
受全球极端天气频繁出现、水资源短缺以及土壤盐碱化日益严重等的威胁,对棉花品种的抗逆性也提出了更高的要求[49]。挖掘抗逆相关基因,培育抗逆棉花品种具有重要意义。 棉花在生长发育过程中会遭遇干旱、低温、高温和盐分等各种非生物胁迫, 会对棉花的产量和品质造成不利影响[49-51]。与其他作物相比,棉花本身具有一定的耐 盐 性。 本 研 究 中,GhAGPL1、GhAGPL7和GhAGPL2受盐胁迫诱导表达, 表明它们在维持棉花对盐胁迫的适应性方面可能起着重要作用,但是其对盐胁迫的响应模式不尽相同,表明其发挥功能的时间可能有所不同。 先前研究发现,AGPase 活性受高温影响较大[52],在玉米中,高温胁迫会导致AGPase 和SS 的活性分别降低约87%和57%,进而导致淀粉合成受阻[53]。本研究发现较多的GhAGP基因参与棉花对高温胁迫的响应, 这可能与AGPase 酶活性对高温比较敏感有关。 总的来说,AGPase家族基因的表达受环境因素影响较大,这与前人的研究结果[6,17,54]一致。另外,实时定量表达分析发现在棉花苗期GhAGPL1和GhAGPL7明显响应多种非生物胁迫,但是实时定量表达分析结果与转录组结果存在一定差异,这可能是由于不同棉花品种对胁迫的响应存在差异; 同时GhAGPL1和GhAGPL7启动子区存在与逆境胁迫响应相关的顺式作用元件,表明它们可能对于维持逆境条件下棉花体内AGPase 活性和淀粉合成有重要作用。 综上,本研究结果不仅有助于了解陆地棉AGPase基因的功能,也为棉花高产和抗逆育种提供了重要的候选基因资源。
4 结论
在陆地棉基因组中共鉴定到20 个GhAGP基因, 包括12 个大亚基基因GhAGPL和8 个小亚基基因GhAGPS。 GhAGP 蛋白在进化上可分为大亚基蛋白AGPL 和小亚基蛋白AGPS 。GhAGP启动子区含有多个与植物激素、 非生物胁迫响应相关的顺式作用元件。 转录组和实时定量分析表明,GhAGPL1和GhAGPL7基因参与棉花对低温、高温、盐和干旱胁迫的响应。 本研究为深入解析陆地棉AGPase家族基因的功能奠定了基础。
附图附表:
详见本刊网站(http://journal.cricaas.com.cn/)本文网页版。
附表1 陆地棉AGPase 蛋白序列一致性分析
Table S1 Sequence identityanalysis ofAGPase proteins inG.hirsutum
附图1 陆地棉AGPase基因启动子区的顺式作用元件
Fig.S1Cis-acting elements in the promoter ofAGPaseinG.hirsutum
