棉花雄性不育细胞质对ATP 和H2O2 含量的影响分析
2023-01-06韩阳臧榕张梦陈亮亮张学贤郭立平戚廷香唐会妮王海林乔秀琴邢朝柱张艳吴建勇
韩阳,臧榕,张梦,陈亮亮,张学贤,郭立平,戚廷香,唐会妮,王海林,乔秀琴,邢朝柱*,张艳*,吴建勇*
(1. 河北农业大学/ 棉花生物学国家重点实验室河北基地,河北 保定 071001;2. 中国农业科学院棉花研究所/ 棉花生物学国家重点实验室,河南 安阳 455000)
杂种优势主要表现在生长势、 生活力、 抗逆性、繁殖力、适应性以及产量、品质等层面。生产实践表明, 杂种优势的利用能够大幅度提高棉花产量、 改善其纤维品质并增强其抵御病虫等逆境胁迫的能力[1]。然而目前棉花杂交种生产中去雄主要由人工、化学处理来完成,其生产成本高、效率低,甚至会对环境造成不利影响[2]。利用细胞质雄性不育(cytoplasmic male sterility,CMS)系作母本,恢复系作父本的“三系”法(不育系、保持系及其恢复系)制种,可以降低种子生产成本,提高种子纯度[3]。
CMS 大多是由线粒体基因结构异常引起的母性遗传,一般表现为产生无功能的花粉[4-5]。 绒毡层细胞中线粒体数量和体积的增加证明花药发育是一个需要大量能量的过程,尤其是在产生大量的花粉母细胞之后,其所需的大部分能量来自于发生在线粒体内膜的氧化磷酸化过程[6]。 现有研究发现大多数CMS 相关基因与氧化磷酸化通路相关基因共表达[7-8],这些CMS 基因可干扰氧化磷酸化各复合体的正常功能, 导致ATP 合成显著减少,最终导致植物CMS[2]。 大多数CMS的机制在很大程度上可以用能量缺乏模型来解释, 即使花粉发育过程中ATP 生成的轻微中断也可能导致CMS[9]。 线粒体基因组携带许多重要的遗传信息,包括能量代谢、发育、细胞程序性死亡(programmed cell death,PCD)和氧化应激反应等[10]。此外,在植物细胞中线粒体代谢通常受到高水平活性氧(reactive oxygen species, ROS)的干扰。 ROS 已经成为植物发育的重要调节因子,许多证据表明,ROS 在细胞生长过程中发挥着重要作用[11-14],其中H2O2含量是反应ROS 水平的一项重要指标。 花粉败育过程通常伴随着各种生理指标的变化。 Teixeira 等[15]研究发现,与其保持系相比, 油菜不育系不同组织中的ATP 含量都有降低的趋势。 在玉米和水稻中的研究表明,相比于保持系, 不育系花药中ATP 含量显著降低、ROS 水平显著升高[3,16]。
哈克尼西棉(Gossypium harknessii)胞质不育系(CMS-D2)和三裂棉(Gossypium trilobum)胞质不育系(CMS-D8)是棉花主要的胞质不育材料[17],其中CMS-D2 属于孢子体不育,CMS-D8属于配子体不育。前人通过细胞学观察发现CMS-D2 一般在花蕾长度为3 mm 左右时发生败育[18],CMS-D8 一般在花蕾长度为5~6 mm 时发生败育[19]。 此外,本课题组前期通过对CMS-D2 不育系及其保持系的线粒体全基因组序列进行比对分析, 鉴定到一个不育系特有的嵌合基因orf610a,在拟南芥中超表达融合线粒体定位信号的orf610a基因,导致阳性植株育性降低[20]。 基于此,本研究通过比较分析CMS-D2 和CMS-D8 两套 “三系” 材料不同发育时期的叶片和花蕾中ATP 和H2O2含量,以及orf610a转基因拟南芥花蕾和角果中ATP 和H2O2含量,并测定不育系、保持系和转基因拟南芥花蕾中ATP 合成相关基因的表达, 探究棉花雄性不育细胞质对ATP 和H2O2含量的影响。
1 材料与方法
1.1 试验材料及生长条件
供试棉花材料为两套“三系”材料,分别为含哈克尼西棉不育胞质(CMS-D2) 的不育系D2A[S(rf1rf1)]及其保持系D2B[N(rf1rf1)]与恢复系D2R[S(Rf1Rf1)],含三裂棉不育胞质(CMS-D8)的不育系D8A [S (rf2rf2)] 及其保持系D8B[N(rf2rf2)]与恢复系D8R[S(Rf2Rf2)]。 上述两套材料均于2021 年4 月下旬种植于河南省安阳市中国农业科学院棉花研究所东场试验基地,棉花行距为80 cm,株距23.8 cm,田间管理措施同当地普通棉田。
转基因受体材料为本课题组保存的哥伦比亚型拟南芥, 种植于装有营养土 (营养土∶蛭石=3∶1)的营养钵(长7 cm,宽7 cm,高cm)中,每穴对角种植2 株。 置于温室中培养,温度为(22±2)℃, 空气相对湿度为80%左右,光照/ 黑暗时间为16 h/8 h。
1.2 试验方法
1.2.1orf610a 基因的克隆、超表达载体构建以及拟南芥遗传转化。 以D2A 3 mm 花蕾的cDNA 为模 板, 用PhantaMax Super-Fidelity DNA Poly merase(南京诺唯赞生物科技有限公司)扩增orf610a的编码区全长;之后将拟南芥线粒体靶向肽atp31-231(GenBank 登录号:NM_128864.4)的编码序列(MTS)与orf610a融合,连接T-zero 载体并转入大肠杆菌感受态细胞Trans 5α 中;以测序正确的质粒作为模板,设计含有相应酶切位点的特异引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,通过同源重组的方法与已酶切完成的经过修饰的pCAMBIA2300 载体进行连接, 将连接产物转入大肠杆菌感受态细胞Trans 5α 中,最终获得正确的超表达载体。
将构建好的超表达载体pCAM2BIA2300-MTS-orf610a转化到农杆菌感受态细胞GV3101中,之后利用农杆菌蘸花法[21]进行拟南芥的遗传转化。 将灭菌的T0转基因拟南芥种子置于含50 mg·L-1卡那霉素的MS 培养基平板上筛选,选取长势较好的植株转移至营养钵中; 待长出7~8 片真叶后,剪取植株叶片,利用CTAB 法提取叶片总DNA 用于PCR 检测(正向引物:ACTGGGCACAACAGACAATCG;反向引物:GCATCAGCCATGATGGATACTTT), 筛选T1阳性植株。 之后用同样的方法,筛选T2阳性植株。
1.2.2取样。棉花叶片:分别在苗期(5 月22 日)、蕾期(6 月17 日)、铃期(7 月23 日)选取两套“三系”材料的倒三叶,使用打孔器进行取样,取样后立即放入液氮,用于后续ATP 和H2O2含量测定。
棉花花蕾: 前期研究发现,CMS-D2 不育系在花蕾长度为3 mm 左右时发生败育,而CMS-D8 不育系在花蕾长度为5 mm 左右时发生败育[18-19]。因此本研究在蕾期取D2A、D2B、D2R 3个材料2 mm、3 mm、4 mm (花蕾长度, 下同)花蕾,D8A、D8B、D8R 3 个材料2 mm、3 mm、4 mm、5 mm、6 mm 花蕾,取样后立即放入液氮,用于后续ATP 和H2O2含量测定以及RNA 提取。
拟南芥: 分别取野生型 (wild type,WT)和orf610a转基因植株(T2)的花蕾和角果,取样后立即放入液氮,用于后续ATP 和H2O2含量测定以及RNA 提取。
以上所有样品取样时均为3 株混样, 并取3次生物学重复。
1.2.3ATP 含量测定。 使用ATP 检测试剂盒(上海碧云天生物技术有限公司), 按照试剂盒说明书对样品进行处理,设3 次技术重复;使用BioTek Synergy HT 多功能酶标仪测定荧光读数,设定读数时间为10 s。 ATP 浓度的标准曲线由已知量(1 nmol~1 μmol)测定后绘制而成,得出计算公式y=8 855.2x+98.677,其中y为酶标仪测定值相对光单位(relative light unit,RLU),x为ATP 含量(nmol),根据样品质量计算得出不同组织中ATP 相对含量(nmol·g-1)。
1.2.4H2O2 含量测定。 使用H2O2含量检测试剂盒(北京索莱宝科技有限公司),按照试剂盒说明书进行样品处理,并设3 次技术重复;取上清液使用BioTek Synergy HT 多功能酶标仪测定415 nm 处吸光值。 根据以下公式,计算得出H2O2含量(μmol·g-1)。
H2O2含量=驻A测定÷(驻A标准÷C标液)×V样本÷(V样本÷V提取×m)=2×驻A测定÷驻A标准÷m
其中 驻A测定=A测定管-A空白管;驻A标准=A标准管-A空白管;A:415 nm 处吸光值;C标液:H2O2标准溶液浓度,2 μmol·mL-1;V样本: 加入的样本体积,0.25 mL;V提取:提取过程中所用体积,1 mL;m:样品质量(g)。
1.2.5基因表达分析。 利用RNAprep Pure 植物总RNA 提取试剂盒(天根生化科技(北京)有限公司)提取CMS-D2 不育系及其保持系3 mm 花蕾的RNA,CMS-D8 不育系及其保持系5 mm 花蕾的RNA,野生型和orf610a转基因拟南芥花蕾的RNA。 检测后使用PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒(TaKaRa,北京)反转录合成第一链cDNA, 以此作为模板进行实时荧光定量PCR(quantitative real-time PCR, qRTPCR)。 荧光定量试剂为TransStartTop Green qPCR SuperMix (北京全式金生物技术有限公司)。 在NCBI 中设计引物,由铂尚生物技术(上海)有限公司合成(引物信息见表1)。 以GhHIS3基因作为棉花内参基因,AtACTIN2 作为拟南芥内参基因,在Mastercycler ep realplex 实时荧光定量PCR 仪(Eppendorf,德国)中进行qRT-PCR。其反应体系总体积为20 μL,设3 次重复,扩增程序:94 ℃预变性30 s;94℃变性5 s,55 ℃退火15 s,72 ℃延伸10 s,40 个循环。 利用2-ΔΔCt法计算目的基因的相对表达量。

表1 qRT-PCR 引物Table 1 Primers for qRT-PCR
1.2.6数据处理与统计分析。 利用Microsoft Excel 2016 对数据进行汇总分析, 用t检验法进行差异显著性分析, 利用GraphPad Prism 8 软件进行绘图。
2 结果与分析
2.1 CMS-D2 和CMS-D8 不同发育时期叶片中ATP 和H2O2 含量变化
随着棉花生育进程的推进,在CMS-D2 中,从苗期到铃期保持系和恢复系叶片中ATP 含量呈上升趋势,而不育系叶片中ATP 含量表现出先降低后升高趋势。 苗期保持系叶片中ATP 含量极显著高于恢复系;蕾期和铃期不育系叶片中ATP 含量极显著低于保持系和恢复系, 保持系叶片中ATP 含量极显著低于恢复系(图1A)。保持系和恢复系叶片中H2O2含量表现为在蕾期最低、铃期最高;不育系叶片中H2O2含量在铃期明显升高。 蕾期不育系叶片中H2O2含量极显著高于保持系和恢复系;铃期不育系叶片中H2O2含量极显著高于保持系和恢复系, 保持系和恢复系间差异极显著(图1B)。 以上结果表明,与其配套的保持系和恢复系相比, 在蕾期和铃期CMS-D2 不育系叶片中ATP 含量极显著降低,H2O2含量极显著升高。
在CMS-D8 中,从苗期到铃期,不育系叶片中ATP 含量呈上升趋势。 苗期不育系、保持系与恢复系叶片中的ATP 含量无显著差异, 蕾期不育系叶片的ATP 含量极显著低于保持系和恢复系, 铃期不育系叶片中ATP 含量极显著高于保持系和恢复系(图1C)。 从苗期到铃期,保持系和恢复系叶片中H2O2含量呈现先下降后上升的趋势, 而不育系叶片中H2O2含量持续升高。 在苗期, 不育系叶片中H2O2含量极显著低于保持系和恢复系; 蕾期不育系叶片中H2O2含量极显著高于保持系和恢复系, 保持系极显著高于恢复系; 铃期3 个材料叶片中H2O2含量无显著差异(图1D)。 以上结果表明,与其配套的保持系和恢复系相比, 蕾期CMS-D8 不育系叶片ATP 含量极显著降低、H2O2含量极显著升高, 铃期CMS-D8 不育系叶片中ATP 含量极显著升高。
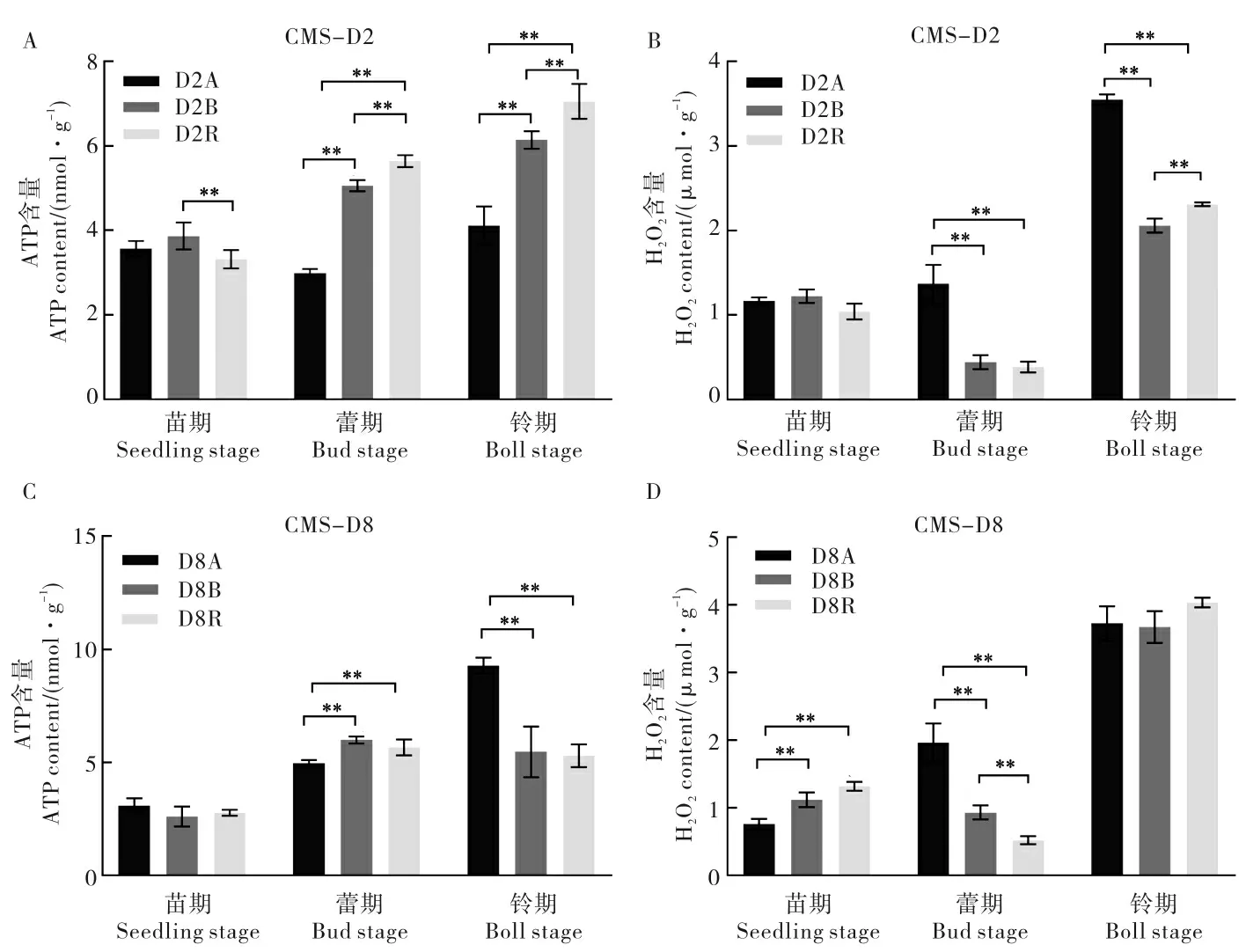
图1 CMS-D2 和CMS-D8 叶片中ATP 和H2O2 含量Fig. 1 ATP and H2O2 contents in the leaves of CMS-D2 and CMS-D8
对比两套“三系”材料叶片中的ATP 和H2O2含量可以发现,两种不育胞质对棉花叶片中ATP含量和H2O2含量产生了不同的影响。 尤其在铃期, 与其配套的保持系和恢复系相比,CMS-D2不育系叶片中ATP 含量极显著降低,H2O2含量极显著升高; 而CMS-D8 不育系叶片中ATP 含量极显著升高,H2O2含量无显著差异。
2.2 CMS-D2 和CMS-D8 花蕾中ATP 和H2O2含量变化
随着花药的发育,在CMS-D2 中,保持系和恢复系2 mm 和3 mm 花蕾中ATP 含量表现出明显上升趋势,在3 mm 到4 mm 花蕾中ATP 含量无明显差异; 不育系2 mm 到4 mm 花蕾中ATP 含量基本不变,均保持在较低水平。 保持系2 mm 花蕾中ATP 含量极显著高于恢复系;不育系3 mm 花蕾中ATP 含量极显著低于保持系和恢复系,恢复系极显著低于保持系;不育系4 mm花蕾中ATP 含量极显著低于保持系和恢复系(图2A)。 不育系和恢复系2 mm 花蕾中H2O2含量均极显著低于保持系;3 个材料3 mm 花蕾中的H2O2含量无显著差异;不育系4 mm 花蕾中H2O2含量极显著高于保持系和恢复系,保持系和恢复系之间差异不显著(图2B)。
在CMS-D8 中, 保持系和恢复系2 mm~6 mm 花蕾中ATP 含量逐渐上升; 而不育系在2 mm 到4 mm 花蕾中ATP 含量逐渐上升,在5 mm 到6 mm 花蕾中ATP 含量稳定。3 个材料在2 mm 和4 mm 花蕾中ATP 含量均无显著差异;恢复系3 mm 花蕾中ATP 含量极显著高于不育系和保持系; 不育系5 mm 和6 mm 花蕾中ATP 含量极显著低于保持系和恢复系,恢复系显著或极显著高于保持系(图2C)。3 个材料2 mm、3 mm、4 mm 花蕾中H2O2含量均无显著差异;保持系5 mm 花蕾中H2O2含量显著高于不育系、极显著高于恢复系;保持系6 mm 花蕾中H2O2含量显著高于不育系,不育系和恢复系之间差异不显著(图2D)。
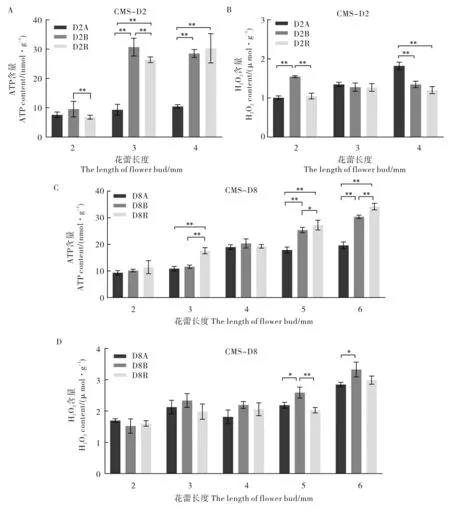
图2 CMS-D2 和CMS-D8 花蕾中ATP 和H2O2 含量Fig. 2 ATP and H2O2 contents in the flower buds of CMS-D2 and CMS-D8
对比两套“三系”材料花蕾中的ATP 和H2O2含量可以发现, 与其配套的保持系和恢复系相比,CMS-D2 不育系3 mm、4 mm 花蕾中ATP 含量极显著下降,4 mm 花蕾中H2O2含量极显著升高;而CMS-D8 不育系5 mm、6 mm 花蕾中ATP含量极显著降低,H2O2含量升高,但差异不显著。
2.3 orf610a 超表达拟南芥中ATP 和H2O2 含量
为进一步探究ATP 和H2O2含量与育性的关系。 将棉花候选不育基因orf610a在拟南芥植株中进行超表达, 测定其对ATP 和H2O2含量的影响。由图3A 可以看出,T2转基因拟南芥植株角果及花蕾中ATP 含量均极显著低于野生型, 约为野生型的57%。 转基因拟南芥植株角果和花蕾中H2O2含量极显著或显著高于野生型(图3B)。结合之前的研究结果[20],推测棉花orf610a基因影响拟南芥花蕾和角果中ATP 的含量以及H2O2水平,可能导致植株育性降低。

图3 orf610a 转基因拟南芥中ATP 和H2O2 含量Fig. 3 ATP and H2O2 contents in orf610a transgenic Arabidopsis
2.4 ATP 合成相关基因表达分析
在CMS-D2 不育系D2A 和保持系D2B 3 mm花蕾中:与氧化磷酸化代谢通路复合体Ⅰ组装相关的基因nad1、nad4、nad5、nad7在不育系中的表达量均极显著低于保持系(图4A~D);复合体Ⅲ组装相关基因cob在不育系中的表达量极显著高于保持系(图4E);复合体Ⅳ组装相关基因cox2在不育系中的表达量极显著高于保持系,cox3在不育系和保持系中的表达量无显著差异(图4F~G);复合体Ⅴ组装相关基因atp6在不育系中的表达量极显著低于保持系(图4H)。 说明CMS-D2 不育系中氧化磷酸化代谢通路部分复合体的组装可能受到了影响, 导致ATP 合成受阻。
在CMS-D8 不育系D8A 和保持系D8B 5 mm花蕾中: 复合体Ⅰ组装相关基因nad1、nad4、nad5、nad7,复合体Ⅲ组装相关基因cob,复合体Ⅳ组装相关基因cox2、cox3, 以及复合体Ⅴ组装相关基因atp6在不育系中的表达量均极显著低于保持系(图4I~P)。在CMS-D8 不育系中,氧化磷酸化代谢通路多个复合体的组装可能受到影响,最终导致ATP 合成受阻。
对比CMS-D2 和CMS-D8 不育系中ATP 合成相关基因的表达可以发现,两种不育胞质对氧化磷酸化代谢通路相关基因的影响不同,说明这两种胞质不育系花粉的败育可能具有不同的分子调控机制。
在野生型和orf610a转基因拟南芥T2花蕾中: 复合体I 组装相关基因nad4、nad6(图4Q~R),复合体Ⅲ组装相关基因cob(图4S),复合体Ⅳ组装相关基因cox2、cox3(图4T~U),以及复合体Ⅴ组装相关基因atp3、atp6(图4V~W)在转基因拟南芥花蕾中的表达量均极显著低于野生型,而atp9基因的表达量无显著差异(图4X)。
3 讨论
线粒体能量供应不足以及ROS 的产生与清除之间的不平衡是导致植物CMS 的关键因素[2,22-23]。ROS 主要来源于线粒体,高浓度的ROS会改变细胞的抗氧化状态,导致PCD[24-25]。花药发育过程需要大量的能量,能量供应不足可能直接导致花药发育异常进而导致花粉败育。 前人在水稻CMS-HL[22]、油菜CMS-Nsa[26]和玉米CMS-S[3]不育系中发现花粉败育过程中花药ATP 含量降低,ROS 过度积累。本研究结果显示,与其保持系和恢复系相比,蕾期CMS-D2 和CMS-D8 不育系叶片中ATP 含量极显著降低、H2O2含量极显著升高(图1);并且在花药发育过程中CMS-D2 不育系3 mm、4 mm 花蕾和CMS-D8 不育系5 mm、6 mm 花蕾中ATP 含量均极显著降低(图2),这与上述前人的研究结果较为一致。但CMS-D2 不育系中H2O2的异常积累发生在4 mm 花蕾中,这可能与CMS-D2 不育系中绒毡层的推迟降解有关[27]。 此 外,在CMS-D2 和CMS-D8 恢 复 系 中ATP 和H2O2含量均未出现这种变化 (图1,图2),这说明在恢复基因存在的情况下不育胞质对棉花叶片和花蕾中ATP 和H2O2含量的影响可能会被抑制。 之前的研究发现棉花orf610a基因在酵母细胞中过表达会抑制酵母的生长, 表现为ATP 含量的降低和ROS 的爆发。 在拟南芥中过表达融合线粒体定位信号的orf610a基因, 发现T2转基因阳性株系花丝变短、花粉量减少、育性降低[20]。 本研究发现orf610a在拟南芥中过表达会导致花蕾和角果中ATP 含量极显著降低、H2O2含量显著升高(图3),且与野生型相比,转基因拟南芥花蕾中大多数ATP 合成相关基因均极显著下调表达(图4Q-X)。 因此,导致CMS-D2 和CMS-D8不育系花粉败育的原因可能是花药发育所需的能量得不到满足,以及ROS 导致的异常PCD。
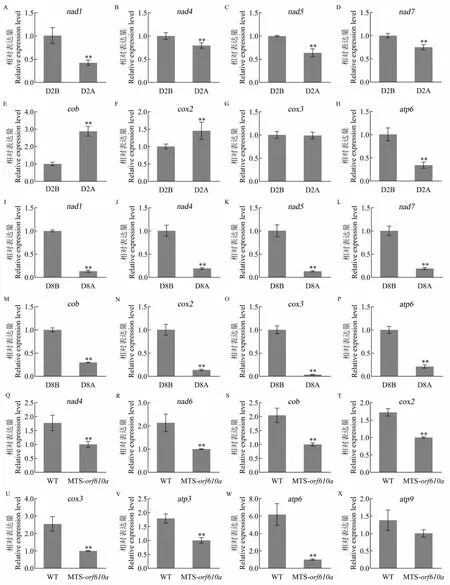
图4 ATP 合成相关基因的表达分析Fig. 4 Expression analysis of ATP synthesis related genes
发生在植物线粒体内膜上的氧化磷酸化对于细胞能量产生至关重要, 涉及ATP 合成和电子传递,是植物生长发育所必须的[28]。线粒体内膜氧化磷酸化代谢通路系统由5 个复合体(复合体Ⅰ~Ⅴ)组成,在呼吸过程中复合体Ⅰ~Ⅳ可以把电子转移到分子氧中结合生成水,同时将质子(H+)泵入线粒体膜间隙中,为ADP 结合无机磷酸盐合成ATP 提供动力, 该过程中复合体Ⅰ和复合体Ⅲ功能异常会导致电子泄露, 加速ROS的生成[29-31]。 本研究结果显示,与保持系相比,CMS-D2 不育系3 mm 花蕾中复合体Ⅰ组装相关基因均极显著下调表达,可能是复合体Ⅰ组装受损,导致电子传递异常;而复合体Ⅲ组装相关基因极显著上调表达,可能与CMS-D2 不育系花蕾中ROS 的爆发有关。CMS-D8 不育系5 mm 花蕾中复合体Ⅰ、Ⅲ、Ⅳ、Ⅴ组装相关基因的表达均极显著低于保持系,可能在CMS-D8 不育系中这4个复合体的组装均出现异常, 导致ATP 合成受阻,致使花蕾中ATP 含量降低,能量供应不足,最终导致花粉败育。
本研究发现, 相较于其保持系和恢复系,CMS-D2 不育系3 mm、4 mm 花蕾中ATP 含量极显著降低,4 mm 花蕾中H2O2极显著升高;CMS-D8 不育系5 mm、6 mm 花蕾中ATP 含量极显著降低,但未见H2O2含量升高(图2)。 说明CMS-D2 不育系的败育时期 (花蕾长度为3 mm时)可能早于CMS-D8 不育系(花蕾长度为5 mm时), 这与前人通过细胞学观察发现的败育时期较为一致[18-19]。CMS-D8 不育系铃期叶片中ATP 含量异常升高、H2O2含量无显著变化;但铃期孢子体不育的CMS-D2 不育系叶片中ATP 含量极显著降低、H2O2含量极显著升高,这与CMS-D8 不育系不同,导致这一现象的内在机制有待进一步研究。
4 结论
CMS-D2 和CMS-D8 不育胞质对不同发育时期的叶片和花蕾中ATP 和H2O2含量均有一定的影响, 两种胞质不育系花粉败育主要与ATP合成与H2O2产生之间的不平衡有关。orf610a转基因拟南芥角果和花蕾中ATP 含量极显著降低、H2O2显著升高,且花蕾中大多数ATP 合成相关基因的表达量极显著下降。 本研究通过系统比较两套棉花“三系”材料及orf610a超表达拟南芥中ATP 和H2O2含量及ATP 合成相关基因的表达, 从生理指标和分子水平上明确了棉花CMS-D2 和CMS-D8 胞质不育系的败育时期,为深入揭示两种胞质不育系花粉败育的调控机制提供了思路。
