钴掺杂二氧化铈基层状复合固态电解质的制备及其性能
2023-01-06高清雯杨智昊李文鹏武文佳王景涛
高清雯,杨智昊,李文鹏,武文佳,王景涛
(郑州大学化工学院,河南 郑州 450001)
全固态锂金属电池(ASSLMB)因其高安全性、高能量密度和可快速充放电等特点而受到了广泛关注。固态电解质(SSE)是全固态锂金属电池的重要组成部分。目前已开发的固态电解质主要分为两种:聚合物固态电解质(SPE)和无机固态电解质(ISE)。聚合物固态电解质具有柔韧性强、电化学窗口宽、与电极界面接触良好等优势而被人们广泛研究。其中,聚氧化乙烯(PEO)基固态电解质还具有易加工、稳定性好等优点,被认为是最具商业化前景的固态电解质材料[1]。然而,在室温下,PEO聚合物电解质具有高的结晶度,导致其离子电导率较低(10-8~10-6S/cm),严重限制了其在ASSLMB中的应用[2]。相较聚合物电解质,无机固态电解质具有高的室温离子传导率、良好的化学稳定性和热稳定性。但其较大的脆性以及与正负极接触较差等缺点限制了其在ASSLMB中的应用[3]。
结合聚合物固态电解质和无机固态电解质的优势,开发复合固态电解质(CSE),被认为是制备综合性能优异的固态电解质的有效策略[4]。无机填料的加入能够有效降低聚合物的结晶度,提高聚合物链段运动能力,从而提高复合电解质的离子电导率。但随着无机填料填充量的增加,离子电导率通常会先增大后降低。Wang 等[5]研究了Li1.3Al0.3Ti1.7(PO4)3(LATP)添加量对PEO(LiClO4)-LATP 复合电解质离子电导率的影响,发现当LATP 添加量为15%时,复合电解质离子电导率最高,为2.63×10-6S/cm。分析发现,这是由于无机填料填充量过高时易发生团聚,导致电解质的离子电导率降低,同时电解质的机械强度也会显著降低。虽然可以通过增大电解质的厚度来优化机械强度,但这又将导致复合电解质的内部电阻增大,倍率性能下降[6]。因此,制备薄型高离子传导率和高机械稳定性的复合电解质仍然具有很大挑战。
近年来,由二维纳米片组装成的层状膜因具有薄的厚度、优异的力学性能和规整的膜结构等优势,在离子/分子选择性分离领域展现出了广阔的应用前景[7-9]。二维纳米片堆积形成的纳米通道,为离子/分子快速传输提供了一个连续的渗透网络,并且二维层状膜薄的厚度能够有效降低传输阻力。例如,Jin 等[10]制备了厚度仅为60 nm 的MXene 层状膜,获得了85.4 L/(m2·h)的水通量和99.5%的高氯化钠(NaCl)截留率,超过了目前的大多数纳滤膜。这种超高的传递分离性能主要是由于离子传输距离短以及膜结构致密无缺陷。因此开发层状结构的固态电解质可能是制备薄型高离子传导率和高机械稳定性的复合固态电解质的有效策略。前期,Zhai等[11]通过真空抽滤蛭石(Vr)纳米片实现层状堆叠结构,然后通过溶胀和过滤将PEO-锂盐(LiTFSI)嵌入Vr纳米片层间制得厚度为10 μm的Vr/PEO层状复合固态电解质,形成了大量的有机-无机界面,提高了离子电导率。室温下(25 ℃),电解质离子传导率达到1.22×10-5S/cm,抗压强度达到131 MPa。
本文通过一种热分解剥离法,利用钴盐作为掺杂剂,将层层堆叠的CeCO3OH块状材料剥离成二维钴掺杂的二氧化铈(Co2+@CeO2)纳米片。后将得到的Co2+@CeO2纳米片与PEO 进行混合,通过真空抽滤制备Co2+@CeO2层状复合固态电解质(L-CSE)。Co2+@CeO2纳米片富含的氧空位作为Lewis酸性基团,在界面处促进了LiTFSI解离,产生更多的自由Li+,因此L-CSE 具有更高的离子电导率(5.81×10-5S/cm,30 ℃)和锂离子迁移数(0.59,60 ℃),同时用L-CSE 组装的LFP||Li 电池具有优异的循环性能,在60 ℃、0.5 C倍率下循环200圈容量保持率达到83.6%。
1 实验部分
1.1 Co2+@CeO2纳米片的合成
以泡沫铜作为基板,将泡沫铜用丙酮、水、乙醇依次超声清洗15 min。再将0.5 mmol 四水合乙酸钴、1.5 mmol 六水合硝酸铈、125 mg 六亚甲基四胺分散在7 mL乙醇和6.5 mL乙二醇的混合溶剂中,搅拌0.5 h 后得到前体溶液[12]。将前体溶液转移到聚四氟乙烯内衬的不锈钢反应釜中,在170 ℃下加热8 h 后,自然冷却至室温。随后用乙醇超声冲洗泡沫铜和反应釜,将冲洗液离心3次,自然晾干后得到前体粉末。最后,将前体粉末在400 ℃空气气氛下煅烧4 h,冷却后得到富含氧空位的0.33Co2+@CeO2。将0.33Co2+@CeO2分散在乙腈中超声2 h后离心,上清液即是0.33Co2+@CeO2纳米片分散液,测得纳米片分散液的浓度为0.5 g/L。通过改变钴盐的含量,可以制备出不同钴掺杂量的纳米片,分别命名为CeO2、0.16Co2+@CeO2、0.33Co2+@CeO2、0.66Co2+@CeO2。
1.2 固态电解质的制备
首先,将0.5 g 的PEO(分子量为600000)和锂盐(LiTFSI)以摩尔比Li∶EO=1∶22 的比例加入到100 mL 乙腈溶液中混合搅拌形成均质溶液。接着取出5 mL该均质溶液与100 mL纳米片悬浮液混合搅拌6 h 获得混合溶液。最后,将混合溶液在阳极氧化铝载体上过滤后干燥得到层状复合固态电解质,并将填充0.33Co2+@CeO2纳米片的层状复合固态电解质命名为L-CSE。将PEO/LiTFSI 空白聚合物电解质命名为SPE。将分散均匀的0.33Co2+@CeO2乙腈溶液与PEO、LITFSI 和乙腈形成的均质溶液混合搅拌均匀后浇铸在聚四氟乙烯板上,干燥后得到0.33Co2+@CeO2/PEO/LiTFSI 复合电解质,其中0.33Co2+@CeO2纳米片的填充量为10%时,电解质的综合性能最好,将0.33Co2+@CeO2(质量分数10%)/PEO/LiTFSI 复合电解质命名为CSE。以上所有操作均在手套箱中进行。
1.3 样品结构和形貌表征
本实验采用Rigaku D/Max 2500v/Pc 型X 射线衍射分析仪(XRD)对样品的晶体结构进行分析,以Cu Kα为辐射源在室温下进行测试,扫描范围为3°~70°,扫描速率为2(°)/min。采用Talos F200S型透射电子显微镜(TEM)对样品的微观形貌进行表征,工作电压为100 kV。采用德国Bruker 公司生产的Dimension FastScan 型原子力显微镜(AFM)测量纳米片厚度。采用Xmax,Oxford Instruments型能量色散光谱仪(EDS)分析样品中元素的分布状态。采用Nicolet MAGNA-IR560 型傅里叶变换红外光谱(FTIR)来分析样品的化学结构。采用Q100,TA Instruments 型差示扫描量热仪(DSC)测试样品的玻璃化转变温度、熔融焓。采用AXIS Supra 型X 射线光电子能谱(XPS)分析样品的化学元素组成和价态变化。采用型号为TGA-50SHIMADZU的热重分析仪(TG)分析样品热性能,氮气为保护气,升温速率为10 ℃/min。
1.4 力学性能测试
本实验采用安捷伦Nano Indenter G200 和CMT6104 仪器进行纳米压痕测试,测试最大压力为3 mN。
1.5 电池组装
采用CR2032型电池壳组装扣式电池,锂箔直径为16 mm,固态电解质直径为18 mm。以不锈钢垫片(SS)作为阻塞电极,组装SS|固态电解质|SS电池,测试固态电解质的离子传导率;以锂箔作为电极,组装Li|固态电解质|Li 对称电池,进行电解质锂离子迁移数和稳定性测试。
将磷酸铁锂(LFP)、聚偏氟乙烯和导电炭黑以质量比为8∶1∶1的比例加入N-甲基吡咯烷酮中充分搅拌6 h 后制成均匀的正极浆料。采用刮涂法将浆料涂覆到铝箔上,置于110 ℃的真空烘箱中干燥48 h,将其裁剪为直径为12 mm 的圆片,其中活性物质负载量约为1.1 mg/cm2。以LFP为正极,锂箔为负极,将正极壳-磷酸铁锂正极依次叠放,并在正极上滴加了2 μL的电解液(1.2 mol/L六氟磷酸锂/碳酸乙烯酯+碳酸丙烯酯+碳酸甲乙酯+碳酸亚乙烯酯),随后依次叠放固态电解质、锂负极、垫片、弹片以及负极壳,组装成LFP|固态电解质|Li 电池进行电池循环性能以及倍率性能测试。上述电池组装过程均在充满氩气的手套箱内进行。
1.6 电化学测试
采用武汉蓝电电池测试系统(CT2001A)进行电池的恒电流充放电测试。分别对固态电池的循环性能和倍率性能进行测试。电压为2.5~4.0 V,测试温度为60 ℃。采用上海辰华电化学工作站(CHI660E)用于测量固态电解质的离子电导率和锂离子迁移数。测试离子电导率的频率范围为0.1~105Hz,温度范围为30~90 ℃。通过式(1)计算电解质的离子电导率。测试锂离子迁移数时,测试电池始态和极化后的界面阻抗,频率范围为0.1~105Hz,测试温度为60 ℃。使用计时电流法测试初始电流和稳定后的极化电流,外加电压为10 mV,扫描时间为8000 s。通过式(2)计算锂离子迁移数

式中,σ为离子电导率,S/cm;L为SPE的厚度,cm;R为SPE的总阻抗,Ω;S为电解质与电极的接触面积,cm2。

式中,ΔV为外加电压10 mV;I0和IS分别为直流极化过程中的初始电流和稳态电流,A;R0和RS分别为锂对称电池直流前后的电极电阻极化,Ω。
采用郑州世瑞思电化学工作站(RST5200F)进行直流极化曲线的测试,测试温度为25 ℃,施加直流偏压为0.1 V,扫描时间为2000 s,取稳定后的极化电流平均值作为稳态电流。根据式(3)计算电解质的电子电阻,进而通过式(1)计算电子电导率

式中,R为电子电阻,Ω;U为直流极化过程中的外加偏压,V;I为稳态电流,A。
2 结果与讨论
2.1 Co2+@CeO2纳米片的制备
图1(a)为前体CeCO3OH和0.33Co2+@CeO2纳米片的XRD图谱以及对应的标准卡片。图中显示,前体的XRD 图谱与CeCO3OH 标准卡片(JCPDF No.41-0013)相符,经过煅烧后的0.33Co2+@CeO2的XRD 图谱符合萤石结构的氧化铈标准卡片(JCPDF No. 34-0394),证明了CeCO3OH 前体粉末和0.33Co2+@CeO2粉末的成功制备。进一步采用FTIR 图谱分析前体粉末CeCO3OH 煅烧前后的化学组成。如图1(b)所示,煅烧后得到的0.33Co2+@CeO2羟基峰强度明显减弱,说明OH-基团显著减少,且在1441 cm-1处没有出现CO2-3的特征峰,说明CeCO3OH经过煅烧后,CO2-3基团消失。
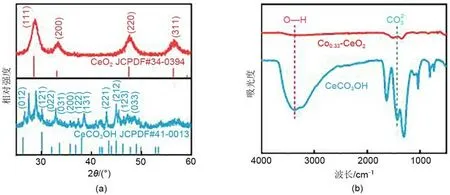
图1 (a)前体和0.33Co2+@CeO2的XRD谱图以及对应的PDF标准卡片;(b)前体和0.33Co2+@CeO2的红外光谱Fig.1 (a)XRD patterns of the precursor and 0.33Co2+@CeO2 and the corresponding PDF standard card;(b)FTIR spectra of the precursor and 0.33Co2+@CeO2
图2(a)、(b)分别为前体CeCO3OH 和0.33Co2+@CeO2的SEM 图像。从SEM 图像能够看出前体CeCO3OH 为多个纳米片形成的纳米花结构。经过煅烧后得到的0.33Co2+@CeO2粉末的纳米花结构更加松散[图2(b)]。进一步地将0.33Co2+@CeO2粉末进行超声剥离得到单层0.33Co2+@CeO2纳米片。如图2(c)中AFM图像所示,纳米片横向尺寸约1 μm,厚度约4.4 nm。采用EDS 元素分析纳米片中元素的分布状态,如图2(d)所示,Ce和Co元素在纳米片上均匀分布,证明Co被成功引入CeO2纳米片。

图2 (a)前体的SEM图像;钴掺杂CeO2的(b)SEM和(c)AFM图像;(d)剥离的Co2+@CeO2纳米片的SEM图像以及对应的Ce、Co的EDS图谱Fig.2 (a)SEM image of precursor;(b)SEM and(c)AFM image of cobalt-doped cerium oxide;(d)SEM image of exfoliated Co2+@CeO2 nanosheets and corresponding EDS elemental mappings of Ce and Co
2.2 Co掺杂量对纳米片氧空位含量的影响
Co元素的掺杂量不同会造成CeO2纳米片上氧空位含量的不同,可通过Ce 3d XPS半定量计算峰面积来判断Ce3+离子浓度,从而计算出CeO2纳米片上氧空位的含量[13-14]。图3 XPS图谱中α、α'、β、β'代表Ce3+的特征峰,u、u'、u"、v、v'、v"代表Ce4+的特征峰。氧空位含量计算公式(4)~(5)如下
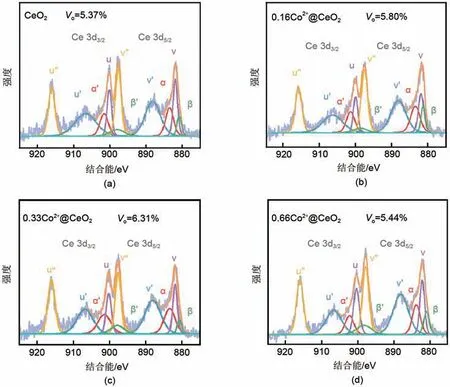
图3 不同钴元素掺杂量的CeO2的Ce 3d XPS谱图Fig.3 Ce 3d XPS spectra of CeO2 with different cobalt doping levels
根据公式计算得到未掺杂Co的CeO2纳米片中氧空位含量为5.37%,加入不同含量的钴盐所制得的0.16Co2+@CeO2、0.33Co2+@CeO2、0.66Co2+@CeO2纳米片的氧空位含量分别为5.80%、6.31%、5.44%,均高于CeO2纳米片,其中0.33Co2+@CeO2纳米片上的氧空位含量最多。同时,氧空位作为Lewis 酸性位点赋予CeO2纳米片正电荷性质。图4 为所测得的纳米片Zeta电位。CeO2、0.16Co2+@CeO2、0.33Co2+@CeO2、0.66Co2+@CeO2纳米片的Zeta 电位分别为5.3 mV、7.2 mV、9.4 mV、5.7 mV[15-16],表明纳米片的Zeta电位随着氧空位含量的增加而增大,证明富含氧空位的CeO2纳米片成功制备。
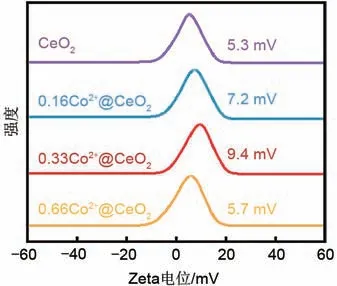
图4 不同钴掺杂量的CeO2的Zeta电位谱图Fig.4 Zeta potential spectra of CeO2 with different cobalt doping levels
2.3 电解质结构与形貌表征
图5(a)为SPE、0.33Co2+@CeO2纳米片和L-CSE 的XRD 图谱。能够看出,SPE在19°和23°处出现了明显的PEO 结晶峰,说明SPE 中存在较强的PEO 结晶区。L-CSE 谱线中的特征峰和0.33Co2+@CeO2纳米片中特征峰吻合,说明L-CSE 中0.33Co2+@CeO2纳米片结构完整,且LCSE 谱线中10°~20°之间只有聚合物无定形态的馒头峰,证明纳米片-聚合物层层有序堆叠结构阻碍了PEO 的结晶行为。图5(b)的红外谱图表明,与SPE 相比,L-CSE 在1335 cm-1和1204 cm-1处峰强明显减弱,对应更多TFSI-的产生。这是因为0.33Co2+@CeO2纳米片表面富含氧空位,氧空位作为Lewis 酸性位点与LiTFSI 中的阴离子TFSI-发生Lewis酸碱作用,促进了LiTFSI解离,产生更多自由TFSI-[17]。图5(c)显示,加入纳米片后,TFSI-中—CF3基团的不对称伸缩振动峰从1200 cm-1偏移至1197 cm-1,这种明显偏移证实了0.33Co2+@CeO2纳米片与—CF3基团间的相互作用,促进了LiTFSI的有效解离[18],产生更多的自由Li+,构建自由Li+的传递通道。
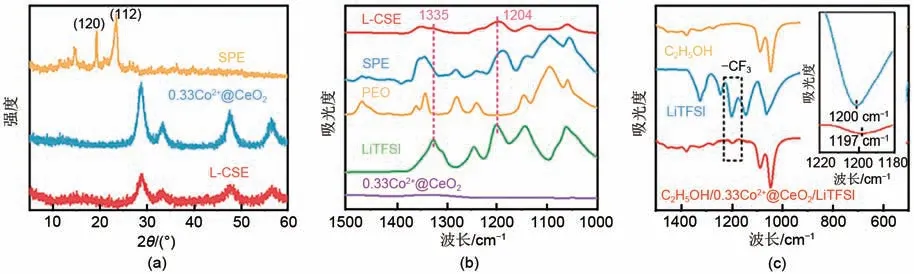
图5 (a)SPE、L-CSE和0.33Co2+@CeO2的XRD谱图;(b)L-CSE、SPE、PEO、LiTFSI和0.33Co2+@CeO2的红外光谱;(c)乙醇、LiTFSI与由0.33Co2+@CeO2、LiTFSI、乙醇组成的分散液的红外光谱Fig.5 (a)XRD patterns of SPE,L-CSE and 0.33Co2+@CeO2;(b)FTIR spectra of L-CSE,SPE,PEO,LiTFSI,and 0.33Co2+@CeO2;(c)FTIR spectra of ethanol,LiTFSI and dispersions composed of 0.33Co2+@CeO2,LiTFSI and ethanol
将Co2+@CeO2纳米片与PEO 混合后真空抽滤制备得到L-CSE,采用SEM 图谱观察固态电解质L-CSE 断面微观结构。图6(a)为未加入PEO 的Co2+@CeO2纳米片层状框架断面SEM 图片,可以看出纳米片堆叠混乱,成膜性比较差。图6(b)为加入PEO 后L-CSE 的断面结构图,所制备的L-CSE厚度约32 μm,相较于纳米片框架,加入聚合物PEO 后,电解质膜更为致密有序且具有良好的成膜性。值得注意的是,L-CSE电解质膜有序性的增加应得益于聚合物在纳米片层间的黏结作用。图6(c)为L-CSE 的EDS 图谱,能够看出S 和N 元素在整个断面均匀分布,这也说明了锂盐在L-CSE中均匀分布。

图6 (a)纳米片框架的断面SEM图像;(b)层状复合电解质的断面SEM图像以及(c)S、N元素的EDS图谱Fig.6 (a)Cross-section SEM image of the nanosheets framework;(b)Cross-section SEM image of the of the laminar composite electrolyte and(c)the EDS spectrum of S and N elements
2.4 热稳定性测试
采用热重测试来分析L-CSE 中的PEO 和0.33Co2+@CeO2纳米片的含量,如图7所示,在室温到800 ℃温度范围内,0.33Co2+@CeO2纳米片几乎没有质量损失,L-CSE 质量损失率为21.0%,PEO 质量损失率达到94.6%,忽略锂盐对PEO 体积的影响,计算得到L-CSE 中的PEO 和0.33Co2+@CeO2纳米片含量分别为22.2%和77.8%。其中,PEO 作为黏结剂确保了复合固态电解质的柔韧性以及电极-电解质界面处的紧密接触,对L-CSE 进行弯折后也没有出现破损。
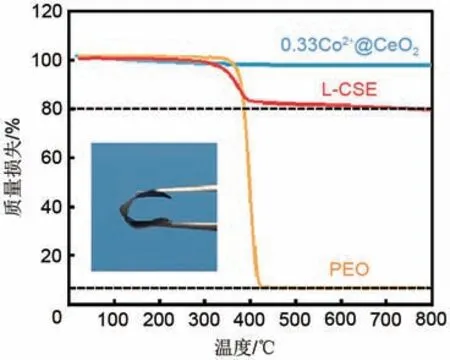
图7 PEO、0.33Co2+@CeO2纳米片和L-CSE的热重曲线Fig.7 (a)TGA curves of PEO、0.33Co2+@CeO2 nanosheets and L-CSE
2.5 力学性能测试
采用纳米压痕模拟锂枝晶对L-CSE进行力学性能测试,如图8 所示,L-CSE 的弹性模量达到1.147 GPa,硬度达到0.077 GPa。与SPE 相比,弹性模量和硬度分别提升了9 倍和4 倍。这主要是因为L-CSE中纳米片高机械强度以及层层堆叠结构带来了强的锂枝晶抑制能力。L-CSE强的力学性能有利于实现电池长循环性能和安全性能[19-21]。
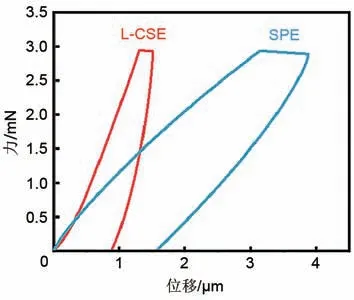
图8 SPE和L-CSE的纳米压痕测试的负载-位移曲线Fig.8 Load-displacement curve of nanoindentationtest of SPE and L-CSE
2.6 电化学性能测试
图9(a)、(b)分别为SPE和L-CSE在30~90 ℃下的阻抗图谱,图9(c)为对应的离子电导率,在30 ℃时,SPE 的离子电导率为1.86×10-6S/cm,而L-CSE的离子电导率达到了5.81×10-5S/cm,是SPE 的31 倍,这主要是因为0.33Co2+@CeO2纳米片表面丰富的氧空位促进了LiTFSI的解离,产生更多自由的Li+,同时,L-CSE的层状结构提供了大量的有机-无机界面,提供了连续的Li+传输路径,提升了离子电导率[11]。图9(d)中随着Co 含量的增多,氧空位含量Vo增多,促进了锂离子传递,证明氧空位能够有效提高L-CSE离子电导率。其原因主要是氧空位作为Lewis酸性基团,在界面处促进了LiTFSI解离,产生了更多的自由Li+,形成了富含Li+的界面传输通道。图9(e)、(f)分别为0.33Co2+@CeO2纳米片和L-CSE的直流极化曲线,计算得到电子电导率分别为5.80×10-8S/cm、8.82×10-10S/cm。
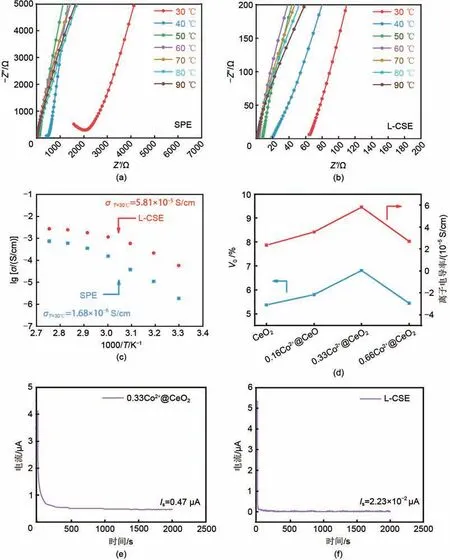
图9 (a)SPE(b)L-CSE电解质在30~90 ℃下的阻抗图谱(c)SPE和L-CSE的阿累尼乌斯谱图;(d)不同纳米片所制备的层状复合电解质的离子电导率;(e)0.33Co2+@CeO2纳米片和(f)L-CSE的直流极化曲线Fig.9 The impedance spectra of(a)SPE(b)L-CSE electrolytes at temperature range of 30 ℃to 90 ℃;(c)Arrhenius plots of SPE and L-CSE;(d)Ionic conductivity of laminar composite electrolyte prepared by different nanosheets;DC polarization curves of(e)0.33Co2+@CeO2 framework and(f)L-CSE
为了探究层状复合固态电解质有序结构的优势,制备了0.33Co2+@CeO2纳米片无序分布的复合电解质(CSE)。L-CSE 和CSE 的离子传导率如图10 所示,30 ℃下,CSE 离子电导率为4.26×10-5S/cm,低于L-CSE(5.81×10-5S/cm)。这是由于富含氧空位0.33Co2+@CeO2纳米片显著促进了锂离子的传递,在CSE 中,0.33Co2+@CeO2纳米片无序堆叠,填充量过多会在PEO中发生团聚,影响离子电导率,而在层状复合电解质中,0.33Co2+@CeO2纳米片负载量达到77.8%,构建了纳米片与聚合物层层堆叠的有序结构,形成了连续的Li+传输通道,离子电导率比CSE高36%。
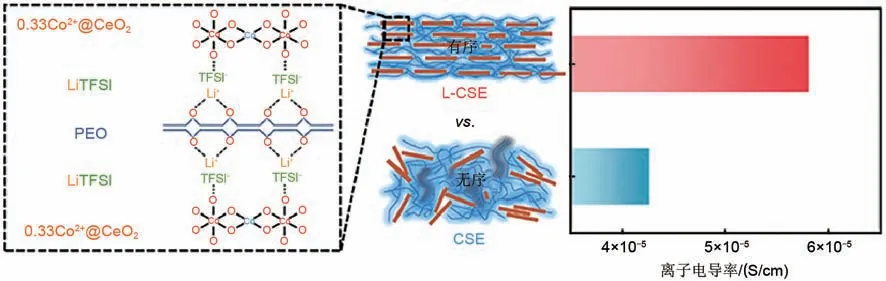
图10 层状复合固态电解质L-CSE与复合电解质CSE的离子电导率Fig.10 Ionic conductivity of laminar composite electrolyte and conventional composite electrolyte
锂离子迁移数反映了锂离子在电解质中的迁移速率,高的tLi+可有效降低电解质内部浓差极化,实现电池在大电流密度下稳定循环。图11(a)、(b)分别为60 ℃下SPE和L-CSE组装的锂对称电池的计时电流谱图和交流阻抗谱图,计算得到SPE 的tLi+为0.22,而L-CSE 的tLi+高达0.59。这主要是由于0.33Co2+@CeO2表面含有大量氧空位能够促进LiTFSI 解离,产生大量自由的Li+,构建了快速Li+传递通道,从而tLi+增大。
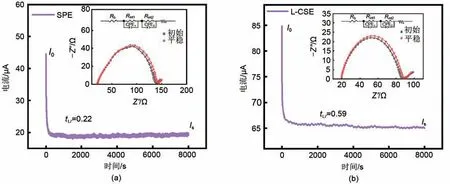
图11 (a)SPE和(b)L-CSE组装的锂对称电池的计时电流谱图和交流阻抗谱图Fig.11 Chronoamperometry profiles and AC impedance spectra of symmetric Li/Li cells assembled by(a)SPE and(b)L-CSE
图12(a)为Li|L-CSE|Li和Li|SPE|Li对称电池在60 ℃下的循环稳定性测试。能够看出,随电流密度增加,SPE和L-CSE所组装的锂对称电池过电位均增大。电流密度为0.35 mA/cm2时,SPE组装的锂对称电池电压平台下降,这是由于高电流密度下Li+沉积不均匀,造成锂枝晶快速生长刺破了电解质,造成电池局部短路[22]。相对而言,L-CSE组装的锂对称电池在高达0.7 mA/cm2的电流密度下电压平台仍保持稳定,证明了L-CSE 界面稳定性更好。图12(b)所示为SPE、L-CSE 组装的锂对称电池在0.05 mA/cm2、0.1 mA/cm2、0.2 mA/cm2电流密度下的循环曲线。SPE组装的锂对称电池在循环180 h时出现了明显的电压波动,在270 h 时完全短路。图12(c)中SEM图像为对应循环后锂负极表面形貌,可观察到明显的苔藓状锂枝晶。相比之下,L-CSE组装的锂对称电池循环400 h后仍保持稳定,循环后的锂负极表面平滑[图12(d)]。证明了L-CSE能够有效抑制锂枝晶生长,促进电池长时间稳定循环。
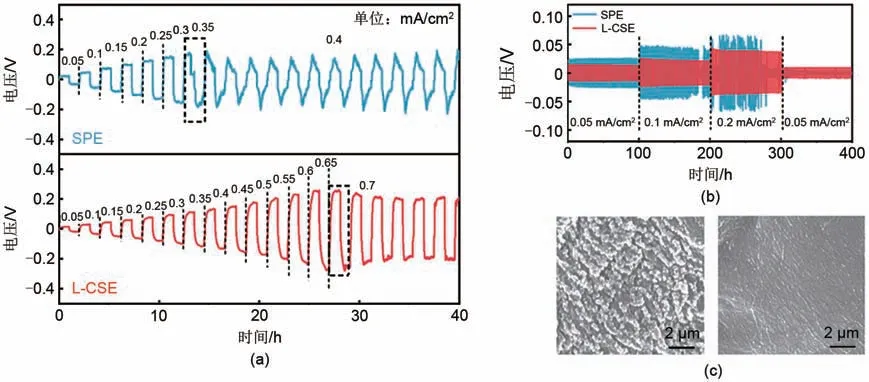
图12 (a)SPE和L-CSE组装的锂对称电池增加电流密度充放电1 h的循环性能谱图;(b)SPE和L-CSE组装的锂对称电池不同电流密度下充放电30 min的循环性能谱图;(c)测试后对应的锂金属电极表面的SEM图像Fig.12 (a)Galvanostatic cycling performance of lithium symmetric cells with SPE and L-CSE under increased current density and the charge/discharge duration of 1 h;(b)Galvanostatic cycling performance of lithium symmetric cells with SPE and L-CSE under different current density and the charge/discharge duration of 30 min;(c)The corresponding SEM images of Li electrode surface after cycling
图13为L-CSE组装的LFP||Li电池的循环性能和倍率性能。如图13(a)所示,在60 ℃、0.5 C下循环200圈后,LFP|L-CSE|Li电池展示了良好的循环稳定性,容量为133.9 mAh/g,容量保持率为83.6%。而LFP|SPE|Li 在循环160 圈后容量快速衰减。对比150 次循环时LFP|SPE|Li 和LFP|LCSE|Li的极化电压分别为0.26 V和0.19 V,也说明L-CSE具有较强的电化学稳定性[图13(b)]。图13(c)倍率曲线中,LFP|L-CSE|Li在0.5 C、1.0 C、1.5 C、2.0 C倍率下分别实现了155.1 mAh/g、145.5 mAh/g、131.4 mAh/g、120.7 mAh/g的可逆放电容量。当电流密度回到0.5 C时,LFP|L-CSE|Li放电容量恢复到155.0 mAh/g,表明了LFP|L-CSE|Li具有良好的倍率性能。

图13 SPE和L-CSE组装的LFP/Li电池的(a)循环性能、(b)不同次循环的充放电曲线、(c)倍率性能以及(d)不同倍率下的初始充放电曲线Fig.13 (a)The cycling performance,(b)charge/discharge curves at various cycles,(c)rate performance and(d)initial charge/discharge curves at various rates of SPE and L-CSE assembled LFP/Li cells
3 结论
通过一种热分解剥离法,利用钴盐作为掺杂剂,将层层堆叠的CeCO3OH块状材料剥离成二维Co2+@CeO2纳米片,随后将得到的Co2+@CeO2纳米片与PEO 进行混合,通过真空抽滤法制备了厚度为32 μm的层状复合固态电解质。研究表明,所制得的L-CSE具有优异的力学性能,其弹性模量达到1.147 GPa,硬度达到0.077 GPa,分别比PEO电解质提升9 倍和4 倍。同时,氧空位的存在促进了LiTFSI 的解离,产生了更多的自由Li+,形成了富Li+界面传输通道。30 ℃下,L-CSE的离子电导率高达5.81×10-5S/cm,比PEO 电解质提高了30 倍;所组装的锂对称电池,在高达0.7 mA/cm2电流密度下电压平台仍能稳定循环40 h。并且,组装的LFP||Li 电池具有良好的循环和倍率性能,在0.5 C、60 ℃下,经200次循环后,电池容量仍能达到120.7 mAh/g,容量保持率为83.6%。这种制备L-CSE的方法可能会为制备薄型高性能固态电解质提供新的思路。
