胞质3-磷酸甘油醛脱氢酶在ABA与H2O2介导的氧化应激中的潜在作用
2023-01-06罗娅,杨敏,葛聪
罗 娅,杨 敏,葛 聪
(1.四川农业大学园艺学院,成都 611130;2.电子科技大学成都学院商学院,成都 611731)
胞质3-磷酸甘油醛脱氢酶(cytosolic glyceralde‐hyde-3-phosphate dehydrogenase,GAPC)是一类极易受到氧化还原修饰的蛋白质[1],基于这个特性,该蛋白质功能往往受到细胞内的氧化还原态势所影响。植物细胞经有氧代谢产生副产物活性氧(reac‐tive oxygen species,ROS),最常见的是过氧化氢(hy‐d rogen peroxide,H2O2)、超氧阴离子(superoxide an‐ion,O2-·)和羟基自由基(hydroxyl radical,OH-)[2]。通常活性氧的生成和降解由细胞精细调控,使其保持极低的稳态活性氧浓度(<10-8M)。然而,干旱、盐、冷和热等各种非生物胁迫破坏细胞的代谢平衡,导致植物中ROS产生过多,从而造成氧化应激影响植物生长发育[3]。
植物响应非生物胁迫信号转导主要通过ROS信号转导、Ca2+信号转导和蛋白质磷酸化[4]。脱落酸(Abscisic acid,ABA)是植物调控非生物胁迫响应中的重要植物激素,调节H2O2的产生,影响细胞质内Ca2+浓度,在氧化应激的调控中担任信号转导的角色。ABA的核心信号通路主要通过蔗糖非依赖蛋白激酶 2(sucrose non-fermenting 1-related protein kinase 2,SNRK2)的激活和磷酸化来调节基因表达、气孔关闭和植物生长发育等一系列的生理生化反应[5]。在ABA介导非生物胁迫调控中,通过SNRK2可以激活细胞膜上的还原烟酰胺腺嘌呤二核苷酸磷 酸(reduced nicotinamide adenine dinucleotide phosphoric acid,NADPH)氧化酶产生 ROS,导致H2O2进入植物细胞共同参与调节非生物胁迫[6]。近年研究发现,GAPC参与了植物H2O2依赖性信号转导的过程,通过“兼职”或以初生代谢方式的转变来响应氧化胁迫[7]。本文将对GAPC在ABA与H2O2介导氧化代谢及响应非生物胁迫的潜在功能作介绍。
1 GAPDH的结构特点与功能
1.1 GAPDH的结构特点
甘油醛-3-磷酸脱氢酶(glyceraldehydes-3-phosphate dehydrogenase,GAPDH)是糖代谢途径糖酵解和糖异生中的关键酶。因GAPDH高度保守,常被用作内参基因使用[8]。根据GAPDH的多种细胞定位,将GAPDH分为以下4类同工型:①GAPC,位于细胞质,特异地以NAD+为辅酶,磷酸化甘油醛-3-磷酸并氧化形成1,3-二磷酸甘油酸(1,3-Di‐phosphoglyceric acid,1,3-BPG);②NP-GAPDH,位于细胞质,被认为是催化糖酵解“旁路”反应的酶,直接将3-磷酸甘油醛氧化为3-磷酸甘油酸,同时生成 NADPH[9];③GAPA/B,位于叶绿体,以 NADP+为辅酶,将1,3-二磷酸甘油酸还原为甘油醛-3-磷酸,是卡尔文循环的关键酶,参与光合作用CO2的固定[10];④质体GAPDH(plastid glyceraldehyde-3-phos‐phate dehydrogenase,GAPCp),参与非绿色质体糖酵解能量的产生[11]。
所有GAPDH蛋白质的三维结构及氨基酸序列高度保守,且各种晶体结构中发现其活性位点也相对保守[12]。细菌/哺乳动物和酵母分别拥有1种GAPDH和3种GAPDH(GAPA、GAPB、GAPC),拟南芥有GAPA1、GAPA2、GAPB、GAPC1、GAPC2、GAPCp1和GAPCp2共7个不同的GAPDH[13]。其中GAPC还参与植物生长发育、细胞代谢及胁迫反应等生物过程[14]。
1.2 多功能的GAPC
近年研究发现,GAPC除糖酵解催化功能外[15],在介导植物的生物/非生物胁迫以及果实成熟调控中起重要作用[16-21]。S.P.Rius等[22]研究发现,拟南芥GAPC1的突变体通过调节植物体内碳通量使转基因拟南芥形成线粒体呼吸障碍,导致ATP合成减少,并受到氧化胁迫,造成植株矮小、结实率低且伴随着雄性不育;Li X.等[23]研究发现TaGAPCp1正响应小麦的干旱胁迫;Luo Y.等[21]发现草莓FaGAPC2作为一个负调控因子参与草莓果实成熟的调控。由此说明,细胞质GAPC是一个多功能蛋白[24]。
1.2.1 GAPC的催化功能
GAPC在糖酵解中可将甘油醛-3-磷酸与其特异性辅因子NAD+和磷酸盐偶联转化为1,3-BPG和NADH。1,3-BPG与ADP经磷酸甘油酸激酶(phos‐phoglycerate kinase,PGK)催化产生 ATP[25]。因此,GAPC也会对涉及到ATP,NADH的细胞代谢产生影响。在蓝细菌中过表达GAPC1会促进NADH积累,而GAPC1无效突变体可以促进氧化型磷酸戊糖(oxidized pentose phosphate,OPP)循环积累更多的NADPH[26]。在拟南芥中,AtGAPC1的突变体可能降低ATP含量和呼吸速率导致种子空胚囊[27],同时,AtGAPCs敲除系/过表达AtGAPCs分别降低/提高脂肪酸、ATP和NAD(P)H的含量,表明AtGAPCs可能通过促进ATP含量的积累来正调节种子中的脂肪酸与NAD(P)H积累[28]。在低磷条件下,AtGAPC2的表达水平被抑制,是因为Pi与糖代谢和能量产生相关,所以Pi含量改变会影响AtGAPC的表达量[29]。
1.2.2 GAPC参与调节H2O2和ABA介导的胁迫信号通路
H2O2以氧气部分还原的形式稳定地存在于植物体,在调节植物发育,如拟南芥种子发芽、细胞增殖和分化以及加强植物对胁迫环境刺激的耐受性中发挥信号分子的作用[30,34]。在高等植物的H2O2信号传导过程中,氧化还原敏感蛋白(如GAPC)发生氧化还原反应[35],再经过氧化还原敏感转录因子(如热激因子(heat shock factor,HSF))感知、转导氧化还原信号[36],进而调节氧化还原平衡,同时氧化还原敏感蛋白激活下游信号分子(如激酶、磷酸酶)发挥作用[37]。H2O2也是ABA响应非生物胁迫信号通路中的关键分子,参与提高小麦的抗旱性及拟南芥的非生物胁迫抗性[23,38],ABA调控气孔关闭是ABA参与非生物胁迫的经典范例,通过钙/非钙依赖两种途径调节[39],SNRK2.6/开放式气孔 1(open stomata 1,OST1)是非钙依赖途径的关键调节因子[40]。在胁迫环境下,ABA积累导致PP2C失活,促进SNRK2.6及下游效应蛋白的磷酸化,如转录因子ABF2、ABA不敏感蛋白4/5(ABA insensitive 4/5,ABI4/5)、离子通道蛋白KAT1和Slow-阴离子关联通道1(slow anion channel-associated 1,SLAC1)以及 NADPH氧化酶等[41-42],从而改变细胞蛋白质和离子分布,导致气孔关闭,减少植物经蒸腾作用失水[43-44]。其中NADPH氧化酶诱导产生O2-·后,在超氧化物歧化酶(super‐oxide dismutase,SOD)作用下产生H2O2[45]。诱导产生的H2O2通过调节离子通道来影响保卫细胞Ca2+的流出和流入,进而调控细胞的膨胀,导致气孔关闭。因此H2O2是ABA介导的应激反应下产生的重要信号分子,协助ABA进一步转导下游信号调控细胞响应胁迫环境(图1)。

图1 植物体内脱落酸诱导产生H2O2并响应胁迫的过程[44-45]Figure 1 Abscisic acid induces the production of hydrogen peroxide and responds to stress in plants[44-45]
为了维持胁迫环境下植物细胞中ROS和活性氮(reactive nitrogen species,RNS)的平衡,高等植物相应蛋白质会发生可逆的氧化还原翻译后修饰(re‐dox post translational modification,RPTM)来感知并传递氧化还原信号[46]。研究表明,GAPC发挥其多功能性是因为自身半胱氨酸的巯基侧链对H2O2和NO等具有较强氧化还原性的分子非常敏感[47],GAPC极易受到H2O2的氧化,或经亚硝基谷胱甘肽(nitrosoglutathione,GSNO)发生S-亚硝基化后强烈抑制酶活性并形成氧化还原依赖性修饰[48],促进GAPC在氧化应激中发挥其它“兼职”功能。由于细胞质中的GAPC浓度高达240µM,且其半胱氨酸结构域高度保守,决定了细胞质GAPC的巯基活性比其他氧化还原蛋白更高[49],更易发生氧化修饰。对GAPC晶体结构分析表明,α-螺旋N-末端的催化性Cys表面积与GAPC的反应速率和巯基酸度呈正相关[50],并运用量子力学(quantum mechanism,QM)构建GAPC活性位点模型,发现His176的氮中和了Cys149的负电作用,形成中性Cys149-(O)nH-His176中间体,促进H2O2对催化性Cys149的多步氧化[48]。在拟南芥中,AtGAPC1和AtGAPA的酸性催化性Cys149极易被修饰,但AtGAPC1的活性Cys巯基盐与H2O2的反应速度以及将次磺酸转化为亚磺酸的速度均比AtGAPA快[51],说明GAPC对H2O2更加敏感。
1.2.3 GAPC作为修饰蛋白的潜在功能
在氧化胁迫下,GAPC被H2O2可逆氧化成次磺酸,但可以被还原型谷胱甘肽(reduced glutathione,GSH)或二硫苏糖醇(dithiothreitol,DTT)恢复,植物体内冗余的H2O2,进一步将次磺酸氧化生成磺酸与亚磺酸[52],并抑制GAPC活性,同时赋予GAPC其它功能,例如,调节胁迫条件下的基因表达,诱导细胞凋亡,保护端粒DNA以及参与调节果实的成熟[21,53-54]。因此,GAPC受到氧化还原修饰后会具备额外的功能[55]。在干旱胁迫下,拟南芥AtGAPCs的双敲除突变体和小麦TaGAPC2/5/6的沉默株系均表现出ROS积累更多、气孔闭合且对ABA响应变弱的特征[8,56]。Zhang L.等[57]研究发现,干旱胁迫下小麦植株ABA含量的增加会诱导TaGAPC1与TaWRKY互作以促进体内H2O2的清除。Guo L.等[58]研究发现,拟南芥植物受到氧化胁迫后使氧化失活的GAPC能与磷脂酶(phospholipase D,PLD)结合后激活PLD促进磷脂酸(phosphatidic acid,PA)产生并介导ABA诱导气孔关闭。因此,GAPC可能通过感知H2O2含量变化并将氧化还原信号传递给PLD,同时促进PLD产生PA来介导气孔关闭,从而响应胁迫信号。此外,拟南芥和烟草经蛋白源二肽Tyr-Asp处理后抑制了GAPC的活性,并将葡萄糖重新导向磷酸戊糖途径(pentose phosphoric acid path‐way,PPP)和NADPH的产生,从而提高植物对氧化应激的耐受性[59](图2)。Li L.等[60]在研究马铃薯块茎发芽的机制中,发现抗菌肽Snakin-2(StSN2)与StGAPC1相互作用后增强StGAPC1酶活性,减少氧化修饰并抑制马铃薯块茎发芽。GAPC除了响应氧化应激,还可以防御植物病原体,阻止竹花叶病毒(Bamboomosaicvirus,BaMV)在感病烟草中复制[61];过表达GAPCs通过与自噬相关蛋白3(autophagyrelated protein 3,ATG3)相互作用抑制烟草自噬,提高烟草抗病性[62]。
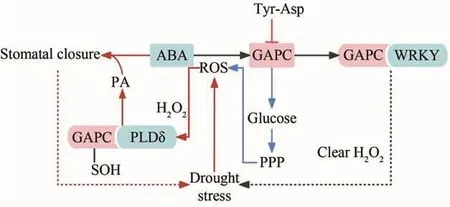
图2 GAPC在氧化还原信号中的作用Figure 2 Functions of GAPC in redox signalling
GAPC多功能性通常与应激诱导GAPC核易位有关。在冷胁迫和镉胁迫下,拟南芥AtGAPC从细胞质易位到细胞核[63-64];在热胁迫下,AtGAPC通过与核转录因子NFYC10相互作用使AtGAPC在细胞核中积累,并促进热诱导基因的表达以响应热胁迫[65](图2)。近期研究发现,E3泛素连接酶(seven in absentia like 7,SINAL7)与AtGAPC1发生相互作用,使单泛素化的AtGAPC1催化活性丧失,使其进入细胞核调控细胞凋亡[66](图3)。此外,在盐胁迫下,烟草NtGAPC的催化性半胱氨酸发生S-亚硝基化及其突变形式均可以在细胞质中与烟草渗透胁迫活化蛋白激酶(NtOSAK)相互作用,但NtGAPC的催化性半胱氨酸位点存在时才能在细胞核中与NtOSAK相互作用。因此,催化性半胱氨酸S-亚硝化只是NtGAPC核易位的必需(图3)[20]。值得注意的是,尽管胁迫诱导GAPC核定位的一些机理已明确,但其在植物细胞核中的明确作用仍然缺失。
GAPC除了受到氧化修饰和S-亚硝化修饰外,还可以发生磷酸化修饰、乙酰化修饰等多种翻译后修饰。在水稻中,GAPDH的核定位会因氧化应激而增强,而GAPDH与组蛋白去乙酰化酶OsSRT1相互作用会减少其核易位,并使GAPDH发生去乙酰化修饰,降低其活性,同时抑制GAPDH转录激活糖酵解基因的功能(图3),从而让植物细胞感知氧化还原状态以积极响应氧化胁迫[67]。而GAPDH的磷酸化会影响种子发育过程中磷酸三糖在不同代谢途径和细胞区间的分配,以满足碳、能量和还原当量的需求[68]。

图3 GAPDH核转位响应非生物胁迫Figure 3 GAPDH nuclear translocation in response to abiotic stress
1.2.4 GAPC氧化失活引起初生代谢转变响应氧化胁迫
植物细胞在氧化胁迫下已经发展出各种包含酶(如SOD、过氧化氢酶和谷胱甘肽过氧化物酶)以及非酶抗氧化剂(如抗坏血酸和还原谷胱甘肽)的抗氧化系统。其中谷胱甘肽是最重要的抗氧化剂之一,直接或间接作为谷胱甘肽还原系统和硫氧还蛋白系统活性氧的清除因子[69]。NADPH是许多合成代谢的供氢体,在PPP途径、三羧酸循环(tricar‐boxylic acid cycle,TCA)和叶酸代谢等途径中都有产生[70]。其中PPP途径是植物NADPH的主要来源,也是维持氧化还原平衡的关键[71]。研究表明,GAPDH作为氧化敏感蛋白,使其半胱氨酸残基受到氧化修饰并限制糖酵解通量,同时使中间产物在PPP中积累来介导短期抗氧化反应,还可能促进DNA损伤修复的核苷酸合成[72]。当人类细胞受到H2O2和紫外线辐射引起的氧化应激,导致GAPDH氧化失活使糖酵解代谢受阻,从而激活葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)使糖代谢转向PPP和嘌呤代谢[73],并可能通过多次循环,产生更多NADPH来满足还原当量的急性需求。用H2O2处理酵母细胞也使糖酵解受到严重抑制后促进初始阶段PPP中间产物浓度急剧增加[74]。拟南芥根被氧化剂甲萘醌处理后改变了糖酵解通量来响应氧化胁迫[75]。因此,GAPDH是响应氧化胁迫的关键蛋白,并通过氧化失活引起初生代谢的转变响应氧化胁迫。
总结与展望
在各种非生物胁迫下,植物通过感知环境变化产生ROS、RNS和PA等第二信使。GAPC由于其易被氧化的结构特点,而且是ROS和RNS的共同靶蛋白[55],成为了ABA与H2O2介导的氧化应激中的关键信号节点,这一发现给进一步探究植物在氧化逆境中的信号调控提供了新的思路。鉴于糖酵解对植物能量代谢、生长发育及抗逆性的重要作用,对于未来GAPC的研究主要涉及以下三个方面。
首先,挖掘作为修饰蛋白GAPC的更多潜在功能。植物GAPC翻译后修饰研究多集中在氧化还原修饰。该类修饰赋予GAPC的功能是响应各种生物与非生物胁迫。在Luo Y.等研究中发现,GAPC参与调控草莓果实成熟和品质的形成[21],且该过程受到乙酰化修饰的影响(数据未发表)。因此翻译后修饰的GAPC对园艺植物生长发育和品质的调控及其机制的解析还需要深入研究。
其次,GAPC细胞核易位机制的解析。哺乳动物GAPDH的核转位机制和凋亡功能已得到很好的阐释[76],植物GAPC核转位的研究仍处于起步阶段。对植物GAPC翻译后修饰关键位点的挖掘以及该修饰位点在促进GAPC核易位中的作用有助于更好的理解GAPC的多功能性。
最后,GAPC在细胞核中的作用仍需深入研究。在动物细胞中,核GAPDH通过与各种核成分结合来影响转录活性、DNA复制和修复以及表观遗传修饰[77-78]。植物GAPC在细胞核中的明确作用仍然缺失。找到GAPC直接调控的细胞核靶基因可以为解答翻译后修饰的GAPC调控植物生长发育、品质形成以及响应各种胁迫的问题提供直接答案。
